桑/柞蚕丝不同溶解体系再生丝素蛋白性能研究
肖 露,杨旭超,余卫华,王佳丽,唐仕成
(四川省丝绸工程技术研究中心,四川 成都 610031)
桑/柞蚕丝不同溶解体系再生丝素蛋白性能研究
肖 露,杨旭超,余卫华,王佳丽,唐仕成
(四川省丝绸工程技术研究中心,四川 成都 610031)
通过对凝胶时间、蛋白质分子质量测试、氨基酸分析、FT-IR等方法的分析,研究了不同溶解体系下制备的再生桑蚕丝素、柞蚕丝素蛋白溶液稳定性差异和再生丝素膜组分、结构的变化。结果表明:桑蚕丝素的溶解以CaCl2-H2O-C2H5OH体系为佳,Ca(NO3)2-4H2O体系则更有利于对柞蚕丝素的溶解;丝素蛋白不同溶解体系下制备的丝素溶液分子量大小与稳定性成反比关系;在制备的再生丝素中桑蚕蛋白膜以非极性小侧基氨基酸为主;柞蚕蛋白膜以极性和非极性混合侧基氨基酸为主;再生桑蚕丝素蛋白分子构象为无规卷曲和β-折叠,并有由前向后的结构转化,再生柞蚕丝素蛋白以无规卷曲、α-螺旋和β-折叠的共存结构为主,并有按前序的结构转化。
溶解体系;再生丝素蛋白;稳定性;分子构象
蚕丝作为传统天然纺织原料由于其优良的柔韧性、吸湿性、透气性和优雅的光泽一直被人们所熟知,随着纺织科学、材料科学和生命科学的交叉渗透,对蚕丝素蛋白的研究扩展到分子水平。在生物医用材料领域,再生桑蚕丝素蛋白(SF)以其良好的透氧性[1]、生物相容性,湿态抵抗酶解能力,附着率和增殖率[2]等优异性能和巨大潜力得到国内外生物材料界的广泛认可,且从生物整体、细胞、分子生物学三个方面证明了桑蚕丝素蛋白是性能优良的生物材料;而柞蚕丝素蛋白(TSF)因其氨基酸序列中含有较多能与细胞发生特异性相互作用的精氨酸(Arg)-甘氨酸(Gly)-天门冬氨酸(Asp)三肽序列(RGD)结构[3],表现出更强的细胞粘附性[4]也备受业界关注。为了给再生丝素蛋白生物医用材料的制备提供实验依据和进一步应用桑蚕丝素与柞蚕丝素,本文从不同溶解体系下制备的桑、柞蚕再生丝素蛋白分子量、氨基酸组成和超分子结构等方面进行探讨。
蚕丝素溶解溶剂主要包括酸、碱、盐或者酶溶液等,其中酸、碱、酶能将蚕丝素降解为小分子肽链,不利于成膜等大分子状态,蛋白质结构也会发生较大变化[5]。因此选用中性溶剂高浓度盐、盐与有机液体的多元溶剂,分别对桑蚕丝及柞蚕丝进行溶解,并通过凝胶时间、再生蛋白质分子量测定,分析在不同体系下制备的再生丝素蛋白溶液的溶解性、稳定性差异,再通过氨基酸的测定及傅里叶红外光谱法(FT-IR)分析,研究其组分及超分子结构的变化。
1 试验部分
1.1 材料与仪器
主要试验材料:桑蚕丝,柞蚕丝,透析袋,Ca(NO3)2,LiSCN,CaCl2,C2H5OH,LiBr,丙烯酰胺,甲叉双丙烯酰胺,十二烷基硫酸钠,三羟甲基氨基甲烷,过硫酸铵,四甲基乙二胺,溴酚蓝,甘油,冰乙酸,甲醇,考马斯亮蓝等。
主要试验仪器:恒温水浴锅,恒温生化培养箱,DYY-6C电泳仪,HITACHI-835-50氨基酸分析仪,Nicolet470傅里叶红外光谱仪。
1.2 再生丝素蛋白制备
1.2.1 再生桑蚕丝素蛋白的制备
将桑蚕丝按1∶50的浴比在0.5% Na2CO3溶液中煮沸脱胶2次,每次30 min。用去离子水清洗净后,在烘箱中(60 ℃)干燥制备完全脱胶桑蚕丝。将完全脱胶桑蚕丝按1∶10的浴比分别在CaCl2-H2O-C2H5OH(摩尔比为1∶8∶2)的温度(80±2) ℃三元混合溶液和温度(60±2) ℃ LiBr:C2H5OH(质量比40∶60)体系中充分溶解。将所得溶液分装于透析袋(截留分子量12 kD)在蒸馏水中充分透析(时间3天,蒸馏水6 h更换一次)制得再生桑蚕丝素蛋白溶液。
1.2.2 再生柞蚕丝素蛋白的制备
将柞蚕茧按照1∶20的浴比在0.5% Na2CO3溶液中煮沸脱胶3次,每次30 min。用去离子水清洗净后,在烘箱中(60 ℃)干燥制备完全脱胶柞蚕丝。将完全脱胶柞蚕丝分别按照1∶20的浴比在Ca(NO3)2-4H2O的溶液中(温度100 ℃)和浴比1∶35,9 mol/L的LiSCN溶液中(温度60 ℃、超声震荡)充分溶解。最后,将所得溶液分装于透析袋(截留分子量12 kD)在蒸馏水中充分透析(时间3天,蒸馏水6 h更换一次)制得再生柞蚕丝素蛋白溶液。
1.3 表征方法
1.3.1 再生丝素溶液凝胶化时间的测定
将不同溶解体系制备的再生丝素溶液浓度调整到10%。分别精确量取各种不同溶液5 ml置于烧杯中,保鲜膜封口,放置于37 ℃的恒温生化培养箱内,观察并记录凝胶化时间。
1.3.2 再生丝素蛋白分子质量测定
采用SDS-PAGE凝胶电泳方法检测[6]。次高分子质量蛋白质配置7%分离胶,低分子质量标准蛋白配置14%分离胶,另分别配置5%浓缩胶。取10 μL标准蛋白溶解液并加入缓冲液10 μL,采用DYY-6C电泳仪,用10 mA电流完成浓缩胶电泳过程,在20 mA下完成分离胶电泳过程。电泳结束后用考马斯亮蓝染色,再用脱色液(冰乙酸75 ml,甲醇50 ml,加蒸馏水定容至1 000 ml)进行脱色。
1.3.3氨基酸检测
将不同溶解体系的再生丝素蛋白在37 ℃的生化培养箱中干燥成膜。用6 mol/dm3HCl于110 ℃水解再生蚕丝素蛋白膜18 h,水解产物用水稀释到25 mg/100 ml,用HITACHI-835-50氨基酸分析仪测定氨基酸组成。
1.3.4 远红外光谱(FT-IR)测定
将不同溶解体系的再生丝素蛋白在37 ℃的生化培养箱中干燥成膜,直接用Nicolet470傅里叶红外光谱仪对制成的膜进行测试。
2 结果与讨论
2.1 丝素蛋白不同溶解体系溶解能力比较
桑、柞蚕丝素纤维在不同体系中溶解,溶解时间和透析液物理现象如表1所示。在桑蚕丝素的溶解过程中,LiBr-C2H5OH溶解温度更低、溶解时间更短,其溶解能力强于CaCl2-H2O-C2H5OH,对柞蚕丝素的溶解,LiSCN溶解能力比Ca(NO3)2-4H2O更强且后者尚未完全溶解。Ca2+与蚕丝素中的酪氨酸、丝氨酸基配位并形成配合物,使得丝素膨润并逐渐溶解;LiBr、LiSCN溶液则通过离子较强的极性破坏丝素蛋白分子间作用力,从而促使丝素的溶解。透析后,再生桑蚕丝素溶液为浅黄色而再生柞蚕丝素为乳黄色。

表1 不同溶解体系丝素纤维溶解时间及透析液物理现象
2.2 不同溶解体系对再生丝素蛋白溶液稳定性分析
再生丝素蛋白溶液的稳定性对溶液浓度、环境温度、盐离子及pH值表现出较强的敏感性。在特定的试验条件下控制这些因素,通过凝胶化时间的测定来表征不同溶解体系丝素溶液的稳定性,测试结果如表2所示。通过比较不同溶解体系的丝素溶液凝胶化时间,LiBr-C2H5OH桑蚕丝素凝胶化时间最短为23 h,其他3种溶液凝胶化时间相差不大分别为29、30、32 h。
表3为不同溶解体系制取的再生丝素蛋白SDS-PAGE电泳测试蛋白分子量分布。对桑蚕丝素的溶解,CaCl2-H2O-C2H5OH体系分子质量分布在30.96~86.7 kD,高分子质量的长肽链溶解彻底,溶液中以小分子肽链为主,丝素蛋白分子质量较低;LiBr-C2H5OH体系分子质量则在33.5~136.8 kD,说明对丝素蛋白的溶解程度相对较低,溶液中多为较高分子质量的丝素肽链,丝素蛋白分子质量较高。对柞蚕丝素的溶解,两种体系降解能力相当,分子质量分别为25.6~50.2 kD、27.6~75.8 kD,Ca(NO3)2-4H2O溶解体系对丝素的溶解最彻底,溶液中基本为小分子肽链,丝素蛋白分子质量最低。
结合表2、表3分析结果,不同溶解体系再生丝素蛋白溶液稳定性与分子量分布呈反比关系,丝素蛋白分子量越大分布越广,溶液凝胶化时间越短,溶液越不稳定。用LiBr-C2H5OH溶解的桑蚕丝素溶液稳定性最差,其他3种体系丝素溶液稳定性相当。
2.3蚕丝素不同溶解体系对氨基酸组成及结构的影响
由表4可见,桑、柞蚕丝素蛋白及其丝素膜氨基酸含量均以脂肪族非极基和极性混合侧基氨基酸Gly(甘氨酸)、Ala(丙氨酸)为主,含量在60%以上。桑蚕丝素蛋白组成与柞蚕丝素蛋白相比较,桑蚕丝素氨基酸组成种类更多,而柞蚕丝素Arg(精氨酸)、Ala(丙氨酸)和Asp(天门冬氨酸)的含量相对更高。再生丝素膜与丝素纤维相比氨基酸组成有所下降。根据氨基酸含量的变化比较,对桑蚕丝素的溶解CaCl2-H2O-C2H5OH体系更好,Ca(NO3)2-4H2O体系对柞蚕丝素溶解程度更高。

表2 再生丝素不同溶解体系溶液凝胶化时间
注:pH值7,温度(37±0.1) ℃,浓度10%。

表3 再生丝素蛋白SDS-PAGE电泳测试蛋白分子量分布

表4 不同溶解体系蚕丝素纤维及再生蚕丝素膜的氨基酸含量 单位:%
桑蚕丝素蛋白结晶构象主要是α-螺旋结构的silkⅠ和β-折叠的silkⅡ。2种溶解体系制备的再生丝素膜红外光谱图相似(如图1所示),酰胺Ⅰ吸收峰在1 640 cm-1左右,酰胺Ⅱ吸收峰在1 520 cm-1左右,酰胺Ⅲ在1 233 cm-1左右,酰胺Ⅴ在669 cm-1左右。在1 629~1 651 cm-1和1 514~1 531 cm-1之间出现了不同程度的吸收峰。对比丝素蛋白红外吸收光谱峰[6],说明2种不同溶解体系的再生桑蚕丝素蛋白膜以无规卷曲和β-折叠结构存在,而且存在着无规卷曲结构到β-折叠结构的转变。LiBr-C2H5OH溶解体系制备再生丝素膜(样品A)酰胺Ⅰ特征峰1 641 cm-1,酰胺Ⅱ特征峰1 531 cm-1,酰胺Ⅲ特征峰1 233 cm-1,酰胺Ⅴ在669 cm-1。CaCl2-H2O-C2H5OH溶解体系制备再生丝素膜(样品B)酰胺Ⅰ特征峰1 632 cm-1,酰胺Ⅱ特征峰1 515 cm-1,酰胺Ⅲ特征峰1 230 cm-1,酰胺Ⅴ在640 cm-1。
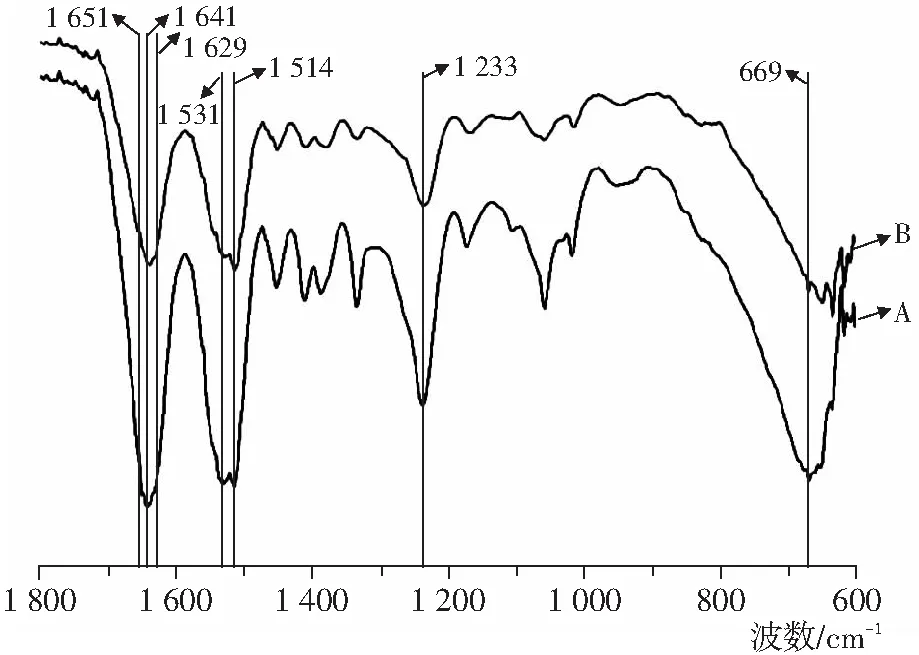
A:LiBr-C2H5OH,B:CaCl2-H2O-C2H5OH图1 不同溶解体系再生桑蚕丝素膜红外光谱图

A:Ca(NO3)2-4H2O,B:LiSCN图2 不同溶解体系再生柞蚕丝素膜红外光谱图
相对于桑蚕丝素,柞蚕丝素蛋白分子构象比较复杂,α-螺旋和β-折叠结构和无规卷曲结构共存。2种溶解体系制备的再生丝素膜红外光谱图相似(如图2所示),酰胺Ⅰ吸收峰在1 629 cm-1左右,酰胺Ⅱ吸收峰在1 545和1 516 cm-1左右,酰胺Ⅲ在1 236 cm-1左右,酰胺Ⅳ吸收峰在966 cm-1,在1 510~1 530 cm-1出现了不同程度的吸收峰。说明2种不同溶解体系的再生柞蚕丝素蛋白以无规卷曲、α-螺旋和β-折叠结构共存为主,而且存在着无规卷曲结构到α-螺旋和β-折叠结构的转变。Ca(NO3)2-4H2O溶解体系制备再生丝素膜(样品A)酰胺Ⅰ特征峰1 629 cm-1,酰胺Ⅱ特征峰1 545 cm-1和1 516 cm-1,酰胺Ⅲ特征峰1 236 cm-1,酰胺Ⅳ特征峰966 cm-1。LiSCN溶解体系制备再生丝素膜(样品B)酰胺Ⅰ特征峰1 629 cm-1,酰胺Ⅱ特征峰1 543 cm-1和1 530cm-1,酰胺Ⅲ特征峰1 233 cm-1,酰胺Ⅳ特征峰965 cm-1。
3 结论
(1)桑蚕丝素的溶解以CaCl2-H2O-C2H5OH体系为佳,Ca(NO3)2-4H2O体系则更有利于对柞蚕丝素的溶解。
(2)不同溶解体系下制备的丝素溶液分子量分布与稳定性不同,且分子量与稳定性成反比关系。LiBr-C2H5OH制备的桑蚕丝素溶液分子量分布最大,稳定性也最差;其他3种溶解体系稳定性、分子量分布相当,CaCl2-H2O-C2H5OH体系制备的桑蚕丝素溶液与LiSCN体系制备的柞蚕丝素溶液,分子量分布、稳定性最为相近。
(3)不同溶解体系下制备的再生丝素蛋白氨基酸含量有所差异,且对比纤维丝素蛋白,氨基酸含量均有所下降;在制备的再生丝素中桑蚕蛋白膜以非极性小侧基氨基酸—乙氨酸、丙氨酸和丝氨酸为主,柞蚕蛋白膜则以极性和非极性混合侧基氨基酸—精氨酸、天门冬氨酸和丙氨酸为主。
(4)再生桑蚕丝素蛋白分子构象以无规卷曲和β-折叠结构存在,并由无规卷曲结构到β-折叠结构的转变;再生柞蚕丝素蛋白以无规卷曲、α-螺旋和β-折叠结构共存为主,而且由无规卷曲结构到α-螺旋和β-折叠的结构转变。
[1] MINOURA N, TSUKADA M, NAGURA M. Fine structure and oxygen permeability of silk fibroin membrane treated with methanol[J]. Polymer,1990,31:265.
[2] CHARU V, DAVID L K. Silk as a biomaterial[J]. Progress in Polymer Science, 2007,32(8/9):991-1 007.
[3] MINOURA N, AIBA S I, HIGUCHI M,etal. Attachment and growth of fiberblast cells on silk fibroin[J]. Biochemical & Biophysical Research Communications,1995,208:511.
[4] SOFIA S, MCCARTHY M B, GRONOWIC G,etal. Functionalized silk-based biomaterials for bone formation[J]. Journal of Bionedical Materials Research, 2001,54:139-148.
[5] 刘 明.FTIR对丝素蛋白构象的研究[D].杭州:浙江大学,2006.
[6] 夏其昌,张祥明,周仲驹,等.蛋白质电泳技术指南[M].北京:化学工业出版社,2007.
PropertiesofRegeneratedSilkFibroinfromMulberry/TussahSilkinDifferentSolventSystems
XIAO Lu, YANG Xu-chao, YU Wei-hua, WANG Jia-li, TANG Shi-cheng
(Silk Engineering Research Center of Sichuan, Chengdu 610031, China)
Several different solvent systems were used to dissolve Bombyx mori silk and Antherara pernyi silk to prepare SF/TSF solutions and membranes. The stability of SF/TSF solutions under different dissolution systems were studied, amino acid compositions and molecular structure changes of the SF/TSF membranes were discussed through the gel time, SDS-PAGE, amino acid analysis and FT-IR testing. The results showed that CaCl2-H2O-C2H5OH was suitable for preparing the SF and Ca(NO3)2-4H2O was suitable for preparing the TSF. It was inversely proportional between the stability and molecular mass of the SF/TSF solutions. SF membrane was mainly composed of non polar small amino acids while TSF was mainly composed of polar and nonpolar mixed amino acids. The molecular structures of SF membranes were random coil and β-sheet. Meanwhile, the random coil could be changed into β-sheet. The TSF membranes were co-existence of random coil, α-helix and β-sheet structures, and random coil could be changed into the other two structures.
solvent systems; regenerated silk fibroin; stability; molecular structure
TS143.2
B
1673-0356(2017)11-0013-04
2017-09-13
四川省应用基础计划项目(2016JY0227)
肖 露(1986-),男,四川西昌人,工程师,硕士研究生,主要研究方向为纺织材料、产业用纺织品,E-mail:xiaolu0932@126.com。

