布鲁氏菌病患者中PD-1和PD-L1的表达①
庞 盼 张峰波 朱玥洁 贾 斌 张跃新 张春桃 甫拉提·热西提 丁剑冰
(新疆医科大学基础医学院,乌鲁木齐 830011)
布鲁氏菌病患者中PD-1和PD-L1的表达①
庞 盼 张峰波②朱玥洁③贾 斌④张跃新④张春桃 甫拉提·热西提 丁剑冰
(新疆医科大学基础医学院,乌鲁木齐 830011)
目的研究程序性死亡受体1(PD-1)/与配体(PD-L1)以及相关细胞因子转化生长因子-β(Transforming growth factor-β,TGF-β)和白细胞介素-10(Interleukin-10,IL-10)在布鲁氏菌病(Brucellosis)患者中的变化。方法选取60例布鲁氏菌病患者与60例健康志愿者,采用流式细胞术分别检测其外周血单个核细胞(PBMC)中CD3+T细胞、CD4+T细胞、CD8+T细胞中PD-1的表达,以及树突状细胞(Dendritic cell,DC)中PD-L1的表达,同时采用流式液相多重蛋白定量技术(Cytometric bead array,CBA )检测血清中TGF-β和IL-10的变化,采用Pearson法分析布鲁氏菌病患者体内PD-1与TGF-β及IL-10的相关性,并对34例布鲁氏菌病治愈患者进行了追踪随访。结果与正常对照组相比,布鲁氏菌病患者组外周血中PD-1、PD-L1的表达及血清中TGF-β和IL-10的水平均明显升高(P<0.01),而治愈组外周血中PD-1、PD-L1的表达及血清中TGF-β和IL-10的水平较治疗前明显降低(P<0.01),并且布鲁氏菌病患者组PD-1的表达与TGF-β (r=0.817,P<0.01)及IL-10均呈正相关(r=0.835,P<0.01)。结论PD-1/PD-L1及TGF-β和IL-10在布鲁氏菌病患者体内高表达,可能共同参与了布鲁氏菌对宿主免疫应答的负性调控作用。
PD-1;PD-L1;布鲁氏菌病;细胞因子
布鲁氏菌病(Brucellosis)简称“布病”,是由布鲁氏菌(Brucella)感染引起的人畜共患病,在我国牧区流行较为严重,新疆是该病的高发地区之一,目前研究发现布病的发生与宿主免疫功能下降有关[1-4]。 我们前期检测布病患者血清中可溶性负性协同刺激分子Tim-3(T-cell immunoglobulin and mucin domain-containing protein-3,Tim-3)和可溶性程序性死亡蛋白1(Programmed death-1,PD-1),发现布病患者血清中sTim-3和sPD-1升高,并存在Th1/Th2细胞的失衡[5,6]。负性协同刺激分子PD-1以膜型和可溶型两种形式存在,属于CD28/细胞毒性T淋巴细胞抗原4(Cytotoxic T lymphocyte antigen 4,CTLA-4)免疫球蛋白超家族,主要表达于活化的T细胞表面,在抗感染免疫中可下调或抑制T细胞的活化和某些细胞因子的产生,增强免疫抑制功能,从而使宿主对病原体的清除能力减弱[7-9]。程序性死亡分子配体(Programmed death ligands,PD-L1,B7-H1) 主要表达于树突状细胞(Dendritic cell,DC)表面[10,11]。许多研究证实膜型PD-1和PD-L1在结核病、肝炎以及艾滋病等感染性疾病中发挥重要的免疫抑制作用[12-14],但其在布病中的作用机制目前未见报道。本研究采用流式细胞术检测布病患者组、治愈组以及健康对照组外周血中T细胞表面PD-1的表达,DC细胞表面PD-L1的表达,同时采用CBA检测TGF-β及IL-10的变化,分析负性免疫分子PD-1/PD-L1和TGF-β及IL-10在布病感染治疗前后的变化特点。
1 资料与方法
1.1资料 收集2016年1月~2017年4月在新疆医科大学第一附属医院感染科就诊的60例门诊患者,年龄5~80岁,中位年龄为45岁,其中男性患者49例,女性患者11例。收集34例布病患者治愈组,年龄6~78岁,中位年龄43岁,其中男性患者26例,女性患者8例。布病病例组纳入标准:布病的诊断参照2012年我国颁布的《布鲁氏菌病诊疗指南(试行)》标准[15]:有流行病学史,临床表现为发热、多汗、骨关节痛、睾丸痛、全身乏力等症状,血清学检查中虎红平板凝集试验阳性,试管凝集试验(SAT)滴度为1∶100及以上或菌培养阳性,排除伤寒、副伤寒、风湿热及结核、败血症等疾病。同时选取60例同期体检的健康人群作为正常对照组,年龄性别均与病例组无统计学差异。所有对照及患者均签署知情同意书,实验经新疆医科大学第一附属医院伦理学委员会批准(20150225-94)。
1.2方法
1.2.1样本处理 将收集到的60例布病患者组、34例治愈组以及60例对照组的全血标本均经2 000 r/min离心10 min,吸取上清于EP管中;将剩下的血细胞吸取至15 ml离心管中,加入与血细胞等体积的PBS用巴氏管轻轻吹打混匀,再取与血细胞等体积的淋巴细胞分离液(北京索莱宝|P8610|人外周血淋巴细胞分离液)注入50 ml离心管中,将与PBS充分混匀的血细胞用巴氏管沿管壁缓慢注入50 ml离心管中,2 000 r/min离心20 min,提取单核细胞。
1.2.2TGF-β和IL-10的检测 采用CBA技术检测60例布病患者组、34例治愈组和60例正常对照组血清中TGF-β和IL-10(Cytometric Bead Array Human TGF-β、IL-10 Cytokine Kit,BD公司)的水平,标准品梯度稀释浓度依次为 5 000、2 500、1 250、625、312.5、156、80、40、20、0 pg/ml,实验步骤严格按照试剂盒说明书进行操作,用流式细胞仪分析读取数据(流式细胞仪为德国美天旎生物技术有限公司产品),根据标准曲线计算样品中TGF-β和IL-10的水平。
1.2.3PD-1和PD-L1的检测 用提取的单核细胞分别检测布鲁氏菌患者组、治愈组、对照组T细胞表面的PD-1和DC细胞表面的PD-L1。在T细胞流式管中分别加入APC标记的CD3、Percp 标记的CD4、FITC 标记的CD8、PE 标记的PD-1单克隆抗体,分别为1 μl、2 μl、2 μl、2 μl;在DC细胞流式管中分别加入Percp 标记的CD11c、PE 标记的PD-L1、PE-cy7 标记的HLA-DR 单克隆抗体各2 μl(所有流式单克隆抗体均购自BD公司,流式细胞仪为德国美天旎生物技术有限公司产品),室温避光15 min 后,用PBS 洗涤2 次,PBS 重悬细胞,调整细胞密度为1×106ml-1。上机检测至少10 000 个细胞,采用FSC/SSC 双参数设门,分析PD-1;采用FSC/SSC 双参数设门,再用HLA-DR/CD11c设门,选定HLA-DR+CD11c+细胞即为DC,进一步分析DC表面PD-L1 表达情况。

2 结果
2.1布病患者基本资料情况 收集的60例布病患者均有流行病学史、经虎红实验阳性确诊为布病的患者。基本情况如表1、2所示。
2.2布病患者组、治愈组和正常对照组PD-1和PD-L1的表达 本研究用流式细胞仪分析T细胞表面PD-1,结果显示,与正常对照组相比,布病组PD-1在CD3+T细胞、CD4+T细胞和CD8+T细胞表面的表达均明显增高(P<0.01),而治愈组PD-1在CD3+T细胞、CD4+T细胞和CD8+T细胞表面的表达较治疗前明显降低(P<0.01)。见表3,图1、2。
2.3布病患者组、治愈组和正常对照组血清中TGF-β和IL-10的水平 本研究用CBA法检测出布病患者组、治愈组和正常对照组血清中TGF-β的水平分别为(912.77±91.05)pg/ml、(418.19±63.40)pg/ml、(406.59±67.35)pg/ml,与正常对照组相比,布病患者组TGF-β的水平明显增高(P<0.01),而治愈组TGF-β的水平较治疗前明显降低(P<0.01);用CBA法检测出布病患者组、治愈组和正常对照组血清中IL-10的水平分别为(27.18±5.88)pg/ml、(5.48±1.79)pg/ml、(5.10±1.31)pg/ml,与正常对照组相比,布病患者组IL-10的水平明显增高(P<0.01),而治愈组IL-10的水平较治疗前明显降低(P<0.01),见图3。
2.4布病患者PD-1的表达与TGF-β 和IL-10的相
表1布病患者的临床特征
Tab.1ClinicalcharacteristicsofpatientswithBrucella

CharacteristicsCategoriesNumber(percentage,%)ofpatients(n=60)ThehistoryofepidemiologyBreedingandcontacthistoryofcattleandsheep57(95%)Eatingundercookedmeatanddairyproducts3(5%)Fever37-37.9℃2(3%)38-38.9℃24(40%)≥39℃34(57%)WeakYes60(100%)HyperhidrosisYes58(97%)No2(3%)ArthrodyniaYes56(93%)No4(7%)GenderMalepatients49(82%)Femalepatients11(18%)Age(years)≥45years34(57%)<45years26(43%)AST1∶1006(10%)1∶20012(20%)1∶40042(70%)
关性 本研究用流式细胞术检测出PD-1在布病患者外周血单核细胞上表达增高,利用CBA法检测出TGF-β 和IL-10在布病患者血清中水平增高。通过Pearson 法分析布病患者体内PD-1与TGF-β 和IL-10的相关性,发现布病患者体内PD-1的表达与TGF-β(r=0.817,P<0.01)和IL-10(r=0.835,P<0.01)的水平均呈明显的正相关,见图4。
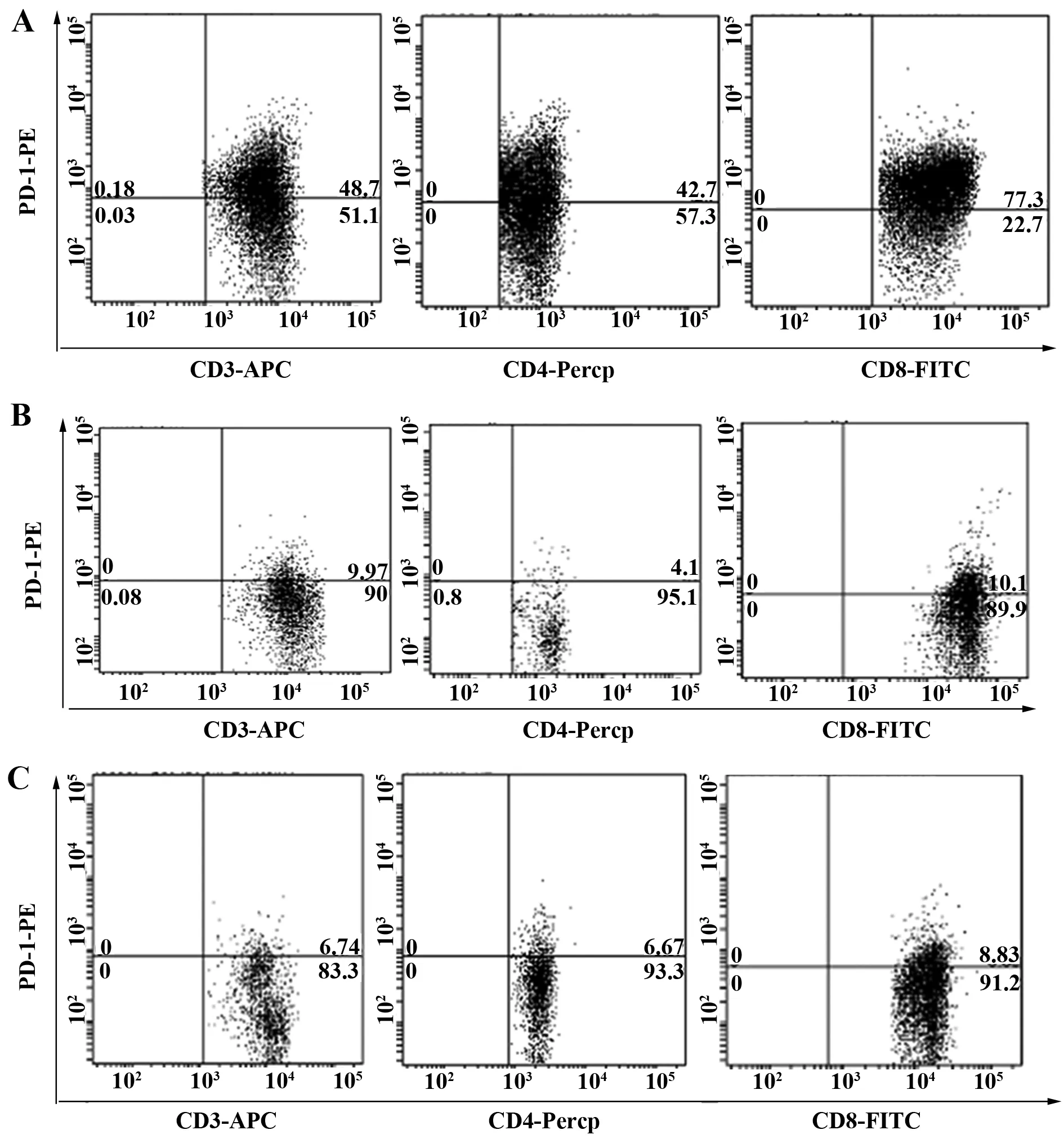
图1 布病患者组、治愈组和对照组CD3+T细胞、CD4+T细胞和CD8+T细胞表面PD-1的表达Fig.1 Expression of PD-1 on CD3+T cells,CD4+T cells and CD8+T cells in brucellosis patients group(A),cured group(B) and control group(C)Note: A.The expression of PD-1 on CD3+T cells,CD4+T cells and CD8+T cells of brucellosis patients group;B.The expression of PD-1 on CD3+T cells,CD4+T cells and CD8+T cells of cured group;C.The expression of PD-1 on CD3+T cells,CD4+T cells and CD8+T cells of control group.
表2布病患者组、治愈组和正常对照组急性炎症因子
Tab.2Brucellosispatientsgroup,curedgroupandnormalcontrolgroupofacuteinflammation

GroupsNumber(n)Procalcitonin(ng/ml)IL-6(pg/ml)Hs-CRP(mg/ml)WBC(×109L-1)Neutrophils(%)Brucellosis607.94±1.211)59.11±2.691)31.4±2.681)11.9±1.281)0.83±0.021)Cured340.99±0.012)2.76±0.672)1.06±0.022)5.23±1.352)0.43±0.012)Control600.28±0.122.28±0.430.57±0.014.01±0.850.46±0.02
Note:Compared with control group,brucellosis patients group had the higher acute inflammation expression,1)P<0.01;while in the patients receiving follow-up cured,the acute inflammation expression were remarkably lower than those in pretherapy,2)P<0.01.
表3布病患者组、治愈组和正常对照组PD-1和PD-L1的表达
Tab.3ExpressionofPD-1/PD-L1inbrucellosispatientsgroup,curegroupandcontrolgroup

GroupsNumber(n)PD-1(%)CD3+TcellCD4+TcellCD8+TcellPD-L1(%)DCcellBrucellosis6048.71±6.431)42.72±5.061)77.30±5.891)60.10±7.431)Cured349.97±1.022)4.12±1.032)10.10±1.042)9.83±1.262)Control606.74±1.476.67±1.038.83±1.578.18±1.04
Note:Compared with control group,brucellosis patients group had the higher PD-1/PD-L1 expression,1)P<0.01;while in the patients receiving follow-up cured,the PD-1/PD-L1 expression were remarkably lower than those in pretherapy,2)P<0.01.

图2 布病患者组、治愈组和对照组PD-L1的表达Fig.2 Expression of PD-L1 in brucellosis patients group,cured group and control group
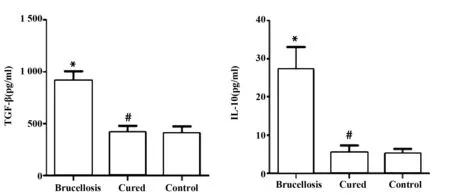
图3 各组血清中TGF-β和IL-10的水平Fig.3 Comparison of serum TGF-β and IL-10 in 3 groupsNote: *.P<0.01,brucellosis group and control group; #.P<0.01,brucellosis group and cured group.
3 讨论
PD-1/PD-L1在宿主体内发挥重要的负性调控作用,主要通过向T细胞内传递抑制信号,阻碍效应T细胞活化和增殖,参与自身免疫病、肿瘤和感染性疾病的发生发展[16-18]。通常PD-1主要表达于活化的T细胞表面,而PD-L1分布较为广泛,在T细胞、B细胞以及抗原提呈细胞等表面均有表达,DC细胞属于专职抗原提呈细胞,能够激活初始和记忆性CD8+T细胞、CD4+T细胞和B细胞,在免疫应答的启动、调控及维稳中发挥重要作用[19]。因此,本研究通过检测布病患者T细胞表面PD-1和DC细胞表面PD-L1,发现布病患者组CD3+T细胞、CD4+T细胞和CD8+T细胞表面PD-1的表达与DC细胞表面PD-L1的表达均高于正常对照组,而治愈组PD-1与PD-L1的表达较治疗前明显降低,推测在布病患者体内PD-1发挥着重要的负性调控作用,抑制T细胞的免疫功能,使布鲁氏菌发生免疫逃逸;当布病患者体内T细胞表面PD-1高达到一定程度时,与DC细胞表面的PD-L1结合,PD-1/PD-L1通路形成,抑制DC细胞的抗原提呈作用,进而使T细胞的功能减弱,分泌的相关细胞因子减少,不利于布鲁氏菌的清除。
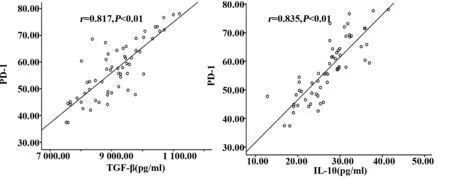
图4 PD-1与TGF-β和IL-10的相关性Fig.4 Correlation analysis of PD-1 with TGF-β and IL-10
TGF-β和IL-10是具有免疫抑制作用的主要细胞因子,大多由调节性T细胞(Regulatory cell,Treg)分泌,Treg细胞可分为天然产生的自然调节性T细胞(nTreg)和诱导产生的适应性调节性T细胞(aTreg 或 iTreg),如Th3、Tr1,其中Tr1细胞分泌IL-10,Th3细胞分泌TGF-β[20]。研究表明,Treg细胞在布鲁氏菌感染中可通过分泌细胞因子TGF-β和IL-10抑制T细胞的免疫应答[21-23]。本研究通过检测布病患者组、治愈组和对照组血清中TGF-β和IL-10的水平发现,布病组TGF-β和IL-10的水平明显高于正常对照组,而治愈组TGF-β和IL-10的水平较治疗前明显降低,推测在布鲁氏菌感染过程中Treg细胞增多,分泌的相应细胞因子功能增强。关于PD-1/PD-L1的研究报道发现,TGF-β可通过激活Smad3信号上调PD-1,进而抑制T细胞的功能[24]。Diana等[25]在研究肿瘤疫苗时发现,IL-10增加可抑制抗原提呈细胞(Antigen presenting cell,APC)的功能,抑制T细胞活化,同时可作用于DC细胞上调PD-L1。本研究通过分析布病患者体内PD-1与TGF-β和IL-10的相关性,发现布病患者体内PD-1的表达与TGF-β和IL-10的水平均呈明显的正相关,推测在布鲁氏菌感染中Treg可能增高,其分泌的相关性细胞因子TGF-β和IL-10也随之增多,TGF-β可能通过激活Smad3信号上调PD-1,IL-10可能通过作用于DC细胞上调PD-L1,有利于PD-1/PD-L1信号通路的形成,传递大量的负性刺激信号,在布鲁氏菌感染中起着重要的负调控作用。
综上所述,在布鲁氏菌感染中,TGF-β和IL-10表达增高使PD-1/PD-L1通路被激活,负调控机体的免疫应答,抑制T细胞的杀菌功能,使布鲁氏菌不能被有效清除,导致机体持续感染。若能研制出下调TGF-β、IL-10、 PD-1和PD-L1的靶向药物,布病将可能会得到很好的控制。
[1] Jia B,Zhang F,Lu Y,etal.The clinical features of 590 patients with brucellosis in Xinjiang,China with the emphasis on the treatment of complications[J].PLoS Negl Trop Dis,2017,11(5):e0005577.
[2] Zhang F,Li Z,La X,etal.Multiple-locus variable-number tandem-repeat analysis of Brucellaisolates from patients in Xinjiang China[J].Int J Clin Exp Med,2015,8(9):15716-15723.
[3] 庞 盼,朱玥洁,胡金伟,等.布鲁氏菌病患者血清sTim-3/HMGB1水平及外周血单个核细胞产生TGF-β斑点形成细胞的变化[J].中国免疫学杂志,2017,33(2):247-251.
[4] Cannella AP,Arlehamn CS,Sidney J,etal.Brucella melitensis T Cell Epitope Recognition in Humans with Brucellosis in Peru[J].Infect Immun,2014,82(1):124-131.
[5] 庞 盼,李 明,段亚楠,等.布鲁氏菌病患者血清中可溶性Tim-3/Galectin-9与相关细胞因子的变化[J].免疫学杂志,2017,33(1):54-58.
[6] 庞 盼,朱玥洁,贾 斌,等.布鲁菌病患者血清中可溶性程序性死亡蛋白1及配体的水平升高[J].细胞与分子免疫学杂志,2016,32(12):1675-1678.
[7] Lindauer A,Valiathan CR,Mehta K,etal.Translational pharmacokinetic/pharmacodynamic modeling of tumor growth inhibition supports dose-range selection of the anti-PD-1 antibody pembrolizumab[J].CPT Pharmacometrics Syst Pharmacol,2017,6(1):11-20.
[8] Shepard MT,Bonney EA.PD-1 regulates T cell proliferation in a tissue and subset specific manner during normal mouse pregnancy[J].Immunol Invest,2013,42(5):385-408.
[9] Xu P,Chen YJ,Chen H,etal.The expression of programmed death-1 in circulating CD4+and CD8+T cells during hepatitis B virus infection progression and its correlation with clinical baseline characteristics[J].Gut Liver,2014,8(2):186-195.
[10] Planès R,BenMohamed L,Leghmari K,etal.HIV-1 Tat protein induces PD-L1 (B7-H1) expression on dendritic cells through tumor necrosis factor Alpha-and toll-like receptor 4-mediated mechanisms[J].J Virol,2014,88(12):6672-6689.
[11] Moret FM,van der Wurff-Jacobs KM,Bijlsma WJ,etal.Synovial T cell hyporesponsiveness to myeloid dendritic cells is reversed by preventing PD-1/PD-L1 interactions[J].Arthritis Res Ther,2014,16(6):497.
[12] Shen L,Gao Y,LiuY,etal.PD-1/PD-L pathway inhibits M.tb-specific CD4+T-cell functions and phagocytosis of macrophages in active tuberculosis[J].Sci Rep,2016,6:38362.
[13] Fontugne J,Augustin J,Pujals A,etal.PD-L1 expression in perihilar and intrahepatic cholangiocarcinoma[J].Oncotarget,2017,8(15):24644-24651.
[14] Fromentin R,Bakeman W,Lawani MB,etal.CD4+T Cells Expressing PD-1,TIGIT and LAG-3 Contribute to HIV Persistence during ART[J].PLoS Pathog,2016,12(7):e1005761.
[15] 中华人民共和国卫生部.布鲁氏菌病诊疗指南(试行)[J].传染病信息,2012,25(6):323-359.
[16] Shi H,Ye J,Teng J,etal.Elevated serum autoantibodies against co-inhibitory PD-1 facilitate T cell proliferation and correlate with disease activity in new-onset systemic lupus erythematosus patients[J].Arthritis Res Ther,2017,19:52.
[17] Lázár-Molnár E,Scandiuzzi L,Basu I,etal.Structure-guided development of a high-affinity human programmed cell death-1:implications for tumor immunotherapy[J].EBio Med,2017,17:30-44.
[18] Tang ZS,Hao YH,Zhang EJ,etal.CD28 family of receptors on T cells in chronic HBV infection:Expression characteristics,clinical significance and correlations with PD-1 blockade[J].Mol Med Rep,2016,14(2):1107-1116.
[19] Elster JD,Krishnadas DK,Lucas KG.Dendritic cell vaccines:A review of recent developments and their potential pediatric application[J].Hum Vaccin Immunother,2016,12(9):2232-2239.
[20] Hotta K,Aoyama A,Oura T,etal.Induced regulatory T cells in allograft tolerance via transient mixed chimerism[J].JCI Insight,2016,1(10):e86419.
[21] Nymo IH,Seppola M,Al Dahouk S,etal.Experimental challenge of atlantic cod (Gadus morhua) with a brucella pinnipedialis strain from hooded seal (cystophora cristata)[J].PLoS One,2016,11(7):e0159272.
[22] Corsetti PP,de Almeida LA,Carvalho NB,etal.Lack of endogenous il-10 enhances production of proinflammatory cytokines and leads to brucella abortus clearance in mice[J].PLoS One,2013,8(9):e74729.
[23] Ganji A,Mosayebi G,Ghaznavi-Rad E,etal.Evaluation of regulatory T cells in patients with acute and chronic brucellosis[J].Rep Biochem Mol Biol,2017,5(2):91-96.
[24] Park BV, Freeman ZT, Ghasemzadeh A,etal.TGF-β1-mediated Smad3 enhances PD-1 expression on antigen-specific T cells in cancer[J].Cancer Discov,2016,6(12):1366-1381.
[25] Llopiz D, Ruiz M,Infante S,etal.IL-10 expression defines an immunosuppressive dendritic cell population induced by antitumor therapeutic vaccination[J].Oncotarget,2017,8(2):2659-2671.
ExpressionofPD-1andPD-L1inpatientsinfectedwithBrucella
PANGPan,ZHANGFeng-Bo,ZHUYue-Jie,JIABin,ZHANGYue-Xin,ZHANGChun-Tao.REXITI·Fulati,DINGJian-Bing.
CollegeofPreclinicalMedicine,XinjiangMedicalUniversity,Urumqi830011,China
Objective:To investigate the roles of PD-1 and PD-L1,as well as related cytokines TGF-β and IL-10 in patients infected with Brucella.MethodsThe expression of PD-1/PD-L1 in peripheral blood mononuclear cell CD3+T cells,CD4+T cells,CD8+T cells,and dendrites cells was detected by flow cytometry in 60 patients infected with Brucella and 34 patients receiving follow-up cured and 60 healthy controls,the serum levels of TGF-β and IL-10 were detected by CBA.The correlations of PD-1 with TGF-β and IL-10 levels in patients infected with Brucella were analyzed by pearson correlation test.ResultsCompared with control,brucellosis patients had the higher PD-1/PD-L1,TGF-β and IL-10 expression (P<0.05),while in the patients receiving follow-up cured,the PD-1/PD-L1,TGF-β and IL-10 were remarkably lower than those in pretherapy (P<0.01),the change of PD-1 was positively correlated with the levels of TGF-β (r=0.817,P<0.01) and IL-10 (r=0.835,P<0.01).ConclusionHigh expression of PD-1/PD-L1 and TGF-β and IL-10 in patients with Brucella may be involved in the negative regulation of Brucella on host immune response.
PD-1;PD-L1;Brucellosis;Cytokine
10.3969/j.issn.1000-484X.2017.12.017
R392.11R378.5
A
1000-484X(2017)12-1838-05
①本文为国家自然科学基金项目(81560322)、新疆维吾尔自治区自然科学基金项目(2015211C100)和新疆医科大学科学创新基金(XYDCX201507)。
②新疆医科大学第一附属医院检验科,乌鲁木齐 830011。
③新疆医科大学第一附属医院生殖助孕科,乌鲁木齐 830011。
④新疆医科大学第一附属医院感染科,乌鲁木齐 830011。
庞 盼(1990年-),女,在读硕士,主要从事布鲁氏菌感染方面的研究,E-mail: 2449579487@qq.com。
及指导教师:丁剑冰(1960 年-),女,博士,教授,免疫教研室主任,博士生导师,主要从事感染免疫和生殖免疫方面的研究, E-mail: djbing002@sina.com。
[收稿2017-06-21 修回2017-08-08]
(编辑 倪 鹏)