不育剂膦氧氮丙啶对雄性红耳龟生殖功能的影响
傅丽容,张瑞红,龚声辉,张海会,史海涛
( 海南师范大学 生命科学学院,海南 海口 571158 )
不育剂膦氧氮丙啶对雄性红耳龟生殖功能的影响
傅丽容,张瑞红,龚声辉,张海会,史海涛
( 海南师范大学 生命科学学院,海南 海口 571158 )
给160只健康成年雄性红耳龟分别腹腔注射0.1、3 g/L和10 g/L的膦氧氮丙啶染毒15 d,每隔2 d注射1次,每次注射2 mL,对照组注射等剂量0.65% 生理盐水,于第16 d和第30 d取样检测血清、睾丸中性激素及相关蛋白含量,恢复期(第30 d和137 d)显微观察了睾丸的组织结构。试验结果表明,高质量浓度膦氧氮丙啶组红耳龟死亡;低、中质量浓度组血清及睾丸性激素含量与对照组无显著差异(P>0.05),表明膦氧氮丙啶对丘脑—垂体—性腺轴没有干扰作用。在试验第30 d,中质量浓度组睾丸及血清抑制素B含量显著低于对照组,支持细胞受损;恢复期,处理组睾丸有不同程度损伤,低质量浓度组红耳龟睾丸微中毒,生精细胞间隙增大,中质量浓度组生精细胞破坏、溶解,没有再生现象,表现不可逆伤害。膦氧氮丙啶主要通过损伤红耳龟睾丸各级生精细胞和支持细胞,破坏睾丸生精环境,导致雄性不育。
膦氧氮丙啶;雄性红耳龟;性激素;组织结构
红耳龟 (Trachemysscriptaelegans)(又称巴西龟)产自于美国中部,已成功入侵包括美国原产地以外的美洲、欧洲、亚洲、非洲、大洋洲等世界各地[1],被列为世界最危险的100个入侵物种之一[2]。红耳龟性成熟早、繁殖力强、生长速度快和食性杂,广受养殖户青睐。据调查,我国红耳龟的年产量已超过5000万只[3]。因养殖逃逸、宗教放生、宠物丢弃等行为,已在我国22个省市的104个地点发现有野外分布,覆盖面积约达3000 hm2[4-5]。红耳龟与我国14种龟的生存环境相同[5],已在我国野外成功繁殖[6-7],严重影响我国自然生态系统。因此,有效遏制红耳龟在我国野外环境的蔓延,显得尤为重要。
目前国内外非常重视红耳龟的防治工作,但行之有效的方法尚未见报道[8]。
不育防治技术在鼠害和虫害等取得较大成效,本试验试将不育防治技术应用于外来种红耳龟。
不育控制是指通过某种手段或方法使雄性或雌性个体绝育,甚至阻断幼体的发育,降低种群出生率,控制种群的数量和密度[9-10],其本质是控制生育率。不育防治的优点在于不育个体除了不能继续生殖外,还会继续获取食物、消耗资源、占领巢穴、占有配偶,保持了紧张的社群压力,限制种群的恢复和发展。不育个体通常会保持正常的性活动和性行为,能对正常个体造成一定的竞争性繁殖。
目前不育剂种类较多,尤其以雄性不育剂种类居多且效果明显。研究表明,有机磷的氮丙啶化合物的不育效果最突出[11]。刘巍[12]发现,膦氧氮丙啶直接作用于小鼠的睾丸生殖细胞,引起生精功能障碍,产生不可逆的不育。龚声辉等[13]将膦氧氮丙啶用于雄性红耳龟,可产生生殖毒性,使睾丸萎缩,生精细胞退化,精子产生受阻,产生明显的不育效应。在此基础上,本试验研究了不同时期红耳龟的生殖毒性,阐明膦氧氮丙啶对雄性红耳龟的不育作用机制及有效性,为遏制红耳龟在野外环境的蔓延提供新的线索和思路。
1 材料与方法
1.1 材料
试验用160只体质量(738.9±101.2) g的健康成体雄性红耳龟,购自海口市鸿旺水产养殖有限公司。
膦氧氮丙啶(MAPO)购自广州市齐云生物技术有限公司(生产批号SY 201309)。
投喂的饲料为文昌琼文歌颂饲料厂生产的浮性甲鱼配合饲料,含白鱼粉60%、膨化大豆3%、α-淀粉24%、啤酒酵母2%、无机盐1%等基本营养成分,不含不育剂成分和其他相似药物;0.9%氯化钠注射液(250 mL加无菌双蒸水配制为0.65%龟类生理盐水)。
睾酮(T)ELISA试剂盒、雌激素(E)ELISA试剂盒、雄激素结合蛋白(ABP)ELISA试剂盒、卵泡刺激素(FSH)ELISA试剂盒、黄体生成素(LH)ELISA试剂盒、催乳素(PRL)ELISA试剂盒和抑制素B(Inh B)均购自北京冬歌博业生物科技有限公司。
1.2 方法
试验龟先混养于160 cm×105 cm×65 cm的白色塑料水缸内,随机分为4组,每组40只,检验各组间个体体质量均一且方差齐性。根据生殖毒理学剂量设置原则,依次设置膦氧氮丙啶溶液质量浓度为0 g/L(对照组)、0.1 g/L、3 g/L、10 g/L,采用腹腔注射,1次/2 d,每次注射2 mL,对照组则注射等剂量0.65%生理盐水,处理15 d,试验周期137 d,第1~15 d为染毒期,第30~137 d为恢复检测期。
1.3 检测指标和方法
1.3.1 血清性激素检测
膦氧氮丙啶染毒处理15 d结束,于第16 d和第30 d每组随机取6只,置于-20 ℃条件下冷冻麻痹60~80 min,心脏取血10 mL,在4 ℃ 3500 r/min下离心10 min后,取上层血清,分装至2 mL离心管,置于-80 ℃环境下保存,待用相应ELISA试剂盒检测血清性激素及相关蛋白含量。
1.3.2 睾丸匀浆液制备及性激素检测
采血完毕,解剖龟体摘除左侧睾丸,剔除脂肪,用4 ℃预冷0.65%生理盐水冲洗睾丸表面,吸附表面水分,于-20 ℃下保存。按照磷酸缓冲盐溶液∶组织=9∶1的比例研磨睾丸组织,匀浆液在4 ℃、3500 r/min条件离心10 min,将上清液进行分装,置于-80 ℃环境下保存,待用相应ELISA试剂盒检测睾酮及相关激素含量。
1.3.3 睾丸脏器系数及体积
于第30 d和137 d取样6只,称量质量,-20 ℃冷冻麻痹60~80 min后,解剖摘取两侧睾丸,剔除附着的结缔组织,用4 ℃预冷生理盐水冲洗后,用滤纸吸干睾丸表面水分,称量质量,测量睾丸的前后宽、左右宽及厚度,计算睾丸脏器系数及体积。
脏器系数/%=m1/m×100%
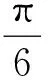
式中,m1为脏器质量,m为体质量,a为睾丸前后宽,b为睾丸左右宽,c为睾丸厚度。
1.3.4 恢复期睾丸组织病理学观察
于第30 d和第137 d摘取红耳龟右侧睾丸,置波恩氏液固定24 h,然后换成75%的乙醇溶液固定,采用苏木精—伊红染色,制作睾丸石蜡组织切片,镜检(MOTIC BA310-T),显微摄像。
1.4 数据统计分析
试验结果以平均值±标准差表示,经SPSS 16.0软件进行单因素方差分析。采用方差分析和多重比较检验不同数据间的差异显著性,P<0.05为差异显著。
2 结果与分析
2.1 膦氧氮丙啶对雄红耳龟存活率的影响
不同质量浓度膦氧氮丙啶对雄红耳龟的存活率影响较大,10 g/L组个体除在第16 d取样的6只外,在15 d的染毒期内死亡1只,停止注射后15 d内(即第16~30 d)死亡31只,随后全部死亡;整个试验期间0.1、3 g/L组,无死亡现象,存活率为100%,红耳龟的外观及行动能力,与对照组基本类似,个体健康活泼、反应迅速、行动敏捷。表明10 g/L的膦氧氮丙啶对红耳龟有伤害,膦氧氮丙啶的安全质量浓度低于3 g/L。
2.2 膦氧氮丙啶染毒期红耳龟性激素水平及相关蛋白含量
试验第16 d,雄性红耳龟血清和睾丸性激素水平及相关蛋白含量见表1。处理组睾丸睾酮、雄激素结合蛋白含量略高于对照组,睾丸抑制素B、卵泡刺激素含量略低于对照组,其变化与膦氧氮丙啶质量浓度未呈现明显的相关性。3个试验组各项指标与对照组无差异显著性(P>0.05),说明膦氧氮丙啶对红耳龟下丘脑—垂体—性腺作用轴没有明显伤害。
2.3 恢复期红耳龟性激素水平及相关蛋白含量的变化
试验第30 d雄红耳龟血清及睾丸性激素水平见表2。处理组血清性激素与对照组相比未见显著差异,睾丸性激素含量略高于对照组,其中卵泡刺激素升高26.42%,无统计学意义(P>0.05)。恢复期雄红耳龟的性激素水平再次说明,膦氧氮丙啶对睾丸损伤作用的靶细胞不是间质细胞,对红耳龟下丘脑—垂体—性腺轴无明显作用。3 g/L组的血清和睾丸抑制素B含量均显著低于对照组(P<0.05),约下降40%,说明试验后期膦氧氮丙啶对睾丸曲细精管支持细胞具有损伤作用。

表1 膦氧氮丙啶对红耳龟性激素水平及相关蛋白含量的影响(n=6)

表2 恢复期红耳龟血清激素及蛋白含量的变化(n=6)
注:*表示同行指标差异显著, ** 表示同行指标差异极显著,下同.
2.4 恢复期红耳龟睾丸组织病理学观察
第30 d和第137 d时,0.1 g/L组与对照组红耳龟的睾丸系数、附睾系数和睾丸体积均无显著差异(P>0.05)(表3),3 g/L组睾丸系数和体积明显小于对照组(P<0.05);第137 d 3 g/L组睾丸体积减小愈加明显,约为对照组的1/4(P<0.05)。解剖观察发现,对照组和0.1 g/L组红耳龟的睾丸大而圆润,富有弹性,附睾体积较大且有乳白色精液,附睾管粗而发白,说明这段时间是雄红耳龟大量产精的季节。3 g/L组红耳龟的睾丸小而质硬,无弹性,附睾小而萎缩,未见精液,说明恢复期膦氧氮丙啶对睾丸损伤作用未恢复。

表3 恢复期红耳龟睾丸形态指标统计(n=6)
组织病理观察发现,第30 d对照组红耳龟的睾丸曲细精管各级生精细胞发育正常,排列紧密,管腔内偶见精子(图1a),0.1 g/L组各级生精细胞正常,细胞之间的间隙增大,管腔中央未见精子(图1b),3 g/L组生精细胞被破坏、溶解,数量明显减少,无精子,可见外层支持细胞(图1c);第137 d对照组曲细精管生精细胞发育正常,管腔可见大量精子,0.1 g/L组生精细胞数量减少,管腔可见发育精子,3 g/L组支持细胞多见胞质有明显空泡,数量减少。恢复期第30 d和第137 d,膦氧氮丙啶质量浓度为3 g/L时,致雄性个体睾丸生精细胞发生病理性改变,与染毒期睾丸发生的组织病理类似,属不可逆损伤。

图1 恢复期红耳龟睾丸组织结构第30 d睾丸组织结构:a. 对照组(示各级生精细胞和精子),b. 0.1 g/L组曲细精管生精细胞间隙增大,c. 3 g/L组(箭头示曲细精管生精上皮细胞减少);第137 d睾丸组织结构:d. 对照组(示各级生精细胞和精子),e. 0.1 g/L组(示生精细胞和部分精子),f. 3 g/L组(箭头示外层支持细胞空泡);皆为400×.
3 讨 论
3.1 膦氧氮丙啶对红耳龟的不育效应
不育剂防治有害生物较为经济、安全、作用周期长,受到国内外有关专家的大力推荐[14]。理想不育剂的特点之一是低剂量且一次使用即可终身绝育[15]。本试验中,采用合理的剂量和适当的给药方法可在不影响红耳龟生长发育的基础上,达到不育的效应。质量浓度3 g/L可作为膦氧氮丙啶不育防制外来物种红耳龟的推荐剂量。
3.2 膦氧氮丙啶影响红耳龟生殖功能的机制
动物脏器的质量及形态是衡量动物健康与否的重要指标之一[16],其脏器系数可近似反映该脏器的功能状态和病变情况[17]。龚声辉等[13]检测发现,膦氧氮丙啶处理第16 d时,红耳龟睾丸体积及脏器系数随着处理质量浓度增加呈明显下降趋势。本试验中,第30 d和第137 d的检测结果与此一致,结合睾丸组织病理学观察,表明膦氧氮丙啶对红耳龟睾丸曲细精管生精细胞具有毒性作用。
睾丸的主要生理功能是曲细精管生精和间质细胞产生睾酮。不同试验阶段的睾丸组织病理学观察显示,膦氧氮丙啶的作用靶细胞是曲细精管内的各级生精细胞,对间质细胞作用不敏感。第16 d和第30 d两次血清和睾丸性激素水平的检测表明,下丘脑—垂体—性腺轴没有受到干扰,睾酮水平没有显著性变化,也验证了这一结果。刘巍等[12,18]研究了膦氧氮丙啶对雄小鼠生殖功能的影响,认为生殖细胞对膦氧氮丙啶毒性作用比较敏感,膦氧氮丙啶能穿过血—睾屏障,对其生殖细胞具有诱变性,其诱变作用可以直接造成各级生精细胞数量减少,甚至退化,导致不育。推测膦氧氮丙啶对雄性红耳龟也具有类似的生殖毒性。
血清抑制素B水平可直接反映睾丸功能和生精上皮状态,是评价精子发生状态的血清学标志物[19]。染毒期(第16 d)各处理组雄激素结合蛋白和抑制素B含量没有明显变化,第30 d时抑制素B含量降低约40%,与该时期支持细胞数量减少、空泡化严重密切相关。支持细胞为睾丸营养细胞,使精子发生,促进精子成熟[20],支持细胞数目降低势必影响精子的产量[21]。膦氧氮丙啶破坏支持细胞,加剧了红耳龟生精功能的障碍。
综上所述,膦氧氮丙啶可使雄红耳龟生殖能力下降,甚至不育,能保持正常发情及性活动。养殖场的红耳龟售前进行不育处理,将有效阻止逃逸、放生个体参与与野外种群的繁殖,干预野外可育个体的繁殖,有效控制该物种在野外迅速蔓延的态势,降低红耳龟对入侵地生态环境的危害。
[1] Newberry R. The American red-eared terrapin in South Africa [J]. African Wildlife,1984(385): 186-189.
[2] ISSG/SSC. 100 of the world′s worst invasive species [J]. Species, 2001(35):5.
[3] 王宁, 杨懿萱. 巴西龟入侵中国[N]. 北京科技报, 2009-05-25(34).
[4] 史海涛, 龚世平, 梁伟, 等. 控制外来物种红耳龟在中国野生环境蔓延的态势[J]. 生物学通报, 2009, 44(4):1-3.
[5] 刘丹, 史海涛, 刘宇翔,等. 红耳龟在我国分布现状的调查[J]. 生物学通报, 2011, 46(6):18-21.
[6] 李闯. 海南万泉河红耳龟(Trachemysscriptaelegans)野外繁殖研究[D]. 海口:海南师范大学, 2013:1-58.
[7] 周鹏. 广东古田外来物种红耳龟的家域及野外繁殖研究[D]. 海口: 海南师范大学, 2013:1-67.
[8] 徐婧,周婷,叶存奇, 等. 龟类外来种的生物入侵隐患及其防治措施[J]. 2006, 25(2):420-422.
[9] Zhang Z. Mathematical models of wildlife management by contraception [J]. Ecol Model, 2000, 132(1):105-113.
[10] 刘汉武, 王荣欣, 张凤琴, 等. 我国害鼠不育控制研究进展[J]. 生态学报. 2011, 31(19):5484-5494.
[11] 杨石先, 李玉桂. 昆虫化学不育剂进展—兼论含磷乙烯亚胺化合物特性[J]. 农药, 1979, 18(4): 503-504.
[12] 刘巍. MOO1雄性不育灭鼠剂的生殖毒性研究及其在农业鼠害防治方面的应用[D]. 北京: 中国协和医科大学, 2006:1-89.
[13] 龚声辉,傅丽容,张海会,等. 磷氧氮丙啶不育剂对雄性红耳龟生殖毒性研究[J]. 四川动物, 2015, 34(5):677-682.
[14] 杨新根, 侯玉, 朱文雅, 等. 雄性不育剂对农田害鼠的防控效果[J]. 山西农业科学, 2012, 40(10):1095-1098.
[15] Marsh R E. Chemosterilants for rodent control in rodent pest management [M]. Flotrida: Prakash, CRC Press, 1988:353-367.
[16] 田永路, 于洪江, 张希牧, 等. 5~7 周龄SD和Wistar大鼠主要脏器系数及体尺的测定[J].实验动物科学, 2009, 26(6):21-25.
[17] 陈贤均, 赵红刚. 盐制杜仲对小鼠生长发育与脏器系数的影响[J]. 四川中医, 2005, 23(11):29-31.
[18] 王爱平, 张清林, 黄春倩, 等.膦氧氮丙啶对雄性小鼠的生殖毒性研究[J]. 中国公共卫生学报, 1992, 11(5):302.
[19] 蔡开来. 抑制素对小鼠卵泡发育和精子发生的分子和细胞调控机制研究[D]. 武汉: 华中农业大学,2011:4-5.
[20] Berger T, Kentfield L M, Roser J F, et al. Stimulation of sertoli cell proliferation: defining the response interval to an inhibitor of estrogen synthesis in the boar[J]. Reproduction, 2012, 143(4):15-20.
[21] Cyr D G. Connexins and pannexins: coordinating cellular communication in the testis and epididymis[J]. Spermatogenesis, 2011, 1(4):325-328 .
EffectofSterilantPhosphineOxideAziridine(MAPO)onReproductiveFunctioninMaleAmericanRed-earedTerrapinTrachemysscriptaelegans
FU Lirong, ZHANG Ruihong, GONG Shenghui, ZHANG Haihui, SHI Haitao
( College of Life Science, Hainan Normal University, Haikou 571158, China )
A total of 160 individuals of healthy adult male American red-eared terrapinTrachemysscriptaeleganswith body weight of (738.9±101.2) g was randomly divided into control group in which the terrapin was injected with 0.65% physiological saline solution (n=40), and three treated groups (n=40,for each group) in which the terrapin was injected intraperitoneally with 2 mL of phosphine oxide aziridine (MAPO) solution at a concentration of 0.1 g/L, 3 g/L and 10 g/L once in 2 day interval for 15 d to study the effect of MAPO on reproductive function in male terrapins and to explore an effective approach to prevent American red-eared terrapin from prevailing. The levels of hormones and relative proteins in serum and testis were measured in 16 d and 30 d, and testicular tissue structures were histologically observed by a microscope during recovery periods (30 d and 137 d). The results showed that high dose of MAPO led to death of the terrapin, and the level of sex hormone in serum and testis was not differed (P>0.05) in both low dose group and middle dose group compared with the control group in 16 d and 30 d, indicating that MAPO has no interference effect on hypothalamic-pituitary-gonadal axis. However, there was significantly lower serum inhibin B in middle dose group than that in the control group in 30 d, suggesting that sertoli cells were damaged. Moreover, the various pathological damages were observed in the testis in treatment groups during recovery periods, with increase in the spermatogenic cell gaps, and slightly toxic in low dose group. The spermatogenic cells were destructive, and dissolution in middle dose group, implying an irreversible damage. In conclusion, MAPO leads to infertility of male American red-eared terrapin by damaging testicular spermatogenic cells, sertoli cells, and the spermatogenic environment, so that MAPO can be used as a potential infertility drug to prevent the species from prevailing.
phosphine oxide aziridine;Trachemysscriptaelegans; sex hormone; tissue structure
10.16378/j.cnki.1003-1111.2017.06.018
S966.5
A
1003-1111(2017)06-0794-05
2016-09-13;
2016-12-11.
国家自然科学基金资助项目(31772486);海南省自然科学基金资助项目(314078).
傅丽容(1964-), 女, 教授; 研究方向:龟鳖动物生理学. E-mail: flr@hainnu.edu.cn. 通讯作者:史海涛(1963-),男,教授;研究方向:两栖爬行动物生态学与保护生物学.E-mail: haitao-shi@263.net

