一磷酸腺苷激活的蛋白激酶对动物糖脂代谢的调节作用
高晓娜 郭小权
(江西农业大学动物科学技术学院,南昌 330045)
一磷酸腺苷激活的蛋白激酶对动物糖脂代谢的调节作用
高晓娜 郭小权*
(江西农业大学动物科学技术学院,南昌 330045)
一磷酸腺苷激活的蛋白激酶(AMPK)广泛存在于真核细胞中,AMPK的活性受一磷酸腺苷(AMP)/三磷酸腺苷(ATP)的调节,应激反应可通过ATP的产生减少或消耗使细胞内AMP/ATP增加,从而激活AMPK。激活的AMPK可通过磷酸化下游靶蛋白,改变脂类和碳水化合物代谢,使其朝着抑制ATP消耗过程、促进ATP生成反应的方向进行,即抑制脂肪酸和糖原合成,促进脂肪酸氧化分解和葡萄糖的吸收,从而迅速恢复细胞中的能量,因此AMPK被称为“细胞能量调节器”,在动物适应环境的过程中发挥着重要的作用。本文在国内外已有文献报道基础上,对AMPK的结构、分布、活性调节及对糖脂代谢的调节作用进行综述。
一磷酸腺苷激活的蛋白激酶;动物;糖代谢;脂代谢
动物机体代谢调节的有效性和协调性是动物体适应环境变化的重要机制,而动物体内糖脂代谢紊乱则会引起一系列代谢紊乱症候群。当机体摄入过多的营养而能量利用减少时,剩余的能量以脂肪和糖原的形式贮存于动物体内,引起过多的脂肪囤积,导致代谢紊乱。一磷酸腺苷激活的蛋白激酶(AMP-activated protein kinase,AMPK)作为丝氨酸家族的一员,表达于各种器官中,是一种对细胞的能量状态非常敏锐的多亚基酶,能够根据机体细胞的能量状态调节代谢产能和耗能的方向,在控制细胞内能量流动方向起着重要作用[1]。AMPK不仅可以在细胞水平作为能量的感受器,还可以通过激素和细胞因子,如瘦素和脂联素,来参与调节机体的能量消耗和能量摄入,是研究糖尿病、非酒精性脂肪肝及其他代谢相关疾病的核心[2]。近年来,由于肥胖、糖尿病和代谢综合征在全球呈爆发流行趋势,AMPK在糖脂代谢中的作用引起了人们的广泛关注,成为生物化学和生物医学的热点研究领域。本文总结了AMPK的研究进展,就AMPK在机体糖脂代谢中的作用做一综述与分析,并为动物生产过程中应激和营养代谢病等疾病提供新的研究思路。
1 AMPK的分子结构和分布特点
AMPK是一个异源三聚体蛋白质,由α、β和γ 3个亚基组成的异源三聚体。α亚基为催化亚基,分子质量为63 ku,有2个功能区:N端催化核;C端负责与β亚基和γ亚基相结合和调节AMPK活性[3]。β亚基和γ亚基为调节亚基,其分子质量分别为38和35 ku。β亚基和γ亚基在维持AMPK的稳定性以及激酶底物的特异性中起着重要的作用,β亚基是AMPK结合到膜糖原的功能区,γ亚基负责与一磷酸腺苷(AMP)结合,而AMPK活性需要3个亚基共同表达[4]。
AMPK的3个亚基各有不同的亚型。α亚基有2种不同的亚型,即α1和α2。α1的分布很广,肝脏、肺脏、肾脏、睾丸以及脑中均有α1分布,而α2主要分布于肝脏、骨骼肌和心肌中。α2对AMP的依赖性比较强,而α1则对蛋白磷酸酶2A(protein phosphatase 2A,PP2A)的去磷酸化作用具有很强的抵抗力,这两者的差异可能是由于不同组织的AMPK各亚基的类型分布不同以及AMPK对不同底物作用的程度不同引起的。β亚基有2种亚型,即β1和β2。β1主要存在于大鼠肝脏中,而β2则在骨骼肌和心肌中大量表达。γ亚基目前已知有3种亚型,分别为γ1、γ2和γ3。γ1和γ2分布较广,大部分的组织器官中均有γ1和γ2的分布,而γ3则主要在骨骼肌中表达[5],γ2对AMP的依赖性很强,可能参与同AMP的结合。
2 AMPK活性调节
2.1 通过AMP/三磷酸腺苷(ATP)调节
在动物体内,AMPK的活性主要受机体内能量水平调节,即主要受细胞中AMP/ATP的调节。当机体内能量被消耗,导致体内的ATP水平降低,AMP水平升高时,AMPK的活性升高,使体内代谢朝着促进ATP的生成、抑制ATP的消耗方向进行,从而维持细胞能量水平[1]。在生理条件下,细胞会维持高浓度的ATP水平以维持机体基本的代谢需要。
研究发现,AMP是AMPK的特异性激活剂,AMP既可作为AMPK的变构活化剂,又影响AMPK激酶(AMPKK)磷酸化AMPK,但是其机理并不十分清楚。随后的研究发现,AMP具有4个方面的作用:1)作为AMPK的直接变构激活剂;2)结合去磷酸化的AMPK,使其成为AMPKK的更佳的底物;3)与磷酸化的AMPK相结合,使其成为蛋白磷酸酶2C(PP2C)的更差的底物;4)直接激活AMPKK。AMP调节AMPK活性的模式见图1。AMPK存在2种构象——活跃的R构象和不活跃的T构象,同时存在2种磷酸化形式——磷酸化AMPK和非磷酸化AMPK,2种构象和2种磷酸化形式共组成4种形式[T、R、T(P)和T(R)]。只有在R构象时AMPKK才可使非磷酸化形式的AMPK磷酸化,而只有在T(P)构象时才会使磷酸化AMPK脱磷酸化。
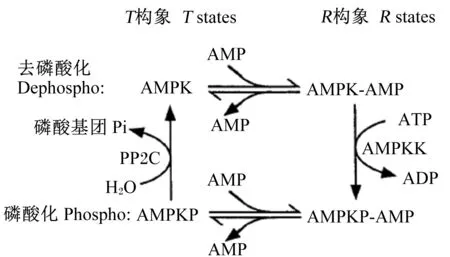
图1 AMP调节AMPK的作用模式
但是AMP作用的受高浓度的ATP抑制,高浓度的ATP会抑制AMP对AMPK的变构激活和磷酸化,而且还可以通过AMPKK抑制AMPK的活化。因此,AMPK活性通过影响AMP/ATP,并不是AMP本身来发挥调控作用。
AMPK可以被大量包括代谢毒物在内的消耗ATP的细胞应激激活,例如三羧酸循环抑制剂(亚砷酸盐)、呼吸链抑制剂(抗霉素A、叠氮化物)或线粒体ATP合酶抑制剂(寡霉素),以及氧化磷酸化的解偶联物如二硝基苯酚[6-7]。AMPK也可以被葡萄糖缺乏、缺血、缺氧、氧化应激等病理应激激活[8]。以上刺激因素均可以增加AMP/ATP,从而激活AMPK。
正常生理条件下,AMPK的激活是通过骨骼肌的运动或收缩引起的,AMPK的活化程度取决于运动强度,并且被认为是由AMP/ATP变化诱导的。AMPK活化后抑制ATP消耗并激活碳水化合物和脂肪酸代谢以恢复肌肉中的ATP水平。
2.2 通过非依赖AMP通路调节
有研究发现,治疗二型糖尿病药物二甲双胍和噻唑烷二酮类药物有激活AMPK的作用,噻唑烷二酮类药物对AMPK的激活依赖AMP,增加AMP/ATP,但二甲双胍对AMPK的激活并不依赖AMP,不会引起增加AMP/ATP改变[8]。Hawley等[9]研究发现二甲双胍通过增加AMPK催化α亚基苏氨酸(Thr)172位点的磷酸化激活AMPK。
近几年研究发现,AMPK也部分介导瘦素、脂联素以及肾上腺素等的降脂效果。瘦素是一种脂肪细胞分泌激素,可调控食物摄取,调节能量消耗,在神经内分泌功能中也起着关键的作用。研究发现,瘦素选择性的刺激骨骼肌中AMPK α2亚基的活化和磷酸化,瘦素对AMPK的激活存在双重效应,早期瘦素在肌肉水平上激活AMPK,后期通过介导下丘脑-交感神经系统轴抑制AMPK活性,引起摄食减少和体重下降[10]。脂联素是一种由脂肪细胞分泌的因子,其在大分子复合物循环、增加脂肪酸氧化和葡萄糖摄取、抑制糖异生等生理活动中发挥着重要的作用[11]。脂联素在体内和体外均能促进AMPK的磷酸化而激活AMPK,但其激活AMPK的具体机制目前仍不清楚。
5-氨基-4-咪唑羧基酰胺核苷(aminoimidazole-4-carboxamide riboside,AICAR)是肌苷单磷酸的生成中的中间体,可被细胞吸收并迅速磷酸化为单核苷酸衍生物(ZMP),ZMP对AMPK的激活效应与AMP类似。AICAR活化AMPK时并不影响AMP、ADP和ATP的浓度,系统研究AMP和ZMP的特征后发现二者的最大激活效应相同,同样影响专一产物的饱和曲线,且二者在同一变构位点结合,因此AMP和AMP的作用具有可加性与竞争性[12]。与AMP相比,ZMP可以以稳定的浓度在细胞内维持较长时间,而AMP在细胞内的代谢半衰期很短,所以AICAR被广泛用作AMPK的特异性激活剂。
迄今为止,在试验动物中对AMPK上游的AMPKK的认识还很匮乏,已知AMPKK是一种大小接近于AMPK的多肽,分子质量为58 ku,AMPKK与AMPK的区别是AMPKK的活性调节对一系列的蛋白磷酸酶不敏感,而且目前并未发现其受磷酸化调节。有研究发现,AMPKK可在AMPK的α亚基的Thr172位点磷酸化AMPK,但是其具体机制目前尚不清楚。最近发现一种肿瘤抑制性激酶——LKB1可催化AMPKα亚基中Thr172位点,激活AMPK,其机制与AMPKK相似。研究发现,与正常表达LKB1的细胞相比缺失LKB1的细胞中AMPK的活性显著降低[13]。但是LKB1的活性并不受激活AMPK的刺激直接调节,也不受AMP直接激活。研究发现,LKB1可通过磷酸化AMPK的Thr172位点激活AMPK,表明LKB1可作为AMPK的上游激酶。多种应激刺激LKB1缺陷小鼠的胚胎成纤维细胞发现,Thr172位点的磷酸化以及下游AMPK的信号几乎完全消失,因此LKB1作为AMPK的上游因子而被广泛研究[14]。
复合物C(compound C)是AICAR诱导AMPK磷酸化的特异性抑制剂,并证明可以阻断AICAR对大鼠脂肪细胞的抗脂肪分解作用,此外,compound C还可抑制AICAR和二甲双胍对乙酰辅酶A羧化酶(ACC)的磷酸化作用。研究证明,compound C可以抑制AICAR引起的动物的食量减少和体重下降[15]。Xu等[16]通过给小鸡脑室内注射compound C发现,compound C可以显著引起小鸡的采食量下降,因此compound C被广泛用于AMPK的特异性抑制剂。
3 AMPK对营养代谢的调节作用
3.1 AMPK对脂质代谢的影响
AMPK是维持动物体内能量代谢的关键物质。AMPK活化后抑制消耗ATP的合成过程,如脂肪酸合成;启动生成ATP的分解代谢过程,如脂肪酸氧化,从而维持机体的能量代谢平衡,因此AMPK被称为“细胞能量调节器”。
研究发现,活化后的AMPK可在体内的多种组织器官中调控糖代谢和脂质代谢。AMPK在作为中枢器官的大脑中,可调控机体对于食物的摄取;调节骨骼肌中的脂肪酸氧化,同时可调节葡萄糖的摄取水平从而调控机体对能量的消耗水平;活化的AMPK可促进肝脏中的脂肪酸氧化,抑制脂肪生成;同时,活化后的AMPK可抑制胰岛中胰岛素的分泌[4]。AMPK的激素调节见图2。
3.1.1 通过ACC调节脂肪酸合成
ACC是调控脂肪酸合成的关键酶。ACC主要以ACC-α和ACC-β 2种同工型的形式存在于动物体内,不同组织内ACC的存在形式不同。肝脏、棕色脂肪组织和大脑同时含有ACC-α和ACC-β 2种同工型,骨骼肌和心肌主要包含ACC-β,而白色脂肪组织则主要包含ACC-α。ACC-α和ACC-β 2种同工型在动物体内发挥不同的作用,ACC-α可催化生成丙二酸单酰辅酶A(malonyl-CoA),主要参与脂肪酸的合成,而ACC-β催化乙酰辅酶A羧化为丙二酰辅酶A,通过变构抑制肉碱棕榈酰转移酶1(carnitine palmitoyl transterase-1,CPT1)的活性,从而参与脂肪酸的氧化分解[17]。早期从泌乳大鼠乳腺分离纯化ACC肽链的研究发现,AMPK在丝氨酸(Ser)79、Ser1200和Ser1215共3个位点磷酸化ACC,其中Ser79位点对ACC活性的影响最大[18]。最近研究发现,细胞应激以及AMPK特异性激活剂AICAR处理等会导致大鼠肝细胞AMPK活性增加的刺激,可通过磷酸化ACC-α使其失活,从而抑制脂肪酸的合成[19]。体内试验也同样证明了活化后的AMPK可使ACC磷酸化,从而降低ACC的活性[20]。
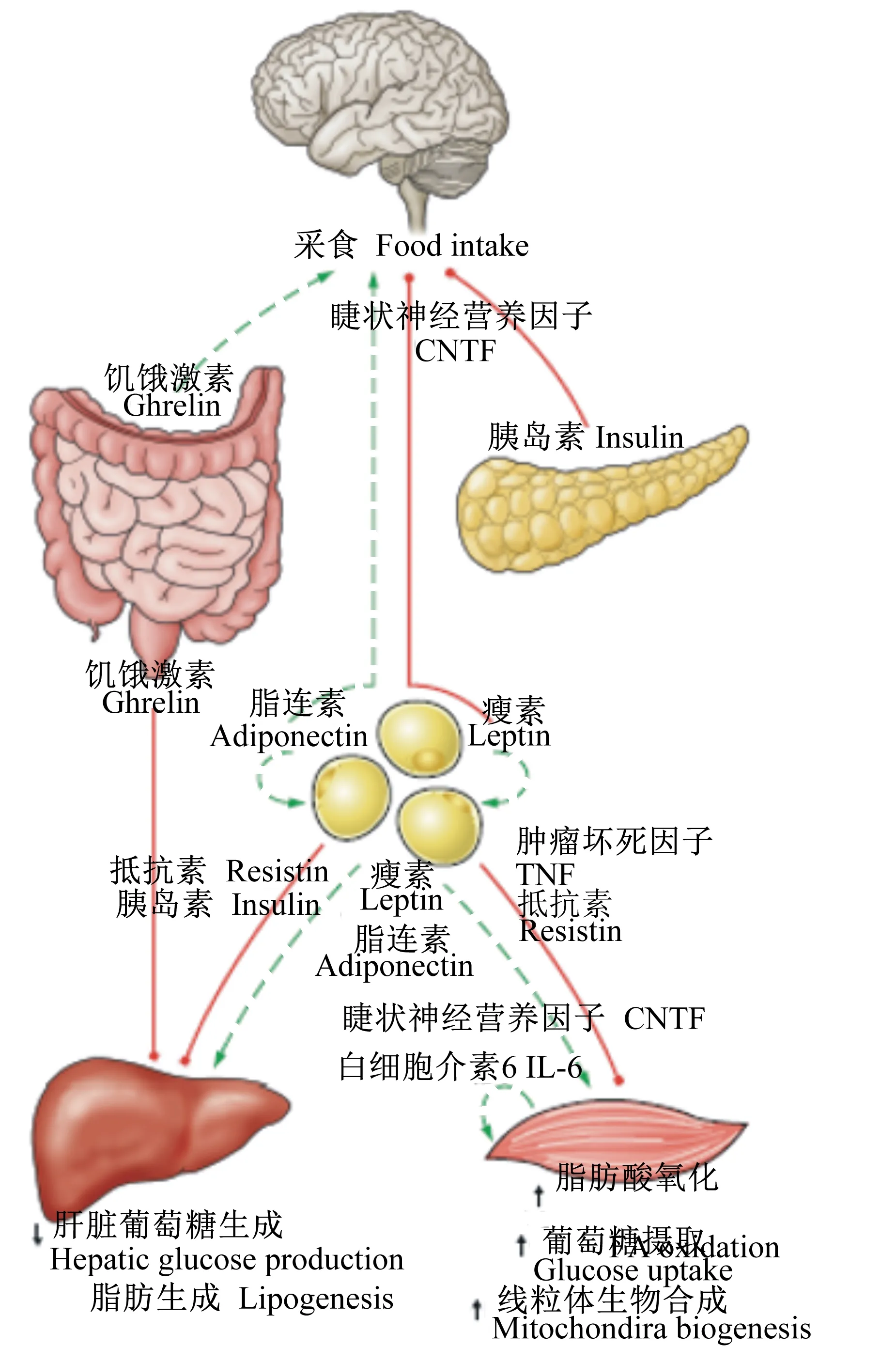


图2AMPK的激素调节
Fig.2 Hormonal regulation of AMPK[4]
脂肪酸合酶(fatty acid synthase,FAS)是在脂肪生成组织例如肝脏和脂肪中发现的多功能酶,其主要作用是利用乙酰辅酶A和丙二酰辅酶A作为底物催化长链脂肪酸(主要是棕榈酸)的合成,在脂肪酸的合成过程中发挥着重要的作用。Foretz等[21]和Kamikubo等[22]发现AMPK参与FAS基因表达的调节,AMPK活化后抑制葡萄糖刺激的基因转录。
3.1.2 通过3-羟基-3-甲基戊二酸单酰辅酶A还原酶(HMGR)影响胆固醇合成
HMGR是AMPK的一种作用底物,主要作用是调节胆固醇的合成,也是第1个被发现的AMPK的作用底物。目前研究发现,AMPK通过磷酸化HMGR肽链中的Ser871位点抑制HMGR的催化活性,消耗ATP的过程中HMGR的活性降低,并且转染细胞后发现,HMGR的Ser871位点的突变导致消耗ATP过程中AMPK的活化对HMGR的抑制不敏感[23]。有研究发现磷酸化的Ser871位点在体内HMGR的运转中不起作用,且当细胞与甲羟戊酸盐、25-羟基胆固醇或低密度脂蛋白(LDL)一起孵育时HMGR的Ser871位点突变体的转录后反馈正常下调。Li等[24]发现脂肪变性细胞中AMPKα的表达量下降,而HMGR的表达量上升。脂联素激活AMPK并减少载脂蛋白E(ApoE)缺陷小鼠中的胆固醇合成发现表明,HMGR通过AMPK的激素调节可能是调节体内胆固醇代谢的关键[25]。研究发现,轻度热应激时,AMPK部分被活化,脂肪酸合成被部分抑制,而胆固醇的合成并没有被抑制;但当重度热应激时,AMPK的活化程度非常高,同时抑制了脂肪酸和胆固醇的合成,说明HMGR对AMPK的活性变化敏感度不如ACC高[19]。
3.1.3 通过激素敏感酯酶(HSL)影响脂酰甘油酯和胆固醇脂水解
HSL是动物体内脂酰甘油酯和胆固醇脂的水解酶。尽管几十年前研究人员就已经发现了脂肪组织对分解代谢刺激敏感,但是近些年才将激素敏感酯酶从大鼠附睾脂肪垫中纯化出来。有研究发现,通过cAMP升高剂(例如肾上腺素、胰高血糖素)刺激细胞在cAMP依赖性蛋白激酶介导的Ser563位点处引起HSL的磷酸化而促进脂肪分解。但是AMPK在几乎与其相邻的位点(Ser565)处磷酸化HSL,虽然对HSL活性没有直接影响,但是完全抑制由cAMP依赖性蛋白激酶介导的磷酸化和活化。通过cAMP依赖性蛋白激酶在Ser563位点上促进HSL的磷酸化,但还通过AMPK在Ser565位点处抑制HSL的磷酸化,这说明HSL的这2个位点的作用是相反的[26]。AMPK在Ser565位点磷酸化HSL,Ser563位点就不再被PKA磷酸化,抑制了脂质的分解。Roepstorff等[27]研究发现,运动后骨骼肌中AMPKα2的活性升高,抑制了HSL的活性,进而抑制脂肪的分解。
3.1.4 通过甘油磷酸酰基转移酶(GPAT)影响甘油三酯合成
研究发现,GPAT是脂肪酸酰基化和甘油三酯合成的关键酶。Hammond等[28]发现GPAT缺失型小鼠的体重降低,脂肪组织的含量降低,同时肝脏内的甘油三酯含量降低,而GPAT过表达小鼠体内脂肪酸氧化减少而甘油三酯的酯化增强。Deborah等[29]通过向体外培养的大鼠肝细胞中添加AICAR发现培养60 min时线粒体GPAT活性降低29%~43%,当培养时间达到90 min时,结合到甘油三酯中的[3H]甘油和[14C]油酸的量分别降低38%和50%,并且结合到甘油二酯的[14C]的量降低60%。Saha等[30]发现,当给大鼠饲喂低剂量的AICAR时GPAT的活性降低,提示CPAT的活性变化可能由AMPK介导。Muoio等[31]发现,CPT1和GPAT都存在于线粒体外膜上,CPT1和GPAT的活性可能决定酰基辅酶A的代谢方向,当AMPK活性升高引起的GPAT失活后不仅抑制了脂肪酸的合成,而且还通过降低了GPAT与CPT1竞争酰基辅酶A的能力,促进了脂肪酸的氧化分解。
3.1.5 促进脂肪酸氧化
研究发现,AMPK可通过AMPK-ACC-丙二酸单酰辅酶A-CPT1途径调节脂肪酸氧化。CPT1可将长链脂肪酸从肉碱运送到线粒体中进行β-氧化。丙二酸单酰辅酶A是CPT1是生理抑制剂,主要功能是调节脂肪酸的氧化分解,正常生理条件下,细胞中的高水平的丙二酸单酰辅酶A可变构抑制CPT1,从而使脂肪酸氧化分解程度降低[32]。当机体应激或添加AMPK激活剂时,体内AMPK的活性升高,抑制ACC的活性,导致丙二酸单酰辅酶A的活性降低,减轻对CPT1的变构抑制,促进线粒体脂肪酸的β-氧化。研究发现,体外培养的人脐静脉内皮细胞用AICAR处理2 h后,AMPK的活性升高,ACC的活性下降,丙二酸单酰辅酶A的浓度也随之下降,棕榈酸氧化升高[33]。Tan等[34]发现饲喂高脂饲粮后小鼠体内AMPK的活性降低,ACC的活性升高。Atkinson等[35]研究发现,ACC-β基因敲除小鼠的采食量升高,但是体内的脂肪含量降低,这表明ACC-β基因敲除后加快脂肪酸的氧化速率,进而导致体内脂肪囤积减少。
3.2 AMPK对糖代谢的影响
3.2.1 促进葡萄糖吸收
有研究发现,肌肉收缩以及AICAR刺激均能增加大鼠骨骼肌AMPK的活性,促进大鼠肌肉细胞对葡萄糖的吸收,但是其机制与胰岛素促进葡萄糖吸收的机制不同。胰岛素主要通过激活磷脂酰肌醇-3-激酶(PI3K)促进葡萄糖吸收,但是PI3K的抑制剂可抑制胰岛素的作用,胰岛素抵抗会引起葡萄糖的吸收发生紊乱[36]。Winder等[37]发现AICAR作用于大鼠心肌细胞可提高葡萄糖的吸收量,且此作用不受PI3K的抑制的影响,但是可被AMPK的抑制剂所抑制。研究发现,AICAR可促进葡萄糖转运蛋白4(GLUT4)由胞内向浆膜转移,证实AMPK的作用与GLUT4有关。
3.2.2 抑制糖原合成
AMPK对糖原代谢调节的作用目前被广泛研究,研究发现AMPK在Ser7位点磷酸化糖原合成酶(GS)从而抑制其活性[38]。几年后,Young等[39]进一步证明了AMPK在糖原代谢中的作用,表明通过AICAR在大鼠肌肉细胞中激活AMPK引起糖原磷酸化酶(GP)活性的增加。Vincent等[40]体外培养大鼠肝细胞发现,向培养液中加入100 μmol/L AICAR可使葡萄糖的生成量降低50%,当加入500 μmol/L AICAR时葡萄糖的生成被完全抑制,说明AMPK可抑制葡萄糖的合成。Wang等[41]研究发现,饲粮中添加AMPK抑制剂时可抑制糖原合成酶的活性,明显降低肝糖原的含量。
4 小 结
AMPK是一种能被腺苷一磷酸激活的蛋白激酶,是蛋白激酶级联系统中的中心元件,是细胞内的能量感受器,可调节肝脏、下丘脑等多种外周组织的代谢状态。活化的AMPK可抑制脂肪和糖原合成,促进脂肪酸氧化和葡萄糖的吸收,对胰岛素抵抗和糖尿病有明显的缓解作用。现有的研究证明了AMPK介导了机体主要糖脂代谢组织的代谢调控过程,虽然在试验动物或人医方面的研究不能完全适用于家畜,但是有关AMPK的研究结果可能为研究动物生产中的问题提供新的思路。随着AMPK的研究越来越深入,弄清楚AMPK在营养代谢疾病中的作用将十分重要。
[1] HARDIE D G,CARLING D.The AMP-activated protein kinase-fuel gauge of the mammalian cell?[J].European Journal of Biochemistry,1997,246(2):259-273.
[2] THOMAS A,BELAIDI E,MOULIN S,et al.Chronic intermittent hypoxia impairs insulin sensitivity but improves whole-body glucose tolerance by activating skeletal muscle AMPK[J].Diabetes,2017,doi:10.2337/db17-0186.
[3] ADAMS J,CHEN Z P,VAN DENDEREN B J,et al.Intrasteric control of AMPK via the γ1 subunit AMP allosteric regulatory site[J].Protein Science,2004,13(1):155-165.
[4] STEINBERG G R,KEMP B E.AMPK in health and disease[J].Physiological Reviews,2009,89(3):1025-1078.
[5] CHEUNG P C,SALT I P,DAVIES S P,et al.Characterization of AMP-activated protein kinase gamma-subunit isoforms and their role in AMP binding[J].Biochemical Journal,2000,346:659-669.
[6] CARLING D.The AMP-activated protein kinase cascade-a unifying system for energy control[J].Trends in Biochemical Sciences,2004,29(1):18-24.
[7] HARDIE D G.The AMP-activated protein kinase pathway-new players upstream and downstream[J].Journal of Cell Science,2004,117(23):5479-5487.
[8] FRYER L G D,PARBU-PATEL A,CARLING D.The Anti-diabetic drugs rosiglitazone and metformin stimulate AMP-activated protein kinase through distinct signaling pathways[J].Journal of Biological Chemistry,2002,277(28):25226-25232.
[9] HAWLEY S A,GADALLA A E,OLSEN G S,et al.The antidiabetic drug metformin activates the AMP-activated protein kinase cascade via an adenine nucleotide-independent mechanism[J].Diabetes,2002,51(8):2420-2425.
[10] MINOKOSHI Y,KIM Y B,PERONI O D,et al.Leptin stimulates fatty-acid oxidation by activating AMP-activated protein kinase[J].Nature,2002,415(6869):339-343.
[11] GOLDSTEIN B J,SCALIA R.Adiponectin:a novel adipokine linking adipocytes and vascular function[J].Journal of Clinical Endocrinology & Metabolism,2004,89(6):2563-2568.
[12] VIOLLET B,HORMAN S,LECLERC J,et al.AMPK inhibition in health and disease[J].Critical Reviews in Biochemistry and Molecular Biology,2010,45(4):276-295.
[13] SHAW R J,KOSMATKA M,BARDEESY N,et al.The tumor suppressor LKB1 kinase directly activates AMP-activated kinase and regulates apoptosis in response to energy stress[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(10):3329-3335.
[14] HONG S P,LEIPER F C,WOODS A,et al.Activation of yeast Snf1 and mammalian AMP-activated protein kinase by upstream kinases[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(15):8839-8843.
[15] HAYES M R,SKIBICKA K P,BENCE K K,et al.Dorsal hindbrain 5′-adenosine monophosphate-activated protein kinase as an intracellular mediator of energy balance[J].Endocrinology,2009,150(5):2175-2182.
[16] XU P W,SIEGEL P B,DENBOW D M.AICAR and compound C regulate food intake independently of AMP-activated protein kinase in lines of chickens selected for high or low body weight[J].Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology,2011,159(4):401-412.
[17] ZHOU B,ZHOU D L,WEI X H,et al.Astragaloside IV attenuates free fatty acid-induced ER stress and lipid accumulation in hepatocytes via AMPK activation[J].Acta Pharmacologica Sinica,2017,38(7):998-1008.
[18] MUNDAY M R,CAMPBELL D G,CARLING D,et al.Identification by amino acid sequencing of three major regulatory phosphorylation sites on rat acetyl-CoA carboxylase[J].European Journal of Biochemistry,1988,175(2):331-338.
[19] CORTON J M,GILLESPIE J G,HARDIE D G.Role of the AMP-activated protein kinase in the cellular stress response[J].Current Biology,1994,4(4):315-24.
[20] WINDER W W,HARDIE D G.AMP-activated protein kinase,a metabolic master switch:possible roles in type 2 diabetes[J].The American Journal of Physiology,1999,277(1):E1-E10.
[21] FORETZ M,CARLING D,GUICHARD C,et al.AMP-activated protein kinase inhibits the glucose-activated expression of fatty acid synthase gene in rat hepatocytes[J].Journal of Biological Chemistry,1998,273(24):14767-14771.
[22] KAMIKUBO R,KAI K J,TSUJI-NAITO K,et al.β-caryophyllene attenuates palmitate-induced lipid accumulation through AMPK signaling by activating CB2 receptor in human HepG2 hepatocytes[J].Molecular Nutrition & Food Research,2016,60(10):2228-2242.
[23] LIU Y J,SHI D,TIAN Y Y,et al.Eicosapentaenoic acid-enriched phosphatidylcholine attenuated hepatic steatosis through regulation of cholesterol metabolism in rats with nonalcoholic fatty liver disease[J].Lipids,2017,52(2):119-127.
[24] LI Y,ZHAO X,FENG X,et al.Berberine alleviates olanzapine-induced adipogenesis via the AMPKα-SREBP pathway in 3T3-L1 cells[J].International Journal of Molecular Sciences,2016,17(11):E1865.
[25] OMKUMAR R V,DARNAY B G,RODWELL V W.Modulation of Syrian hamster 3-hydroxy-3-methylglutaryl-CoA reductase activity by phosphorylation.Role of serine 871[J].Journal of Biological Chemistry,1994,269(9):6810-6814.
[26] GARTON A J,CAMPBELL D G,CARLING D,et al.Phosphorylation of bovine hormone-sensitive lipase by the AMP-activated protein kinase.A possible antilipolytic mechanism[J].European Journal of Biochemistry,1989,179(1):249-254.
[27] ROEPSTORFF C,VISTISEN B,DONSMARK M,et al.Regulation of hormone-sensitive lipase activity and Ser563and Ser565phosphorylation in human skeletal muscle during exercise[J].The Journal of Physiology,2004,560(2):551-562.
[28] HAMMOND L E,GALLAGHER P A,WANG S H,et al.Mitochondrial glycerol-3-phosphate acyltransferase-deficient mice have reduced weight and liver triacylglycerol content and altered glycerolipid fatty acid composition[J].Molecular and Cellular Biology,2002,22(23):8204-8214.
[29] CORTON J M,GILLESPIE J G,HARDIE D G.Role of the AMP-activated protein kinase in the cellular stress response[J].Current Biology,1994,4(4):315-324.
[30] GARTON A J,CAMPBELL D G,CARLING D,et al.Phosphorylation of bovine hormone-sensitive lipase by the AMP-activated protein kinase. A possible antilipolytic mechanism[J].European Journal of Biochemistry,1989,179(1):249-254.
[31] MUOIO D M,SEEFELD K,WITTERS L A,et al.AMP-activated kinase reciprocally regulates triacylglycerol synthesis and fatty acid oxidation in liver and muscle:evidence that sn-glycerol-3-phosphate acyltransferase is a novel target[J].Biochemical Journal,1999,338(3):783-791.
[32] LIU J M,CHEN D,LIU X W,et al.Cyclosporine A attenuates cardiac dysfunction induced by sepsis via inhibiting calcineurin and activating AMPK signaling[J].Molecular Medicine Reports,2017,15(6):3739-3746.
[33] DAGHER Z,RUDERMAN N,TORNHEIM K,et al.Acute regulation of fatty acid oxidation and amp-activated protein kinase in human umbilical vein endothelial cells[J].Circulation Research,2001,88(12):1276-1282.
[34] TAN Y,KIM J,CHENG J,et al.Green tea polyphenols ameliorate non-alcoholic fatty liver disease through upregulating AMPK activation in high fat fed Zucker fatty rats[J].World Journal of Gastroenterology,2017,23(21):3805-3814.
[35] ATKINSON L L,FISCHER M A,LOPASCHUK G D.Leptin activates cardiac fatty acid oxidation independent of changes in the AMP-activated protein kinase-acetyl-CoA carboxylase-malonyl-CoA axis[J].Journal of Biological Chemistry,2002,277(33):29424-29430.
[36] HASENOUR C M,RIDLEY D E,JAMES F D,et al.Liver AMP-activated protein kinase is unnecessary for gluconeogenesis but protects energy state during nutrient deprivation[J].PLoS One,2017,12(1):e0170382.
[37] WINDER W W,WILSON H A,HARDIE D G,et al.Phosphorylation of rat muscle acetyl-CoA carboxylase by AMP-activated protein kinase and protein kinase A[J].Journal of Applied Physiology,1997,82(1):219-225.
[38] SONG J J,WANG Q,DU M,et al.Casein glycomacropeptide-derived peptide IPPKKNQDKTE ameliorates high glucose-induced insulin resistance in HepG2 cells via activation of AMPK signaling[J].Molecular Nutrition & Food Research,2017,61(2):1600301.
[39] YOUNG M E,RADDA G K,LEIGHTON B.Activation of glycogen phosphorylase and glycogenolysis in rat skeletal muscle by AICAR-an activator of AMP-activated protein kinase[J].FEBS Letters,1996,382(1/2):43-47.
[40] VINCENT M F,BONTEMPS F,VAN DEN BERGHE G.Inhibition of glycolysis by 5-amino-4-imidazolecarboxamide riboside in isolated rat hepatocytes[J].Biochemical Journal,1992,281(1):267-272.
[41] WANG Y F,EVERAERT N,SONG Z G,et al.Alpha-lipoic acid impairs body weight gain of young broiler chicks via modulating peripheral AMPK[J].Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology,2017,211:34-40.
RegulatoryEffectsofAdenosineMonophosphate-ActivatedProteinKinaseonGlucoseandLipidMetabolisminAnimals
GAO Xiaona GUO Xiaoquan*
(CollegeofAnimalScienceandTechnology,JiangxiAgriculturalUniversity,Nanchang330045,China)
The adenosine monophosphate-activated protein kinase (AMPK) is found in all eukaryotic cells. AMPK activity is a response to adenosine monophosphate (AMP)/adenosine triphosphate (ATP). When a stress causes an inhibition of ATP production or an increase of ATP consumption, cellular AMP/ATP increases, AMPK is activated. Once activated AMPK can phosphorylates its downstream target proteins. As a result, the lipid and carbohydrate metabolisms are changed towards the switches on promoting ATP-producing and inhibiting ATP-consumption pathways, such as inhibitions of fatty acid and glycogen synthesis, stimulations of fatty acid oxidation and glucose absorption, by which energy in cells are rapidly recovered. Thus AMPK is called regulator of cell energy, and plays an important role for animals to adapt to the environment. This review summarized the structure, distribution, activity regulation and the regulatory roles on the glucose and lipid metabolism of AMPK based on the previous studies at home and abroad.[ChineseJournalofAnimalNutrition,2017,29(12):4287-4294]
AMPK; animal; glucose metabolism; lipid metabolism
10.3969/j.issn.1006-267x.2017.12.007
S852.2
A
1006-267X(2017)12-4287-08
2017-05-17
国家自然科学基金(31460679);江西省自然科学基金重点项目(2017ACB20012)
高晓娜(1991—),女,山东烟台人,硕士研究生,从事动物营养代谢病与中毒病研究。E-mail: xngao1206@163.com
*通信作者:郭小权,教授,博士生导师,E-mail: xqguo20720@aliyun.com
*Corresponding author, professor, E-mail: xqguo20720@aliyun.com
(责任编辑 王智航)

