外泌体内microRNA—135a跨血脑屏障转运的初步研究
刘辰庚++郝婷+杨婷婷++孟双+王培昌
[摘要] 目的 初步研究外泌体内microRNA-135a(miR-135a)跨血腦屏障和细胞转运的现象。 方法 提取APP/PS1双转基因小鼠脑脊液(CSF)的高miR-135a外泌体,将其注射入野生型小鼠脑室并干预SH-SY5Y细胞,检测小鼠外周血和培养基外泌体内miR-135a水平及SH-SY5Y细胞β分泌酶-1(BACE-1)的表达和活性。 结果 高miR-135a外泌体脑室注射能使野生型小鼠CSF和血浆外泌体miR-135a显著升高(P < 0.05);经APP/PS1双转基因小鼠CSF源外泌体干预的SH-SY5Y细胞,其细胞内的miR-135a含量显著高于其他干预组和对照组(P < 0.05);SH-SY5Y细胞的BACE-1活性显著降低(P < 0.05),且其mRNA表达水平的变化趋势与活性变化趋势一致。 结论 外泌体可将脑脊液中的“高miR-135a”这一生物信号跨越血脑屏障传递至外周血,这为将血浆外泌体miR-135a作为阿尔茨海默病诊断生物标志物提供了更坚实的实验依据。
[关键词] 阿尔茨海默病;MicroRNA;外泌体
[中图分类号] R749 [文献标识码] A [文章编号] 1673-7210(2017)11(c)-0022-05
A preliminary study on the cross blood-brain-barrier transport of exosomal microRNA-135a
LIU Chengeng1 HAO Ting2 YANG Tingting1 MENG Shuang3 WANG Peichang1
1.Department of Clinical Laboratory, Xuanwu Hospital, Capital Medcial University, Beijing 100053, China; 2.Department of Pathology, Heze Municipal Hospital, Shandong Province, Heze 274000, China; 3.State Key Laboratory of Infectious Disease Prevention and Control, National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
[Abstract] Objective To study the effect of microRNA-135a (miR-135a) on blood-brain barrier and cell transport in exocrine. Methods The high miR-135a exosomes were extracted from the cerebrospinal fluid (CSF) of the transgenic mice and injected into the ventricles of the wild type mice and intervened with SH-SY5Y cells. The levels of miR-135a in the peripheral blood of mice and the exosomes of the culture, and the expression and activity of β-secretase-1 (BACE-1) in SH-SY5Y cells were determined. Results Intraventricular injection of miR-135a exosomes resulted in a significant increase in CSF and plasma exosomal miR-135a in wild-type mice (P < 0.05). The activity of BACE-1 in SH-SY5Y cells treated with exosomes harvest from the CSF of APP/PS1 double transgenic mice was significantly lower than that in other intervention group and control group (P < 0.05), and the mRNA expression level of SH-SY5Y cells was significantly lower than that of control (P < 0.05). The trend of change is consistent with the trend of activity. Conclusion The signal of "high miR-135a" can be transferred from CSF to blood through the blood-brain barrier, which provides a more solid experimental basis for the use of exosomal miR-135a as a biomarker of Alzheimer's disease.
[Key words] Alzheimer′s disease; MicroRNA; Exosome
微小核糖核酸(microRNA,miR)在发育、分化和衰老等方面都扮演了重要角色[1]。作为重要的神经退行性变疾病之一,阿尔茨海默病(Alzheimer′s disease,AD)的发生发展也不乏相关miR的参与[1-2]。本课题组的前期研究表明,miR-135a可抑制重要的AD相关蛋白——β分泌酶-1(β-site APP cleaving enzyme,BACE-1)的蛋白表达并降低其在细胞内的活性,且这种作用是通过其与BACE-1 mRNA的3′非翻译区(3′-UTR)直接结合而实现的[1,3]。APP/PS1双转基因小鼠具有较典型的AD样病理学和行为学改变,是应用较多的AD模型。本课题组研究表明,APP/PS1双转基因小鼠和AD患者的脑脊液(cerebro spinal fluid,CSF)中总体miR-135a水平显著升高,且小鼠和AD患者CSF和血清中泌体(exosome)内miR-135a亦升高,提示其可作为AD的潜在生物标志物[3]。但外周血中的核酸来源复杂,主要包括组织细胞的病理/生理释放以及细胞死亡/凋亡释放等来源[4-6],在前期研究中被检测到升高的外泌体内miR-135a是否主要来自脑脊液,抑或脑脊液中的高miR-135a状态是否能直接导致外周血中相应指标的改变并未明确[1,3]。本研究主要就脑脊液外泌体内miR-135a跨血脑屏障向外周血转运的现象进行初步研究。endprint
1 材料与方法
1.1 試剂与仪器
外泌体提取试剂盒、Trizol、Lipofectamine 2000(Invitrogen,美国加利福尼亚);DMEM培养基(Gibco,美国加利福尼亚);PBS、小牛血清、蛋白浓度测定试剂盒、引物合成(生物工程公司,中国上海);miR-135a拟似物、Ce_miR-39(Tiangen,中国北京);QuantiTect SYBR Green PCR Master Mix、RNA逆转录试剂盒(Qiagen,德国威斯特法伦);BACE-1活性测定试剂盒(Sigma,美国威斯康星);立体定位仪(Stoelting,美国伊利诺斯);罗氏480 PCR仪(Roche,瑞士巴塞尔);D-8紫外可见分光光度计(菲勒公司,中国江苏)。
1.2 外泌体提取
9月龄APP/PS1双转基因小鼠[SPF级饲养,合格证号:SYXK(京)2014-0036]和9月龄野生型小鼠购自中国医学科学院实验动物研究所,使用立体定位仪抽取CSF;使用眼球摘除法留取肝素抗凝血,于4℃下3000 r/min离心7 min,留取血浆。在无菌环境下,使用外泌体提取试剂盒分别提取CSF,提取出的外泌体经PBS重悬混匀后,再次提取,以去除其他影响因素,再次提取出的外泌体混合物经miR-135a浓度测定后使用PBS重悬成105 copy/mL备用。使用立体定位仪将提取自转基因小鼠CSF的外泌体(105 copy/mL miR-135a)注射入野生型小鼠的第三脑室(定位为前囟前2.0 mm,中缝旁2.0 mm,硬膜下4 mm)作为实验组(5只),使用等体积的PBS注射作为对照组(5只)。6 h和12 h后抽取CSF和血浆标本,提取外泌体[7]。本实验方案已经首都医科大学宣武医院伦理委员会批准。
1.3 细胞培养
SH-SY5Y细胞培养于含10%小牛血清的DMEM培养基中,分别使用来自转基因小鼠和野生型小鼠CSF和血浆的外泌体干预(miR-135a终浓度为105 copy/L),同时使用miR-135a拟似物及Lipofectamine 2000包裹的miR-135a拟似物作用上述细胞作为对照组,干预6 h和12 h后提取细胞总RNA,同时提取培养基的外泌体。根据干预物的名称进行分组,实验组和对照组实验均重复5次。
1.4 BACE-1活性测定
使用试剂盒检测BACE-1的活性,严格按照试剂盒说明书操作:使用PBS将提取并经离心的细胞总蛋白调整至5~7 g/L,加入检测液,使用标准曲线法检测BACE-1的相对活性(相对荧光值)[1]。
1.5 BACE-1 mRNA定量测定
使用Trizol试剂提取SH-SY5Y细胞总RNA。使用QuantiTect SYBR Green PCR Master Mix,以GAPDH为内参,分别使用qPCR检测外泌体干预组和各个对照组BACE-1的mRNA。BACE-1上游引物:3′-AGGCAGTCTCTGGTATACACCCATC-5′,下游引物:3′-T?鄄GCCACTGTCCACAATGCTC-5′,产物长度137 bp;GAP?鄄DH上游引物:3′- GCACCGTCAAGGCTGAGAAC-5′,下游引物:3′-TGGTGAAGACGCCAGTGGA-5′,产物长度138 bp;反应条件:95℃ 30 s;95℃ 5 s、60℃ 30 s,35个循环。使用2-ΔΔCt法进行相对定量[5]。
1.6 小RNA提取及miR-135a定量测定
20 μL逆转录体系中含RNA模板0.4 ng,20 μL miR检测体系中含miR cDNA 1.0 μL。反应条件:95 ℃3 min;95℃ 25 s,62℃ 35 s,72℃ 25 s,35个循环。以提取小RNA前向标本中加入的Ce_miR-39为内参,使用2-△△Ct法计算并统计miR-135a组间表达的差异。
1.7 统计学方法
采用SPSS 18.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;以P < 0.05为差异有统计学意义。
2 结果
2.1 动物标本外泌体内miR-135a检测结果
提取自9月龄APP/PS1双转基因小鼠CSF外泌体内的miR-135a水平显著高于提取自野生型小鼠CSF和血浆外泌体水平(P = 0.000)。提取自9月龄APP/PS1双转基因小鼠血浆外泌体内的miR-135a水平显著高于提取自野生型小鼠CSF和血浆外泌体水平(P = 0.000)。见表1。
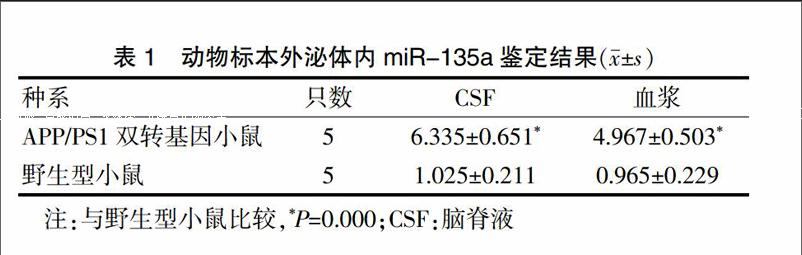
2.2 外泌体干预动物实验结果
经高miR-135a外泌体注射的野生型小鼠,其6 h的CSF和血浆外泌体内miR-135a水平均显著高于对照组(P < 0.05);12 h后,实验组CSF和血浆外泌体内miR-135a水平与对照组比较,差异无统计学意义(P > 0.05)。见图1。
与同时间对照组CSF比较,*P < 0.05;与同时间对照组血浆比较,#P < 0.05;CSF:脑脊液
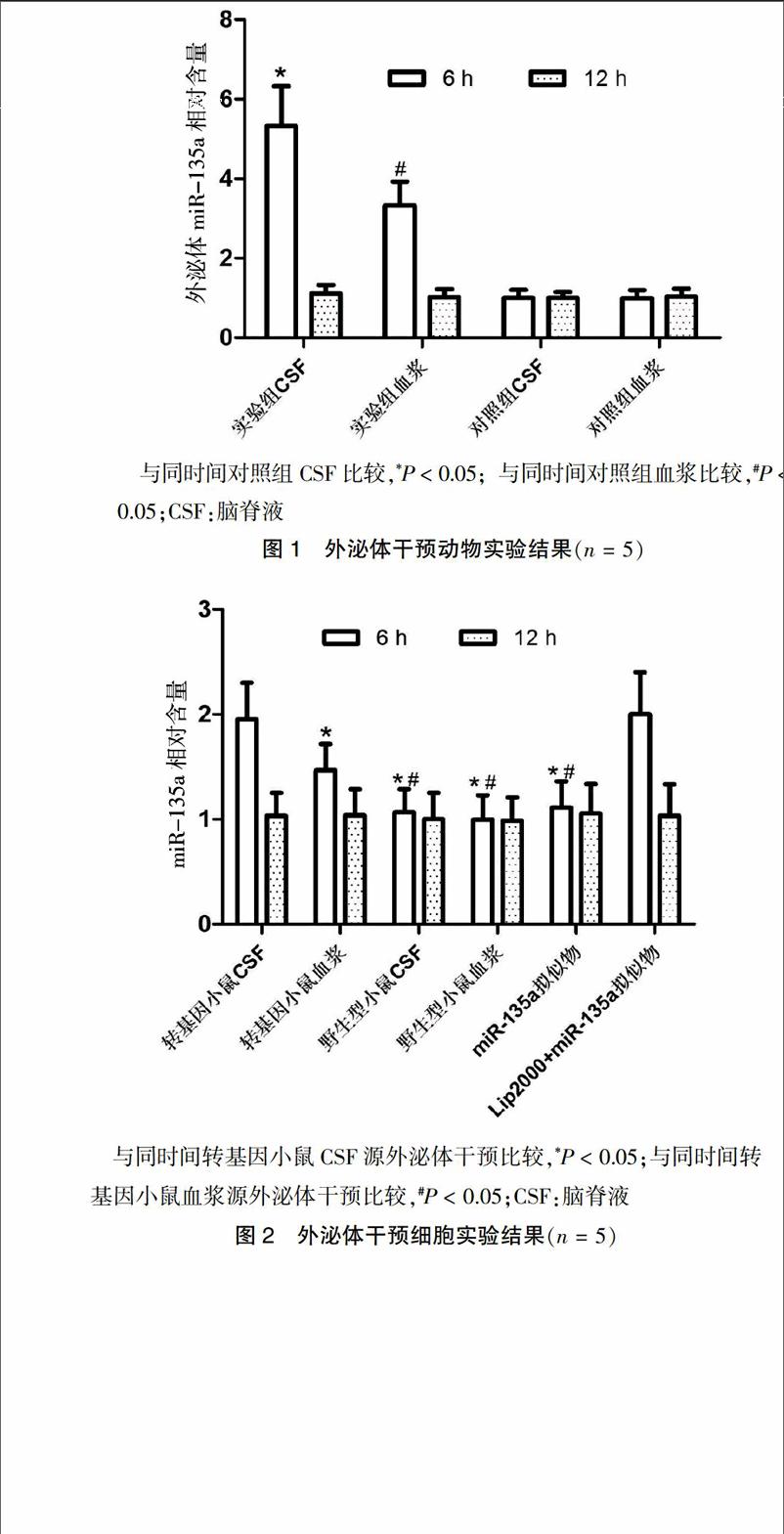
2.3 外泌体干预细胞实验结果
干预6 h后,使用APP/PS1双转基因小鼠CSF源外泌体干预的SH-SY5Y细胞,其细胞内miR-135a含量显著高于其他干预组和对照组(P < 0.05);干预12 h后,细胞内miR-135a水平恢复到基线水平(图2)。干预6 h和12 h后,使用APP/PS1双转基因小鼠CSF源外泌体干预的SH-SY5Y细胞,其培养基外泌体内miR-135a水平与其他来源外泌体干预组及miR-135a拟似物组间差异无统计学意义(P > 0.05)。见图2。endprint
與同时间转基因小鼠CSF源外泌体干预比较,*P < 0.05;与同时间转基因小鼠血浆源外泌体干预比较,#P < 0.05;CSF:脑脊液
图2 外泌体干预细胞实验结果(n = 5)
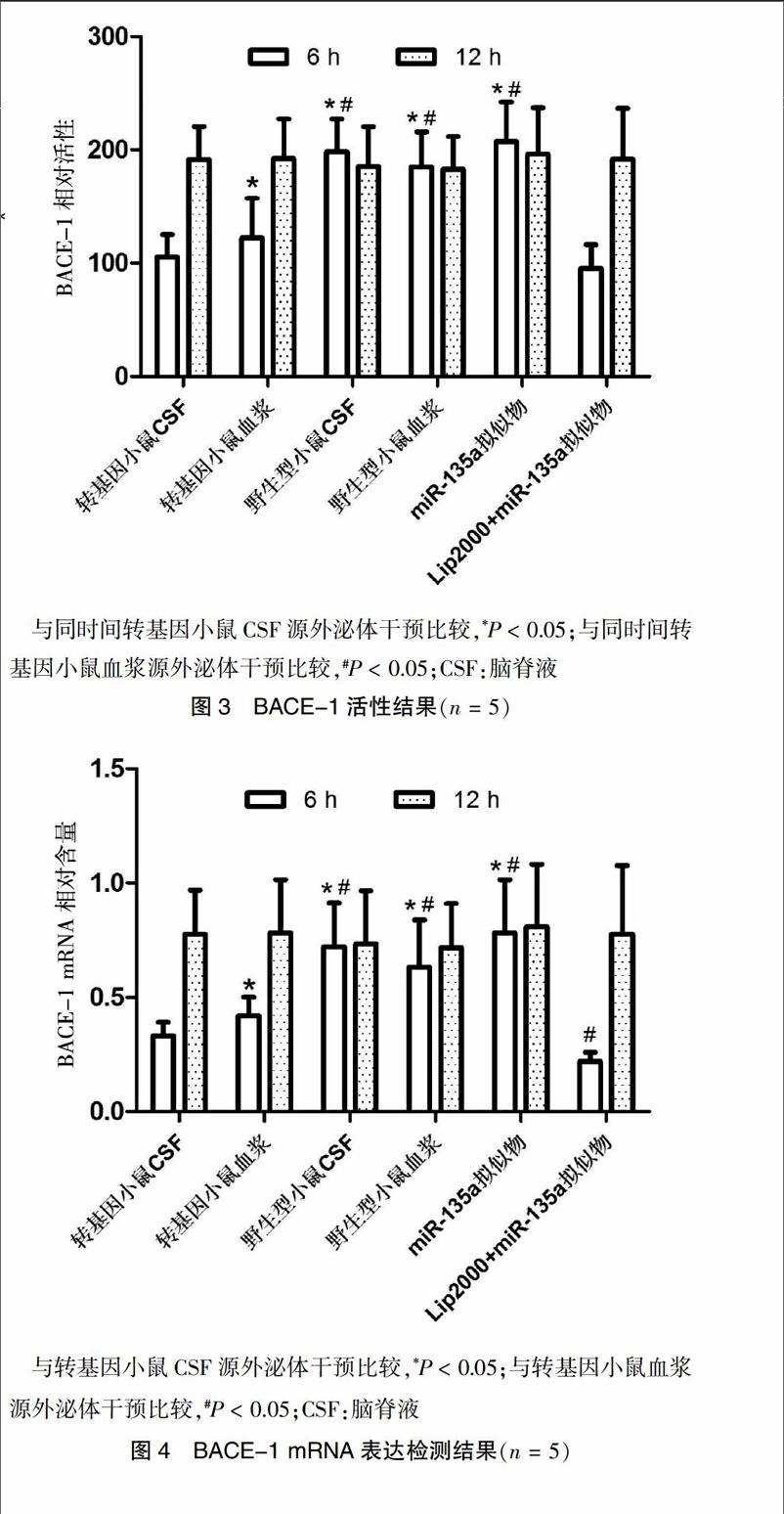
2.4 BACE-1活性和表达
干预6 h后,经提取自9月龄APP/PS1双转基因小鼠CSF外泌体和Lipofectamine 2000包裹miR-135a拟似物干预的SH-SY5Y细胞的BACE-1活性显著低于经提取自转基因小鼠血浆及提取自野生型小鼠CSF和血浆外泌体干预的SH-SY5Y细胞(P < 0.05),且前两者差异无统计学意义(P > 0.05)(图3)。SH-SY5Y细胞BACE-1 mRNA表达水平的变化趋势与其活性的变化趋势一致(图4)。
与同时间转基因小鼠CSF源外泌体干预比较,*P < 0.05;与同时间转基因小鼠血浆源外泌体干预比较,#P < 0.05;CSF:脑脊液
3 讨论
作为发病率最高的神经退行性变疾病,AD在全世界范围内的检出率均呈上升趋势。2011年以前,在AD各版诊断标准中涉及的诊断方法主要为行为、精神量表评分和较为昂贵的影像学检查;2011年3月,发布的AD诊断标准中,首次纳入了CSF tau蛋白和β淀粉样蛋白(amyloid β-protein,Aβ)检测[8-9]。但CSF tau蛋白和Aβ检测面临的现实问题是,作为已经出现典型痴呆症状AD患者而言,目前尚无有效的治疗手段,患者和家属往往不配合CSF抽取;而对于AD的早期诊断和筛查而言,受试者也很难同意采用抽取CSF这种有创检查的方式进行诊断[10-13]。故CSF tau蛋白和Aβ检测在国内开展并不多见。随着AD生物标志物研究的不断进展,越来越多的学者认为应寻找可用于AD诊断,特别是早期诊断的无创检查生物标志物[14]。目前,小分子核酸和特定蛋白在AD诊断中价值的研究逐渐成为热点。
脑组织中的淀粉样前体蛋白(amyloid precursor protein,APP)可通过α和β两种分泌酶代谢,通过β分泌酶(BACE-1)代谢时,将产生可导致AD的Aβ[15]。有研究表明,AD患者脑组织中的BACE-1表达和活性均显著升高,提示其可能参与了AD的发生发展[16]。本课题组的前期研究发现,miR-135a可通过与BACE-1 mRNA的3′-UTR相结合从而抑制其表达和酶活性;同时,CSF和血清外泌体中miR-135a水平显著升高,提示miR-135a的升高可能是AD患者脑细胞自我保护的机制之一[17]。
血脑屏障并不允许核酸分子自由通过,为何血清与脑脊液中会出现miR-135a同方向的变化趋势,该问题尚待解答。已有研究预测,外泌体可作为细胞间信息传导及旁分泌的载体[7,18]。本研究通过将提取自AD模型小鼠脑脊液中的高miR-135a外泌体转入正常小鼠脑室,以此观察高miR-135a外泌体的出现对脑组织BACE-1表达和酶活性的影响,及外泌体是否能将“高miR-135a”这一生物学信号跨越血脑屏障传达至外周血。结果表明,注射入脑室的高miR-135a外泌体可使野生型小鼠脑脊液和血浆内外泌体内miR-135a均升高,提示外泌体能跨越血脑屏障,且能将高miR-135a这一生物信息传达至外周血;同时,也能将这一信号传入脑细胞内并发挥miR-135a的生物学作用。
有研究提示,外泌体的信号转导能将某些病理生理状态在细胞间传递[19-20]。本研究的细胞实验结果表明,使用APP/PS1双转基因小鼠CSF源外泌体干预的SH-SY5Y细胞,其培养基外泌体内miR-135a水平与其他干预组和对照组间无显著性差异,提示高miR-135a不能改变传代脑细胞系向外界分泌外泌体内的miR-135a水平。如将高miR-135a外泌体的分泌看做细胞发出的保护信号,那么接收到这些信号的细胞可能并未将其进行再传递。
综上所述,本研究表明,外泌体可将脑脊液中的“高miR-135a”这一生物信号跨越血脑屏障传递至外周血,这为将血浆外泌体miR-135a作为AD诊断生物标志物提供了更可靠的实验依据。
[参考文献]
[1] Liu CG,Wang JL,Li L,et al. MicroRNA-135a and-200b,potential biomarkers for Alzheimer′s disease,regulate β secretase and amyloid precursor protein [J]. Brain Res,2014, 1583:55-64.
[2] 王全全,吕占云,孙大芳,等.早发家族性阿尔茨海默病家系患者血清miRNA检测及初步分析[J].中华行为医学与脑科学杂志,2017,26(6):554-559.
[3] 刘辰庚,霍贵申,孟双,等.MicroRNA-135a突变体对β分泌酶-1的调控作用及初步临床调查[J].临床和实验医学杂志,2016,15(24):2389-2392.
[4] 刘辰庚,孟双,张跃其,等.MicroRNA-135a在阿尔茨海默病患者中的检测[J].中国老年学杂志,2016,36(1):152-153.
[5] Quinlan S,Kenny A,Medina M,et al. MicroRNAs in neurodegenerative diseases [J]. Int Rev Cell Mol Biol,2017, 334:309-43.
[6] Erdal ME,Y?覦lmaz SG,Gürgül S,et al. MiRNA expression profile is altered differentially in the rat brain compared to blood after experimental exposure to 50 Hz and 1 mT electromagnetic field [J]. Prog Biophys Mol Biol,2017. pii: S0079-6107(17)30147-5. doi:10.1016/j.pbiomolbio.2017. 08.001.[Epub ahead of print]endprint
[7] Riancho J,Vázquez-Higuera JL,Pozueta A,et al. MicroRNA profile in patients with Alzheimer's disease:analysis of miR-9-5p and miR-598 in raw and exosome enriched cerebrospinal fluid samples [J]. J Alzheimers Dis,2017,57(2):483-491.
[8] 贾建平,陆璐,张逸驰,等.美国国立老化研究所与阿尔茨海默病协会诊断指南写作组:阿尔茨海默病源性轻度认知障碍诊断标准推荐[J].中华神经内科杂志,2012,45(5):345-351.
[9] 贾建平,陆璐,张逸驰,等.美国国立老化研究所与阿尔茨海默病协会诊断指南写作组:阿尔茨海默病痴呆诊断标准的推荐[J].中华神经内科杂志,2012,45(5):352-355.
[10] Putteeraj M,Yahaya MF,Teoh SL. MicroRNA dysregulation in Alzheimer′s disease [J]. CNS Neurol Disord Drug Targets,2017.doi:10.2174/1871527316666170807142311.
[11] Silva GJJ,Bye A,El Azzouzi H,et al. MicroRNAs as important regulators of exercise adaptation [J]. Prog Cardiovasc Dis,2017,60(1):130-151.
[12] Recabarren D,Alarcón M. Gene networks in neurodegenerative disorders [J]. Life Sci,2017,183:83-97.
[13] Hu YB,Li CB,Song N,et al. Diagnostic value of microRNA for Alzheimer's Disease:a systematic review and meta-analysis [J]. Front Aging Neurosci,2016,8:13.
[14] Wang X,Liu D,Huang HZ,et al. A novel microRNA-124/PTPN1 signal pathway mediates synaptic and memory deficits in Alzheimer′s disease [J]. Biol Psychiatry,2017. pii: S0006-3223(17)31853-X. doi: 10.1016/j.biopsych.2017.07.023. [Epub ahead of print]
[15] Chen JJ,Zhao B,Zhao J,et al. Potential roles of exosomal microRNAs as diagnostic biomarkers and therapeutic application in Alzheimer's disease [J]. Neural Plast,2017, 2017:7027380.
[16] Zhao J,Yue D,Zhou Y,et al. The role of microRNAs in Aβ deposition and tau phosphorylation in Alzheimer's disease [J]. Front Neurol,2017,8:342.
[17] Maoz R,Garfinkel BP,Soreq H. Alzheimer's Disease and ncRNAs [J]. Adv Exp Med Biol,2017,978:337-361.
[18] Prasad KN. Oxidative stress and pro-inflammatory cytokines may act as one of the signals for regulating microRNAs expression in Alzheimer's disease [J]. Mech Ageing Dev,2017,162:63-71.
[19] Basavaraju M,de Lencastre A. Alzheimer's disease:presence and role of microRNAs [J]. Biomol Concepts,2016, 7(4):241-252.
[20] Batistela MS,Josviak ND,Sulzbach CD,et al. An overview of circulating cell-free microRNAs as putative biomarkers in Alzheimer's and Parkinson's Diseases [J]. Int J Neurosci,2017,127(6):547-558.
(收稿日期:2017-08-10 本文編辑:程 铭)endprint

