NaCl对Q235钢早期腐蚀行为的影响
,, ,, ,
(常州大学 石油工程学院,常州 213016)
NaCl对Q235钢早期腐蚀行为的影响
汪敏慧,王树立,杨燕,徐洪敏,陈虎,季廷伟
(常州大学 石油工程学院,常州 213016)
在实验室模拟了NaCl对Q235钢早期腐蚀的影响,研究了NaCl含量和浸泡时间对Q235钢腐蚀行为的影响。结果表明:试验条件下,当NaCl质量分数为3.5%时,Q235钢腐蚀倾向最大,电极表面的反应电阻最小,腐蚀速率最快;Q235钢的腐蚀电流密度和表面反应电阻随浸泡时间变化而出现波动,浸泡24 h后,腐蚀体系的自腐蚀电位最负,自腐蚀电流密度最大,腐蚀速率最快;电极表面的腐蚀产物对基体具有一定的保护作用,然而腐蚀产物较疏松,在电极表面的附着力小,很容易脱落而使腐蚀反应加快。
Q235钢;NaCl浓度;浸泡时间;早期腐蚀;电化学试验
NaCl普遍存在于海水、污水、土壤、海风等各种腐蚀环境中,是影响钢材腐蚀的重要因素。Cl-能破坏金属材料表面的钝化膜,引起材料发生点蚀[1-2],对金属材料具有很强的破坏性。肖葵等[3]研究了NaCl颗粒沉积对Q235钢早期大气腐蚀的影响,结果表明,在NaCl、CO2和SO2的协同作用下,Q235钢发生表面严重腐蚀,其腐蚀产物主要有Fe3O4、γ-Fe2O3和γ-FeOOH。HU等[4]对Q235钢在NaHCO3和NaCl溶液中的缝隙腐蚀进行了研究,结果表明:缝隙腐蚀的诱导期随着电极面积比的增大而延长。王海杰等[5]研究了NaCl污染土对Q235钢腐蚀的影响,结果表明,随着NaCl含量的增大,土壤含气率、电阻率和氧化还原电位减小,Q235钢腐蚀加强。本工作通过电化学方法研究在实验室条件下,NaCl含量以及浸泡时间对Q235钢早期腐蚀行为的影响。
1 试验
在实验室条件下,利用PARSTAT 2273电化学工作站进行电化学腐蚀试验,记录和分析腐蚀试验结果。工作电极材料为Q235钢,其化学成分为wc0.18%,wSi0.12%,wMn0.40%,wS0.02%,wP0.04%,余量为Fe。试验用试样尺寸为φ5 mm的圆片试样。试验前用砂纸(600~1 200号)逐级打磨试样表面后,Al2O3粉末抛光至镜面。丙酮除油,去离子水清洗之后,自然干燥。试验溶液是NaCl质量分数为0.5%,1.5%,2.5%,3.5%,4.5%的水溶液,试验温度为室温。电化学试验采用三电极体系,工作电极为试样,参比电极为Ag/AgCl电极,辅助电极为Pt电极。测试了Q235钢试样的开路电位曲线、Tafel曲线和电化学阻抗,考察了温度和NaCl含量为Q235钢腐蚀行为的影响。文中电位若无特指,均相对于Ag/AgCl电极。
2 结果与讨论
2.1 NaCl的影响
由图1和表1可见:NaCl质量分数低于3.5%时,自腐蚀电位(Ecorr)随溶液中NaCl量的增大而降低;NaCl质量分数为4.5%时,Ecorr明显升高,达到了-0.47 V。从热力学角度分析,Ecorr越负,越容易发生腐蚀,故当NaCl质量分数为3.5 %时,试样最易发生腐蚀。
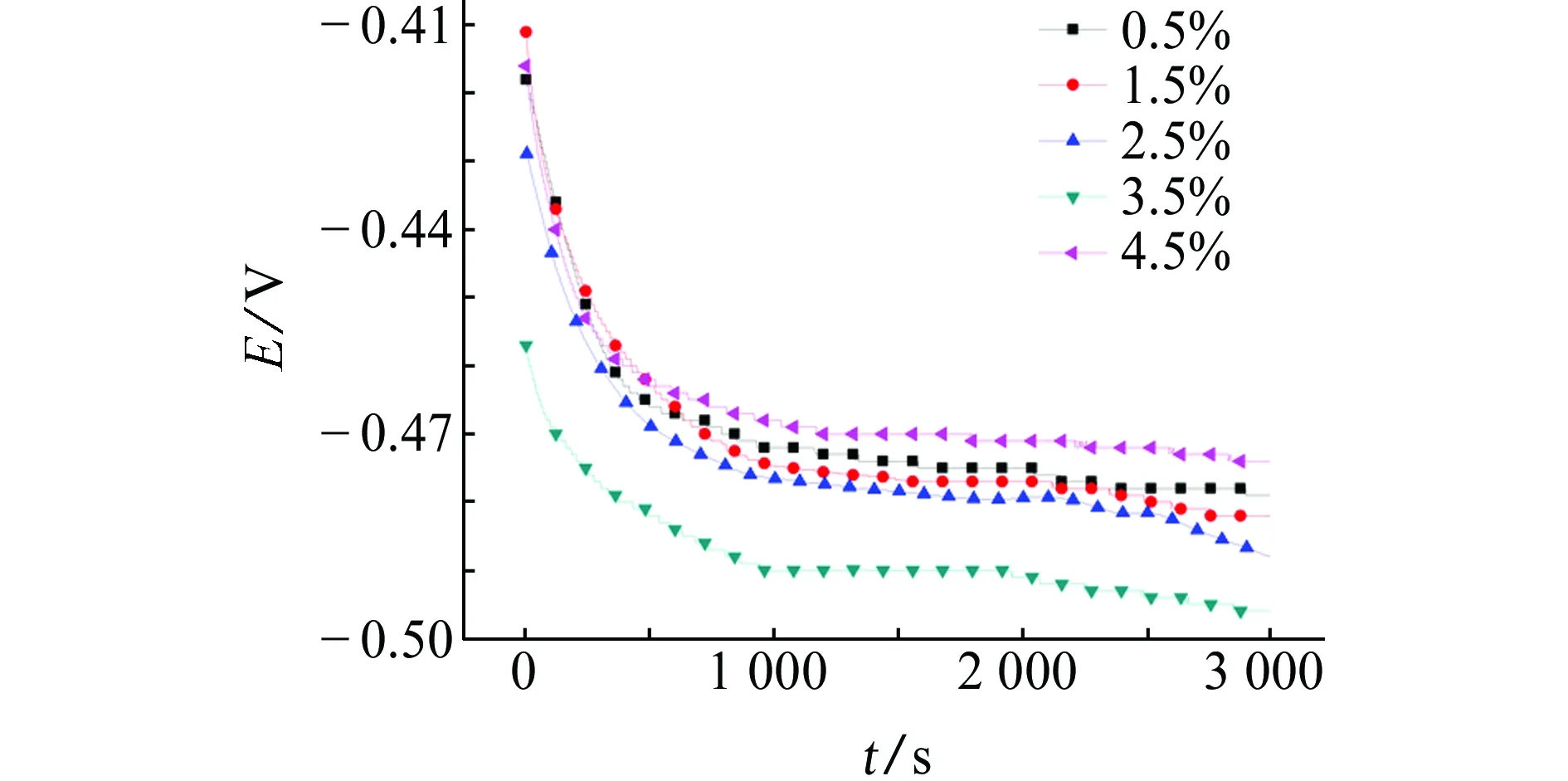
图1 试样在含不同量NaCl溶液中的开路电位Fig. 1 OCP of samples in the solution conaining different concentrations of NaCl

NaCl质量分数/%Ecorr/V0.5-0.4751.5-0.4772.5-0.4803.5-0.4904.5-0.470
由图2可见:试样在5种溶液中均出了活化溶解的腐蚀行为,当NaCl质量分数小于3.5%时,自腐蚀电位随溶液中NaCl量的增加而降低,更容易发生腐蚀,这与开路电位试验结果一致;当NaCl质量分数达到4.5 %时,Ecorr反而增大,腐蚀倾向减弱。

图2 试样在含不同量NaCl的溶液中的极化曲线Fig. 2 Polarization curves of samples in the solution containing different concentrations of NaCl
试样在5种溶液中的自腐蚀电流密度(Jcorr)和腐蚀速率如表2所示,腐蚀速率与Jcorr的计算公式[6]表示为
式中:vd为深度法表示的腐蚀速率;A为金属的相对原子质量;n为金属阳离子的价数;F为法拉第常数;ρ为材料密度。
由表2可见:NaCl质量分数为3.5%时,试样腐蚀速率最大为2.21×10-2mm·a-1,当NaCl质量分数为4.5%时,腐蚀速率明显降低。这是因为当NaCl质量分数为4.5 %时,大量Cl-吸附在试样表面[7],阻止了其他阴离子参与阳极反应,导致腐蚀速率反而降低[8]。

表2 试样在5种NaCl溶液中的自腐蚀电流密度和腐蚀速率Tab. 2 Corrosion current density and corrosion rate of samples in 5 kinds of NaCl solution
图3中,高频部分表现为容抗弧,容抗弧的起点横坐标表征了腐蚀体系的溶液电阻大小,可以看出5种溶液的溶液电阻值及其变化均很小。容抗弧的半径大小反映了电极表面反应电阻的大小[9],NaCl质量分数低于3.5 %时,容抗弧半径逐渐减小,反应电阻也逐渐减小;当其质量分数为4.5 %时,容抗弧半径明显增大,反应电阻增大。
利用ZSimpWin软件对试样在各溶液中的电化学阻抗进行拟合,其等效电路图如图4所示,各元件的拟合结果如表3。其中Rs为溶液电阻,Q为常相位角元件[10],Rt为电荷传递电阻。

图3 试样在5种NaCl溶液中的Nyquist图Fig. 3 Nyquist plots of samples in 5 kinds of NaCl solutions

图4 拟合阻抗谱的等效电路图Fig. 4 Equivalent circuit model of EIS
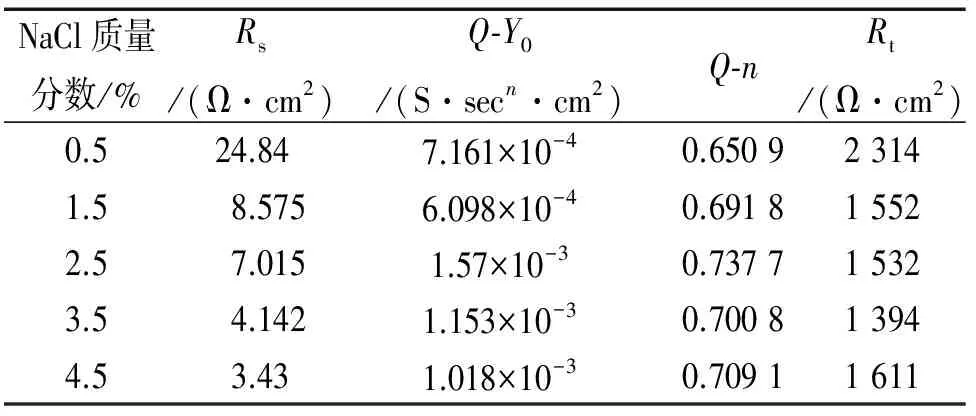
NaCl质量分数/%Rs/(Ω·cm2)Q⁃Y0/(S·secn·cm2)Q⁃nRt/(Ω·cm2)0.524.847.161×10-40.650923141.58.5756.098×10-40.691815522.57.0151.57×10-30.737715323.54.1421.153×10-30.700813944.53.431.018×10-30.70911611
由表3可见:随着NaCl量的增大,Rs逐渐减小;当NaCl质量分数低于3.5%时,Rt逐渐减小,腐蚀速率增大,当NaCl质量分数大于3.5%时,Rt增大,腐蚀速率减小;NaCl质量分数为3.5%时,Rt最小,腐蚀速率最大。
综合上述开路电位、Tafel曲线和电化学阻抗谱,得出Q235钢在3.5% NaCl溶液中最容易发生腐蚀,且腐蚀速率最大,电极表面反应电阻最小。
2.2 浸泡时间的影响
由图5可见:试样在3.5% NaCl溶液中浸泡不同时间后的极化曲线形状基本相同,各腐蚀过程类似,浸泡24 h时,自腐蚀电位最负。由表4可见:试样在3.5% NaCl溶液中浸泡24 h时,腐蚀速率最大,之后随着浸泡时间的延长呈现上升趋势。
由图6可见:经不同时间浸泡后,试样的阻抗谱均表现为一个容抗弧。电化学阻抗随浸泡时间的变化出现了波动,当浸泡时间为24 h时,阻抗弧的半径最小,此时电极表面反应的阻力最小,而后阻抗弧半径又稍有增大;当浸泡时间为96 h时,阻抗弧半径稍有减小,几乎与24 h的重叠。此试验结果从腐蚀体系反应的阻力方面给出了腐蚀随时间发展的规律,与上述极化曲线的试验结果一致,表明Q235钢在3.5% NaCl溶液中,当浸泡时间为24 h时,腐蚀速率达到最大值。腐蚀速率随时间变化出现波动的主要原因是24 h之前电极表面的腐蚀产物较少,腐蚀较快,而后腐蚀产物积累附着在电极表面而对基体产生了一定的保护作用[11],由于腐蚀产物较疏松,在电极表面的附着力小,当腐蚀产物稍微增长即在重力作用下腐蚀产物从电极表面脱落,对基体失去保护作用,腐蚀反应阻力减小。

图5 试样在3.5% NaCl溶液中浸泡不同时间后的极化曲线Fig. 5 Polarization curves of samples after immersed in 3.5% NaCl solution for different times

时间/h腐蚀电流密度Icorr/(A·cm-2)腐蚀速率vd/(mm·a-1)12.85×10-62.21×10-2241.29×10-51.0×10-1)488.87×10-66.89×10-2729.40×10-67.3×10-2961.12×10-58.7×10-2
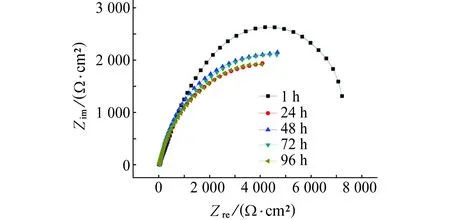
图6 试样在3.5% NaCl溶液中浸泡不同时间后的Nyquist图Fig. 6 Nyquist plots of samples after immersed in 3.5% NaCl solution for different times
对不同时间的电化学阻抗进行拟合,其等效电路图如图4所示,对各元件的拟合结果如表5所示。表5中,Rs随时间变化没有出现很大的波动;1 h时,Rt最大,腐蚀速率最小;24 h时,Rt最小,腐蚀速率最大,48 h~96 h,Rt值逐渐减小,腐蚀速率增大。
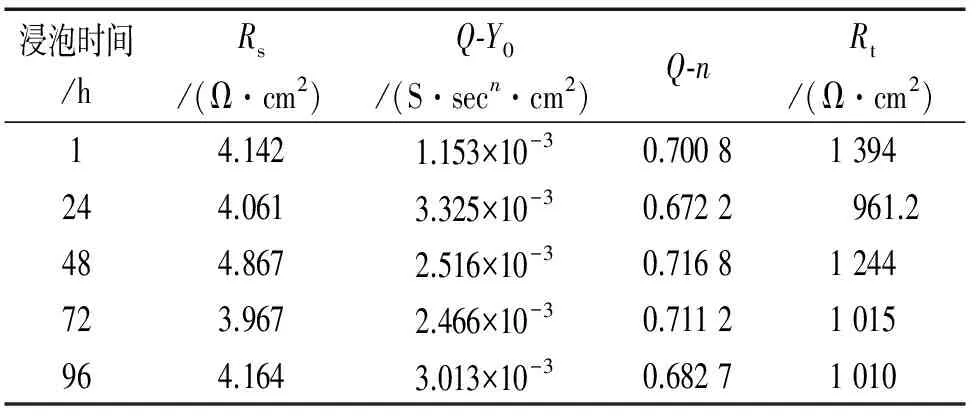
表5 图6的拟合数据Tab. 5 Fitting data of Fig. 6
3 结论
(1) 试验条件下,当NaCl质量分数为3.5%时,腐蚀最易发生,电极表面反应电阻最小,腐蚀速率最大;当NaCl质量分数小于3.5%时,Ecorr随NaCl量的增大而减小,腐蚀更容易发生;Rt逐渐减小,Jcorr随NaCl量的增大而增大,腐蚀加速;NaCl质量分数为4.5%时,Ecorr增大,腐蚀倾向变小;Rt增大,Jcorr增大,腐蚀速率变大。
(2) Q235钢的腐蚀电流密度和表面反应电阻随时间变化而出现波动;24 h时,腐蚀体系的自腐蚀电位最负,自腐蚀电流密度最大,腐蚀最快。
(3) Q235钢的测试结果随时间变化而出现波动的主要原因是随着腐蚀反应的进行,腐蚀产物积累附着在电极表面而对基体产生了一定的保护作用;然而腐蚀产物较疏松,在电极表面的附着力小,当腐蚀产物稍有增长即在重力作用下腐蚀产物从电极表面脱落,对基体失去保护作用,此时,反应电阻减小,腐蚀速率增大。
[1] GAVELE J R,TORRESI R M,CARRANZA R M. Passivity breakdown,its relation to pitting and stress-corrosion-cracking processes[J]. Corrosion Science,1990,31:563-571.
[2] PISTORIUS P C,BURSTEIN G T. Growth of corrosion pits on stainless steel in chloride solution containing dilute sulphate[J]. Corrosion Science,1992,33:1885-1897.
[3] 肖葵,董超芳,李晓刚,等. NaCl颗粒沉积对Q235钢早期大气腐蚀的影响[J]. 中国腐蚀与防护学报,2006,26(1):26-29.
[4] HU Q,QIU Y B,GUO X P,et al. Crevice corrosion of Q235 carbon steels in a solution of NaHCO3and NaCl[J]. Corrosion Science,2010,52:1205-1212.
[5] 王海杰,齐园园,韩鹏举. NaCl污染土对Q235钢腐蚀的试验研究[J]. 中国科技论文,2013,8(5):397-401.
[6] 李晓刚. 材料腐蚀与防护[M]. 长沙:中南大学出版社,2009:7-8.
[7] 赫献超,苏鹏,肖葵,等. 不同NaCl浓度对耐候钢腐蚀产物的影响[J]. 腐蚀与防护,2009,30(5):298-299.
[8] 陈长风,路民旭,赵国先,等. 温度、Cl-浓度、Cr元素对N80钢CO2腐蚀电极过程的影响[J]. 金属学报,2003,39(8):849-851.
[9] 杨燕. X70钢交流腐蚀行为及机理研究[D]. 青岛:中国石油大学(华东),2013.
[10] 曹楚南,张鉴清. 电化学阻抗导论[M]. 北京:科学出版社,2004:26-27.
[11] 张琳,王振尧,赵春英,等. 模拟海洋工业大气环境中Q235钢及耐候钢的腐蚀行为[J]. 材料保护,2015,48(2):21-22.
EffectofNaClonInitialCorrosionBehaviorofQ235Steel
WANG Minhui, WANG Shuli, YANG Yan, XU Hongmin, CHEN Hu, JI Tingwei
(School of Petroleum Engineering, Changzhou University, Changzhou 213016, China)
The effect of NaCl concentration and immersion time on the initial corrosion of Q235 steel was studied in laboratory. The results indicate that the critical corrosion concentration of NaCl was 3.5 wt% under the testing conditions. In 3.5 wt% NaCl solution, Q235 steel was more prone to corrosion and the corrosion rate was the largest, and the reaction resistance on the electrode surface was the least. Corrosion current density and surface reaction resistance of Q235 steel fluctuated with time. After 24 hours′ immersion in 3.5 wt % NaCl solution, the free-corrosion potential in the corrosion system was the lowest, the corrosion current density and corrosion rate were the largest. Corrosion products on electrode surface had a limited protective effect on the substrate. Loose structure and small adhesion of the corrosion product made it easy to fall off from the electrode surface, and thus the corrosion reaction was accelerated.
Q235 steel; NaCl concentration; immersion time; initial corrosion; electrochemical experiment
10.11973/fsyfh-201711005
2016-05-22
江苏省自然科学基金(BK20150270); 江苏省高校自然科学研究面上项目(15KJB440001)
王树立(1957-),教授,博士,从事油气储运设备腐蚀与防护等方面的研究,13813698610,wsl@cczu.edu.cn
TG172.6
A
1005-748X(2017)11-0844-04

