迟缓型爱德华氏菌(Edwardsiella tarda)诱导牙鲆(Paralichthys olivaceus)TLR1及TLR2基因的表达分析*
李庆亚 周 密 张 洁 郑津辉 耿绪云 潘宝平孙金生, 高 虹①
(1.天津师范大学生命科学学院 天津市动植物抗性重点实验室 天津 300387; 2.天津市水产养殖病害防治中心天津 300221)
迟缓型爱德华氏菌(Edwardsiella tarda)诱导牙鲆(Paralichthys olivaceus)TLR1及TLR2基因的表达分析*
李庆亚1周 密1张 洁1郑津辉1耿绪云2潘宝平1孙金生1,2高 虹1①
(1.天津师范大学生命科学学院 天津市动植物抗性重点实验室 天津 300387; 2.天津市水产养殖病害防治中心天津 300221)
Toll样受体是一类重要的蛋白质分子, 参与固有免疫系统, 在哺乳动物在受到细菌感染的时候, TLR1和TLR2基因可以形成异源二聚体, 进而启动宿主的固有免疫。本文应用实时荧光定量PCR的技术, 检测了 TLR1和 TLR2基因在牙鲆健康组织以及牙鲆腹腔注射迟缓型爱德华氏菌(Edwardsiella tarda)后各组织中的表达变化, 并探讨了它们与牙鲆(Paralichthys olivaceus)固有免疫反应的关系。结果表明, TLR1和TLR2基因广泛表达于健康牙鲆的各种组织中, 其中, TLR1在脾脏组织中表达量最高, 其次是心脏、肌肉; TLR2在小肠组织中表达量最高, 其次是肝脏、心脏。免疫刺激实验表明, 多数组织在感染病原 6h后 TLR1基因表达达到峰值, 其中脾脏中基因的表达量最大,是0时间点的290倍(P<0.01)。TLR2基因在感染病原1h后在脾脏中表达量最高, 为0时间点的17.8倍(P<0.01), 在感染病原 1d后心脏组织中基因的表达量为对照组的 14倍(P<0.01), 其余时间点表达变化不明显。结果表明TLR1和TLR2参与了牙鲆对迟缓型爱德华氏菌的免疫应答反应。实验结果还显示, 在牙鲆感染迟缓型爱德华氏菌后, MyD88、TNF-α和IL-1基因的表达也都同步上调, 暗示迟缓型爱德华氏菌有可能通过TLR1通路上调MyD88的表达, 并最终导致炎症因子TNF-α和IL-1的基因表达上调, 以应答病原菌的感染。
TLR1; TLR2; 牙鲆; 迟缓型爱德华氏菌; 表达; 实时荧光PCR
牙鲆(Paralichthys olivaceus)属于硬骨鱼纲, 俗称比目鱼, 亦称“牙片”, 是一种重要的海水养殖鱼类(鲍宝龙等, 1999)。随着养殖业发展的高密度集约化,牙鲆生长的相关疾病造成的影响日趋严重, 导致了水产养殖业发展的极大障碍, 各地养殖场也面临了巨大的经济损失(王建波, 2010), 因此人们越来越关注牙鲆水产养殖业的发展。
Toll样受体(Toll-like receptor, TLRs)是模式识别受体(pattern recognition receptor, PRR)家族中的一种,识别脂多糖, 酵母多糖以及病原微生物的核酸等保守分子, 有着辨别和传递信息的作用(王海坤等, 2006;王德成等, 2008; 范泽军等, 2015)。与大多数脊椎动物不同, TLR1家族并不是单一的遗传因子, 往往具有多重和同源性。在TLR家族中, 根据分子进化树的分支关系, 又可分为六个亚家族, 哺乳动物的 TLR1亚家族包括4个成员, 分别是 TLR1、TLR2、TLR6和TLR10 (Roachet al, 2005)。而在鱼类中没有TLR6和TLR10, 但鱼类有其特有的基因, 如TLR20、TLR21、TLR22、TLR23 (Gaoet al, 2013)。通常TLR1基因和TLR2基因是以异质二聚体的形式存在的, 可识别各类脂蛋白。
在牙鲆的内脏组织中, 脾脏、头肾、肠和肝脏四种组织与鱼类的免疫系统有着密切的联系。其中脾脏中的淋巴小泡中有很多与免疫作用相关的重要细胞,例如淋巴细胞、巨峰细胞等; 而头肾在免疫系统应答中有着非常重要的作用, 是免疫细胞的重要发源地;而肠黏膜则富含与免疫相关的淋巴组织, 肝脏则是基因表达的重要器官。
迟缓型爱德华氏菌(Edwardsiella tarda)是一种革兰氏阴性菌, 在水产养殖业是极具危害的, 在牙鲆水产养殖中, 爱德华氏菌病是影响牙鲆健康生长的主要的传染病之一。全面深入地研究牙鲆对该病原菌免疫应答的分子机理, 将为建立一种有效的、能够预防和控制E.tarda感染的免疫防治新措施提供理论基础。前期研究组克隆了牙鲆TLR1基因的cDNA全长序列(Wuet al, 2012), 本研究继续以TLR1及TLR2基因为研究对象, 利用实时荧光定量 PCR技术检测分析了迟缓型爱德华氏菌感染健康牙鲆后, TLR1和TLR2基因表达量的情况变化。
1 材料与方法
1.1 实验材料
1.1.1 实验鱼 健康牙鲆购买于天津某养鱼场,体长 10—12cm, 将牙鲆放置于大小适中的水循环箱中, 调节盐度(17—18)和温度(20±2)°C (Wuet al, 2012;张洁等, 2015), 使其充分适应生活环境。鱼箱上方遮光, 避免直射, 每日投放鱼饲料一次。
1.1.2 病原体 本次试验病原刺激采用的是迟缓型爱德华氏菌。迟缓型爱德华氏菌是革兰氏阴性菌,由天津市水产养殖病害防治中心从患病的牙鲆鱼体上分离并鉴定, 由本实验室保存。
1.2 实验方法
1.2.1 细菌培养 在超净台上将迟缓型爱德华氏菌接种于LB培养基中(pH=7), 37°C培养, 6000r/min离心 2min, 用无菌的 PBS缓冲液充分洗涤, 再次离心, 保存于PBS缓冲液中, 调整浓度107CFU/mL。
1.2.2 牙鲆免疫 将制备好的迟缓型爱德华氏菌注射到健康牙鲆体内, 每尾注射100μL, 由腹腔注射,对照组注射PBS缓冲液100μL, 分别于感染后0h, 1h,3h, 6h, 12h, 1d, 3d, 6d后, 每组随机取出3尾进行解剖, 于超净台上分离各组织。
1.2.3 RNA的提取和纯化 将上述解剖分离的各组织, 用天平称取 50—100mg, 放入玻璃匀浆器中,加入1mL的Trizol充分研磨提取RNA, 12000r/min,4°C离心 10min, 取上清, 静止 5min, 加入 200μL的氯仿, 震荡15s, 静止5min, 12000r/min, 4°C, 15min离心, 去上层水相, 加入 500 mL异丙醇, 混匀, 静置10min, 12000r/min, 4°C, 离心 10min, 取沉淀, 倒置空干, 加入1mL 75%乙醇, 7500r/min, 4°C, 离心5min,取沉淀, 加入 20μL DEPC水溶解, 水浴 55°C, 5min,放置在–80°C冰箱备用。
1.2.4 cDNA链的合成 购买于 Sangon Biotech®公司的 cDNA试剂盒, 按照其推荐的方法, 用于TLR1基因和TLR2基因cDNA第一链的合成。反应体系包括: RNA 2μg, 随机六合引物(0.2μg/μL) 1μL,RNase free ddH2O, 5×Reaction Buffer 4μL, dNTP Mix(10mmol/L) 2μL, RNase Inhibitor (20U/μL) 1μL,M-MuLV RT (200U/μL) 1μL, 扩增体积总体积是20μL。
1.2.5 基因的定量表达 使用ABI 7500荧光PCR仪, 以反转录的cDNA为模板, 获得各组织的免疫相关基因的定量表达数据。使用 Promega®公司的GoTaq®qPCR Master Mix推荐的使用方法, 反应体系为 cDNA 模版 4μL, 上游引物(10μmol/L) 0.4μL, 下游引物(10μmol/L) 0.4μL, GoTaq®qPCR Master Mix 10μL, Nuclease-Free Water 9.2μL。反应总体积是 24μL,各组织样品设3个重复, 用2–ΔΔCT的方法进行相对定量分析, 用Origin 8软件作柱状图分析。表1为实验所使用的引物序列。
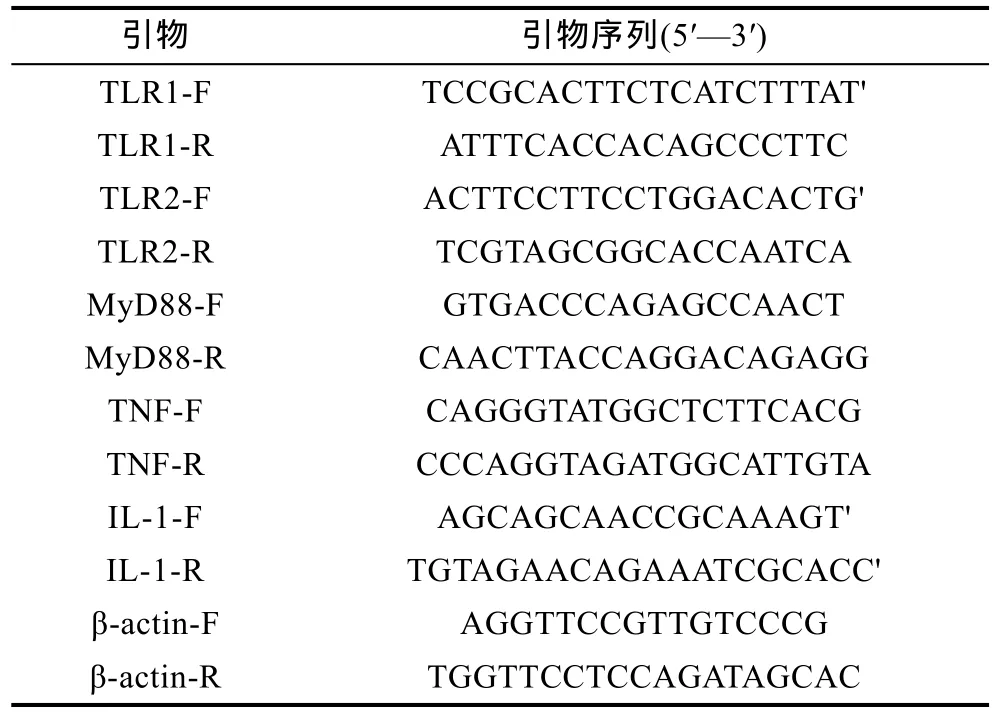
表1 Real-Time RT-PCR所使用的各基因特异性引物Tab.1 The specific primers of each gene used for Real-Time RT-PCR
2 结果
2.1 牙鲆健康组织中TLR1和TLR2的表达分布
TLR1和TLR2基因在健康牙鲆体内广泛表达于所测试的七种组织中。TLR1基因在脾脏组织中基因的相对表达量最高, 其次是心脏、肌肉, 如图1; TLR2在小肠组织中基因的相对表达量最高, 其次是肝脏、心脏、肌肉, 如图2。
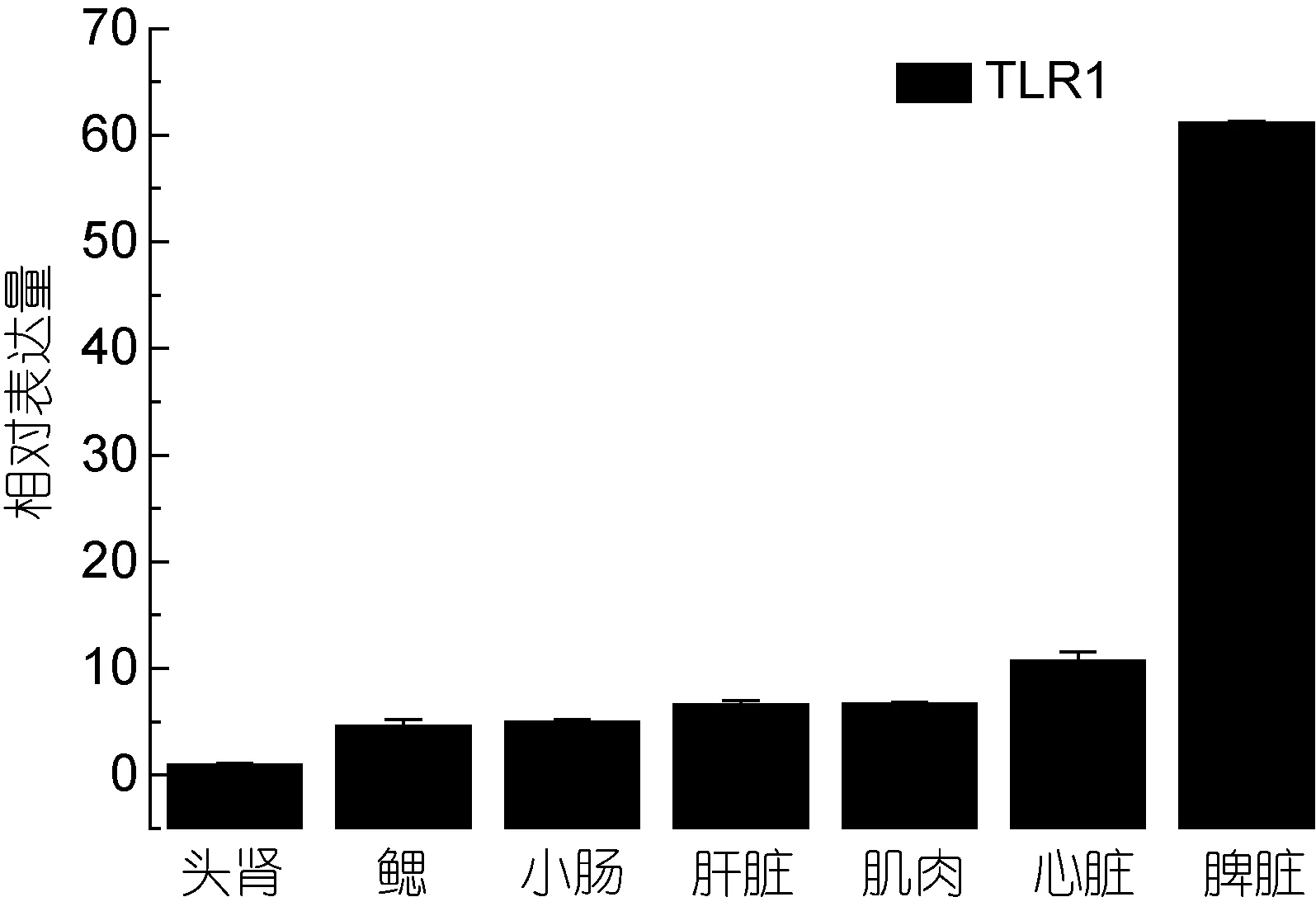
图1 TLR1在牙鲆健康组织中的相对表达量Fig.1 Relative expression of P.olivaceus TLR1 in various tissues
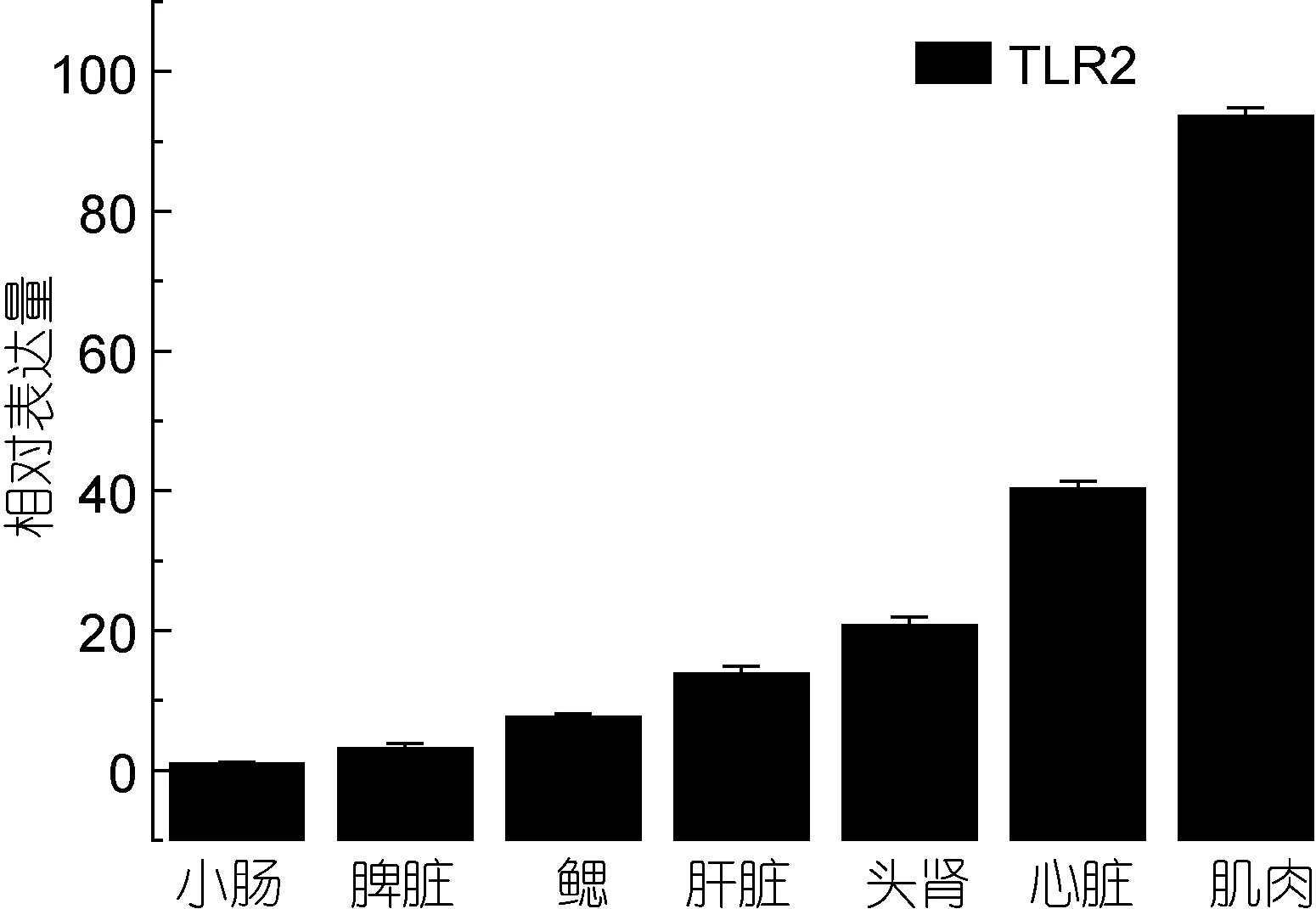
图2 TLR2在牙鲆健康组织中的相对表达量Fig.2 Relative expression of P.olivaceus TLR2 in various tissues
2.2 免疫刺激后TLR1和TLR2基因的表达
TLR1基因在牙鲆刺激迟缓型爱德华氏菌后, 各中组织中基因的相对表达量呈先增高后降低的趋势。基本在感染迟缓型爱德华氏菌6h后, TLR1基因的相对表达量出现最高峰, 之后整体呈下降趋势。在心脏组织中, 牙鲆在注射致病菌 6h后表达量出现第一个高峰, 为对照组的 5.8倍, 之后相对表达量降低, 但在 1d时表达量出现最高峰, 为对照组的 9.8倍(P<0.01)。如图 3, 差异显著(P<0.05)和差异极显著(P<0.01)分别用“*”和“**”表示。在脾脏组织中 TLR1基因相对表达量变化最明显。在脾脏组织中, 感染致病菌 1h后, TLR1基因相对表达量出现第一个高峰,为对照组的90倍(P<0.01), 在免疫6h后, 基因相对表达量达到最高峰, 与对照组相比, 相对表达量为 290倍(P<0.01), 之后 TLR1基因的相对表达量逐渐降低,如图4。在头肾、小肠、肌肉组织中, 牙鲆免疫6h后,TLR1基因的相对表达量出现最高峰, 分别是是对照组的 20倍(P<0.01)、11倍(P<0.01)、8.5倍(P<0.01), 如图5、图6、图7。而牙鲆的鳃组织与其他组织不同, 在鳃组织中, 牙鲆免疫 1h后表达量出现第一个高峰,与对照组比较, 基因的相对表达量是对照组的4.5倍(P<0.05), 而牙鲆在免疫3h后, TLR1的相对表达量出现最高峰, 为对照组的9倍(P<0.01), 如图8。
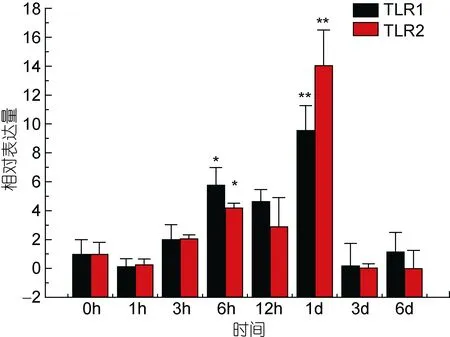
图3 TLR1和TLR2 在受E.tarda刺激后在心脏中的表达量变化Fig.3 Relative expression of P.olivaceus TLR1 and TLR2 in the heart after infection by E.tarda
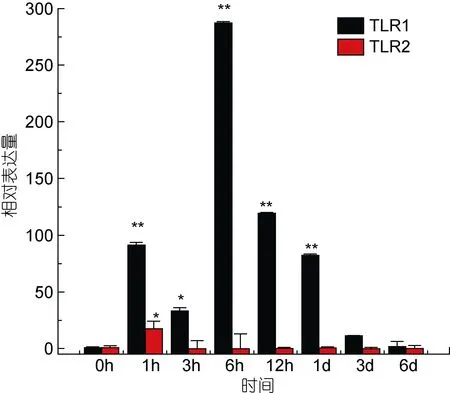
图4 TLR1和TLR2在受E.tarda刺激后在脾脏中的表达量变化Fig.4 Relative expression of P.olivaceus TLR1 and TLR2 in the spleen after infection by E.tarda
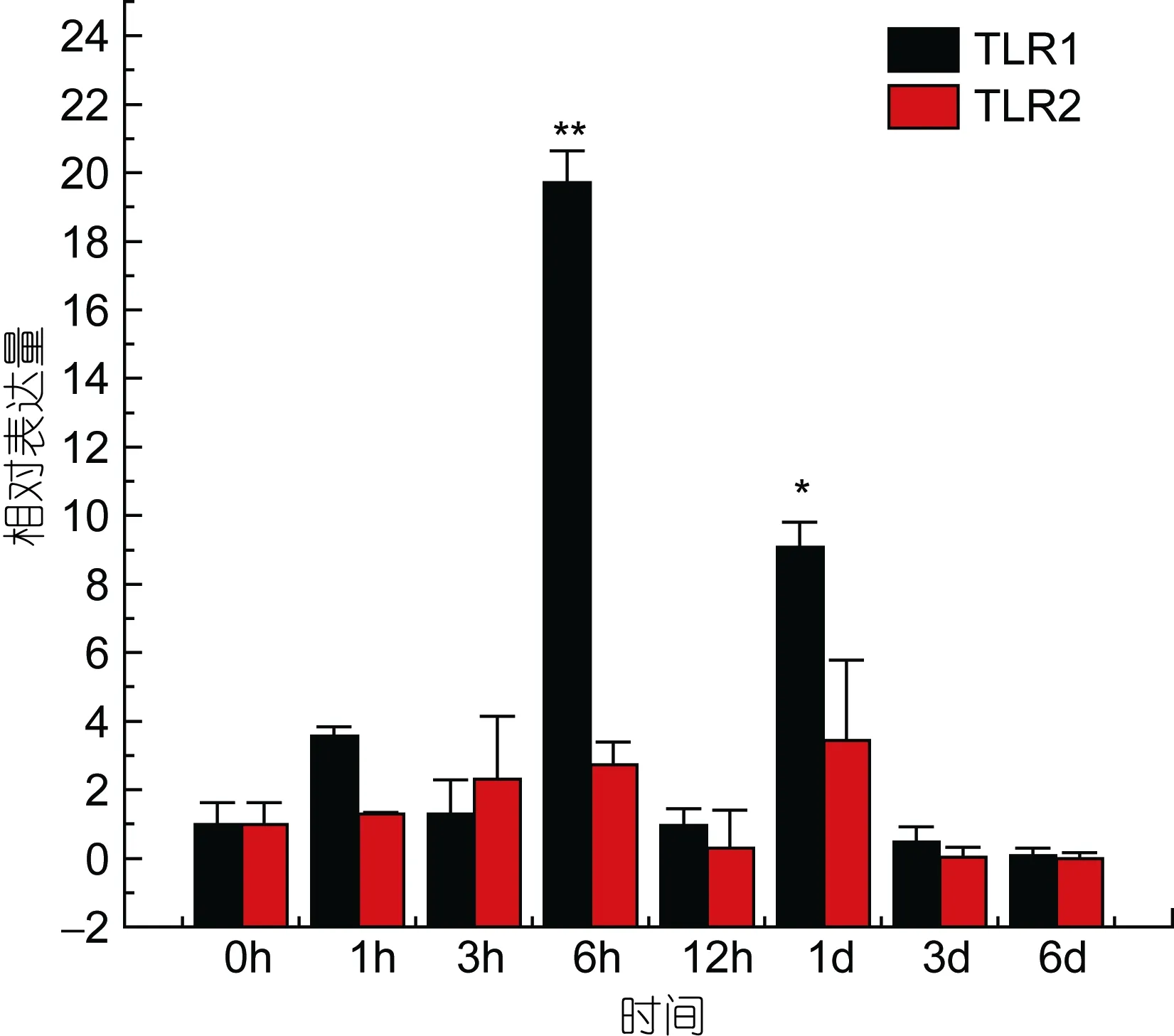
图5 TLR1和TLR2 在受E.tarda刺激后在头肾中的表达量变化Fig.5 Relative expression of P.olivaceus TLR1 and TLR2 in the head kidney after infection by E.tarda

图6 TLR1和TLR2 在受E.tarda刺激后在小肠中的表达量变化Fig.6 Relative expression of P.Olivaceus TLR1 and TLR2 in the intestine after infection by E.tarda
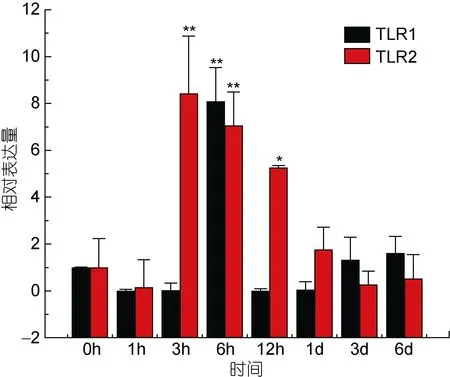
图7 TLR1和TLR2在受E.tarda刺激后在肌肉中的表达量变化Fig.7 Relative expression of P.Olivaceus TLR1 and TLR2 in the muscle after infection by E.tarda
TLR2基因在牙鲆刺激迟缓型爱德华氏菌后, 在脾脏、心脏, 肌肉和小肠中的相对表达量的变化比较明显, 整体呈先增高后降低的趋势。在肝脏(图 9)、肾脏和鳃组织中, TLR2基因的相对表达量变化不明显。在脾脏组织中, 在刺激1h后, 表达量出现第一个高峰, 表达量是对照组的24倍(P<0.01), 之后表达量下调, 基本趋于稳定。在心脏组织中, TLR2在刺激6h后相对表达量出现第一个高峰, 为对照组的 4倍(P<0.05), 之后在刺激1d后, 基因相对表达量达到峰值, 是对照组的 14.5倍(P<0.01), 之后 TLR2基因的表达量下降。在小肠组织中, 刺激3h后, TLR2基因的表达量出现最高峰, 为对照组的8.5倍(P<0.01), 之后表达量出现下调, 最后相对表达量稳定在 0时以下。在肌肉组织中, TLR2基因相对表达量的变化也比较明显, 在刺激致病菌 3h后, 相对表达量出现峰值, 为对照组的 8.5倍(P<0.01), 之后表达量出现下调。而在肝脏组织中, TLR2基因也出现了下调的趋势。在感染致病菌 6h后, 相对表达量是没有变化的, 而在其他时间点, 相对表达量基本稳定在0时左右。图10、图11分别总结了牙鲆在腹腔注射E.tarda后各组织中TLR1及TLR2基因的时空表达变化。
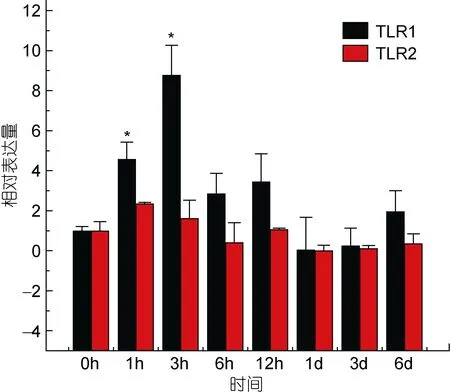
图8 TLR1和TLR2在受E.tarda刺激后在鳃中的表达量变化Fig.8 Relative expression of P.olivaceus TLR1 and TLR2 in the gill after infection by E.tarda

图9 TLR1和TLR2 在受E.tarda刺激后在肝脏中的表达量变化Fig.9 Relative expression of P.olivaceus TLR1 and TLR2 in the liver after infection by E.tarda
图 10总结了迟缓型爱德华氏菌感染牙鲆后TLR1及TLR2在各组织中的表达变化差异。可以看出TLR1在脾脏中的表达上调最显著, 说明脾脏是牙鲆应答迟缓型爱德华氏菌的重要免疫器官。TLR2在脾脏、小肠和心脏中也有较高的表达上调。

图10 牙鲆腹腔注射E.tarda后各组织中TLR1(A)和TLR2(B)的表达量变化Fig.10 Relative expression of P.olivaceus TLR1 (A) and TLR2 (B) in various tissues after infection by E.tarda in different durations
2.3 免疫刺激后MyD88基因的表达
MyD88是髓样分化因子(myeloid differentiation factor 88), 在TLR信号转导通路中起着非常重要的作用, 是 TLR基因家族的关键接头分子(姜华,2010), 它可以介导 TLR 所有的信号传导, 除TLR3外(Bonnertet al, 1997; Akiraet al, 2006)。在 MyD88介导的TLR信号转导通路中, IRAK家族和MyD88相互作用进而募集TRAF6, 导致NF-KB, MAPK或JNK的激活, 诱导一些如TNF的细胞因子及其他前炎症因子的产生, 进而激发一系列免疫应答反应。为了检验 MyD88是否也参与了迟缓型爱德华氏菌的感染应答反应, 我们又测试了MyD88基因在牙鲆三个重要的免疫器官中的表达变化。实验结果表明,在脾脏组织中, MyD88基因的表达量增加较明显,在免疫3h后出现最高峰, 表达量是对照组的18倍(P<0.01), 之后表达量降低, 但表达量仍高于对照组。在肾脏组织中, MyD88基因在免疫 6h后基因表达量出现最高峰, 表达量是对照组的 12倍(P<0.01), 之后表达量逐渐降低, 在免疫 1d后, 基因的表达量是对照组的 6.5倍(P<0.01)。在牙鲆鳃组织中, 在免疫 3h后MyD88的表达出现上调, 表达量是对照组的10倍(P<0.01); 在免疫3d后, 基因的表达量达到最高峰, 是对照组的 10.5倍(P<0.01)。结果如图 11。
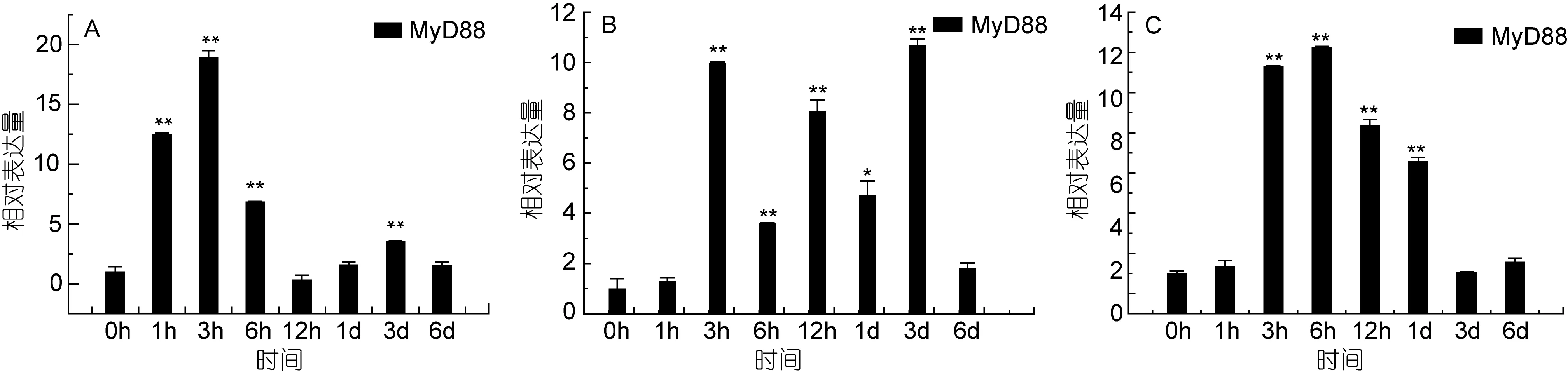
图11 牙鲆E.tarda感染后MyD88基因的表达变化Fig.11 Relative expression of P.olivaceus MyD88 after infection by E.tarda
2.4 免疫刺激后TNF-α和IL-1的表达
细胞因子是一种构成免疫系统的重要介质, 主要由免疫细胞和某些非免疫细胞经刺激后分泌的可溶性小分子蛋白质。细胞因子作为在免疫系统中细胞间相互作用的信号分子、与细胞膜上受体结合后可以发挥多种生物效应, 在免疫调节、免疫应答和炎症反应中有着非常重要的作用(朱立祥, 2010)。参与免疫反应的细胞因子主要有肿瘤坏死因子(TNF)、白细胞介素(IL)、干扰素(INF)等。许多炎症细胞因子也有着非常重要的作用, 例如 TNF-α、IL-6、IL-1β、IL-8等。为了进一步检测 TLRs信号通路下游炎症因子的应答反应, 实验还测定了 TNF-α、IL-1基因的表达变化。
肿瘤坏死因子(tumor necrosis factor, TNF)可以抑制和杀伤肿瘤细胞, 主要由活化的单核/巨噬细胞产生, 它可以促进中性粒细胞吞噬, 抗感染, 会引起发热, TNF会诱导肝细胞急性期蛋白合成(井远方, 2013),进而促进髓样白血病细胞向巨噬细胞分化, 诱导细胞增殖分化, 并参与某些自身免疫病的病理损伤, 是一类重要的炎症因子。实验结果表明, 在脾脏组织中,TNF-α的表达上调比较明显, 在免疫1h后达到峰值,相对表达量是对照组的 300倍(P<0.01), 之后表达量缓慢降低, 但表达量仍高于对照组。在肾脏组织中,TNF-α的表达在免疫 1h后出现第一个表达高峰, 表达量是对照组的 400倍(P<0.01), 之后表达量没有明显的变化。在牙鲆鳃组织中, 在免疫 1h后牙鲆的表达量出现第一个表达高峰, 表达量是对照组的130倍(P<0.01); 在免疫6h后, TNF-α的表达量是对照组的225 倍(P<0.01)。
白细胞介素(interleukin, IL)是一类由白细胞产生又在白细胞间发挥作用的细胞因子。IL-1可以调节细胞免疫激活, 是一种起着致热作用的热原质成分, 也是一种重要的介导炎症炎性介质。抗原、内毒素、细菌及病毒等都可以作为刺激因子诱导IL-1, 在慢性和急性炎症的致病过程中发挥重要作用。实验结果表明,在头肾组织中, IL-1的表达比较明显, 在免疫1h后表达出现峰值, 表达量是对照组的 305倍(P<0.01); 在免疫6h后, 表达量是对照组的370倍(P<0.01), 之后表达量平缓, 但表达量仍高于对照组。在脾脏组织中,IL-1的表达量在免疫 1h后出现第一个高峰, 与对照组相比, 表达量是对照组的75倍(P<0.01), 之后表达量趋于稳定。在牙鲆鳃组织中, 在免疫 6h后表达量出现第一个表达高峰, 与对照组比较, 表达量是对照组的30倍(P<0.01)。结果如图12。
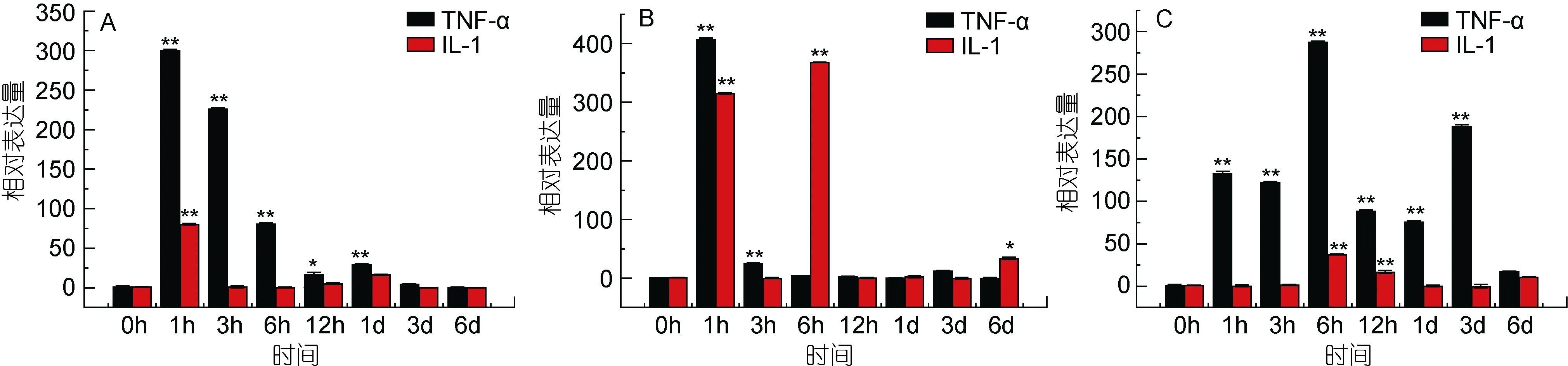
图12 TNF-α和IL-1在牙鲆感染E.tarda后的表达量变化Fig.12 Relative expression of P.olivaceus TNF-α and IL-1 after infection by E.Tarda
3 讨论
Toll样受体是在果蝇体内发现的, 作为一种重要的受体, 在果蝇的发育和天然免疫中发挥抗微生物感染的作用。被报道的TLR1基因组结构表明, 在目前的研究中一些相关内含子的变异现象并没有被证实。研究表明, 斑马鱼的TLR1基因中含有一个内含子(Wuet al, 2008), 但在其他被报道的哺乳类、鸡和硬骨鱼类中不具有内含子(Wuet al, 2008; Paltiet al,2010; Reblet al, 2010)。这些是否是由于物种差异造成的还需要进一步被证实。而TLR2基因是TLR家族在先天免疫中发挥作用的关键成员。在哺乳动物中,TLR2可以触发 MyD88依赖性信号传导诱导的各种细胞因子应答, 也可识别一些特定的微生物的结构(Liet al, 2016)。TLR2可以与TLR1和TLR6形成异质二聚体和同源二聚体, 识别各种不同的病原体相关分子模式(pathogen associated molecular patterns,PAMPs) (Fanet al, 2015)。
目前, 许多研究都致力于鱼类免疫相关基因的克隆和应用鉴定, 解析这些基因的分子结构, 通过免疫刺激实验来研究各基因在组织中的表达, 以期获得该基因功能的相关信息。TLR1和TLR2是牙鲆体内重要的免疫相关基因, 在牙鲆体内它们的转录是否受迟缓型爱德华氏菌的调节, 目前在国内还没有相关报道。TLR1和TLR2基因虽然在一些鱼类中已经被克隆鉴定, 如河豚、斑马鱼(Jaultet al, 2004;Meijeret al, 2004), 但目前可检索到的基因功能方面的研究还是有限的: 有研究显示脂多糖刺激河豚后可使 TLR1基因的表达增加(Wuet al, 2008); 虹鳟TLR1基因的表达不受脂蛋白刺激的影响, 但脂多糖却能上调该基因的表达(Paltiet al, 2010); 斜带石斑鱼用脂多糖、Poly(I:C), 以及鳗弧菌分别刺激后,TLR1和 TLR2基因表达都发生了上调(Weiet al,2011); 鲶鱼经迟缓型爱德华氏菌刺激后, TLR2基因在头肾中表达略微下调, 在脾中先下调后上调(Baoprasertkulet al, 2007)。可见, 在哺乳动物与鱼类之间, TLR1和TLR2所识别的配体存在一定差异, 在哺乳动物中, TLR1和TLR2主要识别的配体是脂蛋白(朱春红等, 2009)。
通过实时荧光定量 PCR的检测, 我们的实验结果显示, 在被研究的牙鲆 7个健康组织中, TLR1和TLR2基因有广泛的组织表达分布, TLR1基因在脾脏组织中的表达量最高, 在鳃和头肾中表达最低; TLR2在小肠组织中表达量最高, 在鳃、脾脏和头肾中表达最低。而头肾和鳃做为鱼类重要的免疫器官, 其TLR1和 TLR2的基础表达量都较低, 也许这一表达特征可用于表征牙鲆鱼体的健康状况。有研究报道,斜带石斑鱼在被检测的9个组织中, TLR1在脾脏的相对表达量最高(Weiet al, 2011), 这一研究结果与我们的研究结果是一致的。河豚的TLR1基因在被检测的 8个组织中, 心脏中表达量最高, 其次是脾脏(Wuet al, 2008)。可见, 不同的TLRs成员基因在不同鱼种或不同组织中的基础表达量是有一定差异的。这种不同鱼种在不同组织表达量高低的生物学意义还有待进一步的研究。在免疫刺激实验中, 迟缓型爱德华氏菌能够上调牙鲆TLR1和TLR2基因的表达, 并且显示TLR1基因对病原体的刺激更加敏感, 且在脾脏中的表达上调程度最大, 说明脾脏中的TLR1在识别迟缓型爱德华氏菌感染中起了重要作用。做为TLRs信号转导中的重要接头分子 MyD88, 在牙鲆感染时期,MyD88基因也有着与TLR1基因同步的表达上调, 暗示迟缓型爱德华氏菌可能通过 TLR1信号通路上调MyD88的表达, 并激活免疫细胞中炎症因子 TNF-α和 IL-1的基因表达上调, 最终释放炎症因子以应答病原菌的感染。
作为低等的脊椎动物, 鱼类似乎有着更丰富的TLRs, 鱼类有其特有的 TLR家族成员(欧阳蒲月等,2010), 例如 TLR20、TLR21、TLR22和 TLR23(Wuet al, 2012), 目前, 在牙鲆、斜带石斑鱼和斑马鱼等硬骨鱼类中就有针对 TLR21基因的相应研究(Liet al,2012; Gaoet al, 2013; Yehet al, 2013; 张洁等, 2015),这也进一步说明了鱼类的 TLR家族有扩张的趋势。TLRs家族可识别同样的PAMP, 例如河豚鱼TLR3、TLR22能识别双链核糖核酸(Matsuoet al, 2008), 虹鳟鱼 TLR5和 TLR5s能识别细菌的鞭毛蛋白(Tsujitaet al, 2004), 另外还有一些研究(李敏等, 2012)报道了TLR5和TLR5s基因在斑点叉尾中的表达分析; 在硬骨鱼和青蛙中能检测到TLR21, 也能检测到 TLR9(Oshiumiet al, 2003; Meijeret al, 2004; Ishiiet al,2007)。但是, 鱼类缺乏哺乳动物中的TLR6和TLR10,分子系统树显示TLR1、TLR2、TLR10和TLR6有相似的分子结构(韦友传, 2011), 处在同一分支上(Roachet al, 2005), 鱼类TLR1和TLR2的功能是否有替代哺乳动物中TLR6和TLR10的功能, 还需进一步的研究证实。
免疫识别成分检测、病原检测与疾病的发生发展是研究鱼类免疫进程重要的三个部分, 只有将三者结合起来, 才能得出更合理的结论。硬骨鱼类机体免疫防御的第一道防线是Toll 样受体对病原体的识别,因此可以通过分析研究 Toll样受体的作用机制进一步开发牙鲆免疫增强剂(Wuet al, 2012); 在牙鲆养殖业中, 爱德华氏菌病是影响牙鲆健康生长的重要因素, 通过分析牙鲆 TLRs基因表达的变化, 可监测养殖牙鲆的健康状况, 分析可能感染的病原种类, 及时采取预防治疗措施。因此, 研究迟缓型爱德华氏菌对牙鲆刺激造成的基因表达特征和结构特征具有一定理论意义。
王建波, 2010.网箱养殖牙鲆的度夏技术探讨.中国水产, (10):50—51
王海坤, 韩代书, 2006.Toll样受体(TLRs)的信号转导与免疫调节.生物化学与生物物理进展, 33(9): 820—827
王德成, 佘 敏, 佘锐萍等, 2008.Toll样受体研究进展.动物医学进展, 29(2): 56—60
井远方, 2013.儿童急性白血病化疗过程中部分细胞因子动态变化及其临床意义.广州: 南方医科大学硕士学位论文
韦友传, 2011.斜带石斑鱼TLR1、TLR2和MyD88基因的克隆与免疫应答研究.南宁: 广西大学博士学位论文
朱立祥, 2010.“人体的免疫调节”的教学组织.生物学通报,45(5): 21—25
朱春红, 吴 娟, 朱国强, 2009.家禽 Toll样受体研究进展.中国家禽, 31(8): 40—43
李 敏, 李 琪, 王启龙等, 2012.斑点叉尾TLR5和TLR5S基因在不同病原诱导下的表达特征.渔业科学进展, 33(05): 30—38
张 洁, 郑津辉, 李庆亚等, 2015.牙鲆(Paralichthys olivaceus)TLR21基因在迟缓爱德华氏菌(Edwardsiella tarda)感染后的表达特征.海洋与湖沼, 46(6): 1502—1508
范泽军, 邹鹏飞, 姚翠鸾, 2015.鱼类 Toll样受体及其信号传导的研究进展.水生生物学报, 39(1): 173—184
欧阳蒲月, 郭成栓, 2010.TLR21在斑马鱼免疫功能中的作用研究.安徽农业科学, 38(3): 1258—1260
姜 华, 2010.益气活血复方对Toll样受体4及其下游信号转导通路的影响及抗动脉粥样硬化的机制研究.沈阳: 辽宁中医药大学博士学位论文
鲍宝龙, 张臻宇, 龚小玲等, 1999.外源甲状腺素及可的松对牙鲆早期发育阶段生长、发育和变态的影响.上海水产大学学报, 8(3): 242—246
Akira S, Uematsu S, Takeuchi Oet al, 2006.Pathogen recognition and innate immunity.Cell, 124(4): 783—801
Baoprasertkul P, Peatman E, Abernathy Jet al, 2007.Structural characterisation and expression analysis of toll-like receptor 2 gene from catfish.Fish & Shellfish Immunology, 22(4):418—426
Bonnert T P, Garka K E, Parnet Pet al, 1997.The cloning and characterization of human MyD88: a member of an IL-1 receptor related family.FEBS Letters, 402(1): 81—84
Fan Z J, Jia Q J, Yao C L, 2015.Characterization and expression analysis of Toll-like receptor 2 gene in large yellow croaker,Larimichthys crocea.Fish & Shellfish Immunology, 44(1):129—137
Gao H, Wu L, Sun J Set al, 2013.Molecular characterization and expression analysis of Toll-like receptor 21 cDNA fromParalichthys olivaceus.Fish & Shellfish Immunology, 35(4):1138—1145
Ishii A, Kawasaki M, Matsumoto Met al, 2007.Phylogenetic and expression analysis of amphibianXenopusToll-like receptors.Immunogenetics, 59(4): 281—293
Jault C, Pichon, Chluba J, 2004.Toll-like receptor gene family and TIR-domain adapters inDanio rerio.Molecular Immunology, 40(11): 759—771
Li X P, Sun L, 2016.Toll-like receptor 2 of tongue sole
Cynoglossus semilaevis: signaling pathway and involvement in bacterial infection.Fish & Shellfish Immunology, 51:321—328
Li Y W, Luo X C, Dan X Met al, 2012.Molecular cloning of orange-spotted grouper (Epinephelus coioides) TLR21 and expression analysis postCryptocaryon irritansinfection.Fish & Shellfish Immunology, 32(3): 476—481
Matsuo A, Oshiumi H, Tsujita Tet al, 2008.Teleost TLR22 recognizes RNA duplex to induce IFN and protect cells from birnaviruses.The Journal of Immunology, 181(5): 3474—3485
Meijer A H, Gabby Krens S F, Medina Rodriguez I Aet al, 2004.Expression analysis of the Toll-like receptor and TIR domain adaptor families of zebrafish.Molecular Immunology, 40(11): 773—783
Oshiumi H, Tsujita T, Shida Ket al, 2003.Prediction of the prototype of the human Toll-like receptor gene family from the pufferfish,Fugu rubripes, genome.Immunogenetics,54(11): 791—780
Palti Y, Rodriguez M F, Gahr S Aet al, 2010.Identification,characterization and genetic mapping ofTLR1loci in rainbow trout (Oncorhynchus mykiss).Fish & Shellfish Immunology, 28(5—6): 918—926
Rebl A, Goldammer T, Seyfert H M, 2010.Toll-like receptor signaling in bony fish.Veterinary Immunology and Immunopathology, 134(3—4): 139—150
Roach J C, Glusman G, Rowen Let al, 2005.The evolution of vertebrate Toll-like receptors.Proceedings of the National Academy of Sciences of the United States of America,102(27): 9577—9582
Tsujita T, Tsukada H, Nakao Met al, 2004.Sensing bacterial flagellin by membrane and soluble orthologs of Toll-like receptor 5 in rainbow trout (Onchorhynchus mikiss).The Journal of Biological Chemistry, 279(47): 48588—48597
Wei Y C, Pan T S, Chang M Xet al, 2011.Cloning and expression of Toll-like receptors 1 and 2 from a teleost fish,the orange-spotted grouperEpinephelus coioides.Veterinary Immunology and Immunopathology, 141(3—4): 173—182
Wu L, Sun J S, Geng X Yet al, 2012.Molecular cloning and expression analysis of Toll-like receptor 1 cDNA in Japanese flounder,Paralichthys olivaceus.Agricultural Science &Technology, 13(12): 2464—2470
Wu X Y, Xiang L X, Huang Let al, 2008.Characterization,expression and evolution analysis of Toll-like receptor 1 gene in pufferfish (Tetraodon nigroviridis).International Journal of Immunogenetics, 35(3): 215—225
Yeh D W, Liu Y L, Lo Y Cet al, 2013.Toll-like receptor 9 and 21 have different ligand recognition profiles and cooperatively mediate activity of CpG-oligodeoxynucleotides in zebrafish.Proceedings of the National Academy of Sciences of the United States of America, 110(51): 20711—20716
EXPRESSION OF TLR1 AND TLR2 GENES OF JAPANESE FLOUNDERPARALICHTHYS OLIVACEUSINDUCED BYEDWARDSIELLA TARDA
LI Qing-Ya1, ZHOU Mi1, ZHANG Jie1, ZHENG Jin-Hui1, GENG Xu-Yun2, PAN Bao-Ping1,SUN Jin-Sheng1,2, GAO Hong1
(1.Tianjin Key Laboratory of Animal and Plant Resistance,College of Life Sciences,Tianjin Normal University,Tianjin300387,China;2.Tianjin Aquaculture Disease Prevention & Treatment Center,Tianjin300221,China)
Toll-like receptors (TLRs) are a class of proteins that play an important role in the innate immunity.Toll-like receptor 1 (TLR1) forms a heterodimer with Toll-like receptor 2 (TLR2) to recognize lipopeptides of pathogenic bacteria and initiate host innate immunity system.We detected the mRNA levels of TLR1 and TLR2 in various tissues of healthy orEdwardsiella tardainduced Japanese flounderParalichthys olivaceusby quantitative real time reverse transcription-PCR(RT-qPCR) and discussed the roles of TLR1 and TLR2 in the innate immunity ofP.olivaceus.The results indicate that TLR1 and TLR2 were widely expressed in various tissues of healthyP.olivaceus.The highest expression level of TLR1 was observed in spleen, followed by heart, muscle, liver, intestine, gills, and head kidney, and that of TLR2 in intestine,followed by liver, heart, muscle, gills, and spleen.Immunostimulation test shows that TLR1 transcript peaked in level 6h afterE.tardachallenge in most tissues; the highest expression level soared to 92.2 fold increase (P<0.01) from that of the initial point in the spleen.Similarly, TLR2 transcript topped in 1h in the spleen for a 17.8 fold increase (P<0.01), and 14 fold increase (P<0.01) in the heart; and then the TLR2 expression stayed.These facts suggest that the TLR1 and TLR2 genes were involved in immune response toE.tardainfection.In addition, expressions of MyD88, TNF-α, and IL-1 genes were up-regulated afterE.tardachallenge.Therefore, we believe thatE.tardacould up-regulate MyD88 expression via TLR1 pathway and up-regulate ultimately the expression of inflammatory factors TNF-α and the IL-1 genes against pathogen infection.
TLR1; TLR2;Paralichthys olivaceus;Edwardsiella tarda; expression; real-time PCR
S917.4
10.11693/hyhz20170200040
* 天津市自然科学基金重点项目资助, 14JCZDJC34200号。李庆亚, 硕士研究生, E-mail: liqingya0914@163.com
① 通讯作者: 高 虹, 副教授, E-mail: skygh@mail.tjnu.edu.cn
2017-02-28, 收修改稿日期: 2017-03-19
- 海洋与湖沼的其它文章
- 瓦氏黄颡鱼(Pelteobagrus vachellii)脂肪酸去饱和酶FAD2和延伸酶ELOVL5的克隆及表达分析*
- 基于de novo高通量测序的曼氏无针乌贼(Sepiellajaponica)ESTs中微卫星位点筛选与特征分析*
- 泥蚶(Tegillarca granosa)重组铁蛋白富集重金属离子的特性及化学传感器的研究*
- 厚壳贻贝(Mytilus coruscus)金属硫蛋白MT-10:cDNA克隆、结构分析及铜离子胁迫下的表达*
- 舟山海洋沉积物及沿海沉积物流动相石油污染的电阻率特性及其影响因素研究*
- 鲤科经济鱼类马口鱼(Opsariichthys bidens)胚胎发育及仔稚鱼形态与生长观察研究*

