站在自贸区改革的前沿,探索医疗器械流通监管
【作 者】沈建华,韩梅仙,陆飞
上海市浦东新区市场监督管理局,上海市,200135
站在自贸区改革的前沿,探索医疗器械流通监管
【作 者】沈建华,韩梅仙,陆飞
上海市浦东新区市场监督管理局,上海市,200135
上海外高桥保税区作为中国(上海)自由贸易试验区海关特殊监管区域之一,集聚了大量从事医疗器械的总代理企业。为进一步贯彻落实国家行政审批改革,加强事中事后监管的要求,该文针对自贸区中上海外高桥保税区特殊环境和医疗器械经营企业特点进行风险分析,并根据当前医疗器械法规新要求及医疗器械行业发展趋势,在研究各国市场化监督惯例基础上,提出实施精准监管、协同监管、分类监管及动态监管等措施,为形成公平规范的市场竞争新秩序,打造国际医药分拨和运输枢纽创造条件。
医疗器械;流通监管;风险分析;国际化监管
1 上海自贸区中医疗器械流通监管面临的挑战
2013年国务院批准建立上海自由贸易试验区,上海率先启动了探索中国改革的深水区,贯彻简化行政审批要求,加强事中事后监管的任务。上海自由贸易试验区外高桥保税区医疗器械流通领域中,有不同种类的企业涉及医疗器械相关业务。按照运营方式分工,有医疗器械物流企业,医疗器械贸易加工企业,医疗器械经营企业,各种医疗器械贸易的服务企业等等。就进入外高桥保税区域的医疗器械而言,有等待转运各国的海关一线监管产品;有尚未具备中文标签的产品;或者有中文标签但还未完成报关手续仍处于海关一线监管的产品等等。因此,对医疗器械实施监管来说,简单地认为只要有仓库存储医疗器械,就可以按照医疗器械经营许可证来实施监管,显然是行不通的。换言之,海关特殊监管区的医疗器械,存在产品流向的不确定性及企业运营方式的不确定性这两种复杂情况。仅仅依靠按照现行的医疗器械相关法规进行监管,有时会缩手无策,难以应对市场经济发展和深化改革开放实际的需要。在外高桥保税区实施医疗器械的监管,必须坚持改革的原则,走解放思想转变观念,积极探索制度创新的道路。
1.1 上海外高桥保税区医疗器械经营企业基本概况
医疗器械贸易是上海外高桥保税区(以下简称,外高桥保税区)经济发展的支柱产业,是经济总量和税收的主要来源之一;其医疗器械物流分拨枢纽,是重点发展的专业贸易平台之一。有数据表明:2015年,外高桥保税区药品及医疗器械批发总值为1 090.83亿元[1]。这里集聚了大量跨国的医疗器械经营企业,高附加值和高风险的产品占了全国主要市场。
截至2015年12月31日,浦东新区共有医疗器械经营企业2 940家(其中,医疗器械第三方物流企业12家)。外高桥保税区内企业301家,占全区医疗器械经营企业10.24%,详见表1。
从表1的数据按医疗器械专营数、三类与二类企业比例及第三方物流企业占比进一步分析,我们发现:外高桥保税区内企业与非保税区内企业各自医疗器械专营企业比重分别为:96.35%、68.06%;各自的三类企业与二类企业比例分别为:4.31、1.95;二者的第三方物流企业占全区的比重分别为75%、25%。
我们曾在2014年对外高桥保税区企业进行了抽样统计、调查。从112家保税区内医疗器械经营企业的构成情况看:属于国际医疗器械厂商在中国的总代理企业74家,占66.07%;作为国外企业在中国的法定注册代理机构的企业41家,占36.61%;各类医疗器械售后服务机构的企业52家,占46.43%;在112家企业中,委托第三方物流储运的企业42家,占37.50%;涉及经营进口医疗器械需在保税区内加贴医疗器械中文标签的企业51家,占45.54%。
上述抽样统计分类显示,外高桥保税区医疗器械经营企业大部分是涉及全球业务的国际企业,其经营的产品代表了当今中国医疗器械市场高端(技术含量)医疗器械、高风险医疗器械、高附加值医疗器械的主要部分。尤其是其中相当一部分企业涉及进口医疗器械的标签转换、储运环节,与医疗器械安全使用重点风险控制密切相关,因此,从这部分企业探索医疗器械经营企业质量监管,探讨与国际市场接轨,推动外高桥保税区实现国际医疗产品的航运、分拨、贸易发展,具有代表性和重要的现实意义。
1.2 外高桥保税区医疗器械监管中风险分析
根据现行监管的要求,本文对浦东医疗器械经营企业的风险因素进行量化。综合对专营医疗器械企业数量、总代理企业数、企业管理人员变动频率、第二经营场所、多处库房、产品是否需要实施中文标签转换、发生产品召回概率与影响、他省市协查的数量、销售量的大小、产品流向的范围大小、经营品种数量的大小、第三方物流企业的数量、企业管理经验的强弱、产品追溯的难度、不良事件报告数量、发生无证产品的影响、发生缺陷产品的影响、经营的产品是否全部为进口产品共计18项影响监督管理的风险因素进行量化分析。
量化的原则为:18项影响监督管理的风险因素,按风险高低依次量化为1、2、3、4、5等数量级,对浦东新区保税区内企业、保税区外企业,按各自管理的风险进行量化。具体情况详见图1所示。
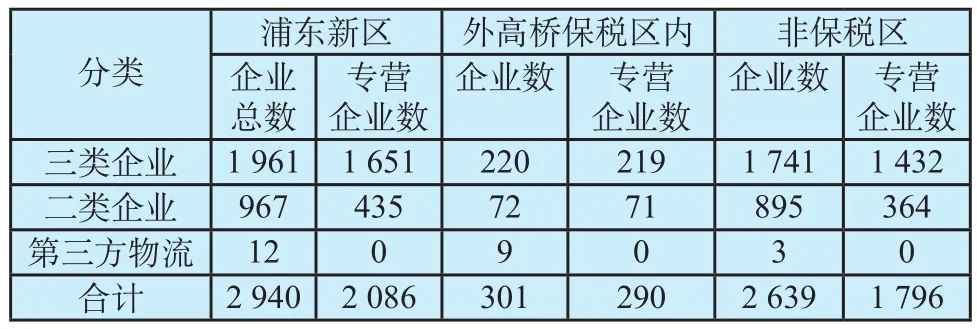
表1 浦东新区医疗器械经营企业分布(n)Tab.1 Distribution of medical device enterprises in Pudong New Area

图1 18项经营风险要素加权量化表Fig.1 Weighted quantif i cation table of 18 operational risk factors
经对风险进行量化:外高桥保税区医疗器械经营企业,风险因素量化总值为83,外高桥保税区外医疗器械经营企业风险因素量化总值为26,外高桥保税区内外企业风险量化总值比为3.19:1。
如进一步对风险量化总值比推演,开展贝叶斯法概率的分析,外高桥保税区内与保税区外医疗器械经营企业需要特别控制的事件总概率,也存在明显差异。详见表2所示。
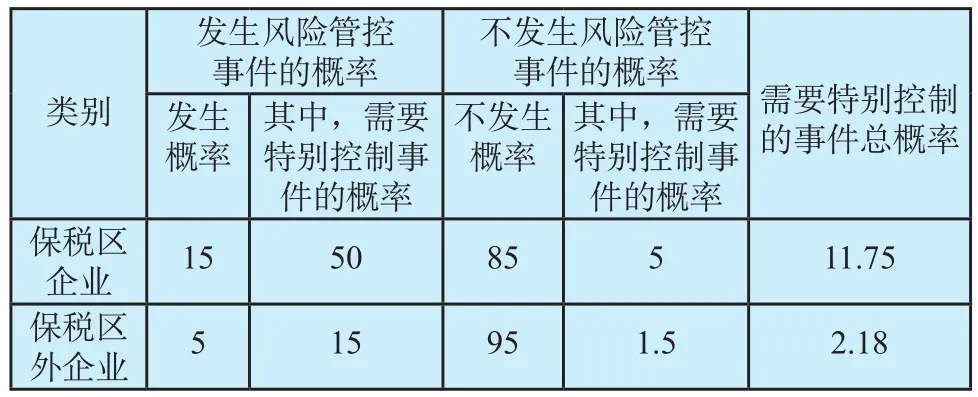
表2 需要特别控制的事件总概率(%)Tab.2 Total probability of events that require special control
从表2中看出,外高桥保税区内医疗器械经营企业需要特别控制的事件总概率明显高于保税区外企业,其概率比为5.40:1。以上分析表明,重点研究并探索保税区医疗器械经营企业监管的措施,将有利于浦东新区医疗器械整体监管有效性的提高。
2 国际医疗器械监管经验及我国现行法规的监管要求
2.1 借鉴国际市场中医疗器械上市后成熟的流通监管手段
纵观美国百年FDA发展制度,以及欧盟统一市场对医疗器械的监管发展历史,各国在医疗器械监管法规发展中,都在一定程度上存在偏重上市前监管的问题。这是各国在制度建立过程中对监管科学性认识和经验积累过程的必然。提高上市后监管有效性,调整上市前后监管重心,促进产品安全信息有效反馈,可以影响到上市前的审批速度,缩短新医疗技术用于临床的时间,有益于促进健康事业发展和保障患者使用器械的安全。
当前各国都在研究和加强对上市后监管制度,主要在两个领域:一是采用医疗器械唯一标识(UDI),目的是在全球范围可以清晰地识别所有上市后的产品,提高产品的追溯效率;二是改进研发、生产、销售全过程质量体系的管理手段。学习和掌握这些国际通用的上市后监管手段,对自贸区进一步深化改革开放,探索强化“事中事后”监管有重要意义。
如果说UDI是医疗器械全球身份证制度,解决识别全球市场中每一个医疗器械,那么医疗器械质量体系ISO 13485则提供了医疗器械的全程供应链管理和追溯管理的解决方案。它可以适用于医疗器械生产和经营企业,不同业务范围用一种统一的要素和模式进行管理,并可以将不同的管理范围和环节全部对接形成系统,保障了医院使用和提供医疗服务的安全和最终患者的安全。
目前,2003版的ISO 13485医疗器械质量体系标准提升到了2016版,增加了:国际质量标准应该符合各国当地法规要求条款;强调了生产以后的供应链管理要求;提出采用UDI标识医疗器械区分上市后器械的要求;要求质量管理应该覆盖产品的全部生命周期,及时报告不良事件的要求等等。
按照简化行政许可的总体思路,类似医疗器械转换标签等行为规范已没有可能通过生产许可解决。本文在充分调研了国际法规发展的现状,以及国内流通领域监管的问题后,按照自贸区深化改革要求,进行了一系列监管模式的探索。
2.2 我国现行医疗器械流通管理要求
2.2.1 强化事中事后监管
中共中央、国务院《关于地方政府职能转变和机构改革的意见》强调,推进简政放权、减少行政审批等事项后,政府机关要转变管理理念,改进工作方式,加强事中事后监管,有效履行职责,避免管理缺位,防止“一放就乱”。加强事中事后监管的内容、措施和职责分工,推动政府部门管理重心由事前审批向事中事后监管转变。事前设置关口,虽然也可以起到管理的作用,但成本太大,而且不利于激发市场活力,事中事后监管新机制是活力激发型监管。事中事后监管,着重解决的是准许之后的监管,是高度市场化、信用化的结果。
2.2.2 体现全生命周期监管
随着新修订的《医疗器械监督管理条例》颁布与实施,医疗器械各类配套规章也相继出台了。新的法规在“放管结合”,从严控制高风险等原则指导下,对医疗器械规范经营的监管提出了更明确的追溯管理要求。医疗器械经营质量管理规范从首营审核、采购、验收、入库、贮存、销售、运输、售后服务、企业责任、产品质量、温度要求、防护要求进行详尽要求。可以说,医疗器械经营企业的监管要求,从企业合法经营向依法经营并且全程规范转变。
医疗器械监管国际化,不但是中国医疗器械行业走向国际市场的需求,也是为顺应中国第一个自贸区建设,促进我国与国际市场规则全面接轨的要求。结合我国当前的实际,推动实现这一目标,是本课题研究的核心。
2.2.3 形成社会化共治结构
事中事后监管,需要一定的监管资源。事实上,目前有限的监管人力,除了应对日常的监管之外,还要应对大量的协查、申投诉调查等等。如何将有限的资源,充分用于监管,查处违法行为、纠正企业不规范经营的行为,这是亟待解决的问题。本课题着重研究了第三方管理方式,通过借力第三方认证机构管理,推进落实医疗器械经营质量管理规范。
3 采用国际化监管手段在外高桥保税区的探索
适应市场经济发展,进一步深化改革和促进市场经济发展,实施精准监管、协同监管、分类监管及动态监管等措施,是提高医疗器械行政管理效能的重要途径。我们探索试行了以下监管方法。
3.1 强化行业自律引导,实施协同监管
外高桥保税区内集中大量进口医疗器械总代理的医疗器械经营企业。调查表明,这些企业执行经营质量管理制度与诚信情况,直接与下游经营与使用的规范与否有着高度的关联。为全面落实《医疗器械监督管理条例》(国务院令第650 号)、《国务院关于促进市场公平竞争维护市场正常秩序的若干意见》(国发〔2014〕20)号等规定,探索强化保税区企业自律,实施市场化监管的要求,我们积极推动行业协会与会员单位签订自律共建协议,制订了包含“坚持公众利益至上”“严格遵守法律法规”“建立质量管理制度”等规范经营自律公约,开展行业自律教育和培训,不断提高企业经营主体责任意识。
3.2 规范器械标签管理,探索分类监管
医疗器械标签对产品合法性、可追溯、能识别、规范化的全程监管有着十分重要的价值。它涵盖了具体的产品、产品注册证(备案凭证)、生产商、可追溯的形式、产品的效期、产品贮运条件等等信息。为落实国家食品药品监督管理总局“医疗器械说明书和标签管理规定” (总局6号令)、“关于规范境外医疗器械标签和包装标识的通知”(国食药监械〔2012〕280号)有关精神,规范医疗器械中文标签管理,我们自2014年起,创新性地将ISO 13485体系管理,引用到了在保税区内加贴医疗器械中文标签企业、第三方储运企业。探索借助第三方认证机构的ISO 13485认证,形成体系化、制度化、文件化的转换标签管理模式,加强对操作环境符合性、人员符合性、流程规范性等国外母公司体系的延伸管理。经三年来的努力,保税区内医疗器械经营企业,已有39家企业获得ISO 13485第三方认证,规范了保税区内转换标签行为。
3.3 加强追溯性管理,试行动态监管
高风险医疗器械尤其是植入性产品,保证可追溯至关重要。在UDI的试行中,我们采取了UDI结合物联网技术的电子标签手段将试点医院库存产品的UDI信息自动实时传送到生产和进口企业,实现实时远程医院库存管理。需要强调的是,这种管理不是通过法规设置的许可证件管理,只是通过信息分享进行管理和监督,互联网手段可以超越法规和地域的界限,解决流通过程的难题。
3.4 引入专业机构,强化精准监管
推动国际和国内知名的医疗器械第三方认证机构进入保税区开展工作,促进企业与医疗器械社会公告机构(NB / Notify Body) 建立市场化的契约关系,维持产品高质量管理的第三方监督常态化运行。今年来,在浦东医疗器械贸易行业协会(简称MDTA)的支持下,积极探索第三方认证机构开展医疗器械GSP全项目核查试点工作。组织了政府、协会、企业、第三方认证机构多次座谈与论证,在对第三方认证机构审核人员完成医疗器械GSP培训后,按照第三方认证机构自愿参与、企业自愿试点,自行选择第三方认证机构、审核结果MDTA汇总、跟踪等原则实行。TUV、TUV南德、BSI、SGS、华光认证5家机构参加了试点。从13家总代理及第三方物流企业试点审核情况来看,共发现157项符合项,平均每家12条不符合项,存在的问题涉及GSP条款的总则,职责与制度,人员与培训,设施与设备,采购、收货与验收,入库、贮存与检查,销售、出库与运输,售后服务等环节。
引入第三方认证机构实施医疗器械GSP第三方审核,充分发挥“第三只眼”的优势。将国际上通行的ISO 13485的审核思路、审核理念、不符合项发现与描述与医疗器械GSP规范相融合,将体系化审核要求与列表式审核细则相结合,发现企业自查时难以发现的不符合项,解决企业质量运行熟视无睹的问题。推动企业持续保证医疗器械经营质量管理体系有效运行。
小结:采用国际惯用的质量体系标准,以及各项配套的措施,解决了目前特殊监管区医疗器械监管矛盾,促进了自贸区诚信自律风气的形成,促进了第三方市场化监督机制的发展,贯彻了减少行政审批的改革要求,加强了对高风险产品事中事后的管理,减少了政府资源的重复消耗,受到了企业的欢迎。
4 建议与设想
按照市政府和浦东新区政府的要求,在市食品药品监管局的支持下,在探索自贸区监管制度创新和加强事中事后监管的过程中,我们做了大量的组织推动和探索研究工作,取得了一定成绩。外高桥保税区内医疗器械经营企业法规意识得到加强、质量管理水平得到了提升。为能更好服务于医疗器械行业发展,促进上海发展成为国际医药分拨和航运运输枢纽。提出以下六项建议。
4.1 管理体系的建立―― 继续推行企业ISO 13485第三方认证
对开展医疗器械第三方物流、标签转换、进口总代理等业务的企业,在行业协会的倡导下,进一步推动实施ISO 13485体系第三方认证,不断提高企业体系化管理的意识水平。
4.2 产品识别的规范―― 制订标签转换规范或管理指南
在国家法规未出台标签转换相关规定前,由行业协会在自律管理的同时,积极探索国际上通行做法,制订符合保税区特色的加贴中文标签中文规范或管理指南。
4.3 追溯体系的应用―― 全面落实产品可追溯
目前,医疗器械产品追溯,尤其是高风险产品的追溯,各个生产商、经销商、医疗机构使用的系统不尽相同。从美国实施UDI管理三年进程来看,UDI的应用极大提升了产品的追溯能力。如果我国实施UDI的产品追溯,可以将计算机系统与UDI结合,将首营的各类信息与要素输入系统,利用系统与UDI的计算能力,快速、方便实行高风险医疗器械产品的信息追溯。
实施这种追溯的前提:一是全国范围内应当统一整个供应链的UDI数据读取计算机软件;二是供应链中全程配备扫码设备[2];三是UDI码的形式无论条码、还是二维码,必须具备可读性、通用性要求。
4.4 开展电子化监管―― 电子随货同行单的应用
在对协查函现场调查中发现,一些可疑产品,存在流通过程中有不法企业将原先医疗器械调换成假冒的产品。尽管在医疗器械流通过程中,国家食品药品监督管理总局第58号公告,要求企业在销售医疗器械产品时,应出具随货同行单,并对该单据进行实物核对。但并不能完全阻止不法企业掉包的违法行为。在现代信息条件下,如果采用电子随货同行单与物理随货同行单组合使用的方式,有效杜绝了这种不法行为。在流通(含运输)过程中,各级分销商及终端用户对电子、物理随货同行单、实物三者进行核对,从而阻断这种掉包行为。
4.5 继续推行协同监管―― 他山之石,可以攻玉
推广协同监管广度和深度,尤其对高风险医疗器械经营企业推行第三方协同监管,开展医疗器械经营质量管理规范的全项目第三方核查,包括对关于整治医疗器械流通领域经营行为的公告(2016年第112号)中的违法行为进行核查。从而全面落实与推进医疗器械GSP,有效加强事中事后监管。
4.6 推动特殊监管区建立医疗器械信息化监管共享平台
UDI可以认为是一个实际产品信息化的一个工具,可以有效地促进产品上市后信息化监管,方便地将各方面监管的要求相互关联起来,形成监管的合力,解决重点产品监管的实时性问题和明晰统一监管的要求。根据自贸区目前实际情况和有利的条件,在高风险进口产品进入中国市场的最前沿,建议尽快设立医疗器械唯一标识的信息化的监管平台,将食药监、海关、商检的相关监督信息形成共享机制。促进医疗供应链的信息透明,缩短供应链,促进国家医改政策的发展,促进企业自觉地诚信和合规经营,促进自贸区逐步实现医疗器械的电子化通关和交易,促进物流、贸易、金融行业的跨界融合,形成自贸区新型业态。
[1] 2015中国(上海)自由贸易试验区保税区域经济发展统计公报[R].
[2] UDI助力医疗质量更上一层楼[N]. 中国医药报,2016-12-6(8).
Exploring Flow and Supervision of Medical Instruments by Standing on Frontier of the Reform of Free Trade Zone
【 Writers 】SHEN Jianhua, HAN Meixian, LU Fei
Pudong New Area Market Supervision and Administration Bureau of Shanghai, Shanghai, 200135
Shanghai Waigaoqiao Free Trade Zone as one of the special customs supervision areas of China (Shanghai) free trade pilot area, gathered a large number of general agent enterprises related to medical apparatus and instruments.This article analyzes the characteristics of special environment and medical equipment business in Shanghai Waigaoqiao Free Trade Zone in order to further implement the national administrative examination and approval reform. According to the latest requirement in laws and regulations of medical instruments, and trend of development in the industry of medical instruments, as well as research on the basis of practices of market supervision in countries around the world, this article also proposes measures about precision supervision, coordination of supervision,classi fi cation supervision and dynamic supervision to establish a new order of fair and standardized competition in market, and create conditions for establishment of allocation and transport hub of international medicine.
medical device, circulation supervision, risk analysis, international supervision
F203
A
10.3969/j.issn.1671-7104.2017.06.012
1671-7104(2017)06-0436-04
2017-03-16
陆飞,E-mail: lufei@smda.gov.cn

