孕晚期宫内生长受限胎儿彩色多普勒血流显像相关参数变化及意义
曹春峰,尉传社,杨彦,林庆禄
(1江苏大学附属第四医院,江苏镇江212001;2江苏大学附属医院;3中国人民解放军第88医院)
孕晚期宫内生长受限胎儿彩色多普勒血流显像相关参数变化及意义
曹春峰1,尉传社2,杨彦1,林庆禄3
(1江苏大学附属第四医院,江苏镇江212001;2江苏大学附属医院;3中国人民解放军第88医院)
目的探讨孕晚期宫内生长受限(FGR)胎儿脐动脉、大脑中动脉、主动脉峡部血流参数变化。方法选取孕晚期胎儿FGR孕妇40例(观察组),同期胎儿宫内发育正常孕妇100例(对照组),分别于孕32~34、34~36、36~40周时进行彩色多普勒超声,测量脐动脉搏动指数(PI)、阻力指数(RI)及收缩期末流速(PSV)、舒张期末流速(EDV),计算PSV/EDV(S/D);大脑中动脉搏动指数(PI)、阻力指数(RI)及收缩期末流速(PSV);主动脉峡部PSV、收缩末反流流速(ESRV)及二者比值(PSV/ESRV)。结果观察组孕32~34、34~36、36~40周时胎儿脐动脉PI、RI、S/D均高于对照组;胎儿大脑中动脉PI、RI均低于对照组;胎儿主动脉峡部ESRV均高于对照组,PSV/ESRV均低于对照组;组间比较P均<0.05。两组各时间点胎儿大脑中动脉及主动脉峡部PSV比较差异均无统计学意义(P均>0.05)。结论孕晚期胎儿宫内生长受限胎儿脐动脉、大脑中动脉、主动脉峡部血流参数均出现改变,脐动脉和大脑中动脉PI、RI、S/D以及主动脉峡部ESRV、PSV/ESRV均可作为评价FGR的敏感指标。
宫内生长受限;彩色多普勒超声;脐动脉;大脑中动脉;主动脉弓峡部
胎儿宫内生长受限(FGR)亦被称为胎盘功能不良综合征或胎儿营养不良综合征,是指在各种因素影响下胎儿未能获得其所应有的生长潜力,其发生可能与母体因素、胎儿因素及胎盘因素有关[1]。目前普遍认为,胎儿宫内营养供应异常及胎盘功能异常是FGR的主要发病机制[2,3]。FGR不仅严重影响胎儿发育,而且可能导致围产儿患病率和病死率异常升高[4,5]。既往多采用超声检查双顶径、头围等指标诊断FGR,但是胎儿生长情况存在个体差异,单纯检测身体发育指标诊断FGR易出现假阳性结果。近年来,彩色多普勒血流显像(CDFI)检测血流参数逐渐应用于FGR的评估。本研究回顾性分析孕晚期FGR胎儿脐动脉、大脑中动脉、主动脉峡部血流参数变化,探讨其评价FGR的临床价值。
1 临床资料
1.1 基本资料 选取2015年1月~2016年12月我院收治的FGR孕妇40例(观察组),年龄22~45(29.4±5.2)岁,孕32~40周;选取同期胎儿宫内发育正常孕妇100例(对照组),年龄21~43(28.7±5.0)岁,孕32~40周;两组年龄、孕周具有可比性。观察组双顶径(7.0±0.9)cm、头围(25.9±2.8)cm、腹围(23.3±3.2)cm、股骨径(5.0±1.1)mm,对照组双顶径(8.8±1.2)cm、头围(30.6±3.7)cm、腹围(30.4±5.3)cm、股骨径(6.4±1.2)mm,观察组上述指标均小于对照组(P均<0.05)。FGR诊断符合第六版《妇产科学》诊断标准。两组均为单胎,在妊娠过程中无妊娠并发症,无吸烟和饮酒史,无胎盘异常或畸形胎儿。
观察组足月妊娠36例,胎儿出生时Apgar评分≤7分,出生体质量1 250~2 600 g,6例胎儿出生时发育正常、6例重度窒息、24例轻度窒息、4例于孕34周时胎死宫内。对照组均为足月妊娠,胎儿出生时Apgar评分均>7分,出生体质量2 500~4 200 g;其中91例胎儿出生时发育正常、9例出生时轻度窒息。观察组异常妊娠结局34例,对照组9例,两组比较P<0.05。异常妊娠结局判定标准:胎儿(孕≥37周)出生体质量<2 500 g或低于相同孕龄胎儿平均体质量的两个标准差;新生儿出生时Apgar评分≤7分[6];胎死宫内;出生时发生缺氧并发症,如脑瘫等;满足上述条件至少一条判定为异常妊娠结局。

结果显示,观察组孕32~34、34~36、36~40周时胎儿脐动脉PI、RI、S/D均高于对照组;胎儿大脑中动脉PI、RI均低于对照组;胎儿主动脉峡部ESRV均高于对照组,PSV/ESRV均低于对照组;组间比较P均<0.05。两组各时间点胎儿大脑中动脉及主动脉峡部PSV比较差异均无统计学意义(P均>0.05)。见表1~3。
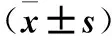
表1 两组胎儿脐动脉PI、RI、S/D比较
注:与对照组同时间点比较,*P<0.05。
2 讨论
FGR是围生期常见并发症之一,FGR胎儿病死率为正常胎儿的4~6倍[7]。研究证实,FGR在一定程度上影响胎儿生长发育,并对其儿童期和青春期智力、体能发育造成负面影响[8~10]。目前,对于此类胎儿临床尚缺乏早期诊断及预测其妊娠结局的特异性方法[11]。
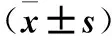
表2 两组胎儿大脑中动脉PI、RI、PSV比较
注:与对照组同时间点比较,*P<0.05。
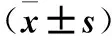
表3 两组胎儿主动脉峡部PSV、ESRV、PSV/ESRV比较
注:与对照组同时间点比较,*P<0.05。
脐动脉是联系母体血液系统及胎儿血液系统的纽带,其血流动力学改变可反映胎盘与母体的病理变化。随着胎盘逐渐发育成熟,脐动脉阻力(可反映胎儿-胎盘的循环状态)逐渐降低,血流量逐渐增加,以满足胎儿的物质代谢需要,确保胎儿正常生长发育[12]。大脑中动脉供应颅脑血液,其血流变化可反映胎儿脑血液循环状态,胎儿大脑中动脉血流动力学参数可用于评价胎儿宫内窘迫。
本研究在总结了国内外学者研究成果的基础上,对脐动脉和大脑中动脉血流参数做了优化选择,脐动脉以S/D、RI、PI作为观察指标,大脑中动脉以RI、PI、PSV为观察指标;主动脉峡部由于特殊的血流特点[14],选择PSV、ESRV及二者比值作为观察指标[13]。结果显示,观察组孕32~34、34~36、36~40周时胎儿脐动脉PI、RI、S/D均高于对照组。FGR胎儿母体胎盘血流阻力增加,脐血流阻力亦随之增大,导致脐动脉PI、RI、S/D升高,进入胎盘血氧进一步减少,宫内缺氧程度逐渐加重。如FGR胎儿持续缺氧,可使周围循环血流阻力加大以致血供减少,影响机体生长发育;同时,肾脏血流量及羊水相应减少,影响宫内环境和围产儿结局。观察组孕32~34、34~36、36~40周时大脑中动脉RI、PI均低于对照组。当机体出现缺血缺氧时,大脑中动脉发生代偿反应,血管扩张,血流阻力下降,以适应机体最大限度供应脑部血流量[15]。但是,当缺氧进一步加重时大脑中动脉阻力进一步增加,此时大脑中动脉处于失代偿状态,其血流变化并不能真实反映脑缺氧状态,需结合其他血流参数进行准确评估。本研究两组各时间点大脑中动脉PSV比较差异无统计学意义,可能与代偿机制启动使血流峰值变化不大有关。
近年来,随着彩色多普勒超声技术的不断发展,脐动脉及大脑中动脉血流参数应用于临床的研究日渐增多,但二者的敏感性和特异性未进一步提高[16]。随着主动脉峡部相关研究的开展,临床监测FGR又多了一可供参考指标,使得通过多血管分析FGR更具说服力。本研究观察组孕32~34、34~36、36~40周时胎儿主动脉峡部ESRV均高于对照组,PSV/ESRV均低于对照组,两组各时间点PSV比较差异无统计学意义。主动脉峡部位于动脉导管与主动脉弓交叉处,受主动脉和肺主动脉双重血流影响。当胎儿发生FGR时,随着周围血管缺血缺氧的激发,机体发动代偿机制促进血管扩张以增加血流灌注,同时产生乳酸、腺苷等代谢产物,扩张血管,导致心脏排血量降低。主动脉峡部对缺血缺氧较敏感,此处心肌对缺血缺氧可迅速作出代偿反应,产生“心保护效应”。此时如发生右心室后负荷加大或左心室负荷降低,主动脉峡部ESRV将异常增高[14],但心脏的代偿效应可使PSV变化不明显。研究发现,PSV/ESRV能更准确反映主动脉峡部血流情况;由于主动脉峡部位置特殊,PSV/ESRV能消除多普勒取样线与夹角产生的频谱误差[17]。观察组ESRV升高、PSV/ESRV降低说明胎儿各器官血氧供应发生重新分配,此类胎儿往往是新生儿窒息的高发人群。有研究指出,当胎儿发生FGR时,其血流指数的改变早于静脉导管[18]。因此,主动脉峡部血流指标ESRV及PSV/ESRV水平变化可能用于早期诊断FGR,并为产科决策是否终止妊娠提供参考依据; PSV/ESRV以指数形式存在,其临床应用价值更高。
综上所述,孕晚期宫内生长受限胎儿脐动脉、大脑中动脉、主动脉峡部血流参数均出现异常改变,脐动脉和大脑中动脉PI、RI、S/D以及主动脉峡部ESRV、PSV/ESRV值均可作为评价FGR的敏感指标。
[1] 罗晓芳,漆洪波.胎儿生长受限的胎盘因素及其临床诊治[J].中国实用妇科与产科杂志,2016,32(4):298-302.
[2] Damron DP. A practical approach to fetal growth restriction[J]. Obstet Gynecol, 2014,124(1):1057.
[3] 章茜,姜纬.低分子肝素联合低分子右旋糖酐治疗胎儿宫内生长受限的效果观察[J].山东医药,2014,54(45):73-74.
[4] 曾南萍.彩色多普勒检测妊高症患者胎儿大脑中动脉和脐动脉的价值研究[J].当代医学,2014,2(31):78-79.
[5] 鲁嘉,孟华,姜玉新,等.中孕筛查期胎儿循环血流动力学参数及与胎儿生长发育的相关性[J].协和医学杂志,2014,16(1):68-73.
[6] 陈莺春.脐动脉血血气分析、Apgar评分评价新生儿窒息的临床意义[J].中国医疗前沿,2010,5(10):42-62
[7] Afrakhteh M, Moeini A, Taheri MS, et al. Uterine Doppler velocimetry of the uterine arteries in the second and third trimesters for the prediction of gestational outcome[J]. Rev Bras Ginecol Obstet, 2014,36(1):35-39.
[8] 王春霞,齐峰,休霞,等.宫内生长受限胎儿动静脉多普勒改变及与围生结局相关性研究[J].中国优生与遗传杂志,2015,23(2):50-53.
[9] Crimmins S, Desai A, Block-Abraham D, et al.A comparison of Doppler and biophysical findings between liveborn and stillborn growth-restricted fetuses[J]. Am J Obstet Gynecol, 2014,211(6):669.
[10] 程艳红,钱敏.多普勒超声评估胎儿生长受限的研究进展[J].中华临床医师杂志(电子版),2013,7(13):6007-6009.
[11] 钟素霞.超声多普勒检测UA及MCA血流参数预测胎儿FGR[J].吉林医学,2014,35(14):3002-3003.
[12] Kafkasl A, Türküoglu I, Turhan U. Maternal,fetal and perinatal characteristics of preeclampsia cases with and without abnormalities in uterine artery Doppler indexes[J]. J Matern Fetal Neonatal Med, 2013,26(9):936-940.
[13] Mari G, Hanif F, Kruger M, et al. Middle cerebral artery peak systolic velocity: a new Doppler parameter in the assessment of growth-restricted fetuses[J]. Ultrasound Obstet Gynecol, 2007,29(3):310-316.
[14] Acharya G. Technical aspects of aortic isthmus Doppler velocimetry in human fetuses[J]. Ultrasound Obstet Gynecol, 2009,33(6):628-633.
[15] 李天刚,杨磊,王艺璇,等.胎儿脐动脉及大脑中动脉血流参数及其比值在诊断胎儿宫内缺氧中的价值[J].临床超声医学杂志,2013,15(5):311-314.
[16] Apocalypse IG, Osanan GC. Combined use of the cardiofemoral index and middle cerebral artery Doppler velocimetry for the prediction of fetal anemia[J]. Int J Gynecol Obstet, 2010,111(3):205-208.
[17] 袁美贞,任芸芸.胎儿主动脉峡部血流多普勒指标的临床价值[J].上海医学影像,2012,21(3):168-172.
[18] Rizzo G, Capponi A, Vendola M, et al. Relationship between aortic isthmus and ductus venosus velocity waveforms in severe growth restricted fetuses[J]. Prenatal Diagnosis, 2008,28(11):1042-1047.
林庆禄(E-mail: lin_1011peony@163.com)
10.3969/j.issn.1002-266X.2017.40.030
R714.5
B
1002-266X(2017)40-0089-03
2017-03-10)

