高原鼠兔组织中精子特异性乳酸脱氢酶的作用机理
王志洁, 汪洋, 安志芳, 魏琳娜, 魏莲, 魏登邦
(青海大学生态环境工程学院,西宁810016)
高原鼠兔组织中精子特异性乳酸脱氢酶的作用机理
王志洁, 汪洋, 安志芳, 魏琳娜, 魏莲, 魏登邦*
(青海大学生态环境工程学院,西宁810016)
高原鼠兔Ochotonacurzoniae具有很强的高原低氧适应能力。前期研究发现,精子特异性乳酸脱氢酶(LDH-C4)在高原鼠兔体细胞中表达。为阐明LDH-C4在高原鼠兔组织中的作用机理,应用RNA干扰技术沉默高原鼠兔心肌、肝脏和脑组织中的Ldh-c基因;应用荧光定量PCR和Western Blot方法,测定Ldh-c基因在心肌、肝脏和脑组织中的表达水平;应用生物化学方法测定沉默Ldh-c基因后,心肌、肝脏和脑组织中LDH比活力、乳酸和ATP的含量。结果表明,腹腔注射腺病毒pMultiRNAi-Ldhc能极显著降低高原鼠兔组织中Ldh-c基因的表达水平,在mRNA和蛋白水平,心肌中Ldh-c基因的表达分别下降48.11%和19.27%;肝脏中Ldh-c基因的表达分别下降70.16%和25.82%;脑中Ldh-c基因的表达分别下降49.08%和25.36%。沉默Ldh-c基因表达后,高原鼠兔心肌、肝脏和脑组织中LDH比活力、乳酸和ATP的含量也显著降低,分别下降25.58%、41.94%和21.23%,28.16%、15.90%和24.66%以及16.65%、12.78%和18.50%。这些结果说明,高原鼠兔在低氧环境中,其心肌、肝脏和脑组织通过LDH-C4催化无氧糖酵解获得部分ATP,增强对低氧环境的适应能力。
高原鼠兔; 组织;Ldh-c基因; 乳酸脱氢酶活力; 乳酸; ATP
高原鼠兔Ochotonacurzoniae隶属兔形目Lagomorpha鼠兔科Ochotonidae鼠兔属Ochotona(蒋志刚等,2015),是青藏高原特有的小型哺乳类世居动物,主要栖息在海拔3 000~5 000 m的高寒草甸及高寒荒漠草原地带(施银柱,樊乃昌,1980;丁晓涛等,1999),其生境的含氧量为139~203 g·m-3;高原鼠兔能有效地从低氧环境中摄取氧、转运氧和利用氧(饶鑫峰,2010),对高原低氧环境具有很强的适应性(Kilicetal.,2004;齐新章等,2008;王晓君等,2008;Zhuetal.,2009;Gonzales,2013)。
先前研究表明,精子特异性乳酸脱氢酶(Ldh-c)基因只在鸟类和哺乳类的精子中特异性表达(Goldberg,1975),而在体细胞中不表达(Wheat & Goldberg,1977;Goldberg,1985)。而我们的研究发现,精子特异性乳酸脱氢酶(sperm-specific lactate dehydrogenase,LDH-C4)不仅在高原鼠兔睾丸和精子中表达,在心肌、肝脏和脑等组织中也有表达(Wangetal.,2013)。LDH-C4是乳酸脱氢酶的一种同工酶(Gupta,2012),主要催化丙酮酸和乳酸(lactic acid,LD)相互转化(Smithies,1959;Everse & Kaplan,1973)。酶促动力学研究结果表明,LDH-C4对丙酮酸的亲和力高于对LD的亲和力,其酶促反应不易受高浓度LD的抑制(Herengetal.,2011),有利于催化丙酮酸转化为LD,说明LDH-C4有利于无氧糖酵解。应用LDH-C4特异性抑制剂(N-isopropyl oxamate)能显著降低高原鼠兔骨骼肌中LDH比活力、减少LD和ATP的生成,并显著降低高原鼠兔的运动能力。为了进一步深入探讨Ldh-c基因在高原鼠兔心肌、肝脏和脑组织中的作用及机理,本文通过构建特异性沉默Ldh-c基因载体,用腺病毒包装,通过腹腔注射7 d后,检测3种组织中Ldh-c基因在mRNA和蛋白水平的表达,测定组织中LDH比活力、LD和ATP的含量,进一步探讨高原鼠兔适应低氧的生理机制。
1 材料与方法
1.1实验动物
高原鼠兔捕捉于青海省海南州贵德县拉脊山(101°28′E,36°72′N,海拔3 900 m)。采样点氧分压为62 kPa,含氧量为182 g·m-3。样本量27只,体质量150~200 g,随机分为3组,每组9只。第1组为干扰组(RNAi-LDHC),向高原鼠兔腹腔注射腺病毒pMultiRNAi-Ldhc,注射剂量为0.650 mL;第2组为空壳组(RNAi-HK),向腹腔注射等剂量腺病毒pMultiRNAi-NS;第3组为空白对照组(Control),不注射。高原鼠兔分组注射后饲养7 d,实验前静息30 min,5%戊巴比妥钠麻醉后,用EDTA2K2抗凝管从颈部采血2~3 mL,离心10 min(4 000 r·min-1),分离血浆,4 ℃保存;采集心肌、肝脏和脑组织样品立即保存于液氮。采样过程所涉及处理动物的措施均按照国家《实验动物管理条例(GB14923-2010)》执行。
1.2RNA干扰在高原鼠兔体内抑制Ldh-c基因表达的研究
1.2.1Ldh-c基因shRNA表达质粒干扰片段的设计
根据GenBank报道的高原鼠兔Ldh-c基因的cDNA序列(HQ704678),选择2个靶位点(321-339,855-875),用Blast进行序列同源性分析,并用RNAstructure 4.2对其二级结构预测。siRNA干扰序列为LDHC321:TTAGTACTTCAAAGATTAC,LDHC855:GCTATTGGACTGTCTGTGA。
1.2.2Ldh-c基因特异性shRNA表达载体构建及腺病毒包装根据高原鼠兔和人Ldh-c基因的编码区序列,设计并合成shRNA靶序列,用合成的单链shRNA寡核苷酸退火后得到双链产物,用低熔点的琼脂糖凝胶电泳回收,并验证所回收的DNA片段,构建Ldh-c基因特异性shRNA表达载体,转入感受态细胞,挑取阳性克隆在培养基中培养过夜,提取质粒,测序鉴定插入序列。根据 DNA 测序结果,将与所设计shRNA序列100%相同的重组质粒及空质粒分别进行腺病毒包装。
序列的合成及测序、质粒的链接与病毒包装由武汉晶赛生物有限公司完成。
1.3荧光定量PCR测定心肌、肝脏和脑组织Ldh-cmRNA表达水平
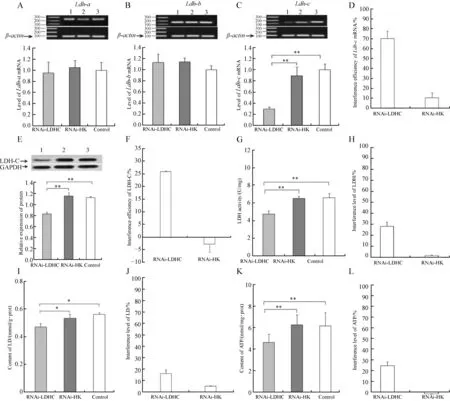
TRIzol(Invitrogen Life Technologies)法提取心肌、肝脏和脑组织总RNA,核酸蛋白含量检测仪测定A260/A280值(1.8 表1 引物序列Table 1 Primer sequence 1.4WesternBlot法测定心肌、肝脏和脑组织中LDH-C蛋白表达水平 用总蛋白提取试剂盒提取心肌、肝脏和脑组织总蛋白,采用Piercetm BCA Protein Assay Kit (Thermo Fisher Scientific,USA)测定浓度。取40 μg蛋白进行SDS-聚丙烯酰胺凝胶电泳后,转到0.22 PVDF膜上。用5%脱脂奶粉稀释液常温封闭2 h;与一抗(抗LDH-C:abcam公司兔单克隆抗体,1∶10 000稀释;抗GAPDH:abcam公司单克隆抗体,1∶4 000稀释)4 ℃孵育过夜;TBST洗涤后,用羊抗兔IgG (山羊抗兔,abcam公司,1∶2 000稀释)常温孵育2 h后再用TBST洗涤。采用ECL荧光试剂盒(Thermo Fisher Scientific,USA)曝光、凝胶成像系统(Bio-Rad,USA)拍照。以LDH-C蛋白条带的灰度值与内参GAPDH的灰度值的比值表示该样品的相对蛋白表达水平。 1.5组织中LDH比活力、LD含量和ATP含量的测定 LD含量及LDH比活力测定:心肌、肝脏和脑组织用0.9%生理盐水冰浴匀浆,质量/体积为1∶9,4 ℃ 5 000 r·min-1离心10 min,取上清液。采用比色法检测组织LD含量及LDH比活力,按照试剂盒(南京建成生物技术有限公司,中国)说明操作(许利娜等,2015)。 ATP含量测定:采用萤光素-萤光素酶法检测组织中ATP含量,按照ATP试剂盒(江苏碧云天生物技术有限公司,中国)说明操作。组织用试剂盒中裂解液冰浴匀浆(质量/体积为1∶5)后,4 ℃ 12 000 r·min-1离心10 min,取上清。以ATP浓度与裂解液蛋白浓度的比值来表示组织中ATP的相对含量(单位:nmol·mg-1),参考许利娜等(2015)。 1.6血清中LDH比活力、LD含量测定 取高原鼠兔血清,生理盐水稀释后,采用LD含量和LDH比活力测试盒(南京建成生物工程有限公司)测定。 1.7干扰效率计算 腺病毒pMultiRNAi-Ldhc对各指标的干扰效率按照以下公式计算:干扰组干扰效率=(空白对照组平均值-干扰组平均值)/空白对照组平均值,空壳组干扰效率=(空白对照组平均值-空壳组平均值)/空白对照组平均值。 1.8数据统计分析 使用Excel 2007和SPSS整理数据并分析,采用Kolmogoroe-Simirnov和Levene检验数据的正态性和方差同质性。符合正态分布并具有同质性的数据采用单因素方差分析(One-Way ANOVA)。数据用Mean±SD表示,P<0.05为差异有统计学意义。 2.1高原鼠兔心肌组织中Ldh-c基因的表达 荧光定量PCR结果表明,高原鼠兔心肌组织中Ldh-a、Ldh-b和Ldh-c基因在mRNA水平均有表达,注射腺病毒7 d后,Ldh-a和Ldh-b基因表达在干扰组、空壳组和空白对照组之间差异无统计学意义(P>0.05),但能特异性地沉默高原鼠兔Ldh-c基因表达;与空白对照组相比,干扰组中Ldh-c基因表达水平极显著降低(P<0.01),干扰效率为48.11%。干扰组、空壳组和空白对照组中LDH-A和LDH-B亚基均表达,且差异无统计学意义(P>0.05);与空白对照组相比,干扰组LDH-C亚基表达极显著减少(P<0.01),干扰效率为19.27%。同时LDH比活力、LD和ATP的含量也显著降低,与空白对照组相比,干扰组LDH比活力极显著减少(P<0.01),干扰效率为25.58%;干扰组LD含量极显著减少(P<0.01),干扰效率为41.94%;干扰组ATP含量极显著减少(P<0.01),干扰效率为21.23%(图1)。 2.2高原鼠兔肝脏组织中Ldh-c基因的表达 荧光定量PCR结果表明,高原鼠兔肝脏组织中Ldh-a、Ldh-b和Ldh-c基因在mRNA水平均有表达,注射腺病毒7 d后,Ldh-a和Ldh-b基因表达在干扰组、空壳组和空白对照组之间差异无统计学意义(P>0.05),但能特异性地沉默高原鼠兔Ldh-c基因表达;与空白对照组相比,干扰组中Ldh-c基因表达水平的差异有高度统计学意义(P<0.01),干扰效率为70.16%。干扰组、空壳组和空白对照组中LDH-A和LDH-B亚基均有表达,且差异无统计学意义(P>0.05);与空白对照组相比,干扰组LDH-C亚基极显著减少(P<0.01),干扰效率为25.82%。 同时LDH比活力、LD和ATP的含量也显著降低,与空白对照组相比,干扰组LDH比活力极显著减少(P<0.01),干扰效率为28.16%;干扰组LD含量显著减少(P<0.05),干扰效率为15.90%;干扰组ATP含量极显著减少(P<0.01),干扰效率为24.66%(图2)。 图1 Ldh-c基因在高原鼠兔心肌组织的表达(n=9)Fig.1 The expression of Ldh-c gene in the heart of Ochotona curzoniae (n=9) A.Ldh-a基因mRNA的表达水平, B.Ldh-b基因mRNA的表达水平, C.Ldh-c基因mRNA的表达水平, D. 腺病毒pMultiRNAi-Ldhc对Ldh-c基因的干扰效率, E. LDH-C蛋白的表达水平, F. 腺病毒pMultiRNAi-Ldhc对LDH-C蛋白的干扰效率, G. 腺病毒pMultiRNAi-Ldhc对乳酸脱氢酶(LDH)比活力的影响, H. 腺病毒pMultiRNAi-Ldhc对LDH的干扰效率, I. 腺病毒pMultiRNAi-Ldhc对乳酸(LD)含量的影响, J. 腺病毒pMultiRNAi-Ldhc对LD的干扰效率, K. 腺病毒pMultiRNAi-Ldhc对ATP含量的影响, L. 腺病毒pMultiRNAi-Ldhc对ATP的干扰效率; 其中A、B、C和E图上侧电泳图和免疫印迹图分别表示Ldh-a、Ldh-b和Ldh-c基因mRNA以及LDH-C蛋白的表达模式; 1、2和3分别表示干扰组、空壳组和空白组;*P<0.05,**P<0.01; 图2、图3同。 A. expression level ofLdh-amRNA, B. expression level ofLdh-bmRNA, C. expression level ofLdh-cmRNA, D. interference efficiency of pMultiRNAi-Ldhc onLdh-cgene, E. expression level of LDH-C protein, F. interference efficiency of pMultiRNAi-Ldhc on LDH-C protein, G. effect of pMultiRNAi-Ldhc on the activity of lactate dehydrogenase (LDH), H. interference level of LDH, I. effect of pMultiRNAi-Ldhc on the content of lactic acid (LD),J. interference level of LD, K. effect of pMultiRNAi-Ldhc on the content of ATP, L. interference level of ATP; in figs. A, B, C and E, the electrophoresis and Western Blot results represent the expression pattern ofLdh-a,Ldh-b,Ldh-cmRNA and LDH-C protein, respectively; 1, 2 and 3 represent RNAi-LDHC, RNAi-HK and control, respectively;*P<0.05,**P<0.01; the same as fig. 2 and fig. 3. 图2 Ldh-c基因在高原鼠兔肝脏组织的表达(n=9)Fig.2 The expression of Ldh-c gene in the liver of Ochotona curzoniae (n=9) 2.3高原鼠兔脑组织中Ldh-c基因的表达 荧光定量PCR结果表明,高原鼠兔脑组织中Ldh-a、Ldh-b和Ldh-c基因在 mRNA 水平均有表达。注射腺病毒7 d后,Ldh-a和Ldh-b基因表达在干扰组、空壳组和空白对照组之间差异无统计学意义(P>0.05),但能特异性地沉默高原鼠兔Ldh-c基因表达;与空白对照组相比,干扰组中Ldh-c基因表达水平极显著降低(P<0.01),干扰效率为49.08%。干扰组、空壳组和空白对照组中LDH-A和LDH-B亚基均有表达,且差异无统计学意义(P>0.05);与空白对照组相比,干扰组LDH-C亚基极显著减少(P<0.01),干扰效率为25.36%。同时LDH比活力、LD和ATP的含量也显著降低,与空白对照组相比,干扰组LDH比活力显著减少(P<0.05),干扰效率为16.65%;干扰组LD含量显著减少(P<0.05),干扰效率为12.78;干扰组ATP含量极显著减少(P<0.01),干扰效率为18.50%(图3)。 2.4血清中LDH比活力和LD含量及干扰率 结果表明,血清中LDH比活力和LD含量,空壳组和空白对照组之间差异无统计学意义(P>0.05);与空白对照组相比,干扰组的LDH比活力和LD含量显著减少(P<0.05),干扰效率分别为18.43%和18.90%(图4)。 RNA干扰是近年来发现的普遍存在于生物体内的一种古老的现象,在转录水平、转录后水平和翻译水平上阻断基因的表达(姜怀春,李宏,2004)。在研究基因功能上RNA干扰有以下优点,一是简单易行;二是周期短,成本低;三是沉默效率高,具有高度特异性(何正波等,2009)。本文通过构建特异性腺病毒结果表明,用RNA干扰技术干扰Ldh-c基因效果好。 腹腔注射法操作比较简单,注射时针头不宜刺入腹腔太深,太深则会刺入内脏,太浅不易穿过腹腔壁,最佳深度为3~5 cm,就可以很好进药(俞玉忠,穆斌,2011;祝春青等,2012;姜国良等,2013),其可行性强,能精准控制给药量(祝春青等,2012),且腹腔面积广并分布大量血管和淋巴管,具有很强的吸收能力(姜国良等,2013)。因此,腹腔注射的腺病毒能充分进入组织并有效地干扰Ldh-c基因。本研究构建了Ldh-c基因特异性载体包装的腺病毒,向高原鼠兔注射后饲养7 d,结果表明,腺病毒能够干扰Ldh-c基因的表达。本文结果显示,运用RNA干扰技术腹腔注射腺病毒pMultiRNAi-Ldhc后,在mRNA水平和蛋白水平均能降低组织中Ldh-c基因的表达,同时降低LDH比活力、LD和ATP含量以及血清中LDH比活力和LD含量,说明腹腔注射的腺病毒在心肌、肝脏和脑组织中发挥了作用,沉默了Ldh-c基因的表达,腺病毒pMultiRNAi-Ldhc对高原鼠兔心肌、肝脏和脑组织中LDH比活力、LD和ATP含量的干扰效率分别为25.58%、41.94%和21.23%;28.16%、15.90%和24.66%以及16.65%、12.78%和18.50%。Wong等(1997)表明N-isopropyl oxamate对LDH-C4具有较强的抑制作用,而对LDH-A4和LDH-B4的抑制作用较小,先前研究向高原鼠兔股二头肌注射N-isopropyl oxamate,研究心肌、肝脏和脑组织中LDH-C4的作用机理,结果表明,当高原鼠兔血液中 N-isopropyl oxamate浓度为0.08 mmol·L-1时,其心肌、肝脏和脑组织中LDH比活力、LD和ATP含量显著下降,N-isopropyl oxamate对高原鼠兔心肌、肝脏和脑组织中LDH比活力、LD和ATP含量的抑制率分别为31.98%、20.90%和28.70%;30.19%、32.22%和24.94%;30.78%、46.47%和21.04%(李筱等,2015;许利娜等,2015;魏琳娜等,2015);前期研究表明用N-isopropyl oxamate注射骨骼肌后,高原鼠兔骨骼肌的LDH比活力、LD和ATP含量相应减少,其运动能力也显著降低(Wangetal.,2015),均与本文结果相近。这是由于LDH-C4沉默了C基因的表达从而减少了LDH-C4的合成,降低了无氧糖酵解水平。这些结果表明,LDH-C4通过催化无氧糖酵解过程,为高原鼠兔组织提供生命活动的部分ATP。 图3 Ldh-c基因在高原鼠兔脑组织的表达(n=9)Fig.3 The expression of Ldh-c gene in the brain of Ochotona curzoniae (n=9) 图4 腺病毒pMultiRNAi-Ldhc对高原鼠兔血清中乳酸脱氢酶比活力和乳酸含量的影响(n=9)Fig.4 Effects of pMultiRNAi-Ldhc on the activity of lactate dehydrogenase (LDH) and the content of lactic acid (LD) in the serum of Ochotona curzoniae (n=9) A. 腺病毒pMultiRNAi-Ldhc对高原鼠兔血清中LDH比活力的影响, B. 腺病毒pMultiRNAi-Ldhc对高原鼠兔血清中LD含量的影响, C.腺病毒pMultiRNAi-Ldhc对高原鼠兔血清中LDH和LD的干扰效率;*P<0.05。 A. effect of pMultiRNAi-Ldhc on the activity of LDH in plateau pika serum, B. effect of pMultiRNAi-Ldhc on the content of lactic acid in plateau pika serum, C. interference level of LDH and lactic acid in plateau pika serum;*P<0.05. 总之,Ldh-c基因在高原鼠兔组织中的表达是对高原低氧环境的适应机制。LDH-C4通过催化糖酵解过程降低高原鼠兔心肌、肝脏和脑组织中对有氧代谢氧的依赖性,为其生命活动提供部分ATP,以保证缺氧条件下高原鼠兔机体的供能,使其减小了在低氧环境中对氧的依赖,增强了高原鼠兔对低氧环境的适应。 丁晓涛, 何秀琼, 曹玉琼, 等. 1999. 高原鼠兔寄生虫感染调查报告[J]. 四川动物, 18(1): 34. 何正波, 陈斌, 冯国忠. 2009. 昆虫RNAi技术及其应用[J]. 应用昆虫学报, 46(4): 525-532. 姜国良, 于晓, 徐恺, 等. 2013. 腹腔和皮下注射D-半乳糖衰老大鼠模型分析[J]. 中国老年学, 33(5): 1101-1103. 姜怀春, 李宏. 2004. RNAi的研究进展[J]. 重庆工商大学学报(自然科学版), 21(6): 570-574. 蒋志刚, 马勇, 吴毅, 等. 2015. 中国哺乳动物多样性及地理分布[M]. 北京: 科学出版社. 李筱, 魏莲, 汪洋, 等. 2015. 高原鼠兔心脏中Ldh-c基因的表达及其对无氧糖酵解水平的影响[J]. 生理学报, 67(3): 312-318. 齐新章, 王晓君, 朱世海, 等. 2008. 高原鼢鼠和高原鼠兔心脏对低氧环境的适应[J]. 生理学报, 60(3): 348-354. 饶鑫峰. 2010. 高原鼠兔组织乳酸脱氢酶同工酶的特异性[D]. 西宁: 青海大学. 施银柱, 樊乃昌. 1980. 草原害鼠及其防治[M]. 西宁: 青海人民出版社: 67-105. 王晓君, 魏登邦, 魏莲, 等. 2008. 高原鼢鼠和高原鼠兔红细胞低氧适应特征[J]. 四川动物, 27(6): 1100-1103. 魏琳娜, 魏莲, 汪洋, 等. 2015. 高原鼠兔肝中Ldh-c基因的表达及其对无氧糖酵解水平的影响[J]. 动物学杂志, 50(6): 846-854. 许利娜, 魏莲, 汪洋, 等. 2015. 高原鼠兔脑组织中精子特异性乳酸脱氢酶的作用[J]. 兽类学报, 35(4): 431-437. 俞玉忠, 穆斌. 2011. 浅谈小鼠腹腔注射的方法与技巧[J]. 中国实用医药, 6(22): 249. 祝春青, 陈冬波, 王苗, 等. 2012. 腹腔注射百草枯构建小鼠肺纤维化模型[J]. 生物技术通讯, 23(4): 563-566. Everse J, Kaplan NO. 1973. Lactate dehydrogenases: structure and function[J]. Advances in Enzymology & Related Areas of Molecular Biology, 37(1): 61-133. Goldberg E. 1975. Lactate dehydrogenase-X from mouse testes and spermatozoa[J]. Methods in Enzymology, 41(1): 318-323. Goldberg E. 1985. Reproductive implications of LDH-C4and other testis-specific isozymes[J]. Experimental Clinical Immunogenetics, 2(2): 120-124. Gonzales GF. 2013. Serum testosterone levels and excessive erythrocytosis during the process of adaptation to high altitudes[J]. Asian Journal of Andrology, 15(3): 368-374. Gupta GS. 2012. LDH-C4: a target with therapeutic potential for cancer and contraception[J]. Molecular and Cellular Biochemistry, 371(1-2): 115-127. Hereng TH, Elgstøen KBP, Cederkvist FH,etal. 2011. Exogenous pyruvate accelerates glycolysis and promotes capacitation in human spermatozoa[J]. Human Reproduction, 26(12): 3249-3263. Kilic BA, Dingil O, Erkula G,etal. 2004. Evaluation of the muscles around the knee in rabbits whose anterior cruciate and/or medial collateral ligaments were dissected[J]. Archives of Orthopaedic and Trauma Surgery, 124(9): 626-630. Smithies O. 1959. Zone electrophoresis in starch gels and its application to studies of serum proteins[J]. Advances in Protein Chemistry, 14(10): 65-114. Wang DW, Wei L, Wei DB,etal. 2013. Testis-specific lactate dehydrogenase is expressed in so-matic tissues of plateau pikas[J]. FEBS Open Bio, 3: 118-123. Wang Y, Wei L, Wei D,etal. 2015. Testis-specific lactate dehydrogenase (LDH-C4) in skeletal muscle enhances a pika’s sprint-running capacity in hypoxic environment[J]. International Journal of Environmental Research & Public Health, 12(8): 9218-9236. Wheat TE, Goldberg E. 1977. An allelic variant of the sperm-specific lactate dehydrogenase C4(LDH-X) isozyme in humans[J]. Journal of Experimental Zoology, 202(3): 425-430. Wong C, Rodríguezpáez L, Nogueda B,etal. 1997. Selective inhibition of the sperm-specific lactate dehydrogenase isozyme-C4 by N-isopropyl oxamate[J]. BiochimicaetBiophysica Acta-Biomembranes, 1343(1): 16-22. Zhu SH, Qi XZ, Wang XJ,etal. 2009. Difference in oxygen uptake in skeletal muscles between plateau zokor (Myospalaxrufescensbaileyi) and plateau pika (Ochotonacurzoniac)[J]. Acta Physiologica Sinica, 61(4): 373-378. TheRoleoftheSperm-specificLactateDehydrogenaseinOchotonacurzoniaeTissues WANG Zhijie, WANG Yang, AN Zhifang, WEI Linna, WEI Lian, WEI Dengbang* (College of Eco-environmental Engineering, Qinghai University, Xining 810016, China) The plateau pika (Ochotonacurzoniae) has a strong adaptability to a hypoxic plateau environment. Previous studies found that the sperm-specific lactate dehydrogenase (LDH-C4) gene is expressed in plateau pika somatic cell. In order to shed light on the role of LDH-C4in plateau pika tissues, we silenced theLdh-cgene in pika heart, liver and brain by RNA interference, and then the expression levels ofLdh-cgene in these tissues were determined by real-time PCR and Western Blot. Additionally, the activities of LDH, the contents of lactic acid and ATP were also measured by biochemical method. The results indicated that intraperitoneal injection of adenovirus pMultiRNAi-Ldhc could significantly reduce the expression ofLdh-cgene in tissues of plateau pika. Specifically, in the mRNA and protein levels, the expression levels ofLdh-cgene in heart were decreased by 48.11% and 19.27%; in liver were decreased by 70.16% and 25.82%; in brain were decreased by 49.08% and 25.36%, respectively. Meanwhile, whenLdh-cgene expression was silenced, the activities of LDH, the contents of lactic acid and ATP in each tested tissues were generally decreased by 25.58%, 41.94% and 21.23%; 28.16%, 15.90% and 24.66%; 16.65%, 12.78% and 18.50%, respectively. These results suggested that under the condition of severe hypoxia, the heart, liver and brain tissues of plateau pika can generate part of ATP uponLDH-C4catalyzed anaerobic glycolysis and therefore enhance the adaptation to the hypoxic environments. Ochotonacurzoniae; tissues;Ldh-cgene; LDH enzymatic activity; lactic acid; ATP 10.11984/j.issn.1000-7083.20170146 2017-05-08接受日期2017-08-11 国家自然科学基金项目(31260512, 30960054, 31040011); 青海省自然科学基金项目(2016-ZJ-901, 2014-ZJ-714, 2012-Z-905) 王志洁(1992—), 女, 硕士研究生, 主要从事高原动物资源保护与利用研究, E-mail:411126871@qq.com *通信作者Corresponding author, E-mail:weidengbang@163.com Q955 A 1000-7083(2017)06-0624-08
2 结果

3 讨论