KLF7联合脂肪源性干细胞对脊髓损伤大鼠运动功能的影响及其机制
李文媛,王莹,郭素芬,刘星,李智刚,刘贵波,许志鹏,张际菲
(1牡丹江医学院,黑龙江牡丹江157011;2牡丹江医学院红旗医院)
KLF7联合脂肪源性干细胞对脊髓损伤大鼠运动功能的影响及其机制
李文媛1,王莹1,郭素芬1,刘星1,李智刚2,刘贵波1,许志鹏1,张际菲1
(1牡丹江医学院,黑龙江牡丹江157011;2牡丹江医学院红旗医院)
目的观察KLF样转录因子7(KLF7)联合脂肪源性干细胞(ADSC)对脊髓损伤大鼠运动功能的影响,并探讨其可能的机制。方法将30只SD大鼠随机分为KLF7联合ADSC组、ADSC组及对照组,每组10只,均采用离断右半脊髓的方法制备脊髓损伤模型。KLF7联合ADSC组于脊髓损伤组织注入100 μL ADSC(ADSC均采用PKH26进行标记)及2 μL AAV2-KLF7腺病毒,ADSC组仅注入100 μL ADSC,对照组仅注入100 μL PBS。术后1天及1、2、3、4周行运动功能评分(BBB评分);术后4周,应用诱发电位仪和磁刺激器经颅磁刺激运动诱发神经电生理反应,记录神经传导速度、潜伏期及波幅。术后4周处死,采用Western boltting法检测脊髓损伤组织KLF7、神经生长因子(NGF)及其受体酪氨酸激酶A(TrkA)蛋白相对表达量,计算脊髓损伤面积百分比及ADSC数量(以PKH26的光密度值表示)。结果与术后1天比较,各组术后1、2、3、4周BBB评分均升高(P均<0.05)。术后4周,KLF7联合ADSC组与ADSC组BBB评分、神经传导速度、波幅、ADSC数量及脊髓损伤组织NGF、TrkA蛋白相对表达量均高于对照组,潜伏期及脊髓损伤面积百分比均低于对照组,且KLF7联合ADSC组上述变化更明显(P均<0.05)。KLF7联合ADSC组脊髓损伤组织KLF7蛋白相对表达量均高于ADSC组及对照组(P均<0.05)。结论KLF7联合ADSC可减轻脊髓损伤大鼠的神经损伤,改善其运动功能;其机制可能与KLF7促进ADSC存活及提高脊髓损伤组织NGF、TrkA表达有关。
脊髓损伤;KLF样转录因子7;脂肪源性干细胞;神经生长因子;酪氨酸激酶A;大鼠
脊髓损伤可导致机体感觉、运动、肌力异常等一系列病理变化,除导致机体感觉和随意运动障碍外,还影响自主神经系统,导致多个器官功能障碍或衰竭[1,2]。KLF样转录因子7(KLF7)属于锌指家庭成员,在斑马鱼神经系统中高表达[3],并可促进大鼠脊髓皮质束轴突再生[4]。KLF7为轴突生长促进剂, 可促进小鼠坐骨神经运动轴突再生和髓鞘形成,其基因转录激活可促进成人皮质脊髓束轴突再生[5]。敲除KLF7基因可引起中枢神经、视网膜和嗅觉神经轴突再生障碍[6]。研究证实,神经生长因子(NGF)及其受体酪氨酸激酶A(TrkA)是KLF7的下游靶基因[4,7],二者也是重要的神经营养因子,在神经损伤修复过程中发挥重要作用。前期研究证实,脂肪源性干细胞(ADSC)能够促进脊髓损伤修复,但单独应用对神经功能的恢复效果并不理想[8,9]。2015年3月~2016年11月,本研究观察了KLF7联合ADSC对脊髓损伤大鼠运动功能的影响,现分析结果并探讨其机制,旨在为脊髓损伤的治疗提供依据。
1 材料与方法
1.1 材料 实验动物:雄性健康C57BL/6小鼠5只,6~8周龄,体质量(19±2)g,购自哈尔滨医科大学实验动物中心。SD大鼠30只,雌雄各半,6~8周龄,体质量(200±20)g,购自哈尔滨医科大学实验动物中心。主要试剂:DMEM/F12 培养液购自美国Hyclone公司,FBS、胰蛋白酶、茜素红、多聚赖氨均购自美国Gibco公司,PKH26、兔抗NGF抗体和兔抗TrkA抗体均购自美国Sigma公司,AAV2-KLF7腺病毒购自美国Vector BioLabs公司。主要仪器:CO2培养箱购自日本三洋公司,诱发电位仪和磁刺激器购自英国Magstim公司,脊髓冲击损伤模型仪(ModelⅡ NYU Impactor)购自美国MASCIS公司。
1.2 ADSC分离培养及标记 参照前期研究方法[9],取5只C57BL/6小鼠的腹部脂肪组织行ADSC分离、原代培养。原代培养8天,ADSC形成的细胞群落较为密集,光镜下呈多角形或梭形伸展,有铺路石状特征。传代培养2周,加入成骨诱导液(基础培养液+0.1 μmol/L地塞米松+50 μmol/L维生素C+10 mmol/L β-甘油磷酸钠)进行成骨诱导。成骨诱导28天茜素红染色结果显示,ADSC细胞质内出现钙盐沉积,茜素红染色后呈红色聚集物,证实该细胞为ADSC(具有成骨诱导分化潜能)。取传4代的ADSC,制备单细胞悬液,调整细胞密度为1×106个/100 μL,参照Wang等[10]的方法行PKH26染色标记。
1.3 模型制备及分组处理 将30只大鼠随机分为KLF7联合ADSC组、ADSC组及对照组,每组10只。三组均参照Gomes-Osman等[2]的方法制备脊髓损伤模型,方法如下:10%水合氯醛溶液腹腔注射麻醉,术区备皮,常规消毒,铺无菌单;以肋骨为定位中心,于大鼠背部棘突体表作一长约3 cm的切口,切开皮肤、皮下组织,剥离椎旁肌肉,显露棘突、椎板及关节突。用咬骨钳咬除T10及部分T9、T11椎板,显露脊髓;显微镜下可见正中静脉,用显微外科剪垂直剪断右侧脊髓,镜下可见脊髓右半部分完全离断,大鼠双下肢出现抽动和瘫痪,证实造模成功。KLF7联合ADSC组于脊髓损伤组织注入100 μL ADSC及2 μL AAV2-KLF7腺病毒(含1×1011pfu/mL),ADSC组仅注入100 μL ADSC,对照组仅注入100 μL PBS。关闭切口,术后切口涂抹红霉素软膏预防感染。
1.4 运动功能检测 ①BBB评分:各组均于术后1天及1、2、3、4周同一时间点(20:00)行BBB评分[11],由两名医师同时进行,取平均值。②神经电生理相关参数:术后4周,参照Wang等[12]的方法,将电磁线圈置于各组大鼠颅骨激活皮层下组织,应用诱发电位仪和磁刺激器经颅磁刺激运动诱发神经电生理反应,记录神经传导速度、潜伏期及波幅。实验重复4次,取平均值。
1.5 脊髓损伤组织KLF7、NGF、TrkA蛋白表达检测 采用Western boltting法。术后4周,采用10%水合氯醛溶液(350 mg/kg)腹腔注射将大鼠麻醉后迅速处死,以T10损伤灶为中心,取出约1 cm的新鲜脊髓组织,-80 ℃冰箱保存。用显微外科手术剪刀将损伤脊髓组织剪碎,研磨器充分研磨,加入相应体积的RIPA裂解液和1% PMSF蛋白酶抑制剂,离心吸取上清液。BCA定量试剂盒测定蛋白浓度合格,进行SDS-PAGE,分离蛋白后转至硝酸纤维素膜;缓冲液封闭后,加入KLF7一抗(1∶200)、兔抗NGF一抗(1∶200)或兔抗TrkA一抗(1∶200),4 ℃孵育过夜;加入辣根过氧化物酶标记的抗小鼠二抗(1∶2 000),孵育 2 h;TBS洗净后经显色液作用15 min,扫描后经Image J图像分析软件对印迹区进行条带灰度分析。以目的蛋白与内参蛋白GADPH灰度值的比值作为目的蛋白相对表达量。
1.6 脊髓损伤面积检测 取脊髓损伤组织,中性甲醛液充分固定,常规脱水制片包埋,25 μm厚度切片。常规行HE染色:将冰冻切片在空气中干燥1~2天,蒸馏水浸泡1~2 min;苏木素溶液中浸泡1 min,蒸馏水洗净;1%盐酸处理30 s,蒸馏水冲洗3 min,80%乙醇脱水1~2 min;伊红溶液中浸泡1~2 min,蒸馏水洗净;80%乙醇脱水1 min,95%乙醇脱水1 min,无水乙醇脱水1 min,二甲苯透明3 min。擦干后中性树胶封片。选择10张切片,采用Image6.0软件计算每张切片空洞面积与正常脊髓面积的百分比,即脊髓损伤面积百分比。实验重复3次,取平均值。
1.7 脊髓损伤组织ADSC数量检测 取各组1.5中的脊髓损伤组织冰冻切片,根据检测PKH26标记的荧光显像说明书进行操作。荧光显像参数设定如下:激发光波长450~570 nm,发射光波长570~700 nm,曝光时间1 min。荧光显微镜下进行观察,PKH26标记后的ADSC呈红色。采用Image6.0软件分析PKH26的光密度值,以此表示ADSC数量。
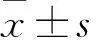
2 结果
2.1 三组BBB评分比较 见表1。
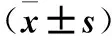
表1 三组BBB评分比较
注:与同组术后1天比较,*P<0.05;与对照组同时间点比较,#P<0.05;与ADSC组同时间点比较,△P<0.05。
2.2 三组神经电生理相关参数比较 见表2。
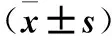
表2 三组神经电生理相关参数比较
注:与对照组比较,*P<0.05;与ADSC组比较,#P<0.05。
2.3 三组脊髓损伤组织KLF7、NGF、TrkA蛋白表达比较 见表3。
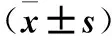
表3 三组脊髓损伤组织KLF7、NGF、TrkA蛋白相对表达量比较
注:与对照组比较,*P<0.05;与ADSC组比较,#P<0.05。
2.4 三组脊髓损伤面积及ADSC数量比较 见表4。
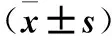
表4 三组脊髓损伤面积百分比及ADSC数量比较
注:与对照组比较,*P<0.05;与ADSC组比较,#P<0.05。
3 讨论
脊髓损伤修复的机制仍然不明确,其临床治疗多以外科手术减压及大剂量激素冲击为主,对于脊髓炎、脊髓空洞等引起的脊髓变性目前暂无有效药物治疗[12]。ADSC不仅可以分化为中、内、外胚层细胞,而且还能够分化为神经细胞,在中枢神经损伤恢复期发挥重要作用[13]。ADSC在脊髓损伤早期具有刺激作用,可促进多种细胞因子和神经营养因子表达,如脑源性神经营养因子、NGF、碱性成纤维细胞生长因子、胰岛素样生长因子、肝细胞生长因子、血管内皮生长因子等[14]。在神经修复过程中,上述细胞因子和神经营养因子可以通过诱导血管生成促进神经功能恢复,减少损伤周边区神经元凋亡,重建树突和轴突突触,并促进神经元再生和分化。ADSC可诱导分泌可溶性因子,如骨形态发生蛋白2和骨形态发生蛋白4等,这些因子在缺血区星形胶质细胞的分化过程中具有重要作用。前期研究也发现,ADSC可合成、分泌大量神经营养因子,如神经生长因子、血管内皮生长因子等,这些促进神经生长的因子可为轴突生长提供营养,促进周围神经轴突再生[8,9]。因此,ADSC移植被认为是一个治疗脊髓损伤的具有广阔前景的方法。
KLF属于锌指家庭成员,具有DNA结合域的羧基末端,由3个高度保守的Cys2/His2锌指结构组成,其DNA结合域通过与靶基因启动子上的C框或CACCC元件结合而发挥调控靶基因表达的作用,广泛参与细胞增殖、凋亡、分化以及胚胎发育等多个生命活动的调控[15]。KLF7在中枢和周围神经系统中广泛存在,可调控多种细胞的发育、增殖和分化,对周围神经系统轴突再生、髓鞘形成发挥重要作用,提高KLF7表达不仅可促进轴突生长,也可增加神经元营养,促进轴突生长[16]。本研究结果显示,与术后1天比较,各组术后1、2、3、4周BBB评分均升高,说明三组治疗后运动功能均有所恢复;KLF7联合ADSC组与ADSC组术后4周BBB评分、神经传导速度、波幅均高于对照组,潜伏期及脊髓损伤面积百分比均低于对照组,但KLF7联合ADSC组变化更明显,说明KLF7联合ADSC可有效减轻脊髓损伤大鼠的神经损伤,并有助于提高其神经功能、促进其运动功能的恢复。
研究发现,KLF7能够在周围神经系统上调靶基因NGF和TrkA表达,激活神经营养因子信号通路;通过增强TrkA受体的稳态,促进NGF诱发神经突起生长的作用[4]。目前已明确NGF/TrkA信号通路在促进神经元生长中发挥重要作用,但KLF7在脊髓损伤中对NGF/TrkA信号通路的调控尚不清楚。本研究结果显示,KLF7联合ADSC组、ADSC组脊髓损伤组织NGF、TrkA蛋白相对表达量均高于对照组,但KLF7联合ADSC组升高更明显;说明KLF7联合ADSC促进脊髓损伤后运动及神经功能恢复的机制可能与NGF/TrkA信号通路激活有关,与以往研究结果一致[16]。本研究结果显示,KLF7联合ADSC组、ADSC组ADSC数量均高于对照组,但KLF7联合ADSC组升高更明显,说明KLF7与ADSC联合移植有助于促进ADSC存活及发挥神经再生功能。
综上所述,KLF7联合ADSC可改善脊髓损伤大鼠的运动功能,减轻其神经损伤;其机制可能与KLF7促进ADSC存活及提高脊髓损伤组织NGF、TrkA表达有关。
[1] Jackson A. Spinal-cord injury: neural interfaces take another step forward[J]. Nature, 2016,539(7628):177-178.
[2] Gomes-Osman J, Cortes M, Guest J, et al. A systematic review of experimental strategies aimed at improving motor function after acute and chronic spinal cord injury[J].J Neurotrauma, 2016,33(5):425-438.
[3] Xue Y, Gao S, Liu F. Genome-wide analysis of the zebrafish Klf family identifies two genes important for erythroid maturation[J]. Dev Biol, 2015,403(2):115-127.
[4] Blackmore MG, Wang Z, Lerch JK, et al. Krüpple-like factor 7 engineered for t ranscriptional activation promotes axon regeneration in the adult corticospinal tract[J]. Proc Natl Acad Sci U S A, 2012,109(19):7517-7522.
[5] Moore DL, Blackmore MG, Hu Y, et al. KLF family members regulate intrinsic axon regeneration ability[J]. Science, 2009,326(5950):298-301.
[6] 王莹,李文媛,赵艳晶,等.KLF7对小鼠脱细胞异体神经支架移植后运动功能的影响[J].神经解剖学杂志,2016,32(3):385-390.
[7] Hirose M, Kuroda Y, Murata E. NGF/TrkA signaling as a therapeutic target for pain[J]. Pain Pract, 2016,16(2):175-182.
[8] 李文媛,王莹,李智刚,等.KLF7 联合脂肪源性干细胞对小鼠坐骨神经缺损后轴突再生的影响[J].中风与神经疾病杂志,2016,33(7):580-583.
[9] 王莹,李文媛,刘贵波,等.黄芪皂甙Ⅳ联合ADSC对坐骨神经缺损后大鼠运动功能的修复作用[J].山东医药,2013,53(39):4-6.
[10] Wang Y, Jia H, Li WY, et al. Synergistic effects of bone mesenchymal stem cells and chondroitinase ABC on nerve regeneration after acellular nerve allograft in rats[J]. Cell Mol Neurobiol, 2012,32(3):361-371.
[11] Basso DM, Beattie MS, Bresnahan JC. A sensitive and reliable locomotor rating scale for open field testing in rats[J]. J Neurotrauma, 1995,12(1):1-21.
[12] Wang Y, Jia H, Li WY, et al. Molecular examination of bone marrow stromal cells and chondroitinase ABC assisted acellular nerve allograft for peripheral nerve regeneration[J]. Exp Ther Med, 2016,12(4):1980-1992.
[13] Wu JH, Li M, Liang Y, et al.Migration of adipose-derived mesenchymal stem cells stably expressing chondroitinase ABC in vitro[J]. Chin Med J (Engl), 2016,129(13):1592-1599.
[14] Ji W, Zhang X, Ji L, et al.Effects of brain-derived neurotrophic factor and neurotrophin-3 on the neuronal differentiation of rat adipose-derived stem cells[J]. Mol Med Rep, 2015,12(4):4981-4988.
[15] Mc Connell BB, Yang VW. Mammalian Kruppel-like factors in health and diseases[J]. Physiol Rev, 2010,90(4):1337-1381.
[16] Wang Y, Li WY, Jia H, et al. KLF7-transfected Schwann cell graft transplantation promotes sciatic nerve regeneration[J]. Neuroscience, 2016(340):319-332.
EffectofKLF7andadipose-derivedstemcellsonmotorfunctionafterspinalcordinjuryinrats
LIWenyuan1,WANGYing,GUOSufen,LIUXing,LIZhigang,LIUGuibo,XUZhipeng,ZHANGJifei
(1MudanjiangMedicalCollege,Mudanjiang157011,China)
ObjectiveTo observe the effect of KLF7 and adipose-derived stem cell (ADSC) on motor function after spinal cord injury (SCI) in rats, and to probe the possible mechanism.MethodsThirty healthy SD rats were randomly divided into the KLF7+ADSC group, ADSC group, and control group, with 10 in each. SCI models were prepared by the method of transection of right half spinal cord. The 100 μL ADSC (ADSC labeled with PKH26) and 2 μL AAV2-KLF7 were injected into the SCI tissues in the KLF7+ADSC group, 100 μL ADSC was injected in the ADSC group, and 100 μL PBS was injected in the control group. At 1 day and 1, 2, 3, 4 weeks after operation, BBB was used to evaluate rats′ double lower limb functional recovery in each group. At week 4 after the operation, evoked electrophysiological responses were evoked by evoke potential instrument and tcMMEP, and the nerve conduction velocity, latency and amplitude were recorded. The rats were killed at 4 weeks after the operation, KLF7, NGF and TrkA protein in the SCI tissues were evaluated by Western blotting. The lesion area percentage of SCI and the number of ADSC were evaluated (the number of ADSC was represented by the light density value of PKH26).ResultsThe BBB scores increased at 1, 2, 3 and 4 weeks after operation as compared with that at 1 day after operation in each group (P<0.05). At 4 weeks after operation, compared with the control group, BBB score, nerve conduction velocity, amplitude, the number of ADSC, NGF and TrkA protein expression in the SCI tissues increased in the KLF7+ADSC group and ADSC group, however, the latency and the percentage of lesion area decreased, moreover, the effect of KLF7+ADSC group was more significant than that of the ADSC group (P<0.05). KLF7 relative protein expression in the SCI tissues in the KLF7+ADSC group was higher than that of the ADSC group and control group (allP<0.05).ConclusionKLF7 combined with ADSC could improve the motor function and alleviate the nerve damage, and the mechanism may be that KLF7 promotes ADSC survival and up-regulates NGF and TrkA expression in the lesion area.
spinal cord injury; KLF-like transcription factor 7; adipose-derived stem cells; nerve growth factor; tyrosine kinase A; rats
国家自然科学基金资助项目(81371362);黑龙江省科学基金资助项目(LC2017040);黑龙江省卫生厅科研课题(2016-357)。
李文媛(1980-),女,副教授,研究方向为肿瘤淋巴管的生成机制。E-mail: yuanyuan19800413@163.com
王莹(1977-),男,副教授,研究方向为肿瘤淋巴管的生成机制。E-mail: Yingwang770224@163.com
10.3969/j.issn.1002-266X.2017.44.002
R496
A
1002-266X(2017)44-0005-04
2016-11-23)

