晚期非小细胞肺癌外周血CTC与肿瘤组织EGFR表达的相关性*
朱颖,江波,杨承纲,金从国,涂长玲,何文杰,刘坤
(昆明医科大学第三附属医院 1.干部医疗科,2.病理科,3.肿瘤研究所,云南 昆明 650118)
晚期非小细胞肺癌外周血CTC与肿瘤组织EGFR表达的相关性*
朱颖1,江波1,杨承纲2,金从国3,涂长玲1,何文杰1,刘坤1
(昆明医科大学第三附属医院 1.干部医疗科,2.病理科,3.肿瘤研究所,云南 昆明 650118)
目的探讨晚期非小细胞肺癌(NSCLC)外周血循环肿瘤细胞(CTC)与肿瘤组织表皮生长因子受体(EGFR)表达的一致性。方法利用流式细胞术及免疫组织化学染色配对检测66例NSCLC患者外周血CTC和肿瘤组织EGFR的表达水平。给予EGFR酪氨酸激酶抑制剂治疗1个月后进行疗效评价。比较CTC与肿瘤组织EGFR表达的一致性,并分析其与患者临床因素、疗效及预后的相关性。结果外周血CTC与肿瘤组织EGFR表达一致率为69.7%。CTC与肿瘤组织EGFR的表达在不同组织学类型间比较,差异有统计学意义(P<0.05),在不同性别、年龄、分期、体力活动状态评分方面比较,差异无统计学意义(P>0.05)。EGFR高表达组疾病控制率高于低表达组(CTC:87.5% vs 35.3%;肿瘤组织:72.7%vs 36.4%)(P<0.05)。生存分析结果显示,EGFR高表达组有更长的无进展生存期(CTC:8个月 vs 2个月;肿瘤组织:6个月 vs 2个月)和总生存期(CTC:20个月 vs 13个月;肿瘤组织:16个月 vs 14个月)(P<0.05)。结论晚期NSCLC患者外周血CTC和肿瘤组织EGFR表达的一致性好,两者对酪氨酸激酶抑制剂治疗的疗效及预后具有一定的预测价值。外周血CTC作为肿瘤组织的替代检测标本是可行的。
非小细胞肺癌,循环肿瘤细胞,肿瘤组织,表皮生长因子受体
肺癌是目前世界范围内发病率和死亡率最高的恶性肿瘤,严重威胁人类健康[1]。所有肺癌中约84%为非小细胞肺癌(non-small cell lung cancer,NSCLC),大部分患者就诊时已属晚期[2],失去了根治性手术治疗的机会,只能进行姑息性放、化疗。近年来出现的生物靶向治疗为NSCLC患者提供新的治疗手段。表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI)已成功应用于临床,极大地改善NSCLC患者的生存质量,延长生存时间[3]。表皮生长因子受体(epidermal growth factor receptor,EGFR)敏感突变是EGFR-TKI对NSCLC患者疗效的预测指标,而肿瘤组织是EGFR突变检测的金标准[4]。对不能手术的晚期NSCLC患者,仅能通过穿刺等手段获取极少量的肿瘤组织,或者无法获取肿瘤组织标本。如何从该类患者中筛选出对EGFR-TKI敏感的人群,成为目前亟待解决的问题。循环肿瘤细胞(circulating tumor cell,CTC)是指由原发灶或转移灶脱落下来,进入外周血循环的肿瘤细胞,是肿瘤播散转移的重要原因[5],相对于肿瘤组织,可以多次、实时获取。为使CTC替代组织作为检测载体,必须识别出CTC,并对其表型特征进行认识,这将有助于提示潜在的治疗靶点,为临床靶向治疗的选择提供一个可行的方法。本研究对晚期NSCLC患者外周血CTC和肿瘤组织EGFR表达水平进行配对检测,旨在探讨外周血CTC与肿瘤组织EGFR表达的一致性,以及外周血CTC作为肿瘤组织替代检测标本的可行性。
1 资料与方法
1.1 临床资料
选取2012年9月-2014年5月昆明医科大学第三附属医院收治且经病理组织学或细胞学确诊的晚期NSCLC患者66例。其中,男性40例,女性26例,男、女比例为1.54∶1.00;年龄41~78岁,平均61岁;病理类型:腺癌52例,鳞癌14例。TNM分期:ⅢB期4例,Ⅳ期62例,体力活动状态(performance status,PS)评分0~1分44例,≥2分22例。治疗前后行胸腹部CT、彩超、颅脑磁共振成像、心电图、血常规、血液生化及肿瘤标志物检查。
1.2 治疗方法
66例患者中,16例为EGFR敏感突变阳性,均给予EGFR-TKI治疗。其余50例患者不愿/不能耐受化疗,在患者知情同意的前提下,给予EGFR-TKI治疗。根据医生经验从以下3种EGFR-TKI类药物中任选1种:吉非替尼片(英国阿斯利康公司)口服250 mg/次,1次/d;厄洛替尼片(美国罗氏公司)口服150 mg/次,1次/d;盐酸埃可替尼片(浙江贝达药业公司)口服125 mg/次,3次/d。无论选择何种药物均服用≥1个月。
1.3 流式细胞技术
1.3.1 标本采集 66例患者在治疗前从肘正中静脉中采血5 ml,随机选取10例患者另采血20 ml,所有血液标本加入肝素抗凝混匀,并在采集后2 h内进行检测。
1.3.2 抗体、试剂及仪器 CD45-PC5荧光单克隆抗体、荧光标记细胞角蛋白18抗体、荧光标记EGFR抗体、氯化铵NH4Cl溶血素均购于美国Beckmancoulter公司,流式细胞仪EPICS XL(美国Beckmancoulter公司),水冷紫外激光器、离心机、恒温箱及摇床购自Coherent公司。
1.3.3 分选CD45-CK18+细胞 将 10 例 20 ml外周血每份分成20份,加入5 ml无菌试管中,每管1 ml;每管加入CD45-PC5、CK18-FITC各200μl,避光保存30 min;加入NH4Cl溶血素4 ml,反复溶血,直到液体透亮,离心后加入培养液待分选。消毒ALTRA流式室,调节室内温度至8℃左右,开始收集细胞,流速控制在10 000~25 000个/s,收集过程中全程振荡,观察1次/30 min。细胞数接近1 000个时结束分选。
1.3.4 确定CD45-CK18+细胞为外周血CTC 将分选的CD45-CK18+细胞用玻片收集微球,置于光学显微镜下观察有无恶性肿瘤细胞的特征。
1.3.5 检测CTC中EGFR的表达水平 将66例5 ml血液标本加入20μl CD45-PC5、20μl EGFR-PE和20μl CK18-FITC,加入肝素抗凝的全血100μl,摇匀后避光室温保存30 min。加入NH4Cl溶血素2 ml,溶血15 min后上机检测,表达CD45-CK18+的细胞为患者外周血残留的CTC,表达CD45-CK18+EGFR阳性的细胞为CTC的EGFR阳性细胞。
1.4 免疫组织化学法
1.4.1 标本采集 66例患者均采集到组织学标本,采集方法包括:纤维支气管镜活检术、CT引导下经皮肺穿刺活检术、胸腔镜取材活检术。
1.4.2 抗体、试剂及方法 鼠抗人EGFR抗体,免疫组织化学SP法试剂盒均购于福州迈新生物技术有限公司。
1.4.3 结果判断 在光学显微镜下对切片染色情况进行评估,EGFR阳性表达主要定位于肿瘤细胞的细胞质或细胞膜上,呈棕黄色颗粒。采用Mattern半定量分析方法,综合染色强度和细胞数量进行分级,按染色强度分为:基本未着色、染色与背景相似计0分;着色浅、略高于背景计1分;中度着色、明显高于背景计2分;强染、着深棕色计3分。阳性细胞数<5%为0分;5%~25%为1分;26%~50%为2分;51%~75%为3分;>75%为4分。2项相加后分为低表达和高表达:0~2分为低表达,>2分为高表达。
1.5 疗效评价
疗效按WHO实体瘤评价标准分为:完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳 定(stable disease,SD)、 疾 病 进展(progression disease,PD),CR+PR为有效,CR+PR+SD为控制。无进展生存期(progression free survival,PFS)指自治疗首日至病变进展日;总生存期(overall survival,OS)为自治疗首日至死亡日或失访日,均以月计算。随访结止时间为2015年6月。
1.6 统计学方法
数据分析采用SPSS 17.0统计软件,一致性比较采用Kappa检验(Kappa >0.75为一致性高,0.40~0.75为一致性好,Kappa <0.40为一致性差)、McNemar检验、准确性检验[受试者工作特征曲线(receiver operating characteristic curve,ROC)的曲线下面积(area under curve,AUC)0.5~0.7表示诊断价值较低,0.7~0.9表示诊断价值中等,>0.9表示诊断价值较高];计数资料以率表示,用χ2检验:生存分析用Kaplan-Meier法、Log-rank法检验,P<0.05为差异有统计学意义。
2 结果
2.1 确定外周血CTC
10例标本中均分选出CD45-CK18+细胞,染色后置于光学显微镜下观察,具备恶性肿瘤细胞的特征:细胞核染色加深,染色质变粗,核浆比例增大。可确定CD45-CK18+细胞为外周血CTC。见图1。
2.2 EGFR在外周血CTC中的表达
66例外周血CTC的EGFR表达值:最小值5.4,最大值50.0,中位数23.0,均值24.6,以24.6分界,>24.6为高表达,<24.6为低表达。高表达数为32例,低表达数为34例。
2.3 EGFR在肿瘤组织的表达
66例肿瘤组织免疫组织化学染色高表达44例,低表达22例。见图2、3。
2.4 外周血CTC与肿瘤组织EGFR表达水平的一致性
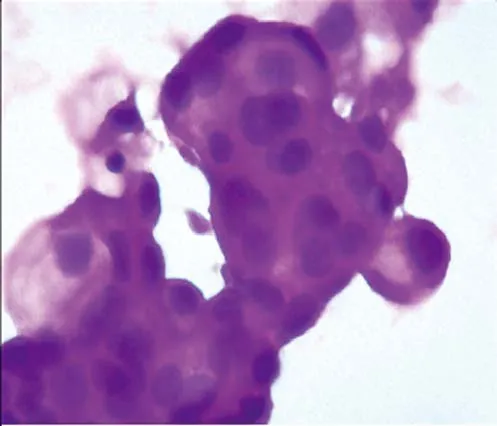
图1 晚期NSCLC患者外周血CTC (SP×400)
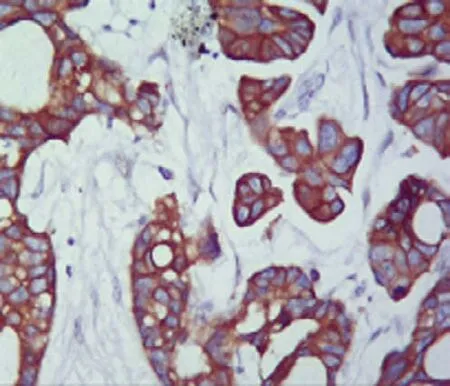
图2 NSCLC组织中EGFR高表达 (SP×200)
外周血CTC检测到EGFR高表达32例,肿瘤组织检测到EGFR高表达44例,在CTC和肿瘤组织中均为高表达28例。以肿瘤组织的EGFR表达结果为参照,CTC检测EGFR表达的敏感性和特异性分别为63.6%(28/44)和81.8%(18/22),阳性预测值和阴性预测值分别为87.5%(28/32)和52.9%(18/34),两者一致率为69.7%(46/66)。说明外周血CTC的EGFR表达与肿瘤组织的EGFR表达一致性好(Kappa =0.400,P=0.000),两者检测结果无差别(McNemar检验P=0.012),CTC的EGFR表达检测有一定诊断价值(AUC =0.770,P=0.001)。见表1和图4。
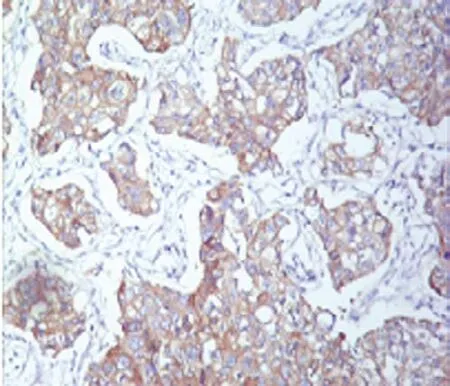
图3 NSCLC组织中EGFR低表达 (SP×200)
2.5 外周血CTC和肿瘤组织EGFR表达水平与临床因素的相关性
66例标本中,不同病理类型的EGFR表达水平比较,差异有统计学意义(P<0.05),腺癌EGFR高表达率高于鳞癌。而在性别、年龄、TNM分期、PS评分方面,外周血CTC和肿瘤组织EGFR表达水平比较,差异无统计学意义(P>0.05)。见表2。
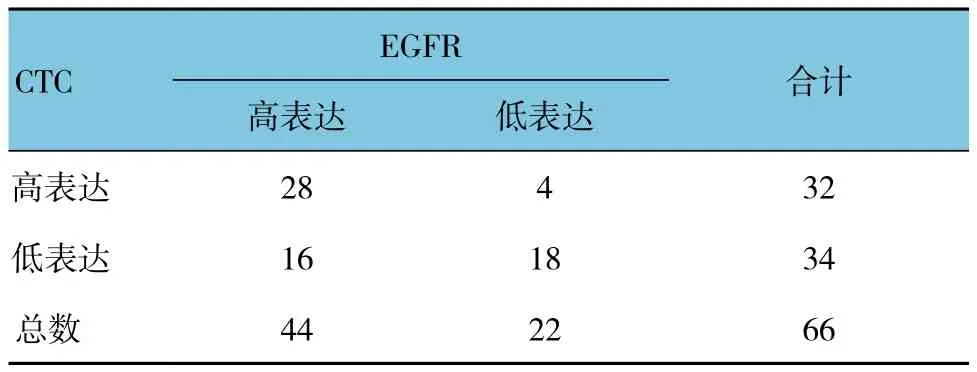
表1 晚期NSCLC患者外周血CTC与肿瘤组织EGFR表达的一致性 例
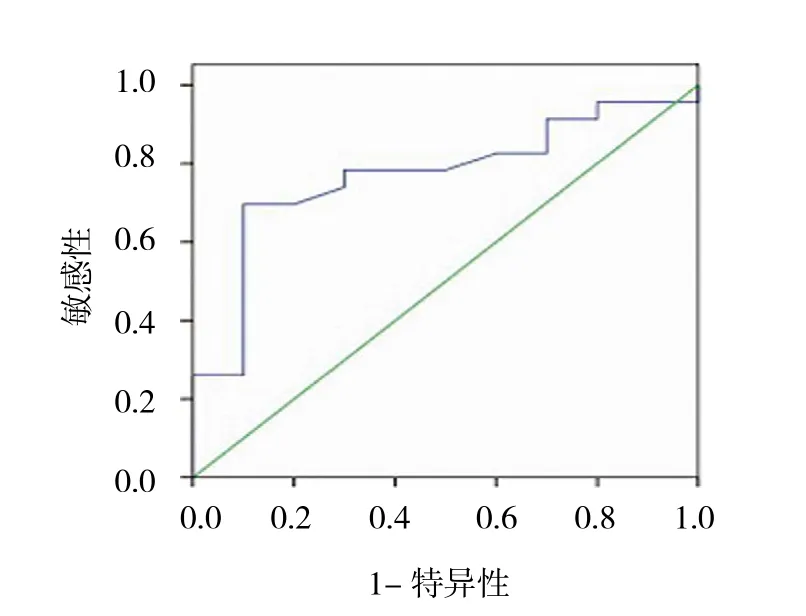
图4 晚期NSCLC患者外周血CTC的EGFR表达的ROC曲线

表2 晚期NSCLC患者临床特征与外周血CTC和肿瘤组织EGFR表达水平的关系 例(%)
2.6 外周血CTC和肿瘤组织EGFR表达水平与酪氨酸激酶抑制剂疗效的相关性
66例晚期NSCLC患者中,2例CR,24例PR,14例 SD,26例 PD,总有效率(CR+PR)为 39.4%(26/66),疾病控制率(disease control rate, DCR)(CR+PR+SD)为60.6%(40/66)。EGFR高表达患者的疾病控制率高于低表达患者(P<0.05)。见表3。
2.7 外周血CTC和肿瘤组织EGFR表达水平与生存期的相关性
本组患者中位OS为15个月(8~30个月),1年生存率为69.7%,2年生存率为18.2%。CTC的EGFR高表达组中位PFS和OS高于低表达组(P=0.000)。肿瘤组织的EGFR高表达组中位PFS和OS亦高于低表达组(P=0.000)。见图5~8。

表3 CTC和肿瘤组织EGFR表达水平与酪氨酸激酶抑制剂疗效的相关性
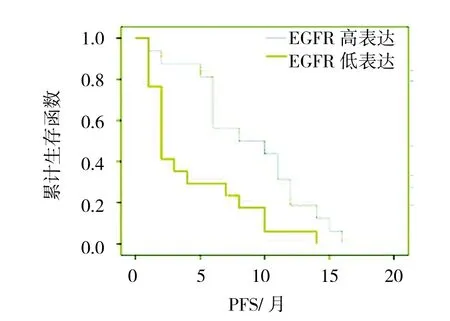
图5 晚期NSCLC患者CTC的EGFR不同表达水平的PFS比较

图6 晚期NSCLC患者CTC的EGFR不同表达水平的OS比较

图7 晚期NSCLC患者肿瘤组织EGFR不同表达水平的PFS比较

图8 晚期NSCLC患者肿瘤组织EGFR不同表达水平的OS比较
3 讨论
EGFR是一种具有酪氨酸激酶活性的细胞膜表面糖蛋白受体,在细胞信号传导通路中起重要作用。针对该靶点的药物有大分子单克隆抗体和酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),其中TKI类药物在临床中使用最为广泛。大量研究显示,对于存在EGFR敏感突变的患者,EGFR-TKI治疗的客观缓解率>70%,无突变者<10%[3,6]。肿瘤组织是进行EGFR突变检测的金标准,突变扩增阻滞系统法是目前标准的检测方法,对肿瘤组织的取材要求也较高。本研究中,16例患者进行肿瘤组织EGFR突变检测,检测率仅为24.2%。对于无法获得组织学标本,或是标本过少无法进行检测的晚期NSCLC患者来说,外周血的检测就显得尤为重要。
从理论上而言,负载肿瘤细胞、基因或蛋白的标本均有可能成为组织的替代物,如外周血、浆膜腔积液、分泌物及体液等,其中以外周血检测较为方便,成为近年研究的热点。有研究通过检测外周血游离DNA发现,外周血和肿瘤组织中检测到的EGFR突变状态有一定相关性[7-8]。2008年MAHESWARAN等[9]分析12例晚期NSCLC患者的外周血CTC和血浆标本,结果显示,两者EGFR突变的检出率分别为92%和33%,提示CTC可能是更好的组织替代标本。近年来,针对外周血CTC检测EGFR突变的研究较多,大部分研究证实其与肿瘤组织突变的一致性[10-11]。然而,关于检测CTC的EGFR蛋白表达水平的研究极少,未见CTC与肿瘤组织EGFR蛋白表达水平相关性研究的报道。
国内外研究表明,应用流式细胞技术检测细胞角蛋白(Cytokeratin,CK)可作为评估肿瘤血行微转移较敏感的指标,但以CK单一指标作为判断存在癌细胞的标准,会产生假阳性的结果。将白细胞共同抗原CD45与CK结合,可以排除大部分CD45+CK+的假阳性细胞,获得比较特异的CD45-CK+微转移癌细胞。本研究利用白细胞抗原CD45,负性分选出CTC,配对检测晚期NSCLC患者外周血CTC和肿瘤组织EGFR表达水平,结果显示,CTC的EGFR高表达率为48%,组织标本的EGFR高表达率为67%,两者一致率为69.7%(46/66),一致性好。可见,外周血CTC有可能替代肿瘤组织,作为液体活检标本。
本研究还显示,无论CTC还是肿瘤组织,腺癌中的EGFR表达水平均高于鳞癌,这与目前大量EGFR突变概况研究结果一致,腺癌EGFR突变率高于鳞癌[12]。而性别、年龄、TNM分期、PS评分方面比较,CTC与肿瘤组织的EGFR表达水平无差异。
有研究显示,对于肿瘤组织未检测到人表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)基因扩增的晚期乳腺癌患者,病情进展后,通过检测CTC的HER2蛋白表达水平,HER2高表达者给予曲妥珠单抗靶向治疗,获得较好的疗效[13-14]。而在NSCLC靶向治疗方面未见类似报道。目前在中国获批用于临床的EGFR-TKI包括吉非替尼、厄洛替尼及埃克替尼,3者具有相似的化学结构及作用机制,CTONG0901、WJOG5108L、ICOGEN等大型临床研究也显示3者疗效相当[15-17]。因此,本研究对药物的选择未做强行规定。本研究66例晚期NSCLC患者中,CTC的EGFR高表达组患者疾病控制率高于低表达组,高表达组的中位PFS和OS高于低表达组。在肿瘤组织也得到相似的结果,EGFR高表达组患者的疾病控制率、中位PFS和OS高于低表达组。本研究中,CTC与肿瘤组织检测结论相似,两者的EGFR表达水平对TKI治疗的疗效及预后有一定的指导意义。
对于晚期NSCLC患者,靶向治疗相对于化疗有明显的优越性,各国指南已将TKI类药物列为EGFR突变者的一线治疗。对于难以获取肿瘤组织的患者来说,需要一种可以替代组织检测的方法来实现个体化治疗。相对于肿瘤组织而言,外周血CTC采集方便,可以反复、多次采集。因此,对于获取肿瘤组织困难的患者,用CTC代替肿瘤组织进行EGFR检测是可行的。
[1]TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics,2012[J]. CA: a Cancer Journal for Clinicians, 2015, 65(2): 87-108.
[2]DETTERBECK F C, BOFFA D J, TANOUE L T. The new lung cancer staging system[J]. CHEST Journal, 2009, 136(1): 260-271.
[3]MOK T S, WU Y L, THONGPRASERT S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J]. New England Journal of Medicine, 2009, 361(10): 947-957.
[4]CAGLE P T. Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors[J].Journal of Molecular Diagnostics, 2013, 15(Issue): 415-453.
[5]PLAKS V, KOOPMAN C D, WERB Z. Cancer circulating tumor cells[J]. Science, 2013, 341(341): 1186-1188.
[6]TAMURA K, OKAMOTO I, KASHII T, et al. Multicentre prospective phase II trial of gefitinib for advanced non-small cell lung cancer with epidermal growth factor receptor mutations:results of the West Japan Thoracic Oncology Group trial(WJTOG0403)[J]. British Journal of Cancer, 2008, 98(5): 907-914.
[7]MACK P C, HOLLAND W S, BURICH R A, et al. EGFR mutations detected in plasma are associated with patient outcomes in erlotinib plus docetaxel-treated non-small cell lung cancer[J].Journal of Thoracic Oncology, 2009, 4(12): 1466-1472.
[8]KIMURA H, SUMINOE M, KASAHARA K, et al. Evaluation of epidermal growth factor receptor mutation status in serum DNA as a predictor of response to gefitinib (IRESSA)[J]. British Journal of Cancer, 2007, 97(6): 778-784.
[9]MAHESWARAN S, SEQUIST L V, NAGRATH S, et al. Detection of mutations in EGFR in circulating lung-cancer cells[J]. New England Journal of Medicine, 2008, 359(4): 366-377.
[10]MARCHETTI A, GRAMMASTRO M D, FELICIONI L,et al. Assessment of EGFR mutations in circulating tumor cell preparations from NSCLC patients by next generation sequencing: toward a real-time liquid biopsy for treatment[J].PLoS One, 2014, 9(8): DOI: 10.1371/journal.pone.0103883.
[11]FRANK B, SANDRA H, KARL W, et al. Development of a highly sensitive and specific method for detection of circulating tumor cells harboring somatic mutations in non-small-cell lung cancer patients[J]. PLOS One, 2014, 9(1): DOI: 10.1371/journal.pone.0085350.
[12]WU Y L, ZHONG W Z, LI L Y, et al. Epidermal growth factor receptor mutations and their correlation with gefitinib therapy in patients with non-small cell lung cancer: a meta-analysis based on updated individual patient data from six medical centers in mainland China[J]. Journal of Thoracic Oncology, 2007, 2(5):430-439.
[13]MENG S, TRIPATHY D, SHETE S, et al. HER-2 gene amplification can be acquired as breast cancer progresses[J].Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(25): 9393-9398.
[14]FEHM T, BECKER S, DUERR-STOERZER S, et al.Determination of HER2 status using both serum HER2 levels and circulating tumor cells in patients with recurrent breast cancer whose primary tumor was HER2 negative or of unknown HER2 status[J]. Breast Cancer Research, 2007, 9(5): 1-8.
[15]谭芬来, 张力, 赵琼, 等. 国家一类新药盐酸埃克替尼的药理与临床评价[J]. 中国新药杂志, 2009, 18(18): 1691-1694.
[16]SHI Y, ZHANG L, LIU X, et al. Icotinib versus gefitinib in previously treated advanced non-small-cell lung cancer(ICOGEN): a randomised, double-blind phase 3 non-inferiority trial.[J]. Lancet Oncology, 2013, 14(10):953-961.
[17]NISHIYAMA A, KATAKAMI N, MORITA S, et al. Randomized phase III study comparing gefitinib (G) with erlotinib (E)in patients (PTS) with previously treated advanced lung adenocarcinoma (LA): WJOG 5108L[J]. Annals of Oncology,2014, 25(supplement 4): DOI: 10.1093/annonc/mdu349.50.
(童颖丹 编辑)
Correlation between EGFR expression in circulating tumor cells and in tumor tissues of advanced non-small cell lung cancer*
Ying Zhu1, Bo Jiang1, Cheng-gang Yang2, Cong-guo Jin3, Chang-ling Tu1, Wen-jie He1, Kun Liu1
(1. Cadre’s Medical Oncology; 2. Department of Pathology; 3. Tumor Research Institute, the Third Affiliated Hospital of Kunming Medical University, Kunming, Yunnan 650118, China)
ObjectiveTo detect the expression level of epidermal growth factor receptor (EGFR) in circulating tumor cells (CTC) and matched tumor tissues from patients with advanced non-small cell lung cancer (NSCLC),and investigate the consisitent rate of these two methods.MethodsThe EGFR expression was analyzed by fl ow cytometry and immunohistochemical staining in the peripheral blood CTC and tumor tissues from 66 advanced NSCLC patients. The therapeutic efficacy was evaluated after 1 month of treatment with EGFR-tyrosine kinase inhibitor (EGFR-TKI). The consistency of the EGFR expression in the CTC and the tumor tissues was compared.The relationships of EGFR expression with clinical characteristics, efficacy, progression-free survival (PFS) and overall survival (OS) were analyzed.ResultsThe consistent rate of the two methods was 69.7% (46/66,P< 0.05).The EGFR expression levels in the CTC and the tumor tissues were signi fi cantly different between the patients with different pathological types (P< 0.05), but not statistically different between the patients with different gender, age,clinical stage or PS score (P> 0.05). The patients with high EGFR expression level had remarkably higher disease control rate than those with low EGFR expression level (CTC: 87.5% vs. 35.3%; tumor tissue: 72.7% vs. 36.4%;P< 0.05), longer PFS (CTC: 8 months vs. 2 months; tumor tissue: 6 months vs. 2 months;P< 0.05) and OS (CTC: 20 months vs. 13 months; tumor tissue: 16 months vs. 14 months;P< 0.05).ConclusionsIn the patients with advanced NSCLC, EGFR expression level in the CTC and the tumor tissues is highly consistent. Both of them can be used for predicting the efficacy of EGFR-TKI therapy and prognosis. CTC can be a substitute for tumor tissue.
non-small cell lung cancer; circulating tumor cell; tumor tissue; epidermal growth factor receptor
R734.2
A
10.3969/j.issn.1005-8982.2017.29.007
1005-8982(2017)29-0032-07
2016-03-31
云南省科技厅应用基础研究面上项目(No:2012FB164);云南省教育厅重点项目(No:2013Z113)
江波,E-mail:jiangruonin1973@163.com

