钆对比剂安全性评价
秦 韵综述 陈卫霞审校
钆对比剂安全性评价
秦 韵综述 陈卫霞审校
钆对比剂是含有顺磁性金属离子Gd3+的螯合物,能够通过增强T1加权像上的信号强度,提高病灶与正常组织的对比度及显示病灶的血流动力学特征,对磁共振成像技术的革新和发展有很大的帮助,近年来使用率呈逐年增加的趋势。自1987年首个钆对比剂被FDA批准上市,目前共9种钆对比剂投入临床使用,不同种类的钆对比剂的稳定性主要取决于各种类型分子结构的热力学常数、动力学稳定常数和条件稳定常数,动物实验及临床研究均证实了使用钆对比剂后钆在体内各组织器官的沉积。尽管目前临床普遍认为钆对比剂是安全的,但仍有部分患者发生不良反应,头痛、恶心、味觉改变和荨麻疹是最常见的不良反应,极少数患者可能发生过敏性休克或远期发生肾源性系统性纤维化。本文旨在通过对大量文献进行回顾分析及本院数据总结,对钆对比剂的主要特征和不良反应进行了详细的介绍,以利于将钆对比剂更安全地应用于临床。
钆对比剂;特征;急性不良反应;迟发性不良反应
概 述
过去的几十年里,随着磁共振成像技术的不断革新,钆对比剂(gadolinium-based contrast agents,GBCAs)的使用也逐年递增。据不完全统计,全球每年约有3400万MR检查,其中约一半的检查都采用了静脉注射GBCAs的方法,静脉注射GBCAs可用于全身所有器官和组织的检查,能够通过提高病灶与正常组织的对比度及显示病灶的血流动力学特征,增加病变的检出率并提高定性诊断的正确率,对于磁共振成像技术的革新和发展有很大的帮助。自1987年FDA批准首个GBCA——钆喷酸葡胺(gadopentetate dimeglumine,Gd-DTPA)上市,目前已有9种GBCAs正式投入临床使用,而钆喷酸葡胺也成为全球磁共振成像应用最广、使用频率最高的GBCA。理想状态下,对比剂能够通过提高图像对比度,对全身各部位异常组织或结构进行显影,在注入体内后,不与蛋白质结合,以原形、快速排出,不对机体产生任何不良反应,但遗憾的是事实并非如此。虽然目前普遍认为临床所用GBCAs是安全的,但并非完全没有风险,发生不良反应的患者大多数表现为以皮肤改变为主、一过性、轻度不良反应,但仍有极少数患者出现过敏性休克或远期发生肾源性系统性纤维化(nephrogenic systemic fibrosis, NSF)[1]。本文通过对大量文献的回顾分析,对GBCAs的主要特征及不良反应进行了详细的总结,以期加深大家对GBCAs的认识和理解,以更好地将GBCAs应用于临床工作。
钆对比剂特征
1.结构及分类
FDA现批准临床使用的9种GBCAs包括6种非特异性细胞外GBCAs(钆弗塞胺gadoversetamide,钆双胺gadodiamide,钆布醇gadobutrol,钆特醇gadoteridol, 钆喷酸葡胺gadopentetate和钆特酸葡胺gadoterate)、2种肝胆特异性GBCAs(钆塞酸gadoxetate和钆贝葡胺gadobenate)及1种磁共振血管增强GBCA(钆磷维塞gadofosveset)。上述GBCAs均为含有顺磁性金属离子Gd3+的螯合物,根据其结构的不同,主要分为线形结构和大环形结构两大类,并且根据Gd3+状态不同又可分为离子型和非离子型。粗略来讲,非离子型线形、离子型线形和大环形的GBCAs的稳定性是逐渐递增的。大环形GBCAs分子中Gd3+位于配体的环形结构中,进入体内后很少通过与内源性离子进行金属置换反应,因此被认为较线形结构更加稳定,而线形结构因其相对的不稳定性,部分种类为了保证药品有效期内的药理作用往往会在溶液中加入过多的含有Gd3+的螯合物。尽管如此,GBCAs的稳定性准确判断主要还是取决于各种类型分子结构的热力学常数、动力学稳定常数和条件稳定常数,这些常数与GBCAs的分子结构并不直接相关(表1)[2]。
2.作用机制及毒性
经静脉团注后,因非特异性细胞外GBCAs属于小分子物质(平均约500 Da),故能够很快从血管分布至细胞外间隙,这种分布是不具有特异性的。而Gd3+具有7个未配对的电子,故GBCAs具有很强的顺磁性,能够缩短邻近组织中水分子中质子的T1、T2和T2*的弛豫时间,从而增强T1加权成上的信号强度,同时降低T2和T2*加权像的信号强度。但是,由于有机配体的化学结构会在一定程度上影响Gd3+与水分子的相互作用位点数量,因此,GBCAs的顺磁性在不同种类间存在一定差异。而肝胆特异性GBCAs不仅在注射早期具有非特异性细胞外GBCAs的特征,还能够被正常的肝细胞摄取,并通过存在于胆小管上的多特异性的有机阴离子转运蛋白排泌到胆汁中,因此,能够在延迟期对正常肝实质进行明显且特异性的强化。钆磷维塞做为目前唯一批准的磁共振血管增强对比剂,注射后能与血液中的白蛋白可逆性结合,不仅具有非特异性细胞外GBCAs的功能,还能对血管进行至少持续1h的显像。非特异性细胞外GBCAs主要以原形经过肾小球滤过,无重吸收或再排泌过程,对于肾功能正常者,98%的GBCAs能在注射后24h内被清除,完全清除需要约24~48h。而肝胆特异性和血管增强GBCAs则经过肝胆和肾脏途径共同排泄,钆塞酸、钆贝葡胺及钆磷维塞的肝胆/肾脏排泄率依次为:50%/50%,2%~4%/96%~98%和9%/91%,其中,钆磷维塞因其分子结构的特殊性,排泄时间最长,14d约能排出84%的注射剂量[3-4]。
部分临床前研究显示,静脉注射GBCAs后可释放出游离的Gd3+,游离的Gd3+可迅速分布到骨与肝脏,并发生少量沉积,沉积量与其药代动力学和热力学稳定性相关[5]。多个临床研究发现,齿状核和苍白球在T1WI平扫时信号强度的比值升高与患者既往使用钆对比剂的次数有显著相关性,且明显高于仅进行MRI平扫检查的患者,间接证实了静脉注射GBCAs后,部分钆在中枢神经系统的沉积,且沉积量与注射次数呈正相关[6]。Sanyal等人通过对一例NSF患者的尸检标本进行研究,发现NSF患者的皮肤、肝、肺、回肠壁、肾、淋巴结、骨骼肌、硬脑膜和小脑及血管壁等多个器官和组织均存在不溶性磷酸钆的沉积[7]。结合上述研究发现,静脉注射GBCAs可导致体内各组织器官的钆沉积,虽然目前尚未发现钆在组织器官中沉积引起的组织学改变,但钆属于镧系金属元素,游离的Gd3+半径(107.8pm)与Ga2+(114pm)相近,能与Ga2+竞争门控通道,抑制Ga2+内流及一系列相关酶(如Ca2+激活ATP酶、一些脱氢酶、激酶、谷胱甘肽转移酶、醛缩酶等)的活性,此外,游离的Gd3+在体内长时间滞留还可能抑制网状内皮系统的功能[8],因此仍需进一步研究以评估GBCAs在活体内的稳定性、安全性和钆在体内沉积是否为引发生物学效应。
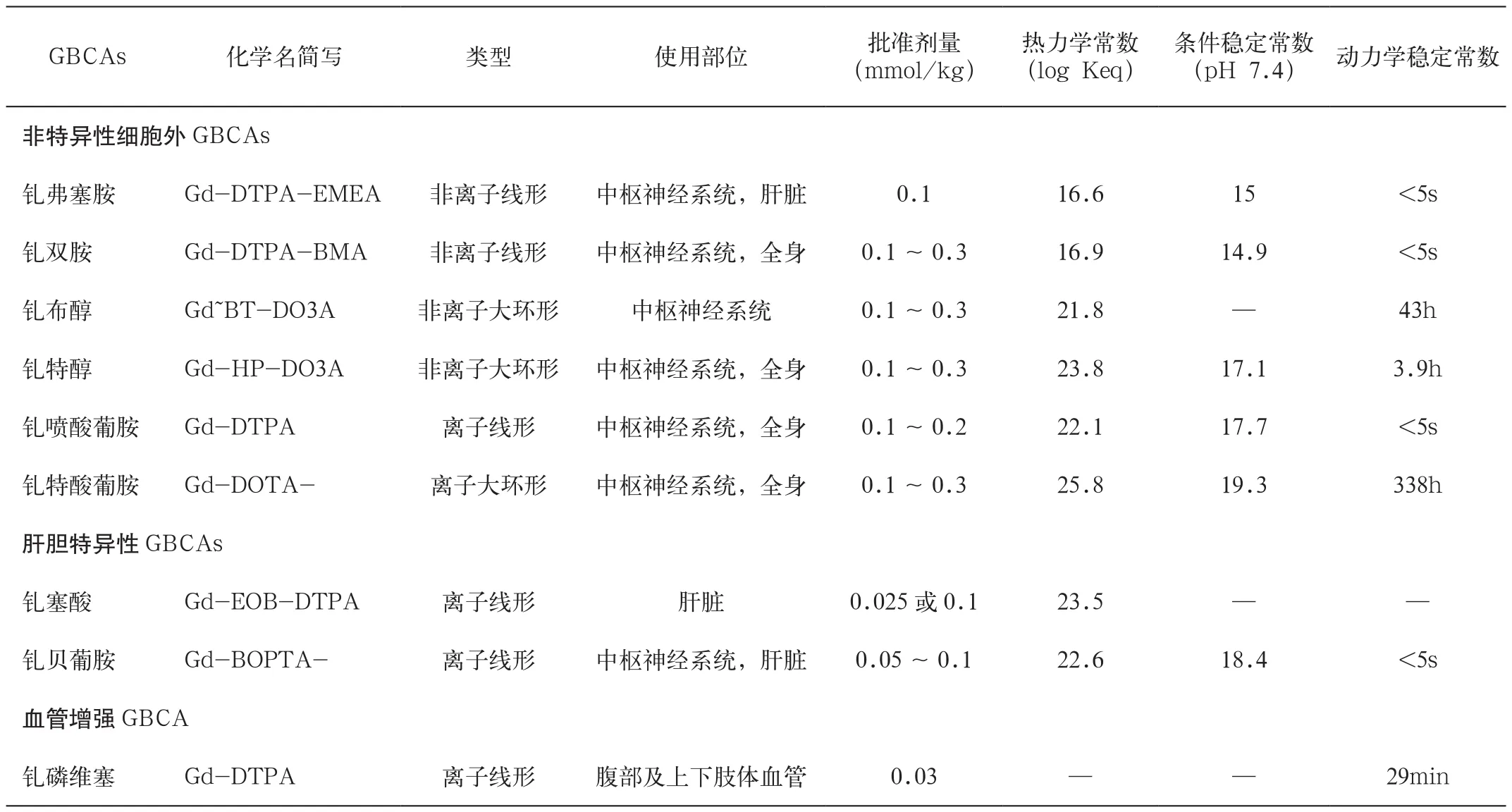
表1 临床使用钆对比剂分类及化学特征表

表2 GBCAs急性不良反应临床表现及治疗原则
安全性评价
大量I~IV期的药物临床试验证实,相较于碘对比剂,GBCAs具有用药剂量小、不良反应发生率低等特点。尽管如此,也有严重不良反应甚至是相关死亡病例的报道。
1.急性不良反应
急性不良反应指注射后即刻到1h内出现的不良反应,根据美国放射协会对比剂不良反应的指南,GBCAs的急性不良反应主要分为轻度、中度和重度三类(表2)。
多项研究结果显示,静脉注射GBCAs的急性不良反应发生率约为0.02%~2.4%,其中,在Prince等人进行的纳入158796名行磁共振增强的患者的大规模研究中,仅94名患者出现了急性不良反应,发生率为0.059%。头痛、恶心、味觉改变和荨麻疹是最常见的急性不良反应,严重的过敏性休克罕有发生(发生率约0.004%~0.01%)。而对于不同种类的GBCAs,组织特异性的钆磷维塞、钆塞酸和钆贝葡胺发生急性不良反应的概率最高,发生率分别高达0.80%、0.31%及0.28%,且钆贝葡胺与重度不良反应的发生及相关的死亡病例关系最为密切。女性和既往的过敏性事件被认为与GBCAs的急性不良反应发生有明确的统计学相关性(P<0.001),年龄、体重、肌酐水平、哮喘病史、既往GBCAs注射史、糖皮质激素预防等因素与急性不良反应的发生皆无统计学相关性[9-10]。回顾性分析我院2014-2016年不良反应数据库,发生GBCAs急性不良反应的例数为34例(发生率约0.025%),其中轻度不良反应14例、中度不良反应15例、重度不良反应5例(发生率约0.004%,4例为女性;3例注射钆贝葡胺,2例钆喷酸葡胺),与过去多数研究结果一致。
2.迟发性不良反应
迟发性不良反应指注射对比剂1h后到数周甚至数月内出现的不良反应,多表现为恶心、头痛、骨骼肌肉酸痛、发热和皮疹等,对症支持治疗均可缓解。极少数患者会发生一种罕见但危及生命的系统性疾病——NSF。2000年Cowper等人首次报道了15例透析患者出现的对称性分布的皮肤增厚、变硬及色素沉着,主要累及踝部到大腿中部和腕部到上臂中部区域。真皮组织活检发现广泛性的皮肤纤维化。虽然发现之初该病被命名肾源性纤维性皮肤病(nephrogenic fibrosing dermopathy,NFD),但之后更多的研究发现,该病还可累及全身其他组织器官,如关节、骨骼肌、心肌、肾脏、神经等。患者往往隐匿起病,症状进行性加重,主要表现为局灶性皮肤增厚变硬,部分出现假橘皮样改变,关节受累者可出现关节挛缩,其他系统受累者可出现肌肉疼痛无力、周围型神经病、呼吸衰竭甚至是心跳骤停等。确诊需要真皮组织活检,主要病理改变包括真皮层大量梭形纤维细胞浸润,裂隙周围胶原纤维束明显增厚,伴黏液沉积及深入到皮下肌层的弹性纤维,免疫组化提示这些纤维细胞CD34及1型前胶原染色阳性,且与骨髓来源的循环纤维细胞具有相似的免疫组化印记[11]。该病目前尚无有效的治疗方法。
自从2006年Grobner首次提出,钆双胺可能在代谢性酸中毒的透析患者中诱发NSF,越来越多的研究证实GBCAs与NSF具有很强的相关性。截止2009年12月,全球共报道1280例GBCAs相关的NSF,其中约3/4患者注射GBCAs时处于慢性肾脏病4~5期,且多在接受注射的2d至18个月内出现症状。美国的一项研究证实,注射GBCAs的患者中发生NSF的概率约为0.01%,透析、肾移植患者发生概率明显增加,分别为1.0%和0.8%,[12]。这些数据都说明在肾衰竭患者中,GBCAs注射与NSF的发生正相关。此外,一项基于FDA药物不良反应数据库的研究结果显示,在382例病理诊断NSF的患者中,291位患者曾注射过钆双胺(76.2%)。而以钆贝葡胺和钆喷酸葡胺替代钆双胺后,NSF发生率显著降低,说明钆双胺注射与NSF发生存在很强的剂量相关性[13]。因此,对于那些需要进行磁共振增强扫描的NSF高危人群,选择合适的GBCAs、严格限制药物注射剂量,或许能够有效降低NSF的发生率。
3.特殊人群
因为缺乏临床研究证据,GBCAs一直被FDA列为妊娠C类药物。目前仅个别研究对GBCAs在妊娠期的安全性进行评价。Ray等人回顾性分析了一组时间跨度达13年的大样本,结果显示,妊娠前3个月行GBCAs注射并未增加胎儿或婴幼儿患先天畸形或肿瘤的风险,但妊娠期间GBCAs注射可能引起免疫性、炎症性或浸润性皮肤改变,引起死胎或新生儿死亡风险的增加[14]。因此,目前的建议是避免妊娠前3个月行磁共振增强检查,对于会严重影响患者及胎儿预后的疾病的诊断,可考虑3个月后行大环形GBCAs注射,以尽可能减少胎儿体内的重金属沉积。
部分学者认为儿童及婴幼儿因其生理功能并不完善,可能引起GBCAs在体内过长时间滞留而导致不良反应,但相关研究数据显示,儿童急性不良反应与成人相当(发生率约0.04%),注射GBCAs致NSF病例报道仅10余例,且各国指南已批准GBCAs用于6个月到18岁儿童静脉注射,证实了GBCAs在儿童中应用的安全性[15]。
总结及展望
总的来说,对于成人和儿童,GBCAs皆是一种安全、耐受性好的静脉注射磁共振增强对比剂。头痛、恶心、味觉改变和荨麻疹是最常见的不良反应。虽然选择稳定性更好的GBCAs及严格限制药物注射剂量或许能够有效降低不良反应的发生率,但严重的过敏性休克和危及生命的NSF仍偶有发生,且一旦发生,前者需紧急抢救,而后者尚无有效的治疗方法,对于这类情况,防重于治。因此,今后的临床研究,重点应该是在检查前筛选可能发生严重的过敏性休克或NSF的高危患者,以尽可能降低不良反应、尤其是重度不良反应、NSF事件的发生。
[ 1 ]曹厚德.含钆对比剂可能引发致命反应.中国医学计算机成像杂志,2011,17:36.
[ 2 ]Idée JM, Port M, Robic C, et al. Role of thermodynamic and kinetic parameters in gadolinium chelate stability. J Magn Reson Imaging,2009,30:1249-1258.
[ 3 ]Bellin MF. MR contrast agents: the old and the new. Eur J Radiol ,2006,60:314-323.
[ 4 ]戴亚婕.特异性肝胆磁共振对比剂Gd-EOB-DTPA在胆道成像的临床应用及研究.中国医学计算机成像杂志,2014,20:291-294.
[ 5 ]Aime S, Caravan P. Biodistribution of gadolinium-based contrast agents, including gadolinium deposition. J Magn Reson Imaging,2009,30:1259–1267.
[ 6 ]Ramalho J, Castillo M, AlObaidy M, et al. High signal intensity in globus pallidus and dentate nucleus on unenhanced T1-weighted MR images: evaluation of two linear gadolinium-based contrast agents.Radiology,2015,276:836-844.
[ 7 ]Sanyal S, Marckmann P, Scherer S, et al. Multiorgan gadolinium(Gd) deposition and fibrosis in a patient with nephrogenic systemic fibrosis--an autopsy-based review. Nephrol Dial Transplant, 2011,26:3616-3626.
[ 8 ]Idee JM, Port M, Raynal I, et al. Clinical and biological consequences of transmetallation induced by contrast agents for magnetic resonance imaging: a review. Fundam Clin Pharmacol, 2006,20:563–576.
[ 9 ]Prince MR, Zhang H, Zou Z, et al. Incidence of immediate gadolinium contrast media reactions. AJR Am J Roentgenol ,2011,196:138-143.
[10]Jung JW, Kang HR, Kim MH, et al. Immediate hypersensitivity reaction to gadolinium-based MR contrast media. Radiology,2012,264:414-422.
[11]Girardi M, Kay J, Elston DM, et al. Nephrogenic systemic fibrosis:clinicopathological definition and workup recommendations. J Am Acad Dermatol, 2011,65:1095-1106.
[12]Lee CU, Wood CM, Hesley GK, et al. Large sample of nephrogenic systemic fibrosis cases from a single institution. Arch Dermatol ,2009,145:1095-1102.
[13]Altun E, Martin D R, Wertman R, et al. Nephrogenic systemic fibrosis: change in incidence following a switch in gadolinium agents and adoption of a gadolinium policy-report from two U.S.universities. Radiology, 2009,253:689-696.
[14]Ray JG, Vermeulen MJ, Bharatha A, et al. Association between MRI exposure during pregnancy and fetal and childhood outcomes.JAMA,2016,316:952-961.
[15]刘 哲, 孙 青, 杨 健.MR钆对比剂的儿科应用现状.中华放射学杂志,2016, 50:718-720.
Safety Evaluation of Gadolinium-based Contrast Agents
QIN Yun, CHEN Wei-xia
Gadolinium-based contrast agents (GBCAs) are composed of gadolinium ion Gd3+ and chelates.Through signal enhancement on T1-weighted imaging, the contrast between normal tissues and lesions could be increased, and their hemodynamic property could be demonstrated. In recent years, the usage of GBCAs is increasing gradually all over the world. Since the first GBCA was approved by FDA in 1987, there are 9 GBCAs available for clinical practice now. The stability of each GBCAs is determined by their thermodynamic, kinetic and conditional stability constants. Animal studies and clinical researches have demonstrated the gadolinium deposition in different tissues and organs after the injection of GBCAs. Despite the fact that GBCAs are considered safe, some patients do have adverse reactions. Headache, nausea, taste change and urticarial are the most common adverse reactions, and very few patients suffer anaphylactic shock and nephrogenic systemic fibrosis. The review aimed to give detailed introduction of the main characteristics and adverse reactions of GBCAs through literature review and data analysis from our hospital and contribute to safer GBCAs application in clinical practice.
Gadolinium-based contrast agents, Characteristics, Acute adverse reactions, Delayed adverse reactions
R981+.9
B
1006-5741(2017)-05-0393-05
中国医学计算机成像杂志,2017,23:393-397
四川大学华西医院放射科
通信地址:四川省成都市武侯区国学巷37号,成都市610041
陈卫霞(电子邮箱:wxchen25@126.com)
Chin Comput Med Imag,2017,23:393-397
Department of Radiology, West China Hospital, Sichuan University
Address: No. 37 Guoxuexiang, Chengdu 610041, P.R. C.
Address Correspondence to CHEN Wei-xia (E-mail: wxchen25@126.com)
2017.06.06;修回时间:2017.08.02)

