3种园林植物的抗盐生理研究
郑欣颖,李鹏飞,薛 立,麦凝珺,蔡金桓,李秋静
(1.华南农业大学 林学与风景园林学院,广东 广州 510642; 2.广州普邦园林股份有限公司,广东 广州 510642)
3种园林植物的抗盐生理研究
郑欣颖1,李鹏飞2,薛 立1,麦凝珺2,蔡金桓1,李秋静2
(1.华南农业大学 林学与风景园林学院,广东 广州 510642; 2.广州普邦园林股份有限公司,广东 广州 510642)
对龙船花Ixora chinensis、红背桂Excoecaria cochinchinensis、朱蕉Cordyline fruticosa进行苗期耐盐性评价,研究其生理机制,为筛选和利用具有优良耐盐性状的园林植物提供依据。设置对照(0)、0.3%和0.6%3个土壤NaCl浓度水平,测定植物的生理指标,在此基础上采用主成分分析综合评价植物的耐盐性,并进行排序。研究结果表明:(1)随着盐胁迫时间的延长,在0.3 %盐浓度的胁迫下,3种植物幼苗叶片的叶绿素含量、可溶性糖含量和SOD活性呈现递增的趋势;龙船花的脯氨酸含量上升,红背桂下降,朱蕉则先降后升;红背桂与龙船花幼苗叶片的可溶性蛋白含量持续递增,朱蕉先升后降;龙船花和朱蕉的MDA递增,红背桂先降后升。(2)在0.6 %盐浓度的胁迫下,红背桂的叶绿素含量上升,其它2种植物先升后降; 3种植物的脯氨酸含量和SOD活性先升后降;龙船花和红背桂的可溶性糖含量上升,朱蕉先升后降;龙船花的可溶性蛋白含量先升后降,其他植物上升;龙船花的MDA持续递增,红背桂则先降后升,朱蕉先升后降。(3)采用主成分分析法表明:0.3%和0.6 %盐浓度胁迫下,3种植物幼苗的生理指标得分均为红背桂>朱蕉>龙船花,植株苗期的生理指标对盐胁迫浓度的变化响应灵敏,可以用于鉴定植物的耐盐性。
盐胁迫;生理指标;主成分分析;幼苗
目前,占世界陆地总面积30%的土地处于盐渍化状态,严重威胁着全球农牧业主产和生态环境[1]。中国的盐渍土主要分布在西北、华北、东北和沿海地区[2],面积达3 600 万hm2,占全国可利用土地面积的4.88%[3]。盐渍化土地中,高浓度的盐增大了土壤的渗透势,对植物产生渗透胁迫,会直接毒害作物[4],严重影响了植物生长和农业生产。植物长期进化过程中产生了一系列适应盐胁迫的生理机制,例如合成渗透调节物质、提高抗氧化酶系统的活性、消除自由基对植物机体的伤害等[5]。因此研究植物对盐胁迫的生理机制,选育和培育耐盐的适生品种,对植物抗盐研究具有重要意义。目前,有关植物耐盐生理的研究主要集中在草本植物,例如碱蓬[6]、红花[7]、姜黄[8]、藜[9],也有少量木本植物[10-12]和海滨植物[13]的耐盐生理报道,而少见海滨园林植物的抗盐生理研究。龙船花Ixora chinensis、红背桂Excoecaria cochinchinensis、朱蕉Cordyline fruticosa是热带、亚热带地区重要的园林绿化植物,常种植于盐含量较高的海滨沙地。通过人工模拟干盐胁迫环境,测定其生理指标变化,研究其抗盐机理,可以为海滨绿化和沿海植被恢复提供参考。
1 材料与方法
1.1 试验材料
本研究的生理试验在广州市天河区华南农业大学林学与风景园林学院进行,试验所用幼苗包括龙船花、红背桂和朱蕉3种园林植物,均来自广州市普邦园林公司的1年生实生苗。3种幼苗的基本概况见表1。
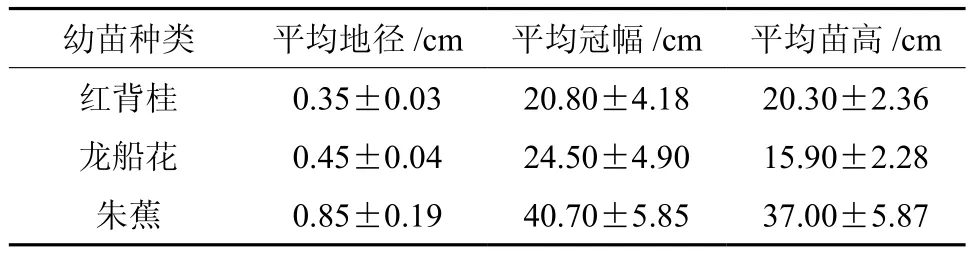
表1 3种幼苗的基本情况(平均值±标准差)Table 1 General growth characteristics of seedlings of the three species
1.2 试验方法
2015年5月底,将新进幼苗栽入规格为直径20 cm、高30 cm的营养袋,每盆定植1株。土壤为黄心土、荷兰土,以3∶1的比例混合。
使用NaCl溶液对3种幼苗进行盐分梯度设置:采用盐分和土壤干质量之比,设置0.3%和0.6%盐处理,以浇同样量的无离子水作为对照(CK)。花盆底部用托盘承接,人工控制水分,渗透水分及时返还花盆中,以确保盆中盐碱总量。加盐前进行适当的控水,以利于加盐后在干燥土壤中充分扩散。处理后定期浇灌少量水,以平衡蒸发量。
试验开始0 、15 、30 d测定幼苗的生理指标,每个指标的测定采用5株苗木为实验材料。试验的当天早晨8点,取试验植株从上到下的第3位至第8位完全展开的成熟叶,用自来水轻轻冲洗除去表面污物,再用蒸馏水冲洗2~3次后,用吸水纸轻轻吸干叶片表面水分,叶片除去中脉并剪碎混合均匀后制样,测定其生理指标,每个指标做3个重复。
1.3 生理指标的测定方法
用分光光度法测定叶绿素含量,用酸性茚三酮法测定脯氨酸含量,用氯化硝基四氮唑蓝(NBT)光化还原法测定超氧化物歧化酶(SOD)活性,用硫代巴比妥酸法(TBA)测定丙二醛(MDA)[14],用蒽酮比色法测定可溶性糖含量[15],用考马斯亮蓝法测定可溶性蛋白质含量[16]。
1.4 数据处理与分析
数据统计分析和作图由Microsoft Excel、SAS8.1软件系统完成。采用主成分分析方法综合评价生理指标,主成分累计贡献率达85 %以上来确定主成分个数[17-18]。
主成分分析前利用极差法对各指标数值进行标准化,生理指标的标准化公式为:

式中:X为标准化后所得数据;x为某项指标的原始数据;xmin为某项指标原始数据的最小值;xmax为某项指标原始数据的最大值。
用标准化后值的计算各个生理指标的得分,以得出3种苗木的抗盐能力排序。
2 结果与分析
2.1 盐胁迫对幼苗叶绿素含量的影响
在0.3%盐浓度的胁迫下,随着胁迫时间的延长,3种幼苗叶片的叶绿素含量递增。30 d时龙船花、红背桂以及朱蕉幼苗叶片的叶绿素含量分别比对照增加了64.25 %、147.36 %、76.42 %(见图1)。在0.6 %盐浓度处理下的龙船花和朱蕉幼苗叶片的叶绿素含量先升后降,红背桂持续上升,30 d时分别比对照增加了64.41 %、52.75 %和86.59 %(见图2)。
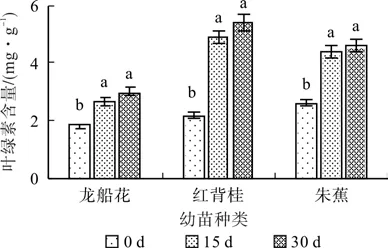
图1 0.3 %盐浓度对叶绿素含量的影响(平均值±SE)Fig. 1 Effect of 0.3% salt stress on chlorophyll content
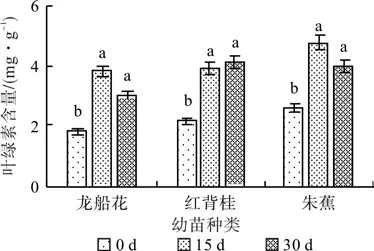
图2 0.6 %盐浓度对叶绿素含量的影响(平均值±SE)Fig. 2 Effect of 0.6% salt stress on chlorophyll content
2.2 盐胁迫对幼苗脯氨酸含量的影响
在0.3 %盐浓度的胁迫下,随着胁迫时间的延长,龙船花持续增加,朱蕉先降后升,红背桂持续下降。30 d时,龙船花幼苗叶片的脯氨酸含量比对照增加了26.36 %,红背桂与朱蕉分别下降了30.41 %与48.36 %(见图3);在0.6 %盐浓度的胁迫下,随着胁迫时间的延长,3种幼苗脯氨酸含量先升后降。30 d时龙船花及红背桂分别比对照增加了21.52 %与6.10 %,朱蕉比对照减少了75.35 %(见图4)。

图3 0.3%盐浓度对脯氨酸含量的影响(平均值±SE)Fig. 3 Effect of 0.3% salt stress on free proline content(mean±SE)

图4 0.6%盐浓度对脯氨酸含量的影响(平均值±SE)Fig. 4 Effect of 0.6% salt stress on free proline content(mean±SE)
2.3 盐胁迫对幼苗可溶性糖含量的影响
盐胁迫对3种园林植物幼苗可溶性糖含量的影响见图5与6。在0.3 %盐浓度的胁迫下,15 d时龙船花几乎不变,红背桂略有上升,但差异不显著,朱焦蕉稍有下降,差异也不明显,30 d时大幅度上升,分别比对照增加了276.44%、221.11%和103.46%(见图5);在0.6%盐浓度的胁迫下,龙船花与红背桂持续递增,朱蕉先升后降,30 d 时分别比对照增加了186.58%、476.17%和97.41%(见图6)。

图5 0.3%盐浓度对可溶性糖含量的影响(平均值±SE)Fig. 5 Effect of 0.3% salt stress on soluble sugar content(mean±SE)

图6 0.6%盐浓度对可溶性糖含量的影响(平均值±SE)Fig. 6 Effect of 0.6% salt stress on soluble sugar content(mean±SE)
2.4 盐胁迫对幼苗可溶性蛋白含量的影响
在0.3 %盐浓度的胁迫下,随着胁迫时间的延长,龙船花与红背桂持续递增,朱蕉先升后降,30 d时分别比对照增加了120.69%、73.27%和30.92%(见图7);在0.6 %盐浓度的胁迫下,随着胁迫时间的延长,龙船花先升后降,红背桂与朱蕉持续递增,30 d时分别比对照增加了79.63%、86.93%和161.81%(见图8)。
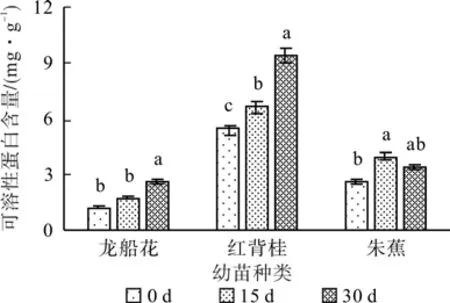
图7 0.3%盐浓度对可溶性蛋白含量的影响(平均值±SE)Fig. 7 Effect of 0.3% salt stress on soluble protein content(mean±SE)

图8 0.6%盐浓度对可溶性蛋白含量的影响(平均值±SE)Fig. 8 Effect of 0.6% salt stress on soluble protein content(mean±SE)
2.5 盐胁迫对幼苗超氧化物歧化酶活性的影响
在0.3 %盐浓度的胁迫下,随着胁迫时间的延长,龙船花与朱蕉幼苗叶片的SOD活性上升后保持稳定,红背桂小幅波动,30 d时分别比对照增加了113.24%、22.94%和9.03%(见图9);在0.6%盐浓度的胁迫下,3种幼苗的SOD先升后降,30 d时龙船花、红背桂以及朱蕉幼苗叶片的SOD含量分别比对照增加了82.96%、1.48%和4.01%(见图10)。
2.6 盐胁迫对幼苗丙二醛含量的影响
在0.3%盐浓度的胁迫下,随着胁迫时间的延长,龙船花先升后降,红背桂先降后升,朱蕉的MDA含量持续递增, 30 d时分别比对照增加了6.36%、18.03%和246.04%(见图11)。在0.6%盐浓度的胁迫下,随着胁迫时间的延长,龙船花的MDA含量持续递增,红背桂先降后升,朱蕉上升后波动,30 d时龙船花与朱蕉幼苗的MDA含量分别比对照增加了622.05%和24.95%,红背桂减少了93.32 %(见图12)。
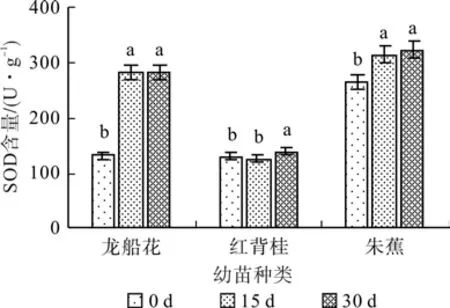
图9 0.3%盐浓度对SOD活性的影响(平均值±SE)Fig. 9 Effect of 0.3% salt stress on SOD activity content(mean±SE)

图10 0.6%盐浓度对SOD活性的影响(平均值±SE)Fig. 10 Effect of 0.6% salt stress on SOD activity content(mean±SE)
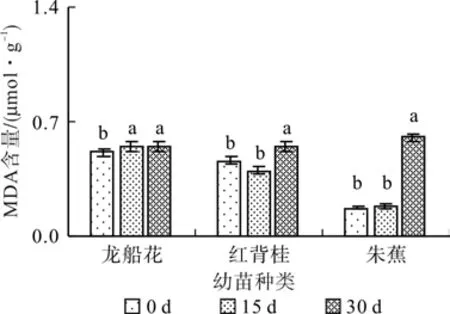
图11 0.3%盐浓度对丙二醛含量的影响(平均值±SE)Fig. 11 Effect of 0.3% salt stress on the content of MDA(mean±SE)
2.7 主成分分析法对3种植物抗盐性的综合评价
由表2可知,在0.3 %和0.6 %盐浓度胁迫下,3种植株幼苗的生理指标抗盐性均为红背桂>朱蕉>龙船花。

图12 0.6%盐浓度对丙二醛含量的影响(平均值±SE)Fig. 12 Effect of 0.6% salt stress on the content of MDA(mean±SE)
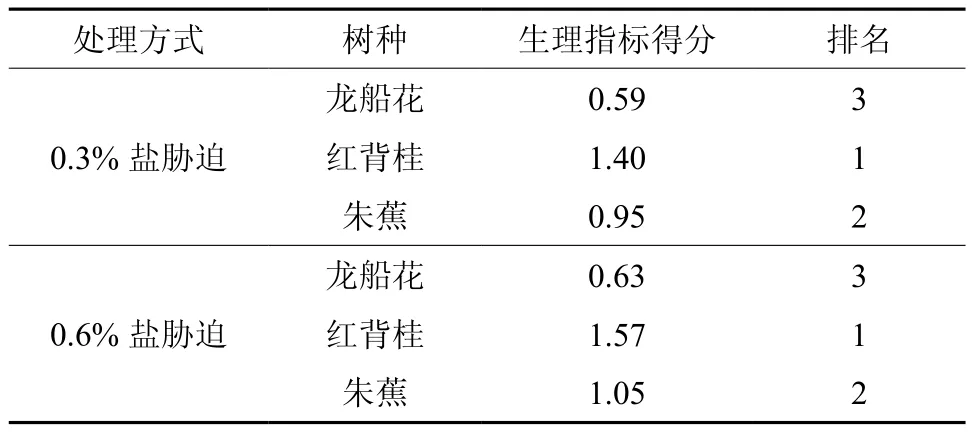
表2 盐胁迫的生理指标的主成分分析结果Table 2 Principal component analysis on the effect of salt stress on physiological indicators
3 结论与讨论
3.1 植物抗盐性与叶绿素
叶绿素在植物光合作用中具有接受和转换光能的作用,影响绿色植物的光合能力。本研究中,在0.3%的低盐浓度下,随着盐胁迫时间的延长,3种植物的叶绿素含量增加,说明这些植物通过提高叶绿素的合成,增强叶片的光合作用以适应盐胁迫[2],这些植物幼苗在低浓度的盐胁迫下表现出对盐的适应性。在0.6%的高盐浓度下,红背桂的叶绿素含量增加,龙船花和朱蕉的叶绿素含量先升后降,可能是高盐浓度下后二者细胞中叶绿素和叶绿体蛋白的解离,引起叶绿素酶活性下降,导致叶绿素分解[19]。在0.6 %盐浓度的胁迫下, 3种园林植物幼苗15 d时的叶绿素含量均高于对照组,说明幼苗初期表现出对高浓度盐的适应,而龙船花和朱蕉30 d时的叶绿素含量下降;表明随着时间的延长,会受到高浓度盐的伤害,抑制了叶绿素的合成。
3.2 植物抗盐性与脯氨酸
脯氨酸是一种细胞质的渗透调节物质,有助于防止细胞因脱水而死亡,还是蛋白质、酶、细胞结构的保护剂,可以稳定生物蛋白结构,防止酶变性失活,因而可以提高植物对盐碱地的抵抗力[20]。在0.3%盐浓度的胁迫下,3种植株苗叶片的脯氨酸含量变化不规律,可能是该浓度的盐不足以造成脯氨酸的显著变化。在0.6%盐浓度的胁迫下,3种植物的脯氨酸含量先升后降,说明植物在盐胁迫早期通过脯氨酸的积累缓解盐胁迫对幼苗造成的伤害[21]。盐胁迫后期脯氨酸含量下降,说明幼苗可能受到盐分的伤害,导致脯氨酸积累能力的下降。
3.3 植物抗盐性与可溶性糖
可溶性糖作为植物体内的调节物质,在逆境胁迫的情况下,会在植物体内大量积累,用于减少外界对植物造成的伤害[22],还中和大量的Na+以避免离子伤害[23]。本研究中,0.3%盐浓度的3种幼苗和0.6%盐浓度处理的,龙船花和红背桂的可溶性糖含量随着盐胁迫时间的延长持续上升,有利于减少盐胁迫对幼苗的伤害。0.6%盐浓度下朱蕉的可溶性糖的含量先升后降,说明高盐胁迫抑制了朱蕉的可溶性糖积累,这可能是大量的Na+和高pH值的共同作用破坏了光系统结构,造成了光合能力降低,影响碳同化过程[24]。
3.4 植物抗盐性与可溶性蛋白
可溶性蛋白作为渗透调节物质参与各种代谢、能量和信息传递。盐胁迫迫会抑制植物蛋白合成,但也会诱导产生新的蛋白或增加原有蛋白含量[25-26],以适应盐渍环境[27]。本研究中,0.3%盐浓度胁迫下,龙船花和红背桂叶片的可溶性蛋白质含量持续递增,0.6%盐浓度胁迫下,红背桂和朱蕉幼苗的可溶性蛋白质含量持续递增,有利于这些幼苗的抗盐。0.3%盐浓度胁迫下,朱蕉叶片的可溶性蛋白质含量先升后降,可能是盐胁迫强度不足以诱导逆境蛋白的形成。0.6%盐浓度胁迫下,龙船花幼苗的可溶性蛋白含量先升后降,表明高浓度盐胁迫会使龙船花的蛋白表达量下降[28]。
3.5 植物抗盐性与超氧化物歧化酶活性
超氧化物歧化酶(SOD)在清除超氧离子、抵御膜脂的过氧化、减轻质膜受损等方面起着重要作用[2]。0.3%盐浓度的胁迫下,3种幼苗的SOD活性随着胁迫时间的延长而上升,说明该盐浓度下,幼苗能通过提高SOD活性来清除多余的活性氧,维持活性氧代谢平衡和保护膜结构[29]。在0.6%盐浓度胁迫下,3种幼苗的SOD活性先升后降,说明幼苗在试验前期表现出抗盐,随着时间的延长,其活性氧水平超过盐胁迫下植物细胞所能忍受的阈值[30],使得细胞受到损伤,SOD 活性受到抑制。
3.6 植物抗盐性与丙二醛
丙二醛(MDA)是膜脂过氧化的主要产物之一,其积累是自由基破坏细胞膜结构的结果, MDA含量是逆境条件下细胞膜受损程度的反应,也表示植物对逆境条件反应的强弱[31]。0.3%盐浓度胁迫前期,3种幼苗的MDA含量变化较小,后期红背桂与朱蕉幼苗的MDA含量急剧增加,表明SOD活性的显著提高未能有效清除产生的过多活性氧,造成了活性氧代谢的失调[9]。大量实验研究表明,丙二醛含量随着盐胁迫浓度的增加会有不同程度的增加[32]。0.6%浓度盐胁迫下,龙船花和朱蕉的MDA含量上升,说明其抗盐能力弱[33]。红背桂的MDA含量先降后升,说明红背桂对盐分耐受能力较强。
[1]蔺 娟,地里拜尔·苏力坦.土壤盐渍化的研究进展[J].新疆大学学报(自然科学版),2007, 24(3): 318-323.
[2]朱金方,刘京涛,陆兆华,等.盐胁迫对中国柽柳幼苗生理特性的影响[J].生态学报,2015, 35(15) : 5140-5146.
[3]王佳丽,黄贤金,钟太洋,等. 盐碱地可持续利用研究综述[J].地理学报,2011, 66(5) : 673-684.
[4]刘 茂,王雪梅,陈波浪, 等. 库尔勒市香梨园土壤肥力评价[J]. 经济林研究, 2015, 33(3): 93-98.
[5]吴 敏,薛 立,李 燕.植物盐胁迫适应机制研究进展[J].林业科学, 2007, 43(8):111-117.
[6]张爱琴,庞秋颖,阎秀峰.碱蓬属植物耐盐机理研究进展[J].生态学报, 2013, 33(12): 3575-3583.
[7]韩 宇,生艳菲,罗 茜,等.药用红花幼苗对盐胁迫的生理响应机制[J]. 生态学杂志, 2014, 33(7):1833-1838.
[8]杨 晨,刘建福,王明元,等. NaCl胁迫对姜黄组培苗生理特性的影响[J]. 生态学杂志,2014, 33(2): 388-393.
[9]李晓荣,姚世响,陈莎莎,等.藜异型性种子后代植株盐响应生理机制[J].生态学报,2015, 35(24) : 8139-8147.
[10]李玉梅,郭修武,代汉萍, 等. 盐碱胁迫对牛叠肚幼苗渗透调节物质及叶绿素含量的影响[J].经济林研究,2015,33(1):9-16.
[11]胡举伟,张慧会,孙广玉. Na2CO3胁迫对青龙桑、蒙古桑叶片生理和叶片光系统Ⅱ活力的影响[J]. 中南林业科技大学学报,2015, 35(5): 51-58.
[12]路 斌, 侯月敏, 李欣洋,等.野皂荚对NaCl胁迫的生理响应及耐盐性[J]. 应用生态学报, 2015, 26(11): 3293-3299.
[13]杨成龙, 段瑞军, 李瑞梅,等.盐生植物海马齿耐盐的生理特性[J]. 生态学报, 2010, 30(17):4617-4627.
[14]陈建勋, 王晓峰.植物生理学实验指导[M]. 广州:华南理工大学出版社, 2002.
[15]高俊凤.植物生理学实验指导[M]. 北京:高等教育出版社,2006.
[16]李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版, 2000.
[17]冯慧芳, 薛 立, 任向荣, 等. 4种阔叶幼苗对PEG模拟干旱的生理响应[J]. 生态学报, 2011, 31(2): 371-382.
[18]邵怡若,许建新,薛 立,等.低温胁迫时间对4种幼苗生理生化及光合特性的影响[J]. 生态学报,2013,33(14):4237-4247.
[19]景 璐,刘 涛,白玉娥.草本园林植物耐盐性研究进展[J].中国农学通报, 2011, 27(13):284-289.
[20]王 波,宋凤斌.燕麦对盐碱胁迫的反应和适应性[J]. 生态环境, 2006, 15(3):625-629.
[21]Santa-Cruz A, Acosta M, Rus A,et al.Short-term salt tolerance mechanisms in differentially salt tolerant tomato species[J]. Plant Physiology Biochemistry, 1999, 37: 65-71.
[22]翁森红.牧草耐盐性鉴定指标和方法的初步研究[D].北京:中国农业科学院, 1990.
[23]Gao Z H, Xue Y B, Dai J R. cDNA-AFLP analysis reveals that maize resistance toBipolaris maydisis associated with the induction of multiple defense-related genes[J]. Chinese Science Bulletin, 2001, 46: 1454-1458.
[24]Guo R, Zhou J, Hao W P,et al.Germination, growth,photosynthesis and ionic balance inSetaria viridisseedlings subjected to saline and alkaline stress[J]. Canadian Journal of Plant Science, 2011, 91: 1077-1088.
[25]毛桂莲, 哈新芳,孙 婕,等. NaCl胁迫下枸杞愈伤组织可溶性蛋白含量的变化[J]. 宁夏大学学报(自然科学版), 2005,26(1): 64-66.
[26]Xu H X, Zhang X ,Wang S M,et al.Genetic diversity ofAchnatherum splendens[J]. Agricultural Science & Technology,2008, 9: 24-28.
[27]周 婵,邹志远,杨允菲.盐碱胁迫对羊草可溶性蛋白质含量的影响[J]. 东北师大学报(自然科学版), 2009, 41(3): 94-96.
[28]刘凤歧, 刘杰淋, 朱瑞芬, 等. 4种燕麦对NaCl胁迫的生理响应及耐盐性评价[J]. 草业学报, 2015, 24(1): 183-189.
[29]宋福南,杨传平,刘雪梅,等.盐胁迫对柽柳超氧化物歧化酶活性的影响[J].东北林业大学学报,2006, 34(3): 54-56.
[30]彭立新,周黎君,冯 涛,等.盐胁迫对沙枣幼苗抗氧化酶活性和膜脂过氧化的影响[J].天津农学院学报, 2009,16(4):1-4.
[31]廖宝文,邱凤英,张留恩,等.盐度对尖瓣海莲幼苗生长及其生理生态特性的影响[J].生态学报,2010, 30( 23) : 6363-6371.
[32]袁 琳, 克热木·伊力, 张利权. NaCl胁迫对阿月浑子实生苗活性氧代谢与细胞膜稳定性的影响[J]. 植物生态学报, 2005,29(6): 985-991,
[33]李婧男,刘 强,贾志宽,等. 盐胁迫对沙冬青幼苗生长与生理特性的影响[J].植物研究, 2009, 29(5): 553-558.
[本文编校:谢荣秀]
Effect of salt stress on physiological characteristics of garden plants of three species
ZHENG Xinying1, LI Pengfei2, XUE Li1, MAI Ningjun2, CAI Jinhuan1, LI Qiujing2
(1.College of Forestry and Landscape Architecture, South China Agricultural University, Guangzhou 510642, Guangdong, China;2.Pubang Landscape Architecture Co Lt, Guangzhou 510642, Guangdong, China)
Salt-tolerance and physiological responses ofIxora chinensis,Excoecaria cochinchinensisandCordyline fruticosawere evaluated under salt stress to explore the salt-tolerance of garden plants, which might be useful for selecting salt-tolerant garden plants.The physiological indexes of the three species were measured under salt stress of 0%, 0.3% and 0.6% NaCl in the soil. Their salt resistance was evaluated using principal component analysis method. The results showed that at 0.3% salt concentration, the chlorophyll content, soluble sugar content and SOD activity of seedlings of the three species tended to increase with increasing time of salt stress;Protein content ofI. chinensisincreased, that ofE. cochinchinensisdecreased, whereas that ofC. fruticosadecreased followed by an increase; Protein content ofI. chinensisandE. cochinchinensisseedlings continuously increased, and that ofC. fruticosaincreased followed by a decrease; MDA content ofI. chinensisandC. fruticosatended to increase whereas that ofE. cochinchinensisdecreased followed by an increase. At 0.6% salt concentration, chlorophyll content ofI. chinensisandC. fruticosaincreased and then decreased,whereas that ofE. cochinchinensisincreased; Poline content and SOD activity of seedlings of the three species increased and then decreased; soluble sugar content ofI. chinensiandE. cochinchinensisincreased, whereas that ofC. fruticosaincreased and then decreased; soluble protein content ofI. chinensiincreased and then decreased and that for other species increased; MDA content ofI.chinensiscontinuously increased, that ofE. cochinchinensisdecreased followed by an increase, and that ofC. fruticosapresented a trend of increase and then decrease. Principal component analysis was used to evaluate physiological indexes, and the results showed that at 0.3%and 0.6% salt concentration, physiological index score of seedlings of the three species decreased in the order ofE. cochinchinensis>C. fruticosa>I. chinensis, Remarkable variations in salt tolerance were detected among the three species, which would provide a basis for utilization of salt tolerant garden plants.
salt stress; physiological index; principal component analysis; seedling
S718.43;Q945.78
A
1673-923X(2017)09-0062-06
10.14067/j.cnki.1673-923x.2017.09.011
2016-09-20
广州市科技项目(2014SY000010);中央财政林业科技推广示范项目“广东省生态公益林培育技术推广”(2015-GDTK-07)
郑欣颖,硕士研究生
薛 立,教授,博士,博士生导师;E-mail:forxue@scau.edu.cn
郑欣颖,李鹏飞,薛 立,等. 3种园林植物的抗盐生理研究[J].中南林业科技大学学报,2017, 37(9): 62-67.

