大黄鱼(Pseudosciaena crocea)leptin和cholecystokinin基因的克隆和表达特性研究*
刘立芹 王茂廷 崔文涛 刘 婉 吕振明 龚 理杨静文 董迎辉
(1.浙江海洋大学 海洋生物种质资源发掘与利用国家地方联合工程实验室 舟山 316022;2.浙江万里学院 浙江省水产种质资源高效利用技术研究重点实验室 宁波 315100)
大黄鱼(Pseudosciaena crocea)leptin和cholecystokinin基因的克隆和表达特性研究*
刘立芹1王茂廷1崔文涛1刘 婉1吕振明1龚 理1杨静文1董迎辉2①
(1.浙江海洋大学 海洋生物种质资源发掘与利用国家地方联合工程实验室 舟山 316022;2.浙江万里学院 浙江省水产种质资源高效利用技术研究重点实验室 宁波 315100)
本文克隆了两种大黄鱼(Pseudosciaena crocea)摄食调控因子胆囊收缩素(CCK)、瘦素(LEP)基因的全长序列,并对其表达特性进行了研究。结果表明,克隆得到CCK基因属硬骨鱼类的CCK1亚家族,全长900nt,编码137个氨基酸,与其他鱼类的CCK1相比序列组成非常保守,特别是在20氨基酸的信号肽和8个氨基酸的CCK-8活性结构区域;而克隆得到LEP基因属硬骨鱼类的LEPA亚家族,全长1290nt,编码161个氨基酸,与其他鱼类LEP相比基因同源性较差,但在3D结构上却保留了LEP经典的4个α螺旋特征。两种因子在所检测的所有组织中均有表达,但尤以脑、胃、肠消化道、肝脏等摄食及能量平衡相关组织中表达活性最高。8天的饥饿能使大黄鱼脑、消化道组织的CCK和肝脏、脂肪组织中的LEP表达显著降低(P<0.05)。该结果说明CCK和LEP可能在大黄鱼的摄食生理和能量平衡中起着重要的调控作用;本研究将为深入了解鱼类食欲调控的神经内分泌机理提供基础。
大黄鱼;瘦素;胆囊收缩素;基因克隆;表达
与其他高等脊椎动物一样,鱼类的摄食活动是受大脑和外周系统间复杂的信号反馈机制来调控的(De Pedroet al,2001)。在高等动物的下丘脑中存在着一个被称为“摄食中枢”的特殊区域,该区域主要接收外周系统如消化道系统的神经内分泌信号从而控制动物的食欲(MacDonaldet al,2009)。而这种外周系统分泌信号多种多样,即包括胃肠道分泌的胆囊收缩素(CCK),神经肽(PYY);也包括胰脏组织分泌的胰高血糖素(GLP-1)和胰脏 B细胞分泌的胰岛素;同时还包括脂肪组织分泌的瘦素(LEP)等多种因子(Volkoffet al,2005)。所有这些信号因子可通过迷走神经上的受体或通过血液直接到达大脑传达动物摄食和能量状态从而控制其食欲(Terovaet al,2008)。此外,大脑本身也可直接合成一些多肽类物质作为中枢神经信号调控食欲,从而与外周信号一起构成了复杂的动物食欲调控互作网络(Kontureket al,2003)。
在诸多的食欲调控因子中,胃肠道分泌的胆囊收缩素(CCK)是其中最重要的一种。在哺乳动物中,CCK主要起着减缓胃排空,促进胆囊收缩和胃、胰脏分泌,减少摄食活动的作用(Rehfeldet al,2007)。直到最近几年,鱼类的CCK基因才得以成功克隆(Fenget al,2012)。不同形式的CCK,包括CCK-8,被证实在鱼类的摄食活动中起着关键的调控作用。如在鲇鱼Ictalurus punctatus(Petersonet al,2012)和金鱼Carassius auratus(Peyonet al,1999)中,CCKmRNA表达在摄食后迅速增加,从而抑制食物的进一步摄入。在金鱼的脑部或腹部中注射 CCK-8能明显抑制食物的摄取(Himicket al,1994)。在欧洲鲈Dicentrarchus labrax中,口服CCK可迅速减少食物的摄取,而该效应可被 CCK专一性的抑制剂丙谷胺阻断(Rubioet al,2008)。类似的结果还在虹鳟Oncorhynchus mykiss(Gélineauet al,2001)和斑点叉尾Ictalurus punctatus(Silversteinet al,2000)中得到证实。但至今,有关 CCK在鱼类食欲调控和能量平衡中的作用仍未得到充分阐述。
由脂肪组织分泌的瘦素(LEP)也是一种重要的食欲调控因子(Zhanget al,1994)。在哺乳动物中,瘦素是一个由167个氨基酸组成的16kDa的多肽,在动物的摄食和能量平衡的调控中也起着关键的作用(Wonet al,2012)。鱼类的LEP基因也是最近几年才得以成功克隆(Zhanget al,2013)。腹腔和脑室注射LEP可迅速减少金鱼的摄食(Volkoff,2003)。同样腹腔注射同源重组的 LEP可在几小时内迅速减弱虹鳟的摄食活动(Murashitaet al,2008)。此外,2—3个星期的饥饿可减少绿太阳鱼Lepomis cyanellus(Johnsonet al,2000)和欧洲鲈(Wonet al,2012)血清循环中的 LEP含量,表明 LEP可能通过哺乳动物类似的机制调控鱼类的摄食和能量平衡。
大黄鱼(Pseudosciaena crocea)是我国最重要的海水网箱养殖鱼类,属鲈形目(Perciformes)、石首鱼科(Sciaenidae)、黄鱼属(Pseudosciaena),曾是我国著名的“四大海产”之一。但20世纪70年代以来,由于过度捕捞和海域环境的变迁,其自然资源已严重衰竭(Sanget al,2007)。近年来,随着大黄鱼的规模化人工繁育和养殖技术的突破,中国沿海大黄鱼养殖产业迅速兴起,2010年我国沿海大黄鱼的养殖产量达到85808t,占当年全国海水鱼养殖产量的8% (农业部渔业局,2012)。为进一步提高大黄鱼的养殖产量,在养殖规模无法继续增长的情况下,如何提高养殖大黄鱼的摄食和饵料转化效率,加快养殖期内大黄鱼的有效生长不失是一种可行的手段,然而,养殖过大黄鱼的人可能都深有体会,大黄鱼摄食行为非常谨慎,有时让大黄鱼开口摄食都是一件非常困难的事情,因此对于大黄鱼摄食生理和调控机制的研究有重要意义。本文拟着重对大黄鱼两种重要的摄食调控相关因子CCK和LEP基因进行克隆,并对其在不同组织中的表达特性进行研究,探索饥饿等摄食和营养状态对其表达的影响,该研究可从一定角度了解 CCK和LEP与大黄鱼摄食调控的相关性,可为今后深入了解海洋鱼类的摄食调控机制提供基础。
1 材料与方法
1.1 材料
用于CCK和LEP基因克隆、组织特异性表达研究的大黄鱼(Pseudosciaena crocea)样本取自浙江海洋大学苍南越洋公司的养殖基地,为体重约 150g左右的1龄大黄鱼;活体解剖大黄鱼样本,取脑、肝脏、胃、肌肉、性腺(精巢)、心脏、前肠、脾脏、脂肪(肠系膜脂)等组织,用液氮保存备用。用于饥饿实验的大黄鱼样本同样取自于该实验基地,将 100尾同规格(体重150g左右)的1龄大黄鱼平均分为两组,正常投喂(一日两次鱼糜),经两周的适应后开始正式实验。一组设为饥饿处理组,停止投喂任何饵料;一组仍为正常投喂的对照组。两组鱼均养殖于基地的渔排中,养殖水温25ºC。经8天的实验后,活体解剖实验组和对照组的样本,取脑、胃、肝脏、脂肪等组织,液氮保存后备用。
1.2 方法
1.2.1 CCK和LEP基因的克隆 大黄鱼肝脏和胃中总 RNA的提取采用 Trizol RNA提取试剂盒(Invitrogen,Carlsbad,CA,USA)参照说明书的方法进行。提取的 RNA经 Nanodrop ND-2000 (Thermo Electrom Corporation,USA)分光光度计定量和琼脂糖电泳检测后,用 Dnase I (Invitrogen,Carlsbad,CA,USA)去处多余的 DNA,纯化的 RNA用反转录试剂盒(Invitrogen,USA)反转为cDNA第一链后,以反转录cDNA为模板,以GenBank中脊椎动物的CCK和LEP保守序列设计引物(表1),扩增大黄鱼 CCK和LEP的核心片断。PCR扩增采用25µL反应体系进行,内含 100ng 模板 cDNA、1×buffer、2.0mmol/L MgCl2、0.2µmol/L各种引物、0.2mmol/L dNTPs和4.0U的TaqDNA聚合酶(Promega,USA)。PCR反应条件为:94ºC预变性 5min,然后 94ºC变性 30s,50ºC 退火 30s,72ºC延伸 30s,35个循环,最后 72ºC延伸 10min。PCR产物经pGEM-T载体(Promega,USA)克隆后送公司双向测序。CCK和LEP的全长序列参照Sambrook等(2001)的 3′ RACE 和5′ RACE 方法扩增。其基本过程如下:根据已获得 CCK 和LEP核心片断设计 3′RACE 上游引物和5′ RACE 下游引物(表1),以SMARTTMRACE试剂盒(Clontech,Palo Alto,CA,USA)反转录合成的 cDNA 第一链为模板,用 3′RACE和5′ RACE引物与SMARTTMRACE试剂盒自带的通用引物配对,并参照试剂盒说明书进行CCK和LEP 3′和5′端序列的扩增。所有的PCR扩增产物克隆到 pGEM-T载体(Promega,USA)后,送公司进行双向测序。

表1 大黄鱼CCK和LEP基因克隆和表达所用引物Tab.1 Primers used for CCK and LEP gene cloning and expression
1.2.2 序列特征与系统进化 将获得的 CCK和LEP全长序列与GenBank中的基因序列进行BLAST比对,分析其同源性;采用 ORF finder server(www.ncbi.nlm.nih.gov/gorf/gorf.html)中的软件确定基因的开放阅读框,采用 SignalP Ver.3.0软件(http://www.cbs.dtu.dk/services/SignalP/)对两种基因的信号肽位点进行识别。采用 SWISS-MODEL(http://swissmodel.expasy.org/SWISS-MODEL.html)程序对基因编码蛋白的可能三维结构进行预测。采用Clustal W 程序将大黄鱼与其他脊椎动物的 CCK和LEP基因序列进行比对,采用 Mega 3.1软件采用Neighbor-Joining法进行系统树的构建,并采用bootstrap重复抽样1000次检验聚类树各分支置信度。
1.3 CCK和LEP基因的组织表达研究
1.3.1 半定量RT-PCR分析 取大黄鱼脑、肝脏、胃、肌肉、性腺(精巢)、心脏、前肠、脾脏、脂肪(肠系膜脂)等9种组织,经同上方法提取和纯化RNA后,取2µg RNA反转录成cDNA后,用CCK和LEP特异性引物(见表1)对各组织中的两种基因进行扩增,以β-actin基因作为内参,检测各组织中基因的表达量,β-actin基因的扩增引物见表1。PCR扩增采用上述20µL 的反应体系,具体反应条件为,94ºC 预变性5min,然后 94ºC 变性 30s,50ºC 退火 30s,72ºC 延伸30s,40个循环,最后72ºC 延伸10min。PCR产物采用 2.0%的琼脂糖电泳检测,并用凝胶成像系统(BIORAD)进行拍照记录。
1.3.2 实时荧光定量qRT-PCR分析 再次取大黄鱼上述9种组织,提取和纯化的RNA经反转录合成第一链 cDNA后,用 CCK和LEP特异性引物(见表1)进行各组织基因表达的实时定量 qRT-PCR扩增,PCR扩增采用上述 20µL的反应体系,内含 10µL的SYBR荧光染料预混extaq酶(TaKaRa),100ng第一链cDNA,0.2µmol/L双向引物。扩增反应条件为94ºC预变性 5min,然后 94ºC 变性 30s,50ºC 退火 30s,72ºC延伸30s,40个循环,最后72ºC延伸10min。以β-actin为内参,荧光定量PCR数据分析采用相对2-ΔΔCt法计算,每种组织基因表达量以 5个样本(5尾鱼)的均值来确定;随机选择一个组织设定其基因表达量为100%,其他组织的表达量则以相对于该组织的相对表达量为计。
1.4 饥饿对CCK和LEP基因表达的影响
选取CCK表达较为丰富的脑、胃组织和LEP表达较为丰富的肝、脂肪组织为研究重点,研究饥饿对两种基因表达的影响。分别提取饥饿组和对照组大黄鱼上述组织的RNA,经反转录为cDNA后,采用同上qPCR法检测各组织CCK和LEP基因的表达量。荧光定量PCR数据分析采用相对2–ΔΔCt法计算,每种组织基因表达量以 5个样本(5尾鱼)的均值来确定,各组织的表达量仍以相对表达量为计。
1.5 数据统计与分析
采用SPSS19.0软件对各项数据进行统计和分析,所有数据均采用均值加减标准差(X±S)的形式进行表述,比较各组织或各处理组间基因表达量的差异,并用T检验进行差异的显著性分析。采用双尾法进行显著性检验,当P<0.05时表示两组间有显著性差异,当P<0.01表示两组间有极显著性差异。
2 结果
2.1 大黄鱼CCK和LEP基因全长序列特征分析
2.1.1 CCK基因 通过RACE PCR克隆到了一条总长为900nt的大黄鱼 CCK序列(GenBank登录号:AGR51146.1),含 166nt的 5′端非编码区(5′-UTR),411nt的开放阅读框和326nt的3′端非编码区(内含终止密码子TAA和一个加尾信号AATAAA)(如图1所示)。该序列编码一条137个氨基酸的多肽,内含有一条20氨基酸的信号肽序列和一条C末端的八肽序列(CCK-8:DYVGWMDF)。同源比对表明,大黄鱼CCK氨基酸序列组成与美国红鱼Sciaenops ocellatus(96%)、鰤鱼Seriola quinqueradiata(89%)、牙鲆Paralichthys olivaceus(84%)和美洲拟鲽Pseudopleuronectes americanus的 CCK同源性最高(图2),聚类分析表明(图3),克隆得到的大黄鱼的CCK与鱼类的 CCK1亚类聚为一支,而与鱼类的CCK2亚类相距较远,表明克隆到的大黄鱼 CCK基因应该属于CCK1亚类。
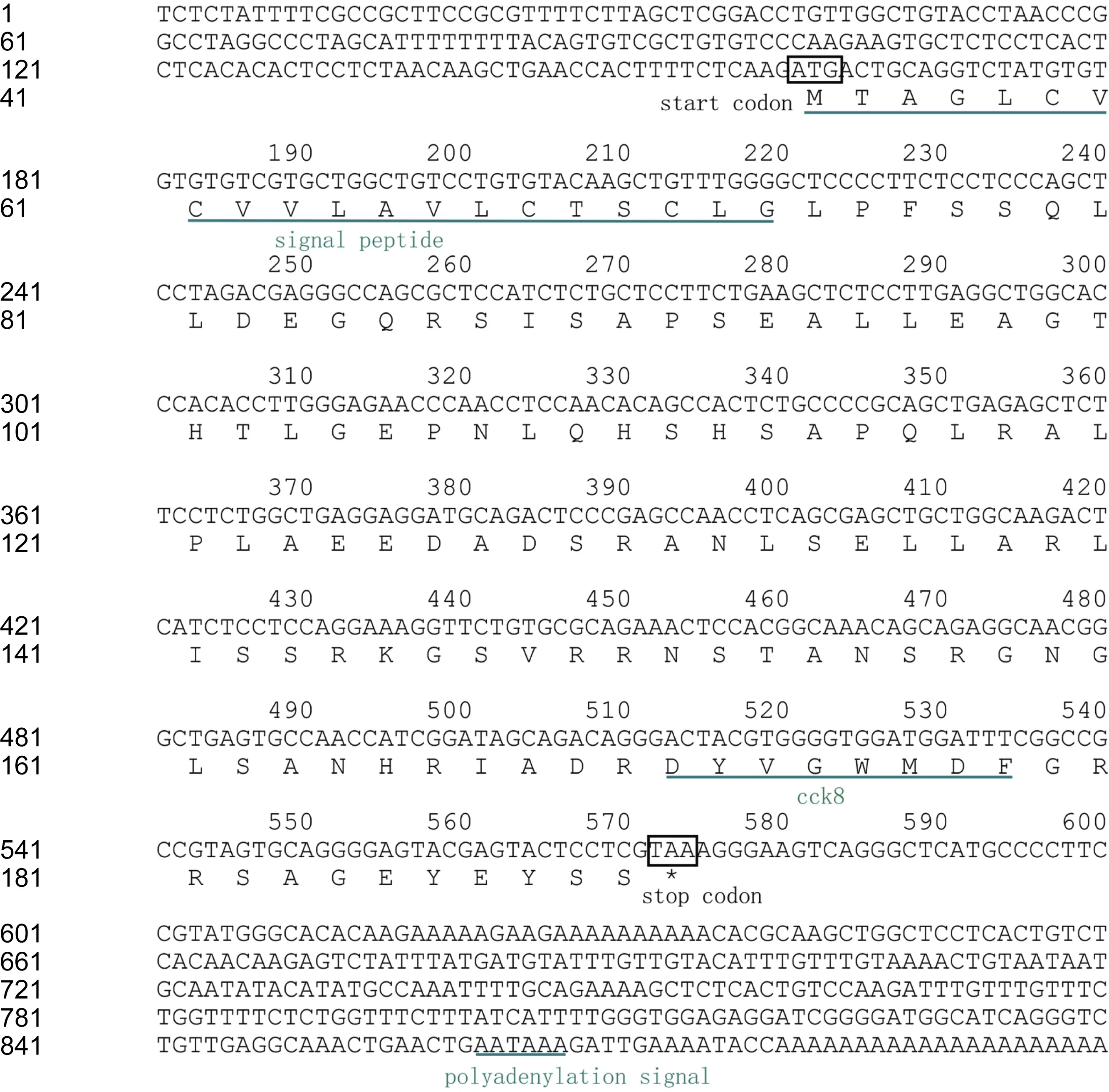
图1 大黄鱼的CCK基因序列特征Fig.1 The characteristics of CCK gene in large yellow croaker P.crocea

图2 大黄鱼与其他鱼类的CCK氨基酸序列比对结果Fig.2 Alignment of the CCK amino acid sequences from large yellow croaker P.crocea with that from other teleost fish
2.1.2 LEP基因 通过RACE PCR克隆到一条长为1290nt的 LEP全长序列(GenBank登陆号:AGR51148.1),该序列含 142nt 的 5’端非编码区,486nt的开放阅读框和662nt的3’端非编码区(内含有一段加尾信号序列 AATAAA和一个 poly A的尾巴)(图4)。该序列编码一条161氨基酸的多肽,内含一条20个氨基酸残基的信号肽序列。相对于CCK,大黄鱼 LEP的保守性相对较弱,其中与斜带石斑鱼Epinephelus coioides的同源性最高,达82%,其次与条纹鲈Morone saxatilis的同源性达75%,而与其他鱼类的同源性均在50%以下(图5)。与人的同源性则更低。但3D结构预测分析表明,大黄鱼的LEP多肽的三维结构则相当保守,含 4个 α螺旋的经典结构,甚至与人类的LEP 3D结构也高度相似(图6),显示了大黄鱼LEP结构在进化上的保守性。聚类分析表明,鱼类的 LEP基因与其他脊椎动物相距较远而单独成支,鱼类的LEP也有两个亚类LEPA、LEPB,其中大黄鱼的LEP与鱼类的LEPA亚类聚为一支,表明克隆到的大黄鱼LEP基因应属于LEPA亚类。
2.2 CCK和LEP基因的组织特性表达分析
采用半定量RT-PCR对大黄鱼9种组织中CCK和LEP基因的表达进行研究,结果表明,CCK在所检测的全部9种组织中均有表达。相对而言,CCK在脑、胃、前肠、性腺(精巢)、心脏及脂肪组织中表达较高,而在肝脏、肌肉、脾脏中表达较低(图8A)。LEP同样在所有组织中均有表达,但其在肝脏、前肠组织中表达最高,而在其他组织中表达相对较低(图8A)。实时定量qRT-PCR也给出了类似的结果,CCK在脑、胃和前肠中表达最高,然后依次是性腺(精巢)、脂肪、心脏、肝脏、肌肉和脾脏;其中脑、胃和前肠中CCK表达量是其他组织的两倍以上(图8B)。LEP在肝脏中的表达最高,然后依次为前肠、脂肪及其他组织,肝脏中 LEP表达量是其他组织的 8倍以上(图8B)。由于CCK在脑和胃中表达较高,而LEP在肝脏和脂肪表达较高,因此我们选取这4种组织用于后续的饥饿实验。

图3 大黄鱼CCK基因的系统进化分析Fig.3 Phylogenetic analysis of CCK from large yellow croaker P.crocea
2.3 饥饿对大黄鱼CCK和LEP基因表达的影响
为进一步验证两种多肽与摄食调控及能量平衡的相关性,本研究还开展了饥饿对两基因表达的影响。结果表明,8天的饥饿可造成大黄鱼脑和胃中CCK基因表达量相对于对照组的显著下降(P<0.05)(图9),其中脑中 CCK表达量下降幅度比胃中更明显。同样,8天的饥饿也可造成大黄鱼肝脏和脂肪组织中 LEP基因表达量相对于对照组的显著下降(P<0.05),这种降低在肝脏中表现得比在脂肪中更为显著,如图9所示。
3 讨论
3.1 大黄鱼CCK、LEP基因的序列特征与分子进化

图4 大黄鱼LEP基因的序列特征Fig.4 The characteristics of LEP gene in large yellow croaker P.crocea

本文首次克隆了的两种大黄鱼的摄食调控因子CCK和LEP基因的全长序列,通过GenBank等数据库的同源比对和blast搜索,结果表明,克隆得到的大黄鱼CCK和LEP与其他鱼类有着较高的同源性。特别是 CCK基因序列,大黄鱼的 CCK与美国红鱼(Webbet al,2010)、鰤鱼(Murashitaet al,2007)、牙鲆(Suzukiet al,1999)、美洲拟鲽(MacDonaldet al,2009)等的同源性高达80%以上,如图2所示,表明鱼类的CCK保守性相对较强。信号肽和CCK-8区域是CCK中最为保守的区域,如图2所示,大黄鱼20个氨基酸的信号肽区域与美国红鱼(Webbet al,2010)、牙鲆(Suzukiet al,1999)的同源性高达 100%和95%。GenBank(AB205406)中的鰤鱼的 CCK信号肽序列尽管不完全,但已获得的 14个氨基酸的信号肽序列与大黄鱼的同源性也高达100%。同样大黄鱼的CCK-8区域也与大多数鱼类的高度同源,仅在第6位(从 C端)氨基酸上存在部分替代,如大西洋鲱中该位点是甲硫氨酸(Met)(Kamisakaet al,2005),而在金鱼(Peyonet al,1998)和牙鲆(Suzukiet al,1999)中该位点由亮氨酸(Leu)取代,而在虹鳟(Jensenet al,2001)中该位点为亮氨酸(Leu)、精氨酸(Asp)或苏氨酸(Thr)。信号肽及 CCK-8区域的保守性可能暗示这些区域在鱼类 CCK功能中扮演着重要角色。诚然,在哺乳动物中,CCK-8中的WMDF区域据认为是CCK最关键的活性结构域(Nielsenet al,1998)。同样,CCK-8中的第6位氨基酸据信也是维持哺乳动物CCK活性的关键(Nielsenet al,1998),该位点的变异往往造成CCK活性的减弱或完全丧失。但该位点在鱼类却存在广泛的变异,该现象可能可归因于鱼类 CCK受体在与其配体识别时相对较低的严谨性。一般而言,硬骨鱼类中普遍存在两种形式的CCK,即CCK1和CCK2亚家族(Kurokawaet al,2003),可能是鱼类早期进化过程中基因组复制的结果(Kamisakaet al,2005)。在虹鳟中,甚至发现了 3种类型的 CCK 即(CCK-L,N 和T)(Jensenet al,2001),从本研究的结果来看,大黄鱼中也可能至少存在两种类型的 CCK,一种是 Cai等(2015)在大黄鱼中发现的 CCK2亚型,而另一种是本研究克隆到的 CCK,聚类分析的结果表明,我们克隆到的大黄鱼 CCK与其他鱼类的 CCK1聚在一起,而与CCK2亚家族相距甚远,因此表明本研究克隆到的大黄鱼CCK可能属CCK1亚型。

图5 与其他鱼类的LEP氨基酸序列比对结果Fig.5 Alignment of the LEP amino acid sequences from large yellow croaker P.crocea with that from other teleost fish
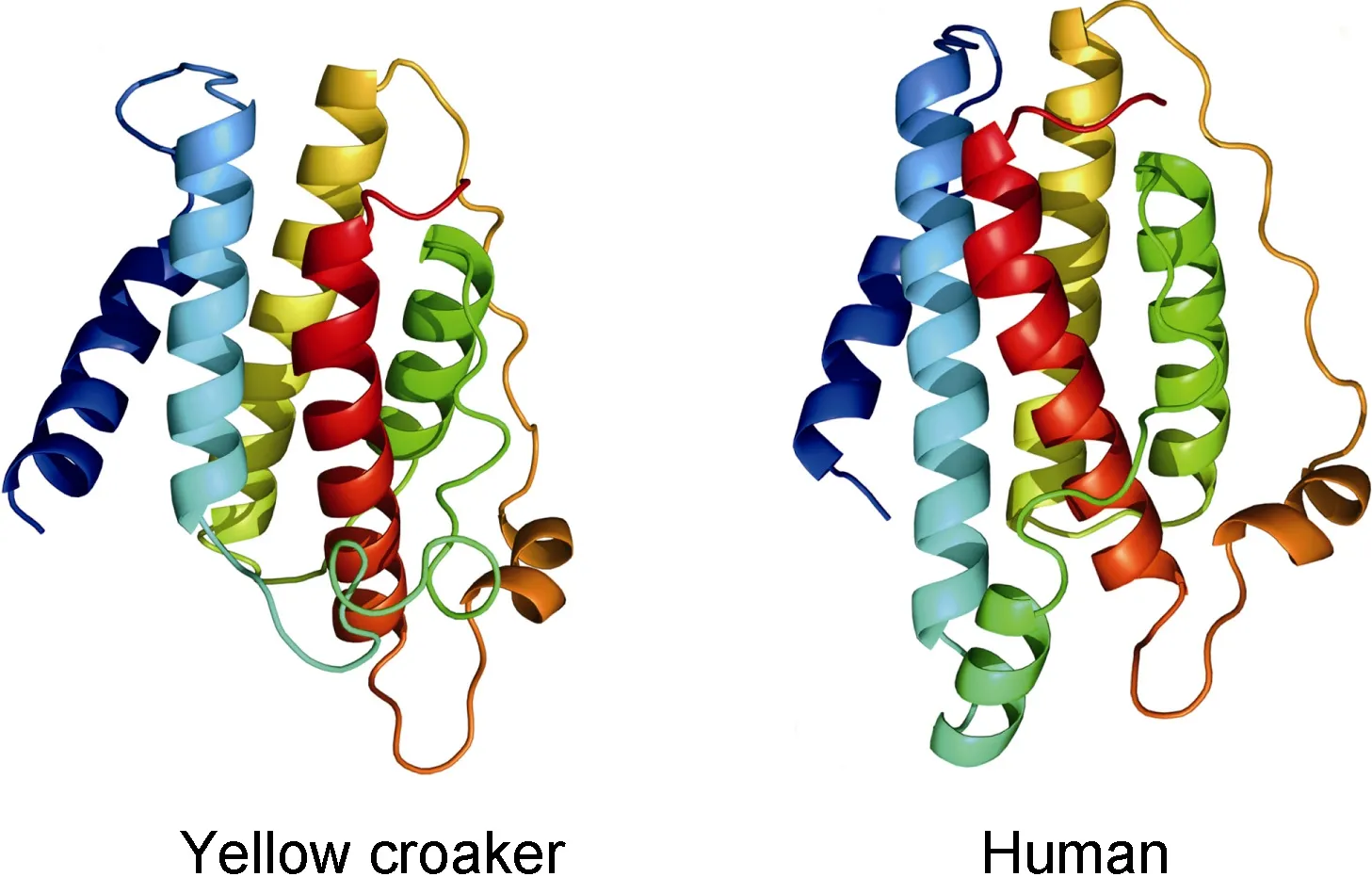
图6 大黄鱼与人LEP蛋白的3D结构比较Fig.6 Comparison in the 3D structures of large yellow croaker and human leptons
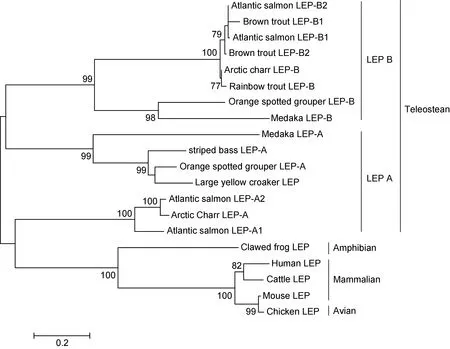
图7 大黄鱼LEP基因的系统进化分析Fig.7 Phylogenetic analysis of LEP from large yellow croaker P.crocea
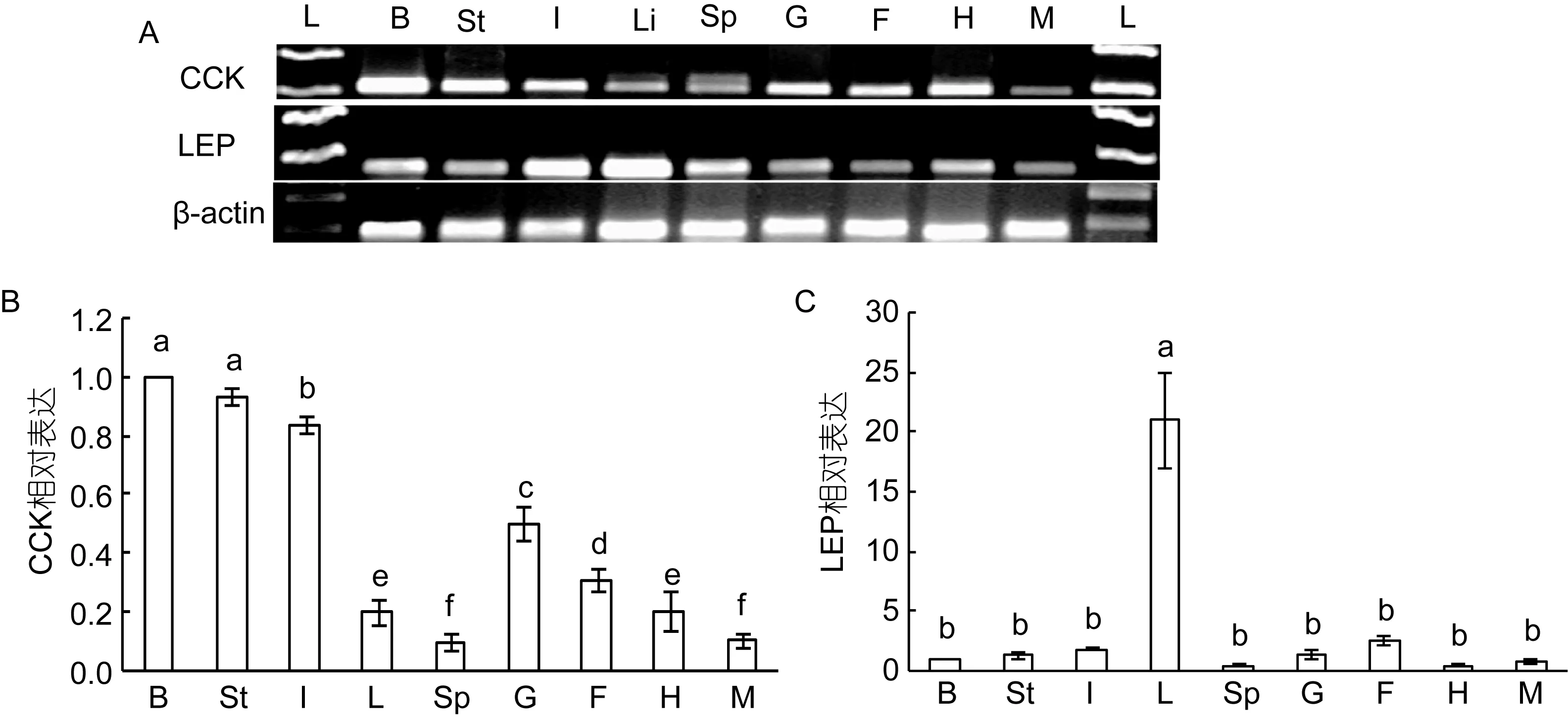
图8 大黄鱼CCK和LEP基因表达的组织特异性研究Fig.8 Tissue distribution of CCK and LEP mRNA in the large yellow croaker P.crocea
相对而言,大黄鱼的 LEP基因与其他鱼类的LEP同源性较低,如图5所示。大黄鱼的LEP仅与斜带石斑鱼(Zhanget al,2013)及条纹鲈(Wonet al,2012)等鲈形目的较为接近(75%以上),而与其他鱼类同源性较低,LEP基因序列这种较大的种间变异在鱼类及其他脊椎动物中颇为常见(Zhanget al,2013)。然而3D结构模拟结果表明,大黄鱼的 LEP在空间结构上却保留了经典的4α螺旋这一LEP蛋白结构特征,甚至与人类的LEP3D结构也高度相似(图6),LEP的这种4α螺旋经典结构据信是维持其与 LEP受体亲和力,并行使其生理功能所必须的(Crespiet al,2006)。本研究在大黄鱼中仅克隆到了一个 LEP基因,鱼类通常具有两个LEP亚家族基因即LEPA和LEPB,两个亚家族可能也起源于鱼类早起进化过程中基因组的复制(Frøilandet al,2010)。然而在鲈形目中情况可能并非如此,在已研究的所有鲈形目种类中除斜带石斑鱼之外,都仅发现了一种类型的LEP基因,如条纹鲈(Wonet al,2012)、蓝鳍金枪鱼(Yanowskiet al,2011)、鳜鱼(李光照,2009)等。因此在大黄鱼中是否还存在另一类型的 LEP基因还有待于今后的进一步研究。然而聚类分析表明,本研究获得的大黄鱼 LEP基因与鱼类的LEPA亚类聚在一起,而与LEPB亚类相距较远,因此推测该LEP基因应属于LEPA亚家族类型。
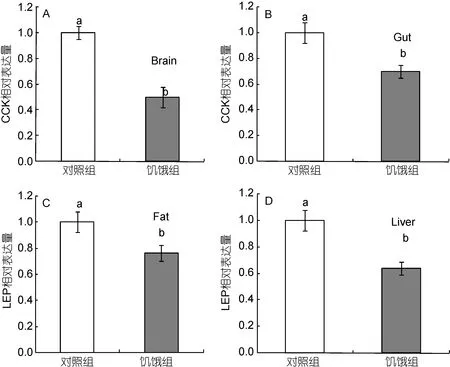
图9 饥饿对大黄鱼CCK和LEP基因表达的影响Fig.9 Effects of fasting on CCK and LEP mRNA expression in the large yellow croaker P.crocea
3.2 大黄鱼CCK、LEP基因的组织表达特征及可能功能作用位点
本研究在所检测的所有 9种组织中均检测到了CCK mRNA的表达,在脑、胃、肠等组织中 CCK mRNA的表达量最高,大大高于剩余其他组织的表达量,类似的结果也在虹鳟(Jensenet al,2001)、鰤鱼(Murashitaet al,2007)、美国红鱼(Webbet al,2010)中有所发现,该结果进一步证实了前人有关脑、外周消化器官是CCK食欲调控功能的主要位点的一般看法(Himicket al,1994)。然而,在大黄鱼的肝脏、心脏、脾脏、肌肉、性腺(精巢)及脂肪中也检测到了少量CCK mRNA的表达,在同为石首鱼科的美国红鱼中,CCK mRNA也在肝脏、肌肉、脾脏、性腺及脂肪中有所表达(Webbet al,2010);CCK mRNA还在美洲拟鲽的心脏、肾脏、鳃(MacDonaldet al,2009)及鰤鱼的胃盲囊、直肠及胆囊(Murashitaet al,2007)中被检测到。CCK在这些组织中的功能尚不得而知。但有研究表明,CCK可能还在动物的感觉系统(Trogeret al,2007)和生殖系统(Micevychet al,1992)中发挥着重要功能;最近,CCK还被证实在鱼类消化道的抗炎症反应及垂体的激素分泌过程也起着重要作用(Peyonet al,1998;Raybould,2007)。因此CCK在大黄鱼组织中的广泛表达可能暗示着其在食欲调控外参与着广泛的生理调控功能。
LEP基因也在所有检测的 9种组织中均有表达,但在肝脏中 LEP基因的表达量最高,类似的结果也出现在东方鲀(Kurokawaet al,2005)、虹鳟(Murashitaet al,2008)、条纹鲈(Wonet al,2012)及大西洋鲑(Rønnestadet al,2010)中,然而在脂肪组织中,LEP基因表达量则要低的多。该结果进一步印证了前人关于硬骨鱼类的肝脏而非脂肪组织更可能是能量收支的调控中心的表述(Wonet al,2012)。在大黄鱼的胃、肠道等消化系统中也检测到了一定量的的 LEP基因表达,该结果与金鱼(Tinocoet al,2012)及大西洋鲑(Rønnestadet al,2010)肠道内检测到大量LEP基因表达相吻合。在哺乳动物中,胃肠道可分泌LEP激素以调控营养物的吸收,从而间接影响能量的收支(Rønnestadet al,2010),鱼类肠道中LEP表达也许也与该生理功能有关。有趣的是,在大黄鱼的性腺(精巢)中也有微弱的LEP基因的表达,在斑马鱼(Gorissenet al,2009)及大西洋鲑(Rønnestadet al,2010)的卵巢中也发现了大量 LEP基因的表达,该结果可能暗示了LEP在鱼类的生殖过程中的可能调控作用。
3.3 饥饿对大黄鱼CCK、LEP基因表达的影响及其可能机制
CCK和LEP在大黄鱼脑、消化道、肝脏及脂肪等摄食及能量存储组织中的大量表达,似乎暗示了两种肽在鱼类食欲调控和能量平衡中的关键作用。为探索两者相关性,我们首先探讨了饥饿等摄食状态对大黄鱼CCK和LEP表达的影响。在哺乳动物中,脑和消化道中CCK mRNA表达量与血液中CCK含量呈正相关,并受到饥饿等摄食状态的影响而显著减少(Suominenet al,1998)。在大黄鱼中,饥饿也会降低脑及胃肠道中CCK mRNA表达量的减少,类似的结果在包括美洲拟鲽(MacDonaldet al,2009)、鰤鱼(Murashitaet al,2007)和草鱼(Fenget al,2012)等硬骨鱼类中屡有发现。然而,LEP mRNA表达与鱼类饥饿等摄食状态的关联性则要复杂的多,LEP mRNA受饥饿等摄食状况的调控或因物种或饥饿时间而异。在虹鳟(Klinget al,2009)和斜带石斑鱼(Zhanget al,2013)中 LEP mRNA表达因饥饿而上升;在绿太阳鱼(Johnsonet al,2000)、大西洋鲑(Rønnestadet al,2010)和条纹鲈(Wonet al,2012)中,LEP mRNA表达因饥饿而减少;而在鲤鱼(Huisinget al,2006)和金鱼(Tinocoet al,2012)中,暂时的饥饿对LEP mRNA表达并无显著影响。在大黄鱼中,短期的饥饿会造成了肝脏及脂肪组织中LEP mRNA表达的显著下降(P<0.05),该结果与绝大多数哺乳动物中的研究结果相类似((Wonet al,2012)。饥饿对大黄鱼CCK和LEP基因表达模式的影响可能从侧面反映出了其与鱼类摄食生理与能量平衡间的相关性。
4 结论
本研究克隆得到了两种大黄鱼的摄食调控因子胆囊收缩素(CCK)、瘦素(LEP)基因的全长序列,两种因子分属鱼类的 CCK1和LEPA亚家族类型。CCK和LEP在大黄鱼脑、消化道等摄食及能量平衡相关组织中表达最高,饥饿等摄食状态会显著影响大黄鱼CCK和LEP的表达,该结果表明,CCK和LEP可能在大黄鱼的食欲调控和能量平衡中起着重要的调控作用。
农业部渔业局,2012.中国渔业统计年鉴.北京:中国农业出版社
李光照,2009.淡水养殖鱼类肥胖基因克隆与组织表达研究.广州:暨南大学硕士学位论文
Cai Z N,Li W J,Mai K Set al,2015.Effects of dietary size-fractionated fish hydrolysates on growth,activities of digestive enzymes and aminotransferases and expression of some protein metabolism related genes in large yellow croaker (Larimichthys crocea)larvae.Aquaculture,440:40—47
Crespi E J,Denver R J,2006.Leptin (ob gene)of the South African clawed frogXenopus laevis.Proceedings of the National Academy of Sciences of the United States of America,103(26):10092—10097
De Pedro N,Bjornsson B T,2001.Regulation of food intake by neuropeptides and hormones.In:Houlihan D,Boujard T,Jobling M eds.Food Intake in Fish.Oxford,UK:Blackwell Science,269—296
Feng K,Zhang G R,Wei K Jet al,2012.Molecular characterization of cholecystokinin in grass carp(Ctenopharyngodon idellus):cloning,localization,developmental profile,and effect of fasting and refeeding on expression in the brain and intestine.Fish Physiology and Biochemistry,38(6):1825—1834
Frøiland E,Murashita K,Jørgensen E Het al,2010.Leptin and ghrelin in anadromous Arctic charr:cloning and change in expressions during a seasonal feeding cycle.General and Comparative Endocrinology,165(1):136—143
Gélineau A,Boujard T,2001.Oral administration of cholecystokinin receptor antagonists increase feed intake in rainbow trout.Journal of Fish Biology,58(3):716—724
Gorissen M,Bernier N J,Nabuurs S Bet al,2009.Two divergent leptin paralogues in zebrafish (Danio rerio)that originate early in teleostean evolution.Journal of Endocrinology,201(3):329—339
Himick B A,Peter R E,1994.CCK/Gastrin-like immunoreactivity in brain and gut,and CCK suppression of feeding in goldfish.American Journal of Physiology:Regulatory,Integrative and Comparative Physiology,267(3):R841—R851
Huising M O,Geven E J W,Kruiswijk C Pet al,2006.Increased leptin expression in common carp (Cyprinus carpio)after food intake but not after fasting or feeding to satiation.Endocrinology,147(12):5786—5797
Jensen H,Rourke I J,Møller Met al,2001.Identification and distribution of CCK-related peptides and mRNAs in the rainbow trout,Oncorhynchus mykiss.Biochimica et Biophysica Acta (BBA)-Gene Structure and Expression,1517(2):190—201
Johnson R M,Johnson T M,Londraville R L,2000.Evidence for leptin expression in fishes.Journal of Experimental Zoology Part A,286(7):718—724
Kamisaka Y,Drivenes Ø,Kurokawa Tet al,2005.Cholecystokinin mRNA in Atlantic herring,Clupea harengus-molecular cloning,characterization,and distribution in the digestive tract during the early life stages.Peptides,26(3):385—393
Kling P,Rønnestad I,Stefansson S Oet al,2009.A homologous salmonid leptin radioimmunoassay indicates elevated plasma leptin levels during fasting of rainbow trout.General and Comparative Endocrinology,162(3):307—312
Konturek S J,Pepera J,Zabielski Ket al,2003.Brain-gut axis in pancreatic secretion and appetite control.Journal of Physiology and Pharmacology,54(3):293—317
Kurokawa T,Suzuki T,Hashimoto H,2003.Identification of gastrin and multiple cholecystokinin genes in teleost.Peptides,24(2):227—235
Kurokawa T,Uji S,Suzuki T,2005.Identification of cDNA coding for a homologue to mammalian leptin from pufferfish,Takifugu rubripes.Peptides,26(5):745—750
MacDonald E,Volkoff H,2009.Cloning,distribution and effects of season and nutritional status on the expression of neuropeptide Y (NPY),cocaine and amphetamine regulated transcript (CART)and cholecystokinin (CCK)in winter flounder (Pseudopleuronectes americanus).Hormones and Behavior,56(1):58—65
Micevych P,Ulibarri C,1992.Development of the limbichypothalamic cholecystokinin circuit:a model of sexual differentiation.Developmental Neuroscience,14(1):11—34
Murashita K,Fukada H,Hosokawa Het al,2007.Changes in cholecystokinin and peptide Y gene expression with feeding in yellowtail (Seriola quinqueradiata):relation to pancreatic exocrine regulation.Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,146(3):318—325
Murashita K,Uji S,Yamamoto Tet al,2008.Production of recombinant leptin and its effects on food intake in rainbow trout (Oncorhynchus mykiss).Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,150(4):377—384
Nielsen K G,Bomgren P,Holmgren Set al,1998.Gastrin and cholecystokinin of the bullfrog,Rana catesbeiana,have distinct effects on gallbladder motility and gastric acid secretionin vitro.General and Comparative Endocrinology,112(2):247—254
Peterson B C,Waldbieser G C,Riley L G Jret al,2012.Pre- and postprandial changes in orexigenic and anorexigenic factors in channel catfish (Ictalurus punctatus).General and Comparative Endocrinology,176(2):231—239
Peyon P,Lin X W,Himick B Aet al,1998.Molecular cloning and expression of cDNA encoding brain preprocholecystokinin in goldfish.Peptides,19(2):199—210
Peyon P,Saied H,Lin X Wet al,1999.Postprandial,seasonal and sexual variations in cholecystokinin gene expression in goldfish brain.Molecular Brain Research,74(1—2):190—196
Raybould H E,2007.Mechanisms of CCK signaling from gut to brain.Current Opinion in Pharmacology,7(6):570—574
Rehfeld J F,Friis-Hansen L,Goetze J Pet al,2007.The biology of cholecystokinin and gastrin peptides.Current Topics in Medicinal Chemistry,7(12):1154—1165
Rønnestad I,Nilsen T O,Murashita Ket al,2010.Leptin and leptin receptor genes in Atlantic salmon:cloning,phylogeny,tissue distribution and expression correlated to long-term feeding status.General and Comparative Endocrinology,168(1):55—70
Rubio V C,Sánchez-Vázquez F J,Madrid J A,2008.Role of cholecystokinin and its antagonist proglumide on macronutrient selection in European sea bassDicentrarchus labrax,L.Physiology &Behavior,93(4—5):862—869
Sambrook J,Russell D W,2001.Molecular Cloning:A Laboratory Manual.3rdedn.New York,USA:Cold Spring Harbor Laboratory Press
Sang W G,Wei X X,Wu H H,2007.Effects of dietary conjugated linoleic acids on the growth and quality of large yellow croaker fishPseudosciaena crocea(Richardson)in cages.Asia Pacific Journal of Clinical Nutrition,16(Suppl.1):404—406
Silverstein J T,Plisetskaya E M,2000.The effects of NPY and insulin on food intake regulation in fish.Integrative &Comparative Biology,40(2):296—308
Suominen A H,Glimm D R,Tedesco Det al,1998.Intestinal nutrient-gene interaction:the effect of feed deprivation and refeeding on cholecystokinin and proglucagon gene expression.Journal of Animal Science,76(12):3104—3113
Suzuki T,Kurokawa T,McVey D C,1999.Sequence and expression analyses of cholecystokinin (CCK)precursor cDNA in the Japanese flounder (Paralichthys olivaceus).Fish Physiology and Biochemistry,21(1):73—80
Terova G,Rimoldi S,Bernardini Get al,2008.Sea bass ghrelin:molecular cloning and mRNA quantification during fasting and refeeding.General and Comparative Endocrinology,155(2):341–351
Tinoco A B,Nisembaum L G,Isorna Eet al,2012.Leptins and leptin receptor expression in the goldfish (Carassiusauratus).Regulation by food intake and fasting/overfeeding conditions.Peptides,34(2):329—335
Troger J,Kieselbach G,Teuchner Bet al,2007.Peptidergic nerves in the eye,their source and potential pathophysiological relevance.Brain Research Reviews,53(1):39—62
Volkoff H,Canosa L F,Unniappan Set al,2005.Neuropeptides and the control of food intake in fish.General and Comparative Endocrinology,142(1—2):3—19
Volkoff H,Eykelbosh A J,Peter R E,2003.Role of leptin in the control of feeding of goldfishCarassius auratus:interactions with cholecystokinin,neuropeptide Y and orexin A,and modulation by fasting.Brain Research,972(1—2):90—109
Webb K A Jr,Khan I A,Nunez B Set al,2010.Cholecystokinin:Molecular cloning and immunohistochemical localization in the gastrointestinal tract of larval red drum,Sciaenops ocellatus(L.).General and Comparative Endocrinology,166(1):152—159
Won E T,Baltzegar D A,Picha M Eet al,2012.Cloning and characterization of leptin in a Perciform fish,the striped bass (Morone saxatilis):control of feeding and regulation by nutritional state.General and Comparative Endocrinology,178(1):98—107
Yanowski E,Mylonas C C,Corriero Aet al,2011.Atlantic bluefin tuna (Thunnus thynnus)leptin-cloning and expression patterns during the reproductive season.Indian Journal of Science and Technology,4:104—105
Zhang H X,Chen H P,Zhang Yet al,2013.Molecular cloning,characterization and expression profiles of multiple leptin genes and a leptin receptor gene in orange-spotted grouper(Epinephelus coioides).General and Comparative Endocrinology,181:295—305
Zhang Y Y,Proenca R,Maffei Met al,1994.Positional cloning of the mouseobesegene and its human homologue.Nature,372(6505):425—432
MOLECULAR CLONING,CHARACTERIZATION AND EXPRESSION PROFILES OF CHOLECYSTOKININ AND LEPTIN IN LARGE YELLOW CROAKER(PSEUDOSCIAENA CROCEA)
LIU Li-Qin1, WANG Mao-Ting1, CUI Wen-Tao1, LIU Wan1, LÜ Zhen-Ming1,GONG Li1, YANG Jing-Wen1, DONG Ying-Hui2
(1.National and Provincial Joint Laboratory of Exploration and Utilization of Marine Aquatic Genetic Resources,Zhejiang Ocean University,Zhoushan316022,China;2.Zhejiang Key Laboratory of Aquatic Germplasm Resources,Zhejiang Wanli University,Ningbo315100,China)
cDNAs encoding for two feeding regulation factors,cholecystokinin (CCK)and leptin (LEP),were cloned in large yellow croakerPseudosciaena crocea.mRNA tissue distribution was examined for the two peptides,as well as the effects of 8-day fasting on their expression.The results show that large yellow croaker CCK sequences displayed identity with that of teleost CCK1 gene sub-family.It is a 900bp nucleotide sequence,encoding a peptide composed of 137 amino acids.The sequences displayed great identity with the teleost CCK1 gene,especially within the segments of signal peptide and cck-8 sequences.In contrast,large yellow croaker LEP displayed less identity with other teleost LEP gene,but kept a classic LEP 3D structure formed by four-helix bundle.It is a 1290bp nucleotide sequence,which encodes a peptide composed of 161 amino acids.The sequences displayed identity with teleost LEPA gene sub-family.Both peptides are present in all tissues examined,but only abundant in the feeding regulation tissues,such as brain,gastrointestinal tract,and other peripheral tissues,including liver.The 8-day fasting induced a significant decrease in both brain and gut CCK,and liver and mesenteric fat LEP mRNA expression (P<0.05).Therefore,the CCK and LEP played possibly a role in feeding regulation and digestive processes in large yellow croaker.The present results provide a basis for further investigation into the neural and gastroenteric mechanisms regulating appetite in large yellow croaker.
large yellow croakerPseudosciaena crocea;leptin;cholecystokinin;gene cloning;expression profile
Q789
10.11693/hyhz20170400096
* 国家自然科学基金项目,41606150号;浙江省水产种质资源高效利用技术研究重点实验室开放课题,KL2015-2号。刘立芹,博士,副教授,E-mail:liuliqin-666@163.com
① 通讯作者:董迎辉,博士,副教授,E-mail:15067427669@126.com
2017-04-18,收修改稿日期:2017-05-19

