肺炎支原体肺炎患儿免疫功能的变化
薛丽雯, 符辰潞, 庄一波
(苏州大学附属第三医院 江苏省常州市第一人民医院 儿科, 江苏 常州, 213003)
肺炎支原体肺炎患儿免疫功能的变化
薛丽雯, 符辰潞, 庄一波
(苏州大学附属第三医院 江苏省常州市第一人民医院 儿科, 江苏 常州, 213003)
目的观察肺炎支原体肺炎(MPP)患儿免疫功能的变化。方法114例肺炎支原体肺炎(MPP)患儿作为实验组,于病程第7~10天检测MPIgM抗体为阳性,并采集外周血标本。同期保健门诊体检的50例健康儿童作为对照组,采集外周血标本。分别检测外周血标本中T细胞亚群(CD3、CD4、CD8、CD4/CD8、NK)以及体液免疫(IgG、IgA、IgM、C3、C4)的水平。结果实验组患儿血清中CD3、CD4、CD4/CD8比值、NK值均显著低于正常对照组(P<0.05), IgA、C3和C4均显著低于正常对照组(P<0.05), 而IgG和IgM值无显著差异(P>0.05)。结论肺炎支原体(MP)感染可引起免疫功能紊乱,抑制细胞免疫及体液免疫。
肺炎支原体肺炎; T细胞亚群; 体液免疫
肺炎支原体(MP)作为最小原核致病微生物,缺乏细胞壁,是儿童社区获得性呼吸道感染,尤其是社区获得性肺炎(CAP)的常见病原体,其致病的主要原因之一为过度的免疫反应。MP可以通过激活淋巴细胞,产生多种细胞因子,且与多种组织关联产生自身抗体[1-2]。本研究检测本科2015年1—12月收住入院的114例肺炎支原体肺炎(MPP)患儿的外周血T细胞亚群及细胞免疫功能水平,现报告如下。
1 资料与方法
1.1 一般资料
将2015年1—12月常州市第一人民医院儿科住院诊断的114例MPP患儿作为实验组, MPP患儿诊断标准参照《2015儿童肺炎支原体肺炎诊治专家共识》[3]。其中男62例,女52例,年龄9~156个月,平均年龄(52.75±28.5)月。于病程7~10 d采集外周血,检测T细胞亚群(CD3、CD4、CD8、CD4/CD8、NK)及体液免疫功能(IgG、IgA、IgM、C3、C4)。同时,随机选择同期儿童保健门诊的50例健康儿童检测支原体抗体MPIgM阴性者作为对照组,检测其T细胞亚群及体液免疫功能。既往有基础疾病、特应质、反复呼吸道感染以及本次呼吸道病原9项有其他病原菌感染者不纳入实验组。2组儿童性别、年龄差异无统计学意义(P>0.05)。
1.2 检测方法
所有标本送检验实验室进行检测。体液免疫(IgG、IgA、IgM、C3、C4)由美国贝克曼库尔特的IMMAGE800全自动特定蛋白分析仪测定。T细胞亚群(CD3、CD4、CD8、NK、CD4/CD8)采用美国BD公司生产的FACScan型流式细胞仪检测。
1.3 统计学方法
采用SPSS 20.0统计学软件进行数据处理,计量资料采用均数±标准差表示,两组间数据比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
MPP患儿外周血T细胞亚群与对照组比较,结果显示CD3、CD4、CD4/CD8比值均显著低于对照组(P<0.01); MPP患儿CD8水平显著高于对照组(P<0.01)。见表l。MPP患儿外周血体液免疫功能与对照组比较, MPP患儿IgA、补体C3和C4均显著低于对照组(P<0.05); 2组IgG、IgM差异无统计学意义(P>0.05)。见表2。
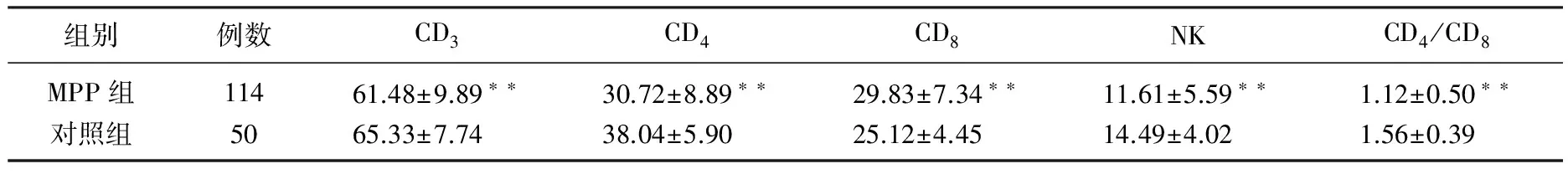
表1 MPP组和对照组T细胞亚群指标比较
与对照组比较, **P<0.01。

表2 MPP组和对照组体液免疫功能指标比较
与对照组比较, *P<0.05。
3 讨 论
肺炎支原体是介于病毒和细菌之间能独立生存的最小微生物,是儿童常见的呼吸道感染病原,也是儿童CAP的主要病原菌之一,文献[4-6]报道住院儿童CAP中10%~40%是由MP引起的。4~5岁儿童最容易受MP感染,流行周期约为3~4年[7]。目前认为MPP的致病机制主要有以下2个方面: 一方面MP直接黏附呼吸道上皮细胞,引起损伤导致呼吸道症状; 另一方面MP感染后引起免疫紊乱,导致多器官损伤即肺外症状,已证实细胞免疫与体液免疫共同参与发病过程[8]。
机体的免疫平衡主要依赖于各型淋巴细胞的相互调节,T淋巴细胞亚群主管细胞免疫,具有抵抗病毒和调节免疫系统功能的作用。细胞免疫取决于T淋巴细胞总值(CD3+)及其亚群(CD4+、CD8+)的相对组成,特别是CD4+T淋巴细胞、CD8+T淋巴细胞的调节,当CD4+T淋巴细胞、CD8+T淋巴细胞数及比值发生紊乱,则容易引发疾病。文献报道感染MP后, CD4+、CD8+T细胞促进细胞因子IL-4、IL-6及 IL-10表达水平的升高,而这些细胞因子进一步促使Th2细胞占优势, Th2细胞导致分泌更多细胞因子及炎症介质,同时促使B淋巴细胞分泌多种抗体,从而导致机体免疫功能紊乱[9-11]。黎四平等[12]报道MPP患儿急性期CD4、CD4/CD8比值较恢复期显著降低, CD8急性期较恢复期显著升高。梁坤[13]报道肺炎支原体肺炎支气管肺泡灌洗液中T细胞亚群CD3、CD4、CD4/CD8比值明显低于对照组。本研究发现, MPP组的CD3、CD4以及CD4/CD8比值明显低于对照组, MPP组CD8值较对照组明显升高,提示存在细胞免疫功能抑制及免疫失衡,与上述文献报道相符。本研究还发现MPP组自然杀伤细胞(NK)值显著低于对照组。NK细胞属淋巴细胞谱系,但有别于T细胞、B细胞的一类非特异性免疫细胞,含有穿孔蛋白和粒酶颗粒的非特异性细胞毒淋巴细胞,是固有免疫系统的主要成员,对杀伤肿瘤细胞和病毒感染细胞起重要作用。NK细胞可通过多种途径被活化,包括膜表面的CD2、CD3分子和IL-2、IL-12、IFN-α、以及白细胞调节素(LR)等多种细胞因子。有研究[14]提示MP感染机体后抑制了NK细胞表面的受体,从而阻断了NK细胞表面受体介导的信号传导。
本研究对体液免疫功能指标的结果显示, MPP外周血免疫球蛋白IgA值、补体C3和C4值均低于对照组; 而2组IgG、IgM表达水平无显著差异。对于MP感染患儿体液免疫功能的相关研究目前报道结果不一,大多数学者[15]认为MP感染患儿血清免疫球蛋白水平升高。Atkinson等[16]研究提示,MP感染患儿血清IgG、IgM水平显著高于正常儿童。IgM一般出现于MP感染后7~14 d, 3~6周达到高峰。特异性IgG较IgM出现晚,一般在感染后20 d出现。本研究2组血清中IgG、IgM水平无显著差异,可能与病程7~10 d检测免疫球蛋白,MP感染时间尚短有关。本研究发现,在病程7~10 d, MPP患儿血清免疫球蛋白IgA水平显著低于对照组。IgA是机体黏膜防御系统的主要成分,覆盖在鼻咽、气道、肠道和膀胱黏膜表面,能抑制微生物在呼吸道上皮的附着,是黏膜重要屏障。幼儿易患或反复呼吸道感染,与IgA合成降低有一定关系[17-19]。本研究提示MP感染者IgA降低,但不能区分是MP感染导致的IgA降低还是IgA降低者易发生MP感染。本研究结果显示,MP感染后补体C3、C4水平下降,补体在机体的免疫系统中担负抗感染和免疫调节作用,并参与免疫病理反应,主要产生细胞为肝细胞和巨噬细胞。补体含量下降主要见于感染导致的免疫损伤如链球菌性肾小球肾炎、系统性红斑狼疮、类风湿性关节炎,及肝功能损伤后合成减少。MP感染后补体下降可能与免疫紊乱及肝功能受损有关。
综上所述, MPP患儿存在免疫功能抑制,治疗期间要注意监测,必要时可给予免疫调节辅助治疗,以促进患儿疾病的康复。
[1] Shimizu T, Kida Y, Kuwano K. Cytoadherence-dependent induction of inflammatory responses by Mycoplasma pneuoniae[J]. Immunology, 2011, 33(1): 51-61.
[2] Stelmach I, Podsiad owicz-Borzecka M, Grzelewski T, et al. Humoral and cellular immunity in children with Mycoplasma pneumoniae infection: a 1-year prospective study[J]. Clin Diagn Lab Immunol, 2005, 12(10): 1246-50.
[3] 申昆玲, 陈志敏, 尚云晓, 等. 儿童肺炎支原体肺炎诊治专家共识(2015版)[J]. 中华实用儿科临床杂志, 2015, 30(17): 1304-1308.
[4] Jain S, Williams D J, Arnold S R, et al. Community-acquired pneumonia requiring hospitalization among U. S. children[J]. N Engl J Med, 2015, 372(9): 835-845.
[5] Liu WK, Liu Q, Chen de H, et al. Epidemiology of acute respiratory infections in children in Guangzhou: a three-year study[J]. Plos One, 2014, 9(5): e96674-9.
[6] 李萍, 孙秋凤, 陈正荣, 等. 苏州地区住院儿童下呼吸道感染的病原菌分析[J]. 儿科药学杂志, 2014, 20(9): 33-36.
[7] Blystad H, nestad G, Vestrheim D F, et al. Increased incidence of Mycoplasma pneumoniae infection in Norway 2011[J]. Euro Surveill, 2012, 17(5): 20074-9.
[8] 刘中生, 匡艳华. 肺炎支原体肺炎患者血清TNF-α、IL-6和hs-CRP的测定及意义[J]. 中外医学研究, 2011, 9(7): 25-28.
[9] Huang B, Wang Q T, Song S S, et al. Combined use of etanercept and MTX restores CD4+/CD8+ ratio and Tregs in spleen and thymus in collagen-induced arthritis[J]. Inflamm Res, 2012, 61(11): 1229-39.
[10] Tosiek M J, Gruber A D, Bader S R, et al. CD4+CD25+Foxp3+ regulatory t cells are dispensable for controlling CD8+ T cell-mediated lung inflammation[J]. J Immunol, 2011, 186(11): 6106-18.
[11] Qing Ye, XiaoJun Xu, WenXia Shao, et al. Mycoplasma pneumoniae Infection in Children Is a Risk Factor for Developing Allergic Diseases[J]. Scientific World Journal, 2014, 2014: 986527.
[12] 黎四平, 刘绍基, 陆小梅, 等. 小儿肺炎支原体肺炎不同病期免疫功能的动态变化[J]. 中国小儿急救医学, 2012, 19(3): 245-247.
[13] 梁坤, 田玲, 吴小磊, 等. 难治性肺炎支原体肺炎患儿肺泡灌洗液中白细胞介素-6、白细胞介素-10及T细胞亚群水平研究[J]. 中国小儿急救医学, 2014, 21(11): 689-692.
[14] 贾文燕, 刘继贤. 支原体肺炎患儿自然杀伤细胞检测及转移因子对该细胞的作用[J]. 临床肺科杂志, 2012, 17(10): 1798-1799.
[15] 徐哲, 陈华英, 刘亚军, 等. 肺炎支原体肺炎患儿体液免疫活性的临床研究[J]. 西部医学, 2011, 23(5): 905-907.
[16] Atkinson T P, Duffy L B, Pendley D, et al. Deficient immune response to Mycoplasma pneumoniae in childhood asthma[J]. Allergy Asthma Proc, 2009, 30(2): 158-65.
[17] Ozkan H, Atlihan F, Genel F, et al. IgA and/or IgG subclass deficiency in children with recurrent respiratory infections and its relationship with chronic pulmonary damage[J]. Journal of Investigational Allergology & Clinical Immunology, 2005, 15(1): 69-74.
[18] Dominguez O, Giner M T, Alsina L, et al. Clinical phenotypes associated with selective IgA deficiency: a review of 330 cases and aproposed follow-up protocol[J]. Anales de Pediatria, 2012, 76(5): 261-7.
[19] Rojas-Torres D S, Bastidas-Yaguana D K, Sierra-Santos L, et al. Importance of selective immunoglobulin A deficiency[J]. Semergen Sociedad Espanola de Medicina Rural y Generalista, 2014, 40(3): e65-8.
Changeofimmunologicfunctioninchildrenwithmycoplasmapneumoniaepneumonia
XUELiwen,FUChenlu,ZHUANGYibo
(DepartmentOfPediatrics,ChangzhouFirstPeople′sHospital,TheThirdHospitalAffiliatedtoSoochowUniversity,Changzhou,Jiangsu, 213003)
ObjectiveTo observe the change of immunologic function in children with mycoplasma pneumoniae pneumonia (MMP).MethodsTotally 114 children diagnosed with MPP were selected as experimental group, and MPIgM were positively detected in the course of 7 to 10 days, and the blood samples were collected. At the same time, 50 healthy children in health clinic were selected as control group, and peripheral blood samples were collected. The levels of T cell subsets (CD3, CD4, CD8, CD4/CD8, NK) and humoral immunity (IgG, IgA, IgM, C3, C4) in peripheral blood samples were detected respectively.ResultsThe serum CD3, CD4, CD4/CD8ratio and NK value in the experimental group were significantly lower than those in the control group (P<0.05), and IgA, C3 and C4 were significantly lower than those in the control group (P<0.05), but there was no significant difference in IgG and IgM values (P>0.05).ConclusionMycoplasma pneumoniae (MP) infection can cause immune dysfunction, inhibit cellular immunity and humoral immunity.
mycoplasma pneumoniae pneumonia; T lymphocyte subsets; humoral immunity
R 563.1
A
1672-2353(2017)21-039-03
10.7619/jcmp.201721011
2017-04-22

