低温离体保存黄独微型块茎转录组、蛋白质组和代谢组的关联分析
洪森荣,吴夏俊鹏,徐文慧,占学林,谢妮妮,蒋 妍,汪金华,凌 飞,吴丽霞,万 琳
(上饶师范学院 生命科学学院,江西 上饶 334001)
低温离体保存黄独微型块茎转录组、蛋白质组和代谢组的关联分析
洪森荣,吴夏俊鹏,徐文慧,占学林,谢妮妮,蒋 妍,汪金华,凌 飞,吴丽霞,万 琳
(上饶师范学院 生命科学学院,江西 上饶 334001)
为探究黄独微型块茎低温离体保存的内在机理,对其转录组、蛋白质组和代谢组进行关联分析。结果表明:黄独微型块茎低温和常温离体保存的转录本比例和蛋白比例的log2值均呈现正态分布,十分类似,符合真实生物样品的要求;差异蛋白和差异转录本韦恩图结果表明,84个转录本在两者中均有差异,表明大多数差异的转录本在蛋白组数据均有差异;差异蛋白和差异转录本的log2对数热图分析结果表明,相对于蛋白质组来说,转录组差异程度更大,两者的差异转录本多数一致,少数不同;差异蛋白和差异转录本log2散点关联密度图分析结果表明,两者的比例在0附近居多,左下角和右上角(转录本和蛋白的上下调关系一致)相对左上角和右下角(转录和蛋白上下调关系不一致)更多,表明两者差异表达趋势一致性的程度更高。低温离体保存黄独微型块茎转录组、蛋白质组和代谢组的关联分析结果表明,低温离体保存的黄独微型块茎主要涉及碳代谢、氨基酸生物合成、糖酵解途径、淀粉蔗糖代谢和丙酮酸代谢等途径,这为黄独微型块茎的低温离体保存和低温破除休眠提供了理论依据。
黄独;微型块茎;低温离体保存;转录组;蛋白质组;代谢组
黄独(DioscoreabulbiferaL.)为薯蓣科薯蓣属多年生藤本植物[1-2],其地下块茎,俗名黄药子,性平、味苦、有毒,有散结消瘿、清热解毒和凉血止血的功效,在临床上黄药子还具有抗病毒、抗肿瘤等活性,常用于治疗甲状腺疾病[3]。黄独长期进行营养繁殖,造成病毒感染严重,产量逐年下降,品质不断退化[4]。因此,保存黄独种质资源具有一定的现实意义。黄独的腋芽处常会长出地上变态块茎,俗称零余子、珠芽等,在组织培养中特称它为微型块茎[5]。微型块茎由于体积小、携带方便、活力久、成活率高,常可作为薯蓣属植物快速繁殖的材料[6]。研究表明,黄独微型块茎能够在黑暗和低温条件下长期保存而不丧失活力,还有助于打破休眠[7],但微型块茎低温离体保存的内在原因尚无报道。高通量组学分析工具的发展,引导系统生物学进入大数据时代,在单组学研究显现瓶颈之际,可通过多组学整合关联分析,深入阐明生命活动的本质和规律[8]。本研究将对黄独微型块茎低温离体保存的转录组、蛋白质组和代谢组三大组学进行关联分析,旨在为黄独微型块茎低温离体保存提供理论依据。
1 材料与方法
1.1 材料
黄独微型块茎由上饶师范学院生命科学学院植物组织培养室提供。
1.2 方法
1.2.1 转录组、代谢组和蛋白质组检测
利用黄独试管苗的带芽茎段,接种到MS + KT 2 mg·L-1+ NAA 0.5 mg·L-1+蔗糖60 g·L-1的液体培养基中,使其诱导出微型块茎,然后挑选出直径约0.5 cm的微型块茎转移到100 mL无菌三角瓶(空瓶)中,4 ℃低温离体保存。试验材料分成4 ℃处理组(以Con4表示)和25 ℃对照组(以Con25表示),保存60 d后进行转录组学、代谢组学和蛋白质组学检测。每个温度3个重复。基本方法如下。
转录组学:提取2组试验样品的总RNA后,通过Bioanalyzer 2100(Agilent,Germany)完成质量控制。然后进行mRNA捕获和片段化处理,随后用SuperScriptIII cDNA Synthesis Kit (Life technologies,USA)进行cDNA反转录。根据Illumina公司HiSeq SBS Kit and Cluster Kit v4(Illumina,Sandiego)说明制备Total RNA测序文库。最后,按照Illumina公司Hiseq 2500的操作说明对cDNA文库进行2×125 bp的高通量测序。
代谢组学:2组试验样品在液氮中磨碎,并转移到10 mL离心管,经过涡旋振荡、超声波清洗机处理、氮气吹干等处理,测定其次生代谢物含量,GC/MS检测设备为Agilent 7890A/5975C气-质联用仪(安捷伦,美国)。利用GC-MS预处理软件XCMS(www.bioconductor.org/)对Agilent 7890A/5975C气质联用仪检测获得的原始文件进行数据预处理。最后对样本进行信息比对分析,并对得到的数据进行生物信息学分析。
蛋白质组学:提取2组试验样品的蛋白,加入trypsin进行酶解和TMT标记,标记后的样本分段是用Agilent 300Extend C18 column(5 μm particles, 4.6 mm ID, 250 mm length)在高pH进行反向HPLC分离,检测用Thermo ScientificTM Q ExactiveTM Plus液质联用仪配备Thermo ScientificTM EASY-nLC 1000TM纳升级UPHLC分离系统进行分析。
1.2.2 转录组、蛋白质组和代谢组的关联分析
密度图分析:密度分布图用于考察转录组和蛋白组Con4/Con25差异倍性变化的分布,选用软件为R语言(www.r-project.org)。
Venn图分析:韦恩图用于考察转录组和蛋白组差异蛋白之间的异同。在本研究中,由于蛋白分析所用的参考库为转录组库,我们以所检测蛋白为基础,分析差异转录本和蛋白之间的异同,所用软件为venny2.0.2(http://bioinfogp.cnb.csic.es/tools/venny/)。
热图分析:对转录组和蛋白组Con4/Con25差异倍性变化进行直观的热图分析,考察转录本和蛋白差异的变化。所用方法为层次聚类,聚类软件为R语言(www.r-project.org)包Pheatmap。
散点密度图分析:对转录组和蛋白组Con4/Con25差异倍性变化进行直观的散点密度图分析,考察转录本和蛋白差异的变化。选用软件为R语言(www.r-project.org)。
代谢通路分析:对差异的蛋白和转录本及差异的代谢产物同时向KEGG通路进行映射,从代谢通路图上了解整体变化。
2 结果与分析
2.1黄独低温保存微型块茎转录组、蛋白组和代谢组的简要分析
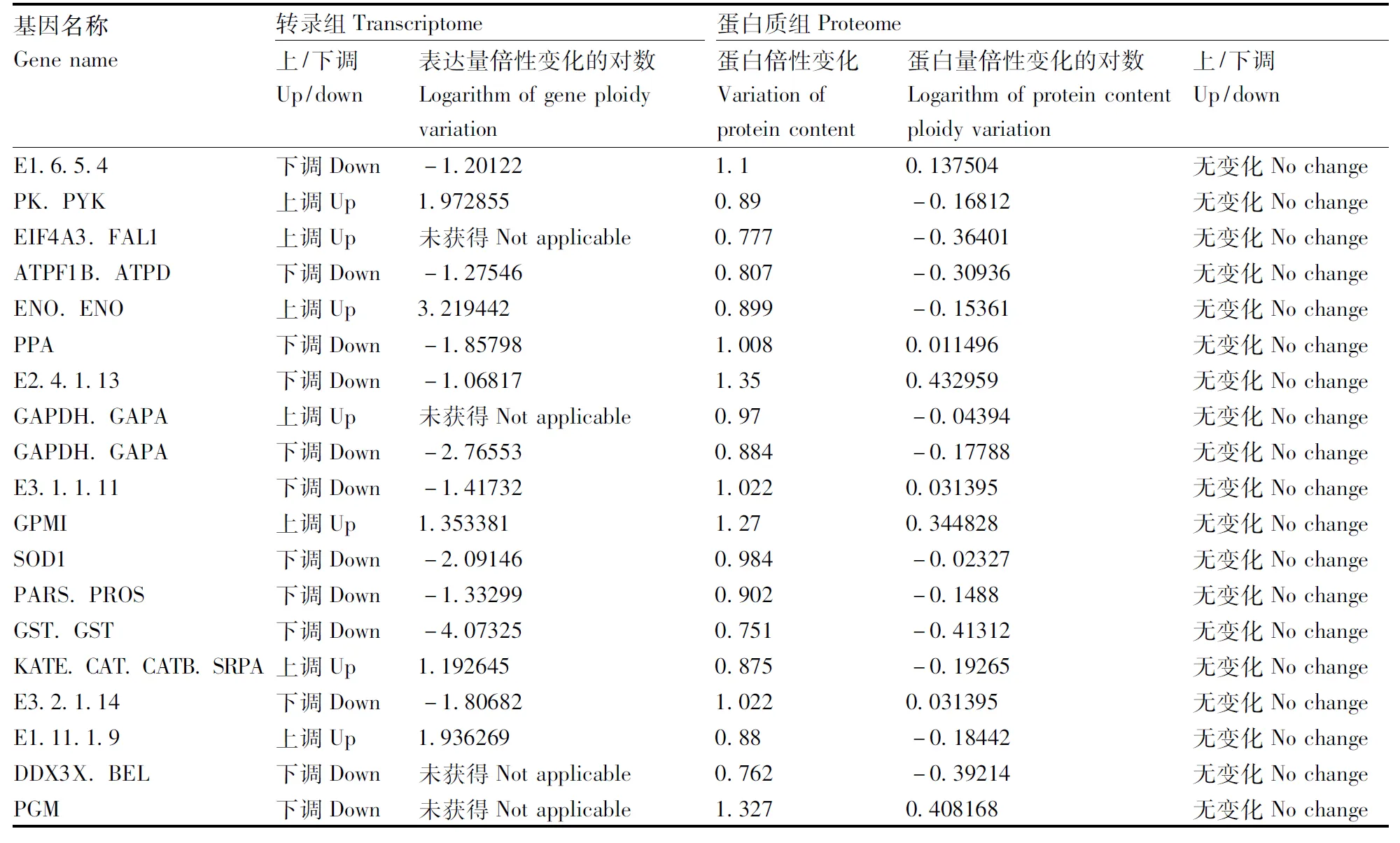
样品间基因表达水平相关性是检验实验可靠性和样本选择是否合理的重要指标,每个样品有3个重复,相关系数为0.885,表明样品之间表达模式的相似度较高。在黄独微型块茎低温离体保存中,共获得164 145个差异表达基因,其中63 305个基因表达上调,100 840个基因表达下调,部分结果见表1。差异表达基因富集度极显著(P<0.01)的部分相关GO term有液泡继承、单链断裂修复、纺锤体伸长、麦芽糖分解代谢过程、甘露糖基转移酶活性、甘露糖磷酸转移酶活性、细胞壁甘露糖蛋白的生物合成过程、G1期细胞有丝分裂周期早期细胞芽和有丝分裂纺锤体定位的建立等。Con4、Con25两组样本的差异蛋白有106个,上调表达蛋白61个,下调表达蛋白45个,其中,伸长因子3, 6-磷酸葡萄糖酸脱氢酶、磷酸甘油酸激酶、蔗糖合成酶、分子伴侣DNAK和S-腺苷甲硫氨酸合成酶等为在4 ℃离体保存黄独微型块茎中上调表达的蛋白,而α-淀粉酶、淀粉磷酸化酶等为在4 ℃离体保存黄独微型块茎中下调表达的蛋白。与25 ℃离体保存的黄独微型块茎相比较,4 ℃离体保存的黄独微型块茎差异性代谢物有丙氨酸、儿茶素、N, N-双(2-羟乙基)甲胺、水杨酸和山梨糖等。
2.2黄独低温保存微型块茎密度图比较
对Con4/Con25各差异转录本和差异蛋白的log2进行柱状密度曲线分析,考察转录本比例和蛋白比例的分布。结果(图1)表明,大多数转录本比例和蛋白比例的log2位于0附近,转录本比例和蛋白比例的log2均呈现正态分布,两者比较类似,符合真实生物样品的要求。
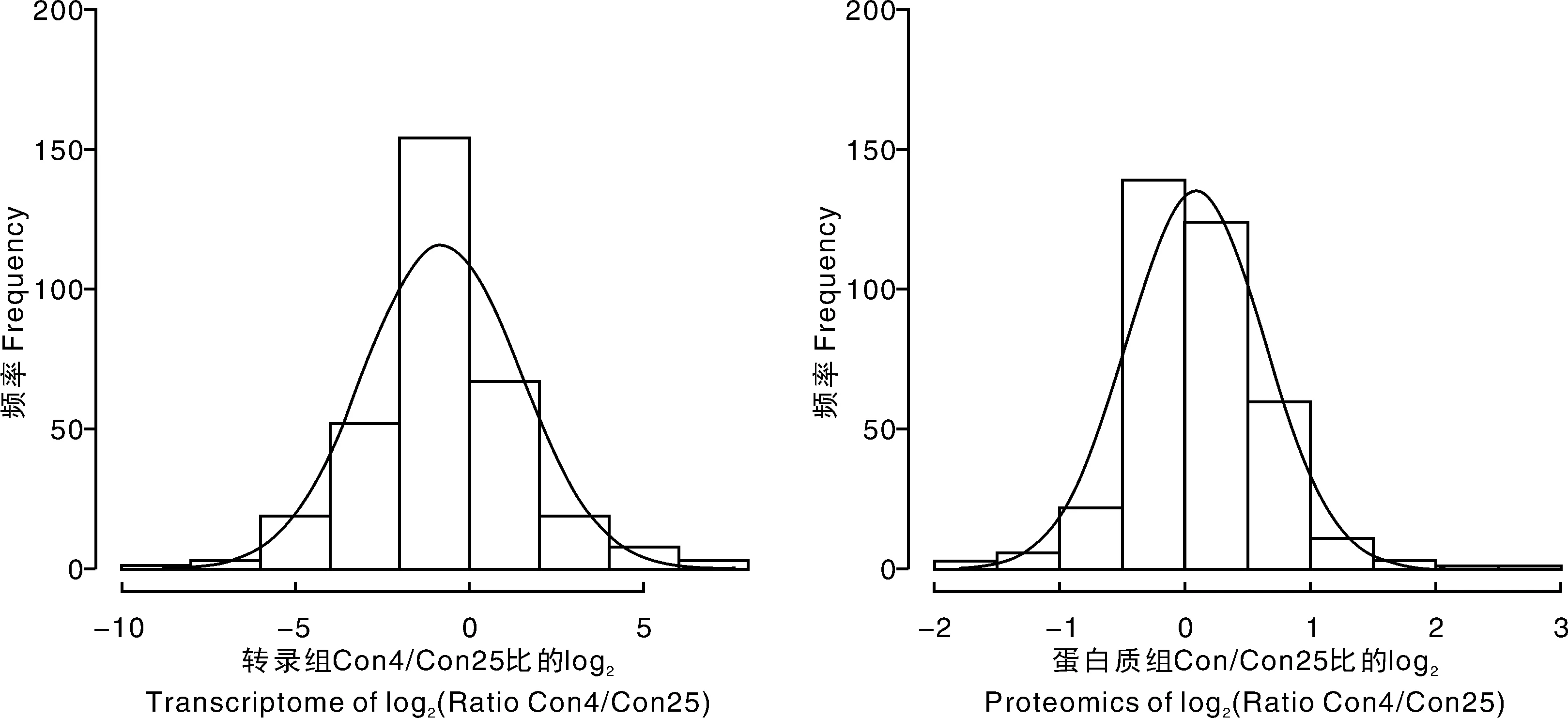
图1 黄独低温保存微型块茎差异转录本和蛋白比例密度曲线Fig.1 Differential transcript and protein density profile of Dioscorea bulbifera L. microtuber conserved at low temperature
2.3 Venn图比较分析
以蛋白组获得的蛋白为基础,同时对Con4和Con25中的差异蛋白和差异转录本进行韦恩图分析。由图2可知,Con4和Con25中共有84个转录本在转录组和蛋白质组中的表达均有差异,表明大多数差异转录本在蛋白质组中均有差异。
表1黄独低温保存微型块茎转录组、蛋白组部分差异表达结果
Table1Partial differential expression in transcriptome and proteome ofDioscoreabulbiferaL. microtuber conserved at low temperature

基因名称Genename转录组Transcriptome上/下调Up/down表达量倍性变化的对数Logarithmofgeneploidyvaria-tion蛋白质组Proteome蛋白倍性变化Variationofproteincontent蛋白量倍性变化的对数Logarithmofproteincon-tentploidyvariation上/下调Up/downHEXA_B下调Down-1.662970.718-0.47794下调DownRFWD2.COP1下调Down-3.55020.639-0.64611下调DownE1.11.1.7下调Down-1.440570.535-0.90239下调DownGLGP.PYG下调Down-7.051420.386-1.37333下调DownGST.GST下调Down-1.459430.738-0.43831下调DownE3.2.1.86B.BGLA下调Down未获得Notapplicable0.644-0.63487下调DownAMYA.MALS下调Down-1.725830.349-1.5187下调DownPLD1_2下调Down-1.834780.745-0.42469下调DownGST.GST下调Down-4.19640.652-0.61706下调DownFDH下调Down-2.397250.591-0.75877下调DownRHM下调Down未获得Notapplicable1.9950.996389上调UpMETE下调Down-1.975751.5260.609755上调UpMETK下调Down-1.142792.741.454176上调UpATPF1A.ATPA上调Up2.8073551.5570.638769上调UpMETK下调Down-1.556042.0131.009347上调UpGDHA上调Up1.1890342.3691.244278上调UpMDH2上调Up未获得Notapplicable1.6190.695103上调UpMETE下调Down-2.121021.70.765535上调UpHPPA下调Down-2.860461.6770.745883上调UpPDXS.PDX1下调Down-1.591241.5580.639695上调UpISPH.LYTB下调Down-1.284531.5820.66175上调UpPGD.GND下调Down未获得Notapplicable4.5312.179829上调UpPGK.PGK上调Up未获得Notapplicable3.9971.998918上调UpGAPDH.GAPA上调Up未获得Notapplicable1.030.042644无变化NochangeALDO下调Down-1.619520.846-0.24127无变化NochangeMETE下调Down-2.536051.3230.403813无变化NochangeENO.ENO上调Up3.946050.839-0.25326无变化NochangeE3.6.3.6上调Up3.8073551.2560.328836无变化NochangeATPEV1A.ATP6A上调Up未获得Notapplicable1.0610.085425无变化NochangeLOX1_5下调Down-4.481130.904-0.14561无变化NochangeATPEV1A.ATP6A下调Down-1.510470.95-0.074无变化NochangeASNB.ASNS上调Up未获得Notapplicable1.1640.219091无变化NochangeNOP1.FBL下调Down-5.321931.3770.461529无变化NochangeALDO下调Down-1.046540.885-0.17625无变化NochangeMAEB下调Down-1.259060.824-0.27928无变化NochangePK.PYK上调Up2.6130730.989-0.01596无变化NochangeMETE下调Down-2.562161.4590.54498无变化NochangeCHS上调Up3.4059921.0350.049631无变化NochangeE3.2.1.21下调Down-2.169930.782-0.35476无变化NochangeALDO下调Down-2.165340.909-0.13765无变化NochangeASD上调Up2.1203520.772-0.37333无变化Nochange
续表1
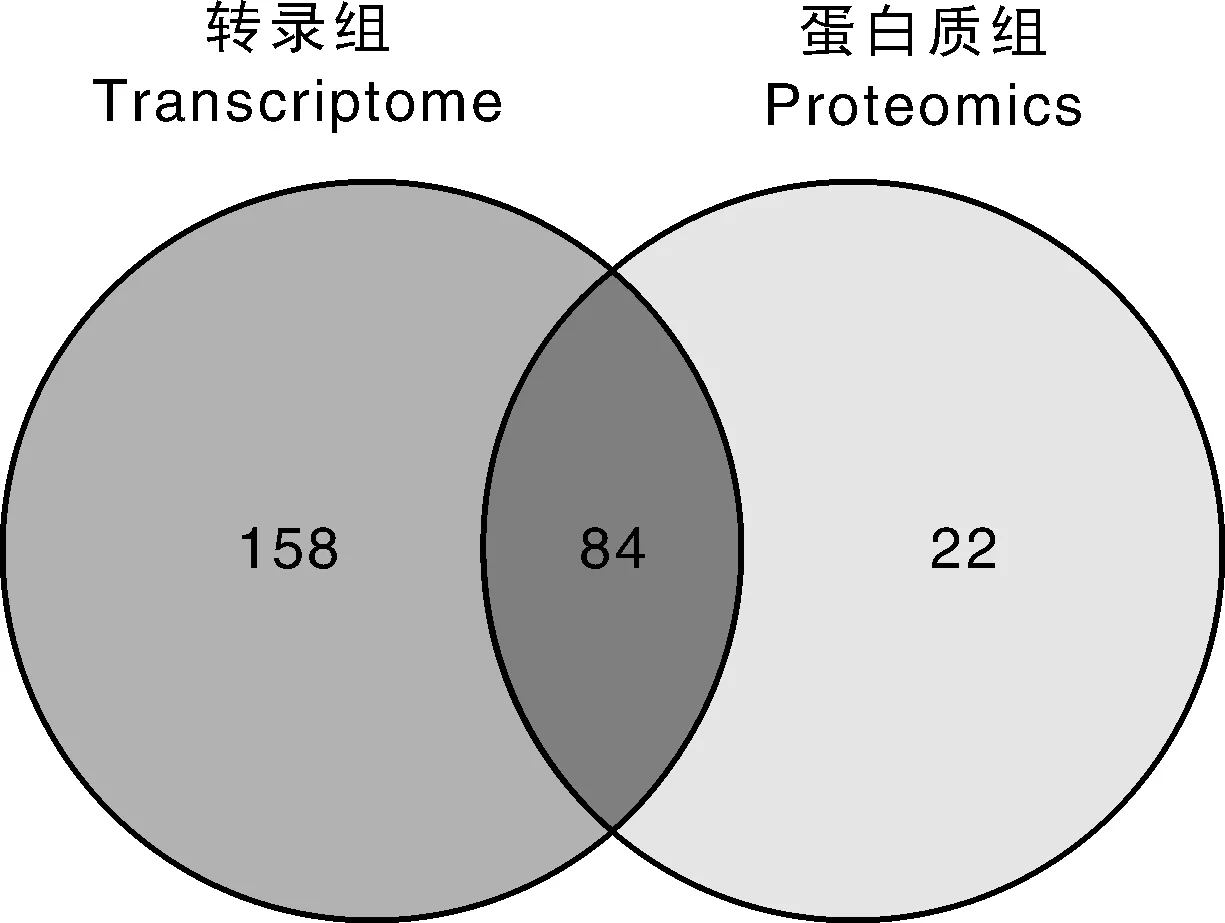
图2 黄独低温保存微型块茎差异转录本和蛋白维恩图分析Fig.2 Venn diagram analysis of differential transcripts and proteins of Dioscorea bulbifera L. microtuber conserved at low temperature
2.4 热图比较分析
以蛋白组获得的蛋白为基础,对差异蛋白和差异转录本的Con4/Con25各蛋白比例的log2进行热图分析,比较两者之间的异同。从图3可知,相对于蛋白组来说,转录组差异程度更大,两者差异蛋白多数一致,少数不同。两者均表现差异的基因主要有氨基己糖苷酶、过氧化物酶、淀粉磷酸化酶、谷胱甘肽S-转移酶、6-磷酸-β-葡糖苷酶、α-淀粉酶 、高半胱氨酸甲基转移酶、S-腺苷甲硫氨酸合成酶、F型H +转运ATP酶α亚基、谷氨酸脱氢酶(NADP+)、苹果酸脱氢酶酶、6-磷酸葡萄糖酸脱氢酶、磷酸甘油酸激酶等。
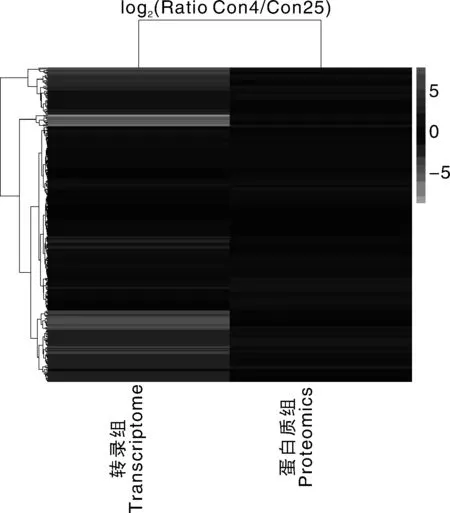
聚类软件为R语言(www.r-project.org)包Pheatmap。红色是表达显著上调的蛋白,绿色表示表达显著下调的蛋白The clustering software was R language pack (www.r-project.org) Pheatmap. Red meant significantly up-regulated proteins, and green meant significantly down-regulated proteins图3 黄独低温保存微型块茎差异转录本和蛋白比例热图Fig.3 Thermography of differential transcripts and proteins ratio of Dioscorea bulbifera L. microtuber conserved at low temperature
2.5 散点关联密度图比较
以蛋白组获得的蛋白为基础,同时对差异蛋白和差异转录本中各蛋白Con4/Con25比例的log2值进行散点关联密度图分析,比较两者的异同。从图4可知,两者的比例在0附近居多,左下角和右上角(转录本和蛋白的上下调关系一致)相对左上角和右下角(转录本和蛋白的上下调关系不一致)更多,表明两者差异表达趋势一致性的程度更高。
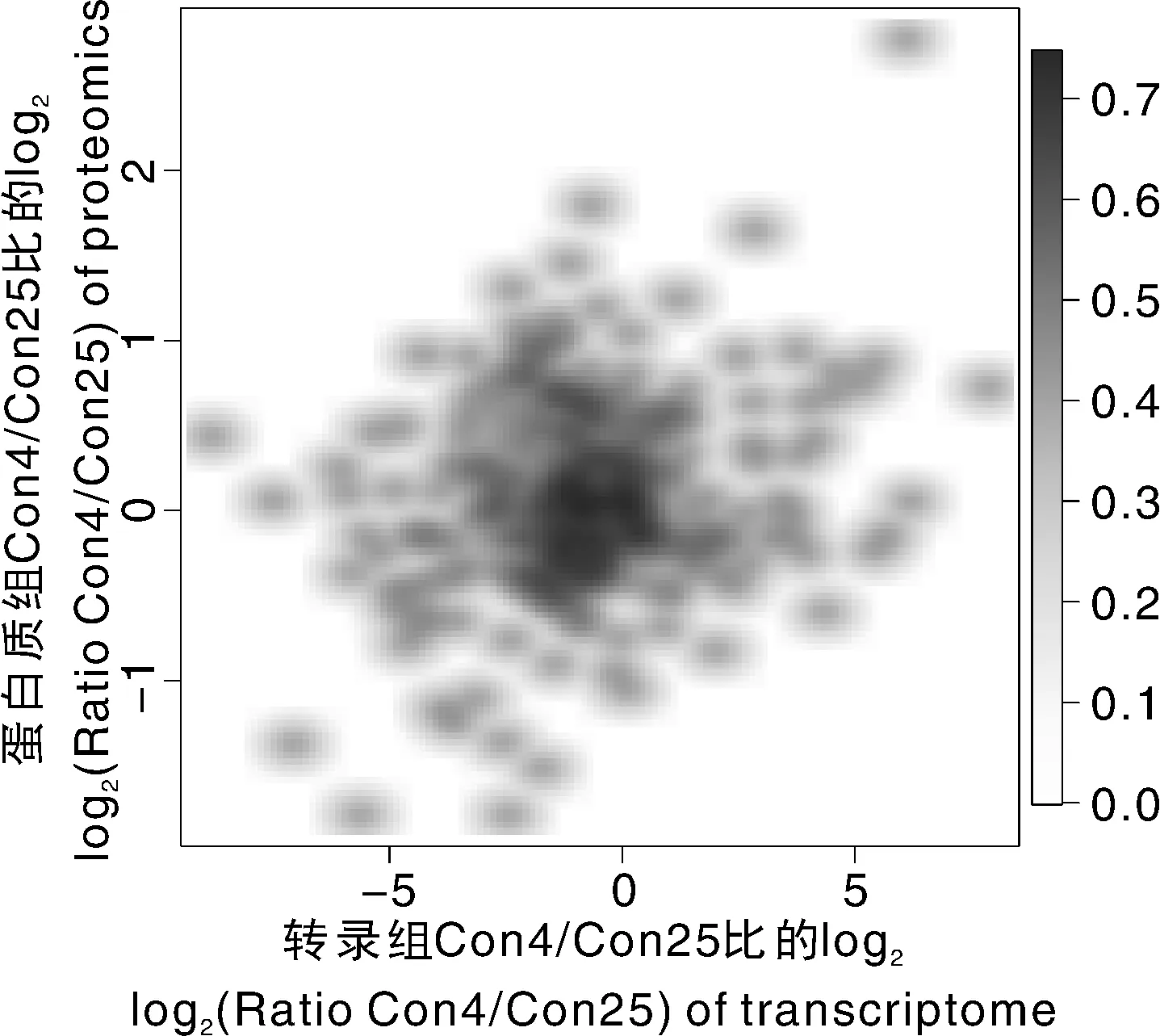
图4 黄独低温保存微型块茎差异转录本和蛋白比例散点密度图分析Fig.4 Density map analysis of differential transcripts and proteins of Dioscorea bulbifera L. microtuber conserved at low temperature
2.6 代谢通路综合分析
在生物体内,不同蛋白相互协调行使其生物学功能,通过通路显著性富集能确定差异表达蛋白参与的最主要生化代谢途径和信号转导途径,KEGG(Kyoto Encyclopedia of Genes and Genomes)是有关通路的主要公共数据库。与常温离体保存相比,低温离体保存的黄独微型块茎转录组分析表明,样本差异基因富集的KEGG途径有钙信号通路、柠檬酸循环(TCA循环)、氧化磷酸化、黄酮和黄酮醇的生物合成等(表2)。蛋白质组分析表明,黄独低温保存微型块茎部分差异蛋白富集的GO term有谷胱甘肽转移酶活性、高尔基液泡运输和披网格蛋白小泡膜等(表3)。代谢组分析表明,差异性代谢物有丙氨酸、儿茶素和水杨酸等(表4)。其中,丙氨酸参与氰基氨基酸代谢,儿茶素参与次生代谢产物生物合成、黄酮类化合物的生物合成和苯丙素的生物合成;水杨酸参与多环芳烃降解、微生物在不同环境中的代谢,植物激素信号转导,次生代谢产物生物合成,二恶英降解,苯丙氨酸代谢,芳烃降解,植物激素生物合成,铁载体组非核糖体肽合成和苯丙素的生物合成等。
表2黄独低温保存微型块茎部分差异基因富集的KEGG途径
Table2KEGG pathways of part differentially expressed genes ofDioscoreabulbiferaL. microtuber conserved at low temperature
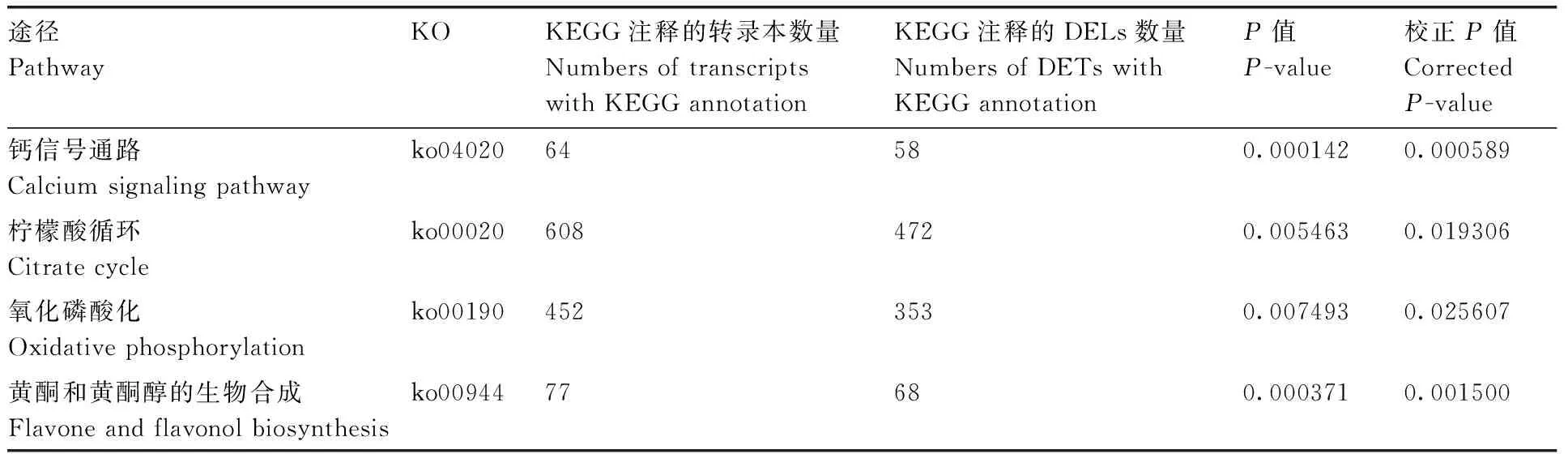
途径PathwayKOKEGG注释的转录本数量NumbersoftranscriptswithKEGGannotationKEGG注释的DELs数量NumbersofDETswithKEGGannotationP值P-value校正P值CorrectedP-value钙信号通路Calciumsignalingpathwayko0402064580.0001420.000589柠檬酸循环Citratecycleko000206084720.0054630.019306氧化磷酸化Oxidativephosphorylationko001904523530.0074930.025607黄酮和黄酮醇的生物合成Flavoneandflavonolbiosynthesisko0094477680.0003710.001500
表3黄独低温保存微型块茎部分差异蛋白富集的GO terms
Table3Enriched GO terms of part differentially proteins ofDioscoreabulbiferaL. microtuber conserved at low temperature

类别CategoryP值P-value差异蛋白数量Numberofdifferentialproteins蛋白数量Numberofproteins功能描述信息Functiondescriptioninformation功能信息FunctionalinformationGO:00043640.01304748434谷胱甘肽转移酶活性Glutathionetransferaseactivity分子功能MolecularfunctionGO:00068960.02403472422高尔基液泡运输Golgitovacuoletransport生物学功能BiologicalprocessGO:00306650.02403472422披网格蛋白小泡膜Clathrin-Coatedvesiclemembrane细胞组件Cellularcomponent
表4黄独低温保存微型块茎部分差异代谢物
Table4Differential metabolites inDioscoreabulbiferaL. microtuber conserved at low temperature
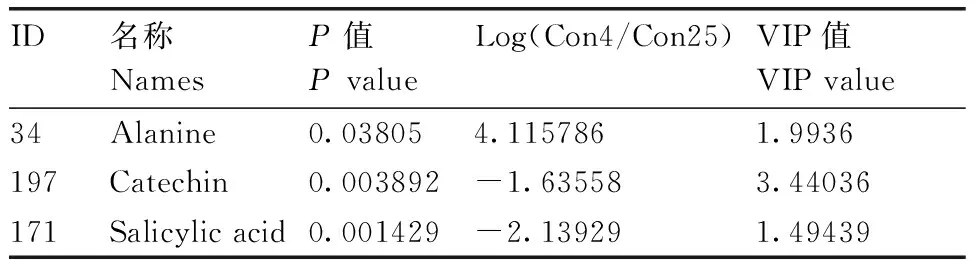
ID名称NamesP值PvalueLog(Con4/Con25)VIP值VIPvalue34Alanine0.038054.1157861.9936197Catechin0.003892-1.635583.44036171Salicylicacid0.001429-2.139291.49439
VIP值,对模型贡献度大(超过1)的化合物的值,一般根据PLS-DA模型的VIP值大于1、P<0.05的原则获得差异性物质。
The VIP value refered to the value of the compounds which were more than 1 and contributed greatly to the model. In generally, differential substances were obtained according to the principle that the VIP value of the PLS-DA model was greater than 1 and thePvalue was less than 0.05.
3 讨论
系统生物学的发展产生了海量的基因组、转录组、蛋白质组和代谢组等组学数据。基于多平台组学数据整合的代谢通路分析为全面深刻了解生物系统提供了前提条件[9]。近年来,系统生物学已逐渐成为后基因组学时代生命科学研究的新热点。转录组学、蛋白质组学、代谢组学技术是目前系统生物学研究的重要方法。通过转录组学、蛋白质组学和代谢组学数据关联分析,可以深入理解基因、蛋白质和代谢物之间的内在联系[10]。张振亚等[11]对正常培养和盐胁迫条件下的2个南方型紫花苜蓿的根系进行转录组和蛋白质组关联分析,发现了紫花苜蓿耐盐相关候选基因。马进等[8]通过蛋白质组和转录组关联分析,揭示了南方型紫花苜蓿适应盐胁迫环境的分子机制。张黛静等[12]通过对铜胁迫下小麦幼根转录组学及蛋白质组学的研究,发现小麦在重金属逆境中转录水平和翻译水平具有一致性,差异均表现在代谢、物质合成、糖酵解等生命活动方面。本研究通过黄独微型块茎低温离体保存转录组、蛋白质组和代谢组的关联分析,发现转录本和蛋白的比例均呈现正态分布,两者比较类似,符合真实生物样品的要求;黄独低温离体保存微型块茎差异基因富集的KEGG途径主要有钙信号通路、柠檬酸循环、氧化磷酸化、黄酮和黄酮醇的生物合成等,差异蛋白富集的GO term主要有谷胱甘肽转移酶活性、高尔基液泡运输和披网格蛋白小泡膜等;差异代谢物主要有丙氨酸、儿茶素和水杨酸等。黄独微型块茎低温离体保存的主要差异基因有过氧化物酶、谷胱甘肽S-转移酶、淀粉磷酸化酶、S-腺苷甲硫氨酸合成酶、谷氨酸脱氢酶(NADP+)、苹果酸脱氢酶、6-磷酸葡萄糖酸脱氢酶、磷酸甘油酸激酶等,这些基因大多与柠檬酸循环、氧化磷酸化相关。究其原因,推测与黄独微型块茎低温保存需要较多能量供应有关。可见,黄独微型块茎低温离体保存的转录水平、翻译水平以及代谢水平具有一致性。
基因表达的主要环节包括转录、蛋白质合成以及代谢物的形成。因此,从生长条件和状态相同的细胞、组织或器官获得的转录组、蛋白质组和代谢物数据之间应该具有较高的相关性[13]。Koh等[14]比较了干旱胁迫下油菜的20个基因在转录和蛋白质水平的表达,发现尽管有些基因转录本和蛋白的表达模式不尽相同,但二者之间仍存在显著正相关。Budak等[15]发现,硬粒小麦品种Kiziltan和野生二粒小麦系TR39477、TTD22(T)在有些胁迫条件下,转录本的变化和蛋白水平的变化一致,但也有部分转录本的变化和蛋白水平的变化趋势相反。本研究结果与这2项研究结果相一致。本研究中,黄独微型块茎低温离体保存的差异蛋白和差异转录本韦恩图分析结果表明,84个转录本在两者中均为差异,表明大多数差异的转录本在蛋白组数据均为差异。差异蛋白和差异转录本的log2对数热图分析结果也表明,相对于蛋白组来说,转录组差异的程度更大,蛋白组数据差异的程度较小。两者差异蛋白多数一致,少数有不同。差异蛋白和差异转录本log2散点关联密度图分析结果表明,两者的比例在0附近居多,左下角和右上角(转录和蛋白上下调关系一致)相对左上角和右下角(转录和蛋白上下调关系不一致)更多,表明两者差异表达趋势一致性程度更高。但Peng等[16]在模拟干旱胁迫下,对体细胞杂交小麦品种Shanrong 3及其亲本面包小麦品种Jinan 177苗期叶片和根进行蛋白质组学和转录组学分析,发现仅有20个(27.0%)差异表达蛋白在转录水平与蛋白水平有相关性,指出其蛋白质组和转录组之间的相关性不强。黄独微型块茎低温离体保存的转录组、蛋白质组和代谢组的关联分析,可以为黄独微型块茎低温离体保存提供理论依据。
[1] PASSAM H C, WICKHAM L D, WILSON L A. Comparative observations on the polarity of sprouting of bulbils ofDioscoreabulbiferaL. andDioscoreaalataL.[J].AnnalsofBotany, 1982, 49(3): 359-366.
[2] TEPONNO R B, PONOU B K, TAPONDJOU L A, et al. Bafoudiosbulbin H, a new clerodane diterpene from the flowers ofDioscoreabulbiferaL. varsativa[J].PhytochemistryLetters, 2013, 6(2): 310-314.
[3] 刘劲松, 高卫娜, 郑娟, 等. 黄独鲜块根化学成分研究[J]. 中国中药杂志, 2017, 42(3): 510-516.
LIU J S, GAO W N, ZHENG J, et al. Chemical constituents from fresh tubers ofDioscoreabulbifera[J].ChinaJournalofChineseMateriaMedica, 2017, 42(3): 510-516. (in Chinese with English abstract)
[4] 尹明华, 洪森荣. 黄独的茎尖培养和病毒检测[J]. 中草药, 2009, 40(9): 1462-1466.
YIN M H, HONG S R. Shoot tip culture and virus detection ofDioscoreabulbifera[J].ChineseTraditionalandHerbalDrugs, 2009, 40(9): 1462-1466. (in Chinese with English abstract)
[5] 王运英, 张晓丽, 白英豪, 等. 山药微型块茎萌发影响因素研究[J]. 北方园艺, 2015 (17): 194-196.
WANG Y Y, ZHANG X L, BAI Y H, et al. Impact factors in germination of microtubers fromDioscoreaopposite[J].NorthernHorticulture, 2015 (17): 194-196. (in Chinese with English abstract)
[6] 李明军, 邓丽, 刘欣英, 等. 生长素和细胞分裂素对怀山药微型块茎诱导形成的影响[J]. 河南农业科学, 2008, 37(11): 102-106.
LI M J, DENG L, LIU X Y, et al. Effects of auxin and cytokinin on the induction of microtuber ofDisocoreaoppositaThunb.[J].JournalofHenanAgriculturalSciences, 2008, 37(11): 102-106. (in Chinese with English abstract)
[7] 尹明华, 洪森荣, 夏瑾华, 等. 黄独微型块茎低温保存及其萌发苗遗传稳定性研究[J]. 广西植物, 2015 (5): 733-740.
YIN M H, HONG S R, XIA J H, et al. Low temperature conservation ofDioscoreabulbiferamicrotuber and genetic stability of its germination seedling[J].Guihaia, 2015 (5): 733-740. (in Chinese with English abstract)
[8] 马进, 郑钢, 裴翠明, 等. 南方型紫花苜蓿叶片响应盐胁迫蛋白质组和转录组关联分析[J]. 核农学报, 2016, 30(9): 1706-1715.
MA J, ZHENG G, PEI C M, et al. Correlation analysis on proteomic and transcriptomic of salt-response in leaves of southern typeAlfalfa[J].JournalofNuclearAgriculturalSciences, 2016, 30(9): 1706-1715. (in Chinese with English abstract)
[9] 周滔, 李静宜, 马毅, 等. 基于组学数据库整合工具的代谢通路分析应用[J]. 国际药学研究杂志, 2015, 42(5): 587-592.
ZHOU T, LI J Y, MA Y, et al. Metabolic pathway analysis and application based on the database and integrated tool of omics[J].JournalofInternationalPharmaceuticalResearch, 2015, 42(5): 587-592. (in Chinese with English abstract)
[10] WU H X, JIA H M, MA X W, et al. Transcriptome and proteomic analysis of mango (MangiferaindicaLinn) fruits[J].JournalofProteomics, 2014, 105: 19-30.
[11] 张振亚, 裴翠明, 马进. 基于转录组和蛋白质组关联研究技术筛选紫花苜蓿耐盐相关候选基因[J]. 植物生理学报, 2016, 52(3): 317-324.
ZHANG Z Y, PEI C M, MA J. Screening of candidate salt tolerance-related genes inalfalfabased on transcriptome-proteome correlation research techniques[J].PlantPhysiologyJournal, 2016, 52(3): 317-324. (in Chinese with English abstract)
[12] 张黛静, 王多多, 董文,等. 铜胁迫下小麦幼根转录组学及蛋白质组学研究[J]. 河南农业科学, 2015, 44(4): 31-35.
ZHANG D J, WANG D D, DONG W, et al. Transcriptomics and proteomics analysis in root of wheat under copper stress[J].JournalofHenanAgriculturalSciences, 2015, 44(4): 31-35. (in Chinese with English abstract)
[13] 张红亮, 王道文, 张正斌. 利用转录组学和蛋白质组学技术揭示小麦抗旱分子机制的研究进展[J]. 麦类作物学报, 2016, 36(7): 878-887.
ZHANG H L, WANG D W, ZHANG Z B. Progress and prospects in the research on wheat drought response and resistance mechanisms using transcriptomic and proteomic approaches[J].JournalofTriticeaeCrops, 2016, 36(7): 878-887. (in Chinese with English abstract)
[14] KOH J, CHEN G, YOO M J, et al. Comparative proteomic analysis ofBrassicanapusin response to drought stress[J].JournalofProteomeResearch, 2015, 14(8): 3068-3081.
[15] BUDAK H, AKPINAR B A, UNVER T, et al. Proteome changes in wild and modern wheat leaves upon drought stress by two-dimensional electrophoresis and nanoLC-ESI-MS/MS[J].PlantMolecularBiology, 2013, 83(1): 89-103.
[16] PENG Z, WANG M, LI F, et al. A proteomic study of the response to salinity and drought stress in an introgression strain of bread wheat[J].Molecular&CellularProteomics, 2009, 8(12): 2676-2686.
(责任编辑侯春晓)
Correlationanalysisoftranscriptome,proteomeandmetabolomeofDioscoreabulbiferaL.microtubersconservedinvitroatlowtemperature
HONG Senrong, WU-XIA Junpeng, XU Wenhui, ZHAN Xuelin, XIE Ni’ni, JIANG Yan, WANG Jinhua, LING Fei, WU Lixia, WAN Lin
(CollegeofLifeSciences,ShangraoNormalUniversity,Shangrao334001,China)
In order to explore the internal mechanism ofDioscoreabulbiferaL. microtubers conservedinvitroat low temperature, the correlation of transcriptome, proteome and metabolome was analyzed. The results showed that Log2of transcript ratio and protein ratio ofD.bulbiferaL. microtubers conservedinvitroat low temperature and room temperature all showed normal distribution, which were very similar and consistent with the requirements of real biological samples; Wayne plot analysis of differential proteins and differential transcripts showed that the 84 transcripts were different in both groups, indicating that most of the transcripts were differentially expressed in proteome data; Log2logarithm thermal analysis of differential proteins and differential transcripts showed that the difference in transcriptome was greater than that in proteome, most of their differential transcripts were consistent, few were different; Analysis of log2logarithmic scatter correlation density plot showed that ratio of differential proteins and transcripts was in the vicinity of 0, the lower left corner and upper right corner that indicating the up/down regulation relationship of transcripts and proteins was consistent were more compared with the upper left corner and lower right corner that indicating the up/down regulation relationship of transcripts and proteins was not consistent, which indicated that consistency degree of the trend of differential expression was higher. Correlation analysis results of transcriptome, proteome and metabolome showed that conservationinvitroofD.bulbiferaL. microtubers at low temperature mainly involved the pathway, such as carbon metabolism, amino acid biosynthesis, glycolysis, starch and sucrose metabolism, and pyruvate metabolism etc., which could provide a theoretical basis for conservationinvitroat low temperature and low temperature breaking dormancy forD.bulbiferaL. microtubers.
DioscoreabulbiferaL.; microtuber; conservationinvitroat low-temperature; transcriptome; proteome; metabolome
洪森荣,吴夏俊鹏,徐文慧, 等. 低温离体保存黄独微型块茎转录组、蛋白质组和代谢组的关联分析[J]. 浙江农业学报, 2017, 29(11): 1827-1834.
10.3969/j.issn.1004-1524.2017.11.08
2017-04-05
国家自然科学基金项目(31360072)
洪森荣(1974—),男,江西永新人,硕士,教授,研究方向为药用植物生物技术。E-mail: hongsenrong@163. com
S632.1
A
1004-1524(2017)11-1827-08

