食管癌术后食管主动脉瘘相关危险因素的病例对照研究
邓 益,程 念,曾 莉,黄朝琼,王曾辉
(第三军医大学大坪医院野战外科研究所:1.肿瘤科;2.全军胸外科研究所,重庆 400042)
食管癌术后食管主动脉瘘相关危险因素的病例对照研究
邓 益1,程 念2△,曾 莉2,黄朝琼2,王曾辉2
(第三军医大学大坪医院野战外科研究所:1.肿瘤科;2.全军胸外科研究所,重庆 400042)
食管主动脉瘘;危险因素;病例对照研究
食管主动脉瘘(AEF)是食管癌术后一种罕见的严重并发症[1]。临床大多表现为急剧凶险的突发性大呕血,患者多因出血性休克或窒息死亡。详细了解AEF的发病原理、发病过程可以有效减少其发生率,从而控制和降低病死率。为探讨食管癌术后AEF的相关因素,本文对本院胸外科食管癌术后发生AEF的相关危险因素进行了配比病例对照研究,现将结果报道如下。
1 资料与方法
1.1一般资料 选择本院胸外科2000-2015年食管癌术后临床诊断为AEF患者18例为观察组,男11例,女7例,平均年龄(69.0±9.2)岁。另选本科同期具备近似基础疾病或危险因素的食管癌患者术后未发生AEF 54例为对照组。观察组与对照组按1∶3进行配比。病例入选条件包括:(1)性别相同;(2)出生日期相差不超过 1年;(3)肿瘤pTNM分期一致;(4)肿瘤位置一致。两组性别、年龄、pTNM分期及肿瘤部位等因素差异无统计学意义(P>0.05),具有可比性。
1.2诊断标准 两组患者经术后病理学确诊为食管鳞癌,采用pTNM分期,并根据病理学诊断明确淋巴结转移情况。AEF的诊断采用临床诊断,即Chiari 三联征(胸骨后疼痛、信号性动脉出血和无症状间歇期后致命性大出血)[2];肺部并发症(PPCs)根据美国内科学会于2006年提出的《围术期肺部并发症的评估和处理指南》[3];高脂血症诊断符合中国成年人血脂防治指南标准;肥胖诊断标准按照体质量指数(BMI)=体质量(kg)/身高2(m2);淋巴结清扫数目以第7版国际抗癌联盟(UICC)提出建议以12枚淋巴结为标准[4]。
1.3方法 采用1∶3配比的病例对照研究方法,对观察组和对照组患者资料进行回顾性调查,内容主要包括:(1)手术操作时间;(2)术前肥胖情况;(3)术中出血量;(4)术前胆固醇水平;(5)手术吻合方式;(6)术后有无肺部并发症;(7)术后有无心律失常;(8)术前有无高血压;(9)术前有无糖尿病;(10)术中淋巴结清扫数目。具体赋值见表1。
1.4统计学处理 采用SPSS23.0统计软件进行分析。配对两分类资料先用χ2检验法进行单因素分析,以P<0.05为差异有统计学意义。在单因素分析结果基础上用非条件Logistic回归模型进行多因素综合分析,筛选对术后AEF发病影响显著的危险因素。

表1 主要研究因素及赋值方法
2 结 果
2.1单因素分析 运用单因素条件Logistic回归对食管癌术后AEF的10个相关因素进行分析,初筛出5个可疑危险因素,包括术前肥胖、术前低密度脂蛋白、术后肺部并发症、手术吻合方式及淋巴结清扫数目,其余因素差异无统计学意义(P>0.05)。变量分析结果见表2。

表2 观察组与对照组单因素分析结果
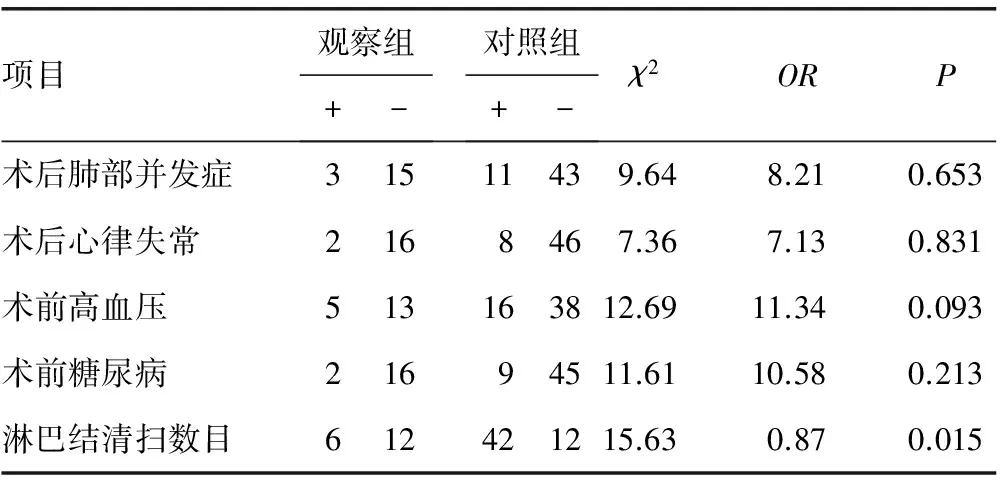
续表2 观察组与对照组单因素分析结果
2.2多因素分析结果 应用非条件Logistic逐步回归分析方法,让单因素分析显著的5个变量进入Logistic回归分析模型,选取进入变量的不同X2,直到模型中的所有变量均显著为止。结果显示术前肥胖(OR=8.63,95%CI=1.35~17.60)、术前低密度脂蛋白(OR=0.81,95%CI=0.23~0.98)、淋巴结清扫数目(OR=0.32,95%CI=0.14~0.59)与食管癌术后AEF存在相关,见表3。

表3 观察组与对照组多因素分析结果
3 讨 论
AEF是食管癌术后的严重并发症,文献报道对于Ⅳ期无法手术治疗患者行放化疗后,AEF的发生率高达18%~29%[5]。在本研究中食管癌术后AEF发生率为0.47%,远低于放化疗的AEF发生率。但食管癌术后出现AEF的发生率及相关危险因素目前没有相关文献报道。由于食管癌术后AEF较为罕见,本文采用配比病例对照研究。随着配比数的增加,研究的精度将明显提高,结合配比研究的灵敏度及稳定性最适配比以1∶3或 1∶4左右为宜[6]。同时考虑该并发症发病率较低,病例数较少,本研究采用1∶3病例配比。
文献报道低胆固醇血症是放化疗后AEF的危险因素[7]。另有研究表明,术前低胆固醇血症与非小细胞肺癌术后生存率相关[8],但其中的机制还不明确。在本研究中发现,术前低水平低密度脂蛋白(LDL)是食管癌术后AEF的危险因素。LDL可以通过引起细胞炎性反应[9],并通过脂质过氧化产物如氧化低密度脂蛋白(oxLDL)参与体内氧化应激,从而在肿瘤的发展中发挥了关键作用[10]。Sonoda等[11]报道LDL受体相关蛋白1B在食管癌中表达明显降低,同时通过甲基化LDL受体相关蛋白1B能诱导食管癌的发生。低水平LDL与受试者颅内出血风险相关[12],LDL结构的改变还能会引起大动脉的功能和抗动脉粥样硬化作用的改变,促进主动脉硬化[13]。这些因素都是造成食管癌术后AEF的原因,有待进一步研究。
在本研究中食管癌的病变位置不是发生AEF的主要因素,可能与术中病变完整的切除有关。本研究根据第7版国际抗癌联盟(UICC)提出建议以12枚淋巴结为标准,发现淋巴结清扫数目与AEF发生相关。尽管目前对食管癌患者术中淋巴结清扫的数目存在争议,但术中淋巴结清扫数目是影响食管癌患者预后的独立影响因素已得到广泛的认同[14]。淋巴结导致肿瘤复发及向主动脉的转移可能是造成食管癌术后AEF的危险因素。由于食管癌存在多点起源和黏膜下跳跃式转移的生物学特点,导致食管切除后行胸内淋巴结癌细胞残留率高[15]。上述均证明了广泛淋巴结清扫在食管癌切除术中的必要性。由于食管癌术后AEF的发生率较低,还需要进一步观察研究。
研究表明,肥胖与中国人群食管癌发病风险呈负相关(OR=0.56,95%CI:0.35~0.90),并且这种负相关不受研究类型、地区、BMI 获取方式和病例来源的影响[16]。但本研究发现,肥胖(高BMI)是AEF发生的危险因素。Heys等[17]研究认为肥胖因素通常不利于手术的开展或者容易导致部分并发症的增加。有研究认为食管癌患者术后吻合口瘘的发生率随着BMI的增大而逐渐增加[18],可能与手术时间较长,术后易发生脂肪液化及肥胖导致肺容积下降,肺部并发症发生率较高等因素有关[19]。同时BMI较高的患者高血压发生率明显增高,主动脉压力较高,高张力的主动脉与食管接触后更容易导致AEF的发生[20]。
本研究采取严格配对的病例对照设计,有效提高了检验效率,探讨了食管癌术后AEF与多种因素具有相关性。本研究初步发现,术前肥胖(高BMI)、术前低水平LDL、术中淋巴结清扫数目是食管癌术后发生AEF的危险因素,临床工作中应给予高度重视并提供有效的干预措施,从而达到改善患者预后的目标。但本研究病例数较少,还有待今后进一步加大样本量研究。
[1]田烨,周凌霄,任光.1 208例食管癌患者术后吻合口瘘风险因素分析[J].重庆医学,2016,43(15):1924-1927.
[2]Hollander JE,Quick G.Aortoesophageal fistula:a comprehensive review of the literature[J].Am J Med,1991,91(3):279-287.
[3]Damian D,Esquenazi J,Duvvuri U,et al.Incidence,outcome,and risk factors for postoperative pulmonary complications in head and neck cancer surgery patients with free flap reconstructions[J].J Clin Anesth,2016,28(28):12-18.
[4]李林峻,吴庆琛,张敏,等.影响食管癌患者预后因素的Cox回归分析[J].重庆医学,2016,45(1):66-68.
[5]Nishimura Y,Suzuki M,Nakamatsu K,et al.Prospective trial of concurrent chemoradiotherapy with protracted infusion of 5-fluorouracil and cisplatin for T4 esophageal cancer with or without fistula[J].Int J Radiat Oncol Biol Phys,2002,53(1):134-139.
[6]Tang YQ.Comments on `sample size evaluation for a multiply matched case-control study using the score test from a conditional logistic (discrete cox PH) regression model[J].Stat Med,2009,28(1):175-177.
[7]Taniguchi H,Yamazaki K,Boku N,et al.Risk factors and clinical courses of chemoradiation-related arterio-esophageal fistula in esophageal cancer patients with clinical invasion of the aorta[J].Int J Clin Oncol,2011,16(4):359-365.
[8]Sok M,Ravnik J,Ravnik M.Preoperative total serum cholesterol as a prognostic factor for survival in patients with resectable non-small-cell lung cancer[J].Wien Klin Wochenschr,2009,121(9/10):314-317.
[9]Mandal CC,Sharma A,Panwar MS,et al.Is cholesterol a mediator of cold-induced cancer?[J].Tumour Biol,2016,37(7):9635-9648.
[10]Wells BJ,Mainous AG,Everett CJ,et al.Iron,cholesterol,and the risk of cancer in an 18-year cohort[J].Asian Pac J Cancer Prev,2005,6(4):505-509.
[11]Sonoda I,Imoto I,Inoue J,et al.Frequent silencing of low density lipoprotein receptor-related protein 1B (LRP1B) expression by genetic and epigenetic mechanisms in esophageal squamous cell carcinoma[J].Cancer Res,2004,64(11):3741-3747.
[12]Lee JG,Koh SJ,Yoo SY,et al.Characteristics of subjects with very low serum low-density lipoprotein cholesterol and the risk for intracerebral hemorrhage[J].Korean J Intern Med,2012,27(3):317-326.
[13]Twardowski L,Cheng F,Michaelsen J,et al.Enzymatically modified Low-Density lipoprotein is present in all stages of aortic valve sclerosis:implications for pathogenesis of the disease[J].J Am Heart Assoc,2015,4(10):e002156.
[14]Ninomiya I,Okamoto K,Tsukada T,et al.Recurrence patterns and risk factors following thoracoscopic esophagectomy with radical lymph node dissection for thoracic esophageal squamous cell carcinoma[J].Mol Clin Oncol,2016,4(2):278-284.
[15]Yamamoto Y,Tanaka H,Maruyama T,et al.Long-term survival of a patient with esophageal cancer with brain metastasis after multidisciplinary therapy-a case report[J].Gan to Kagaku Ryoho,2014,41(12):2006-2009.
[16]郭兰伟,刘曙正,张韶凯,等.中国人群体重指数与食管癌发病风险的Meta分析[J].现代预防医学,2015,42(17):3085-3088.
[17]Heys SD,Schofield AC,Wahle KW,et al.Nutrition and the surgical patient:triumphs and challenges[J].Surgeon,2005,3(3):139-144.
[18]朱学应,陈浩,高理锦,等.体重指数与食管癌切除术后预后之间的关系[J].安徽医学,2011,15(3):347-349.
[19]Adams JP,Murphy PG.Obesity in anaesthesia and intensive care[J].Br J Anaesth,2000,85(1):91-108.
[20]刘晓梅,张瑾熔,阿衣古丽·哈热,等.食管癌同步放化疗后营养风险因素分析[J].重庆医学,2016,45(12):1656-1658.
Case-controlstudyonrelatedriskfactorsofaortic-esophagealfistulaafteresophagealcarcinomaoperation
DengYi1,ChengNian2△,ZengLi2,HuangChaoqun2,WangZenghui2
(1.DepartmentofOncology;2.DepartmentofThoracicSurgery,InstituteofFieldSurgeryResearch,DapingHospital,ThirdMilitaryMedicalUniversity,Chongqing400042,China)
aortic-esophageal fistula;risk factors;case-control study
目的探讨食管癌术后发生食管主动脉瘘的相关危险因素。方法以2000年1月至2015年12月在该院胸外科治疗的18例食管癌术后食管主动脉瘘患者为观察组,并按照病例对照研究设计,以1∶3配比,选择同一时期具备近似基础疾病或危险因素的54例食管癌手术患者为对照组。以观察组发病前具有的危险因素,如年龄、性别、肿瘤TNM分期、肿瘤部位作为配比变量。对手术操作时间,术前肥胖情况,术中出血量,术前低密度脂蛋白(LDL)水平,手术吻合方式,术后有无肺部并发症,术后有无心律失常,术前有无高血压,术前有无糖尿病,术中淋巴结清扫数目等非配比变量进行病例对照研究。结果单因素Logistic回归分析初筛出5个可疑危险因素,包括术前肥胖、术前低密度脂蛋白、术后肺部并发症、手术吻合方式及淋巴结清扫数目,其余因素差异无统计学意义(P>0.05)。多因素非条件Logistic逐步回归分析发现,观察组和对照组术前肥胖(OR=8.63,95%CI=1.35~17.60,P=0.021)、术前低密度脂蛋白低水平(OR=0.81,95%CI=0.23~0.98,P=0.001)、术中淋巴结清扫数目(OR=0.32,95%CI=0.14~0.59,P=0.015)差异有统计学意义,而与其余因素差异均无统计学意义(P>0.05)。结论术前肥胖、术前低密度脂蛋白低水平、淋巴结清扫数目可能是食管癌术后发生食管主动脉瘘的相关因素。
R735.1
A
1671-8348(2017)31-4357-03
10.3969/j.issn.1671-8348.2017.31.013
邓益(1983-),主治医师,硕士,主要从事胸部肿瘤治疗。△
,E-mail:475027844@qq.com。
ObjectiveTo explore the related risk factors of aortic esophageal fistula (AEF) after esophageal carcinoma operation.MethodsAccording to the design of case-control study and matching proportion of 1∶3,18 cases of AEF after esophageal carcinoma operation treated in the thoracic surgery department of Daping Hospital of Third Military Medical University from 2000 to 2015 served as the observation group,and contemporaneous 54 cases of esophageal carcinoma operation,who had approximate basic diseases or risk factors,were selected as the control group,18 pairs were formed.The risk factors possessed by the observation group before disease onset such as age,sex,tumor TNM stage and tumor location served as the matching variables.The non-matching variables including operation time,preoperative body mass index (BMI),amount of intraoperative hemorrhage,preoperative LDL level,anastomosis mode,postoperative pulmonary complications,postoperative arrhythmia,preoperative hypertension,preoperative diabetes and number of removed lymph nodes were performed the case-control study.ResultsThe univariate Logistic analysis preliminarily screened out 5 risk factors,including preoperative obesity,preoperative LDL level,postoperative pulmonary complications,anstomosis mode and number of removed lymph nodes,the difference in other factors was not statistically significant(P>0.05).The multivariate non-conditional Logistic stepwise regression analysis revealed that preoperative obesity (OR=8.63,95%CI=1.35-17.60),preoperative LDL level (OR=0.81,95%CI=0.23-0.98) and the number of intraoperatively removed lymph nodes (OR=0.32,95%CI=0.14-0.59) had statistical differences between the observation group and control group,but the difference in other factors had no statistical significance.ConclusionPreoperative obesity,preoperative LDL level and number of removed lymph nodes might be the risk factors for AEF occurrence after esophageal carcinoma operation.
2017-04-12
2017-06-30)

