AMPK活化对慢性间歇缺氧大鼠胰岛素抵抗和炎症因子的影响*
陈 实,孟庆华,李承红
(江汉大学附属医院/武汉市第六医院呼吸内科,武汉 430000)
AMPK活化对慢性间歇缺氧大鼠胰岛素抵抗和炎症因子的影响*
陈 实,孟庆华,李承红△
(江汉大学附属医院/武汉市第六医院呼吸内科,武汉 430000)
单磷酸腺苷激活蛋白激酶;睡眠呼吸暂停综合征;胰岛素抵抗;炎症因子;脂联素;瘦素
阻塞性睡眠呼吸暂停综合征(OSAS)是一种发病率高、危险性大的疾病[1-2]。其主要病理生理变化是睡眠时反复出现的呼吸暂停引起慢性间歇缺氧[3],此过程引起氧化应激活化,促发炎症因子释放,影响脂肪代谢和糖代谢,可导致胰岛素抵抗(IR)的发生。上述的发挥均有赖于单磷酸腺苷激活蛋白激酶(AMPK)的活化。AMPK的活化在机体炎性反应和能量代谢方面具有重要价值。为此,本文建立慢性间歇缺氧大鼠模型,模拟OSAHS患者存在的缺氧/再复氧病理生理过程,观察大鼠脂肪组织中AMPK、炎症因子的变化和IR情况,探讨AMPK活化对炎症介质和胰岛素抵抗的影响。
1 材料与方法
1.1材料
1.1.1动物及饲料 健康雄性SD大鼠,SPF级,体质量(200±10)g,由华中科技大学同济医学院实验动物中心提供。大鼠普通饲料,由北京科奥协力饲料有限公司提供,合格证号SCXK(京)-2009-0008。
1.1.2仪器与试剂 数字测氧仪(上海市嘉定学联仪表厂);全自动酶标仪(型号Multiskan-MK3,美国Thermo scientific公司);酶联免疫吸附试验(ELISA)试剂盒(伊莱瑞特生物科技有限公司);显微成像分析系统(日本Olympus公司)、LC-20A高效液相色谱仪(日本岛津公司)、AMPK激活剂(AICAR)、兔抗大鼠p-AMPK-α(Thr172)抗体、兔抗大鼠AMPK-α抗体购自美国Cell Signaling公司,AMPK抑制剂(Compound C)购自德国Merck公司,小鼠抗大鼠甘油醛-3-磷酸脱氢酶(GADPH)抗体购自上海康成生物工程有限公司,小鼠抗大鼠α-actinin抗体、羊抗小鼠IgG-辣根过氧化物酶(HRP)及羊抗兔IgG-HRP购自武汉博士德生物工程有限公司,免疫印迹发光试剂盒购自美国Millipore公司。
1.2模型制备及干预
1.2.1动物分组 用随机数字表法将大鼠分为常氧对照组、间歇缺氧2周组,间歇缺氧8周组,每组12只。
1.2.2慢性间歇缺氧大鼠模型的建立 参考文献[4]的方法,自制密闭有机玻璃间歇缺氧箱,选用4 mm厚有机玻璃制成28 cm×15 cm×15 cm长方体舱,一端留孔加盖密封用于取放动物,侧壁留两孔用于输入氮气与混合空气。缺氧过程中动物活动自由,不进饮食。由进气孔向密闭缺氧箱内循环充入氮气和压缩空气,每个循环过程为前55 s充入氮气,后55 s充入压缩空气,总长110 s,采用数字测氧仪检测缺氧箱中氧浓度,调节气体流量,使每个循环缺氧箱内的最低氧浓度达到7%~8%,然后逐渐恢复至21%,每天持续8 h。
1.2.3干预处理 对已建立慢性间歇缺氧的大鼠模型使用AICAR(含AICAR 1 mmol/L)和Compound C(含Compound C 1 μmol/L)进行相应处理。为方便数据统计表达:用N代表常氧对照组和未进行干预;H代表间歇缺氧,阿拉伯数字代表持续间歇缺氧时间;A代表经过AMPK特异性激动剂处理;C代表经过AMPK特异性抑制剂处理。将实验大鼠分为上述9组,每组4只。干预6 h后提取大鼠血清样品和脂肪组织,存放待测。
1.2.4血液样品的采集和处理 测定各组大鼠体质量。血样采集前,所有大鼠禁食12 h,用3%戊巴比妥钠进行动物麻醉,每千克体质量给药15 mg(15 mg/kg)。动物麻醉后尾部取血测血糖,沿腹中线切开皮肤,腹主动脉取血,置于肝素化的离心管中,3 000 r/min离心20 min,分离出血浆,于-20 ℃存放待测。
1.2.5脂肪组织的采集和处理 将所有处理后的大鼠麻醉后,取各组大鼠肾周脂肪、肠系膜周脂肪,电子天平上准确称质量后迅速放入-80 ℃低温冰箱保存待测。
1.3观察指标及方法
1.3.1Western blot法半定量检测AMPK、GLUT4的表达 用Western blot分析,加入各种抗体,利用SDS-PAGE电泳,免疫印迹用增强化学发光法(ECL)显影、定洗片。结果用凝胶成像软件量扫描条带灰度,以p-AMPK条带/β-acdn蛋白条带值为AMPK活化水平。采用IPP6.0以图像分析软件检测。以GAPDH作为内参,以灰度比值表作为内参,表示所检测蛋白质的相对含量[5]。
1.3.2血清胰岛素和胰岛素抵抗测定 采用放射免疫分析法测定空腹胰岛素(FINS)水平。采用稳态模型IR指数(HOMA-IR)作为IR评价指标[6]:公式为FBG×FINS/22.5,其中空腹血糖单位为mmol/L,FINS单位为μU/mL。
1.3.3血清炎症因子测定 采用ELISA检测核因子κB(NF-κB)、缺氧诱导因子(HIF-1)、脂联素、瘦素、白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、肿瘤坏死因子(TNF-α)、脂联素、瘦素。按试剂说明书进行。

2 结 果
2.1不同程度慢性间歇缺氧大鼠和常氧对照组大鼠处理前炎症因子和氧化应激因子比较 慢性间歇缺氧大鼠NF-κB、HIF-1、IL-1、IL-6、TNF-α均高于常氧对照组(P<0.05),且缺氧程度越重,炎症介质水平越高,差异有统计学意义(P<0.05)。见表1。
2.2不同程度慢性间歇缺氧大鼠经AICAR和Compound C处理后炎症因子和氧化应激因子比较 间歇缺氧大鼠经AICAR处理后与处理前相比,其炎症因子(IL-1、IL-6、TNF-α)和氧化应激因子(NF-κB、HIF-1)均有所下降,而经过Compound C处理后指标有所上升(P<0.05)。见表2。

表1 慢性间接缺氧大鼠和常氧对照组大鼠炎症因子和氧化应激因子比较
*:P<0.05,与间歇缺氧2周、8周组比较

表2 慢性间歇缺氧大鼠经AICAR和Compound C处理后炎症因子和氧化应激因子比较

续表2 慢性间歇缺氧大鼠经AICAR和Compound C处理后炎症因子和氧化应激因子比较

图1 慢性间歇缺氧大鼠经AICAR和Compound C处理前后IR指数比较
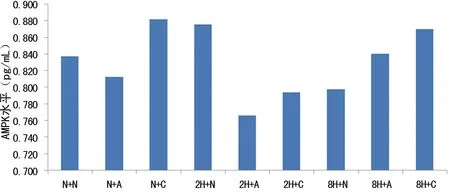
N+N:常氧对照组+未干预;N+A:常氧对照组+AICAR组;N+C:常氧对照组+Compound C组;2H+N:间歇缺氧2周组+未干预;2H+A:间歇缺氧2周组+AICAR组;2H+C:间歇缺氧2周组+Compound C组;8H+N:间歇缺氧8周组+未干预;8H+A:间歇缺氧8周组+AICAR组;8H+C:间歇缺氧8周组+Compound C组
图2慢性间歇缺氧大鼠经AICAR和Compound C处理前后AMPK水平比较

N+N:常氧对照组+未干预;N+A:常氧对照组+AICAR组;N+C:常氧对照组+Compound C组;2H+N:间歇缺氧2周组+未干预;2H+A:间歇缺氧2周组+AICAR组;2H+C:间歇缺氧2周组+Compound C组;8H+N:间歇缺氧8周组+未干预;8H+A:间歇缺氧8周组+AICAR组;8H+C:间歇缺氧8周组+Compound C组
图3慢性间歇缺氧大鼠经AICAR和Compound C处理前后GLUT4水平比较
2.3不同程度慢性间歇缺氧大鼠和常氧对照组大鼠经AICAR和Compound C处理前后IR指数比较 8周间歇缺氧组大鼠的IR指数均高于2周间歇缺氧组大鼠及常氧对照组,差异有统计学意义(P<0.05)。见图1。
2.4Western blot检测脂肪组织中AMPK水平 Western blot结果显示,与慢性间歇缺氧大鼠处理前比较,AICAR组脂肪细胞AMPK水平增高(P<0.05),Compound C组脂肪细胞AMPK水平降低(P<0.05),提示AICAR能激活脂肪细胞AMPK,而Compound C则抑制AMPK激活。见图2。
2.5Western blot检测脂肪组织中GLUT4水平 Western blot结果显示,与慢性间歇缺氧大鼠处理前比较,AICAR组脂肪细胞GLUT4水平增高(P<0.05),Compound C组脂肪细胞GLUT4水平降低(P<0.05),提示AICAR能激活脂肪细胞GLUT4,而Compound C则抑制GLUT4激活。见图3。
3 讨 论
OSAS是一种发病率高、危险性大的疾病。其主要病理生理变化是患者睡眠时反复出现的呼吸暂停引起的慢性间歇缺氧,导致低氧血症及高碳酸血症,从而导致高血压、冠心病、脑卒中、代谢综合征等多种并发症[7-10]。本实验通过建立慢性间歇缺氧大鼠模型,模拟OSAS。
慢性间歇低氧引起的机体持续增强的炎性反应在其中发挥重要推动作用[11-12]。反复发生缺氧/复氧过程引起氧化应激活化NF-κB和HIF-1等信号途径,继而促发炎症因子的TNF-α、IL-1和IL-6等的大量释放,本研究也发现慢性间歇缺氧大鼠缺氧程度越重,体内炎症介质NF-κB、HIF-1、IL-1、IL-6、TNF-α释放量增加。这些过量释放的炎症因子导致各种脂质代谢、瘦素、脂联素代谢紊乱而最终导致IR的发生[13]。有研究发现,与健康人群相比,OSAS患者糖代谢异常的发病率亦明显增加。Meslier等[14]研究494例男性OSAS患者,2型糖尿病和糖耐量异常的发生率分别为30.1%和20.0%,血糖水平与OSAS严重程度呈正相关,并认为OSAS是独立于年龄、肥胖等因素之外与糖代谢异常相关的因素。本研究也发现缺氧程度越重的大鼠体内IR的程度越重。
但慢性间歇缺氧介导的OSAS导致的全身炎症因子的改变和代谢异常是通过什么信号通路传导,目前尚无相应研究。
AMPK是真核细胞生物中重要的丝氨酸/苏氨酸蛋白激酶[15]。AMPK可通过影响细胞物质代谢的多个环节维持细胞能量供求平衡[16]。当细胞内三磷腺苷(ATP)减少时,AMPK可通过抑制糖原、脂肪和胆固醇的合成,减少ATP 的利用;另外可通过促进脂肪酸氧化、葡萄糖转运等,增加ATP 的产生。因此,AMPK 被认为是调节细胞能量代谢的开关。研究表明AMPK在缺乏胰岛素情况下AICAR可促进葡萄糖的摄取,增加GLUT4从微囊转位到质膜上从而促进葡萄糖摄取[17]。
AMPK系统是一个新型的抗炎信号途径,AMPK的活化在治疗炎症性疾病中具有重要价值。AMPK的激活减少cAMP介导的上皮氯化物的分泌,从而减轻炎性反应。有研究显示,AICAR抑制脂多糖诱导的致炎细胞因子(如TNF-α、IL-1和IL-6)及诱导型一氧化氮合酶的表达从而调节炎性反应[18]。
本研究中,通过AICAR和Compound C干预慢性间歇缺氧大鼠,观察不同缺氧程度的大鼠脂肪组织炎症因子水平,AMPK及GLUT4的释放量,发现AMPK激活后的大鼠体内炎症因子释放减少,胰岛素抵抗情况较前有改善,GLUT4水平增加。而抑制AMPK活性后大鼠体内炎症因子水平均上升,IR更严重,GLUT4水平也进一步下降。以上结果提示AMPK能够减少炎症介质的释放,增加GLUT4水平,改善IR,从而调节能量代谢及炎症介质。
综上所述,本课题研究OSAS大鼠模型缺氧、炎症、能量代谢与AMPK的关系,发现AMPK与OSAS的能量代谢和炎性反应有关,其意义在于探讨AMPK在OSAS中的发病机制,为临床治疗OSAS相关疾病提供新的思路与靶点。
[1]Fletcher EC.Obstructive sleep apnoea and cardiovascular death:cause-effect[J].Monaldi Arch Chest Dis,1995,50(5):340-341.
[2]Bradley TD.Right and left ventricular functional impairment and sleep apnea[J].Clin Chest Med,1992,13(3):459-479.
[3]Lurie A.Obstructive sleep apnea in adults:epidemiology,clinical presentation,and treatment options[J].Adv Cardiol,2011,46(1):1-42.
[4]Neubaauer JA.Physiological and genomic Consequences of intermittent hypoxia invited review:physiological Consequences of intermittent hypoxia:systemic blood pressure[J].J Appl Physiol,2001,90(4):1593-1599.
[5]Riek U,Scholz R,Konarev P,et al.Structural properties of Amp-Activated protein kinase:dimerization,molecular shape,and changes upon LigandBinding[J].J Biol Chem,2008,283(26):18331.
[6]Matthews DR.Insulin resistance and beta-cell function-a clinical perspective[J].Diabetes Obes Metab,2001,3(Suppl 1):28-33.
[7]Peppard PE,Young T,Palta M,et al.Prospective study of the association between sleep-disordered breathing and hypertension[J].N Engl J Med,2000,342(19):1378-1384.
[8]MesIier N,ouksel H,Racineux JL.Obstructive sleep apnea syndrome and cardiovascular risk[J].Rev Neurol,2001,157(11):S42-S45.
[9]Engleman HM,Kingshott RN,Martin SE,et al.Cognitive function in the sleep apnea/hypopnea syndrome(SAHS)[J].Sleep,2000,23(4):102-108.
[10]Luboshitzky R,Aviv A,Hefetz A,et al.Decreased pituitary-gonadal secretion in men with obstructive sleep apnea[J].J Clin Endocrinol Metab,2002,87(7):3394-3398.
[11]Drager LF,Togeiro SM,Polotsky VY,et al.Obstructive sleep apnea:a cardiometabolic risk in obesity and the metabolic syndrome[J].J Am Coll Cardiol,2013,62(7):569-576.
[12]Surani S,Subramanian S.Effect of continuous positive airway pressure therapy on glucose control[J].World J Diabetes,2012,3(4):65-70.
[13]Ogihara T,Asano T,Katagiri H,et al.Oxidative stress induces insulin resistance by activating the nuclear factor-kappa b pathway and disrupting normal subcellular distribution of phosphatidylinositol 3-kinase[J].Diabetologia,2004,47(5):794-805.
[14]Meslier N,Gagnadoux F,Giraud P,et al.Impaired glucose-insulin metabolism in males with obstructive sleep apnoea syndrome[J].Eur Respir J,2003,22(1):156-160.
[15]Arad M,Seidman CE,Seidman JG.AMP-activated protein kinase in the heart-role during health and disease[J].Circ Res,2007,100(4):474-488.
[16]蔡明春,黄庆愿,高钰琪.AMPK与能量代谢[J].重庆医学,2005,34(1):120-122.
[17]Koistinen HA,Galuska D,Chibalin A.5-Amino-Imidazole Carboxamide Riboside increases glucose transport and cell-surface GLUT4 content in skeletal muscle from subjects with type 2 diabetes[J].Diabetes,2003,52(5):1066-1072.
[18]Jung CH,Lee MJ,Kang YM,et al.Vaspin inhibits cytokine-induced nuclear factor-kappa B activation and adhesion molecule expression via AMP-activated protein kinase activation in vascular endothelial cells[J].Cardiovasc Diabetol,2014,13(1):41.
EffectsofAMPKactivationoninsulinresistanceandinflammatoryfactorsinratswithchronicintermittenthypoxia*
ChenShi,MengQinghua,LiChenghong△
(DepartmentofRespiration,AffiliatedHospitalofJianghanUniversity/WuhanMunicipalSixthHospital,Wuhan,Hubei430000,China)
AMP activated protein kinase;sleep apnea hypopnea syndrome;insulin resistance;inflammatory factor;adiponectin;leptin
目的探讨单磷酸腺苷激活蛋白激酶(AMPK)活化对慢性间歇缺氧大鼠胰岛素抵抗和炎症因子的作用及其机制。方法建立慢性间歇缺氧大鼠模型模拟阻塞性睡眠呼吸暂停综合征(OSAS),将36只雄性SD大鼠分为常氧对照组、2周间歇缺氧组、8周间歇缺氧组。观察AMPK激动剂和AMPK抑制剂作用不同缺氧程度的大鼠体内炎症介质、血脂、脂联素、瘦素及胰岛素抵抗水平,监测大鼠脂肪组织AMPK、葡萄糖转运蛋白(GLUT4)水平,并进行统计学分析。结果间歇缺氧大鼠总胆固醇、三酰甘油、肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6、IL-2、核因子κB(NF-κB)、缺氧诱导因子(HIF-1)显著高于对照组(P<0.05);脂联素、瘦素及胰岛素抵抗指数显著低于对照组(P<0.05)。使用AMPK激活剂后的大鼠体内炎症因子释放减少,脂联素、瘦素含量增加,血脂、胰岛素抵抗情况较前有改善,GLUT4水平增加。而使用AMPK抑制剂处理后大鼠体内炎症因子、脂联素、瘦素水平均上升,胰岛素抵抗更严重,GLUT4水平也进一步下降。结论AMPK能够减少炎症介质的释放,促进脂联素、瘦素的释放,增加GLUT4水平,改善胰岛素抵抗,从而调节能量代谢及炎症介质,为临床治疗OSAS相关疾病提供新的思路与靶点。
R446.62
A
1671-8348(2017)31-4332-04
10.3969/j.issn.1671-8348.2017.31.004
湖北省自然科学基金面上项目(ZRY2014000966)。
陈实(1983-),硕士,主治医师,主要从事睡眠呼吸暂停疾病的研究。△
,E-mail:15827636399@163.com。
ObjectiveTo investigate the effect and mechanism of adenosine monophosphate activated protein kinase(AMPK) activation on insulin resistance and inflammatory factors in rats with chronic intermittent hypoxia.MethodsThe chronic intermittent hypoxia rat model was established to simulate the obstructive sleep apnea syndrome (OSAS),and the 36 male SD rats were divided into the normal oxygen control group,2-week intermittent hypoxia group and 8-week intermittent hypoxia group.The levels of rat inflammatory medium,serum lipid,adiponectin,leptin and insulin resistance in different hypoxia degrees of rats by the action of AMPK agonist and AMPK inhibitor were observed,and the levels of AMPK and GLUT4 in rat adipose tissue were monitored and statistically analyzed.ResultsThe levels of total cholesterol,triglyceride,TNF-α,IL-6,IL-2,NF-κB and HIF-1 in the intermittent hypoxia rats were significantly higher than those in the control group(P<0.05);while the levels of adiponectin,leptin and insulin resistance index were significantly lower than those in the control group(P<0.05).The release of inflammatory factors in rats after using AMPK activator was decreased,the contents of adiponectin and leptin were increased,blood lipid and insulin resistance were improved compared with before,and the expression level of GLUT4 was increased.But after treatment by using AMPK inhibitor,the levels of inflammatory factors,adiponectin and leptin were increased,insulin resistance was more severe,and the expression level of GLUT4 protein was also further decreased.ConclusionAMPK can reduce the release of inflammatory mediators,promotes the release of adiponectin and leptin,increases the level of GLUT4,improves insulin resistance,thus regulates the energy metabolism and inflammatory mediators,which provides a new idea and target for clinical treatment of OSAS related diseases.
2017-03-22
2017-06-10)

