绿色木霉和草酸青霉对Hg2+、Zn2+、Cu2+和Pb2+的耐性和吸附特征*
刘少文 焦如珍 董玉红 刘彩霞 孙 岩
(中国林业科学研究院林业研究所 林木遗传育种国家重点实验室 国家林业局林木培育重点实验室 北京 100091)
绿色木霉和草酸青霉对Hg2+、Zn2+、Cu2+和Pb2+的耐性和吸附特征*
刘少文 焦如珍 董玉红 刘彩霞 孙 岩
(中国林业科学研究院林业研究所 林木遗传育种国家重点实验室 国家林业局林木培育重点实验室 北京 100091)
【目的】 通过对已筛选出的耐较高浓度重金属的绿色木霉和草酸青霉菌株进行Hg2+、Zn2+、Cu2+和Pb2+耐受性和吸附性试验,为其应用于土壤修复提供科学参考。【方法】 通过测定重金属离子对菌株的生长抑制率和半致死浓度(EC50)评价真菌重金属耐性; 将一定质量的菌丝球添加到已知浓度的重金属离子溶液中,测试菌株对重金属的吸附速率和吸附量,并对吸附过程进行函数拟合,分析其重金属吸附特征。【结果】 2株菌株生物量随重金属浓度增加而降低,其过程分2个阶段,在金属离子浓度较低(0~200 mg·L-1)时,生物量下降不明显或略有上升,当重金属离子浓度大于某个临界值(400 mg·L-1左右)时,生物量下降迅速; Hg2+、Zn2+、Cu2+和Pb2+对菌株lys2015f1的EC50值分别是158.07、464.02、229.33和209.59 mg·L-1,对菌株lys2015f5的EC50值分别是580.47、572.88、231.85、2 284.01 mg·L-1,因此,菌株lys2015f1对重金属耐受程度为Zn2+gt;Cu2+gt;Pb2+gt;Hg2+,菌株lys2015f5对重金属耐受程度为Pb2+gt;Hg2+gt;Zn2+gt;Cu2+。菌株的吸附过程更加拟合准二级吸附动力学模型,由模型速率常数k2可知,2株菌株吸附重金属速率排序变化一致,均为Pb2+gt;Hg2+gt;Cu2+gt;Zn2+,菌株lys2015f1通过模型得到的理论Hg2+、Zn2+、Cu2+和Pb2+最大吸附量分别是37.12、14.63、16.62和107.31 mg·g-1,菌株lys2015f5理论最大吸附量47.12、16.50、25.78和201.22 mg·g-1; 吸附的限速步骤是由化学反应控制的,在同等条件下,2株菌株对4种重金属吸附速率排序均为Hg2+gt;Cu2+gt;Zn2+gt;Pb2+。【结论】 绿色木霉和草酸青霉菌株具有较高的重金属耐性和较好的吸附性,现有研究也表明其在生物防治、植物促生、土壤有机物降解等方面具有较好效果,因此2株菌株具有较好的重金属修复应用潜力。
绿色木霉; 草酸青霉; 重金属耐性; 生物吸附
重金属是土壤污染重要来源,重金属污染具有隐蔽性、积累性、不可逆性和滞留时间长、毒性大等特点(彭强等, 2011)。传统的土壤重金属物化修复办法有其无法克服的局限性,利用微生物修复重金属污染,越来越受到人们的重视(Adamoetal., 2014)。
土壤微生物修复技术是指培养土著或添加外源微生物,通过促进微生物新陈代谢活动,促使污染物降解的方法(Tyagietal.,2011)。研究表明,针对污染物培养特定功能微生物,并使微生物活性和数量维持在一定水平,可有效降低土壤中污染物的含量(Kumaretal.,2011)。真菌在微生物修复领域,相比于细菌,具有生物活性强、抗逆性强、对营养条件要求简单、生物量大等优势。多种真菌都有对重金属污染的修复能力,如树脂枝孢霉(Cladosporiumresinae)、黑曲霉(Aspergillusniger)、类酵母(Aureobasidiumpullulans)、白腐菌(Funaliatrogii)、灵芝(Ganodermalucidum)、青霉(Penicilliumsp.)、木霉(Trichodermasp.)(Sayetal., 2003)。
草酸青霉(Penicilliumoxalicum)属半知菌纲(Fungi Imperficti)、壳霉目(Sphaeropsidales)、杯霉科(Discellaceae),是一种常见的土壤真菌,具有促进植物生长、解磷等作用。王超(2013)研究了草酸青霉在Cu2+、Zn2+胁迫下生物学特征及锰过氧化氢酶、加氧酶的活性变化,结果表明高浓度的重金属均显著抑制酶的活性,Cu2+浓度、Zn2+浓度分别为125、1 250 mg·L-1时,草酸青霉停止生长。Abedin(2014)研究了草酸青霉菌株JQ624873对Cu2+和Ni2+的吸附过程,结果表明草酸青霉菌株JQ624873对Cu2+吸附速率的最大影响因子为重金属离子浓度,对Ni2+的吸附速率影响较大的因素为温度和培养时间; 经过一系列的条件优化,JQ624873菌株对Cu2+和Ni2+的最大吸附速率可达到94%和80%。木霉属真菌主要生长于温暖潮湿的生境中,如农田、坡沟、森林、草地等,可利用腐败植物残体和其他菌类子实体作为生长基质(Doi, 2006)。绿色木霉(T.viride)对重金属耐受能力较强,具备一定的吸附能力,在土壤重金属污染修复中具有较高的应用潜力。Siddiquee 等(2013)对比了3种常见木霉属菌黄绿木霉(T.aureoviride)、哈茨木霉(T.harzianuml)和绿色木霉对重金属Cu2+、Zn2+、Pb2+、Ni3+离子吸附性和耐受性,结果表明,绿色木霉在其中表现出最高的耐受性,耐受最大浓度为1 200 mg·L-1(Pb2+、Ni3+)。综上,绿色木霉和草酸青霉在纤维素降解、生物防治、发酵生产、解磷等方面具有较好的应用效果,对人类和作物不存在毒害作用,为应用较广的功能微生物,但关于绿色木霉和草酸青霉在土壤重金属污染防治方面的研究和应用还鲜有报到。
绿色木霉和草酸青霉人工培育技术成熟,对多种病原菌具有较强的抑制作用,同时对重金属有较强的耐受性和吸附性。在植物-微生物联合修复体系中,可有效降低重金属对植物生长的影响,增强植物修复重金属污染土壤的潜力。森林是重要的陆地生态系统,是物质和能量循环的重要枢纽。林木个体大,适应力强,生活周期长,对营养要求相对较低,是植物修复的理想材料。很多研究表明,微生物可分泌质子,改变林木根际酸碱环境,进而影响林木对重金属的吸收。同时,微生物可分泌有机酸、蛋白质和多糖等,这些分泌物可与重金属结合,降低重金属对林木的毒害作用(刘少文, 2016)。笔者通过系统研究草酸青霉和绿色木霉对重金属(Hg2+、Zn2+、Cu2+、Pb2+)耐受性和吸附性特征,为2菌株应用于重金属污染修复提供科学依据。
1 材料与方法
1.1试验材料
1.1.1 菌种来源 从汞污染土样中提取菌株,经分离、纯化、并进行DNA鉴定后,接种于PDA斜面培养基上,4℃保存。
1.1.2 培养基和试剂 基础培养基: 固液PDA培养基,根据试验梯度设计要求添加HgCl2、ZnCl2、CuSO4·5H2O、 (CH3COO)2Pb(分析纯)配制成特定浓度的重金属培养基。
1.1.3 主要仪器 生化培养箱(LRH-150,上海)、超净工作台(DE-CJ-1 N,苏州)、自动灭菌锅(MLS-3780,日本)、原子吸收分光光度计(PEAA700,USA)、电感耦合等离子光谱仪(OPTIMA 8000DV,美国)
1.2真菌的重金属离子耐性检测
2株真菌分别为绿色木霉(编号lys2015f1)、草酸青霉(编号lys2015f5),进行耐性测试所用药剂分别为HgCl2、ZnCl2、CuSO4·5H2O、(CH3COO)2Pb。每种重金属溶液(以重金属离子计)设置7个浓度梯度(0、200、400、600、800、1 000、1 200 mg·L-1),每个浓度设置3次重复。活化菌株3次,在PDA平板上选择生长较旺盛的菌落,利用灭菌后的打孔器在菌落边缘打下直径1.2 cm的菌丝培养物,置于含有100 mL PDA液体培养基的250 mL锥形瓶中,在28 ℃和初始pH值为7的条件下静置培养约96 h。
真菌生物量的测定方法为菌丝干质量法: 称取干燥的滤纸质量,将培养基加到滤纸上,真空抽滤,去掉培养基液体,滤出全部的菌丝体,蒸馏水冲洗3次,洗净菌丝表面粘连的培养基。在60 ℃下烘箱内,将菌丝与滤纸烘干至恒质量。从烘箱取出后,放入干燥器中冷却,电子分析天平称质量,可得菌丝体干质量(刘少文, 2016)。
按公式计算可得每种重金属对菌株lys2015f1和lys2015f5的抑制率效率,得半致死浓度值(EC50),依照计算结果求得毒力方程。
生长抑制率=(对照菌丝干质量-处理菌丝干质量)/对照菌丝干质量×100%。
1.3真菌的重金属离子吸附特征
1.3.1 菌丝球的制备 接种后真菌于PDA平板培养基上培养3~4天,在超净工作台中,将菌丝接种到内含已灭菌玻璃珠和100 mL培养液的250 mL锥形瓶中,在180 r·min-1、28 ℃恒温摇床中培养3~4天,待其长成菌丝球(王国惠等, 2007)。用无菌纱布在超净工作台内过滤获得菌丝球,无菌水将培养液冲洗干净,放入灭菌后的0.9%氯化钠溶液中,4 ℃冰箱内保存备用。用滤纸吸干菌丝球表面水分,用于吸附试验(冯宏等, 2013)。利用烘干法测量菌丝干质量,计算可得2种菌丝球的干湿质量比值。
1.3.2 菌丝球投加量对重金属离子吸附的影响 取初始浓度为100 mg·L-1、pH值为5的重金属(Hg2+、Cu2+、Zn2+、Pb2+)溶液各30 mL,加到100 mL锥形瓶中,根据菌丝球干湿比,按干质量为0.5、1、2 g·L-1加入菌丝球。28 ℃、60 r·min-1条件下进行重金属吸附试验,设置空白对照,每组重复3次。720 min后吸附完成,将菌液在12 000 r·min-1离心3 min,所得上清液过0.45 μm无菌滤膜,滤液的重金属含量用电感耦合等离子光谱仪和原子吸收分光光度计测得。
1.3.3 真菌对重金属离子的吸附动力学特征 按上述试验条件设置,添加特定比例的菌丝球,进行菌丝重金属吸附试验。分别在10、30、60、100、120、240、360、720、1 440 min进行取样,并检测其重金属离子浓度。数据录入Origin,进行函数拟合与数据分析。计算公式:
吸附速率W=(C0-Ct)/C0,
吸附量Q=(C0-Ct)V/m。
式中,C0为所测溶液中离子的初始浓度(mg·L-1);Ct为在t时段离子的瞬时浓度(mg·L-1);V为吸附溶液体积(L);m为菌丝干质量g;Q为吸附容量,即每克干菌丝吸附该金属离子的质量(mg·g-1)。
将试验所测得数据,拟合准一级吸附动力学模型和准二级吸附动力学模型,由拟合程度判断重金属离子的吸附特征(Wuetal., 2009)。
准一级吸附动力学表达式:

准二级吸附动力学表达式:
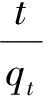
式中,k1为准一级吸附速率常数;t为吸附所用时间(min);qt为t时刻下吸附容量(mg·g-1);qe为吸附平衡时吸附容量(mg·g-1);k2为准二级吸附速率常数。
1.4数据处理
采用Origin8.0软件进行数据分析,比较差异显著性(α=0.05)。
2 结果与分析
2.1菌株对重金属离子的耐性
2.1.1 重金属离子对菌株生物量的影响 随着重金属离子浓度的增加,菌株生物量不断下降,直至停止生长(图1)。抑制效果在重金属离子浓度较低时(0~100 mg·L-1)即出现,并且4种重金属离子在100 mg·L-1点位上的菌丝干质量相差不大。随着重浓度的不断增加,金属离子对2个试验菌株的抑制效果发生变化。
Hg2+对lys2015f1菌株具有较强的抑制效果,当重金属离子浓度大于200 mg·L-1时,抑制效果更为明显(Plt;0.05)。当Hg2+浓度为400 mg·L-1时,菌株停止生长。Zn2+溶液在0~200 mg·L-1浓度范围内对菌株lys2015f1抑制效果不明显(Pgt;0.05);当浓度超过200 mg·L-1时,菌株生物量随Zn2+浓度的增加而降低;当浓度达到1 000 mg·L-1时,菌株无法生长。 Cu2+对该菌株生物量的抑制效果随金属浓度的增加而加大,当浓度为800 mg·L-1时,菌株停止生长。随着Pb2+浓度的升高,菌株生物量受到抑制不断下降,下降幅度在试验各个阶段都比较稳定,当浓度为800 mg·L-1时,菌株无法生长。
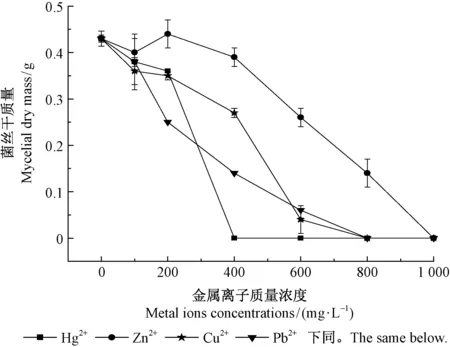
图1 不同金属离子浓度下菌株lys2015f1生物量的变化Fig.1 The change of biomass of fungi strain lys2015f1 with different metal ions concentrations
对于lys2015f5菌株,随重金属离子浓度的增加,菌株生物量呈不断下降的趋势(图2),可分为2个较为明显的阶段。当4种重金属离子浓度为在0~400 mg·L-1之间时,对lys2015f5菌株生物量的抑制效果不明显(Pgt;0.05); 当浓度大于400 mg·L-1时是,对该菌株生物量增长的抑制作用显著增强(Plt;0.05)。 Hg2+浓度大于400 mg·L-1时效果逐渐明显,当浓度为1 200 mg·L-1菌株停止生长。 Zn2+浓度在0~400 mg·L-1范围内,菌株lys2015f5生物量增加,当浓度超过400 mg·L-1时,菌株生物量随浓度的增加而显著降低(Plt;0.05)。 ,当浓度达1 000 mg·L-1时,菌株无法生长。 Cu2+浓度小于400 mg·L-1时抑制效果不显著(Pgt;0.05),尤其在200~400 mg·L-1范围内菌株生物量反而有所增加;但当浓度大于400 mg·L-1时,抑制效果迅速增强;浓度800 mg·L-1时,菌株无法生长。 随着溶液Pb2+浓度增加,菌株生物量持续减少,但是降低幅度不大;当Pb2+浓度为1 000 mg·L-1时,菌丝的干质量为0.21 g。
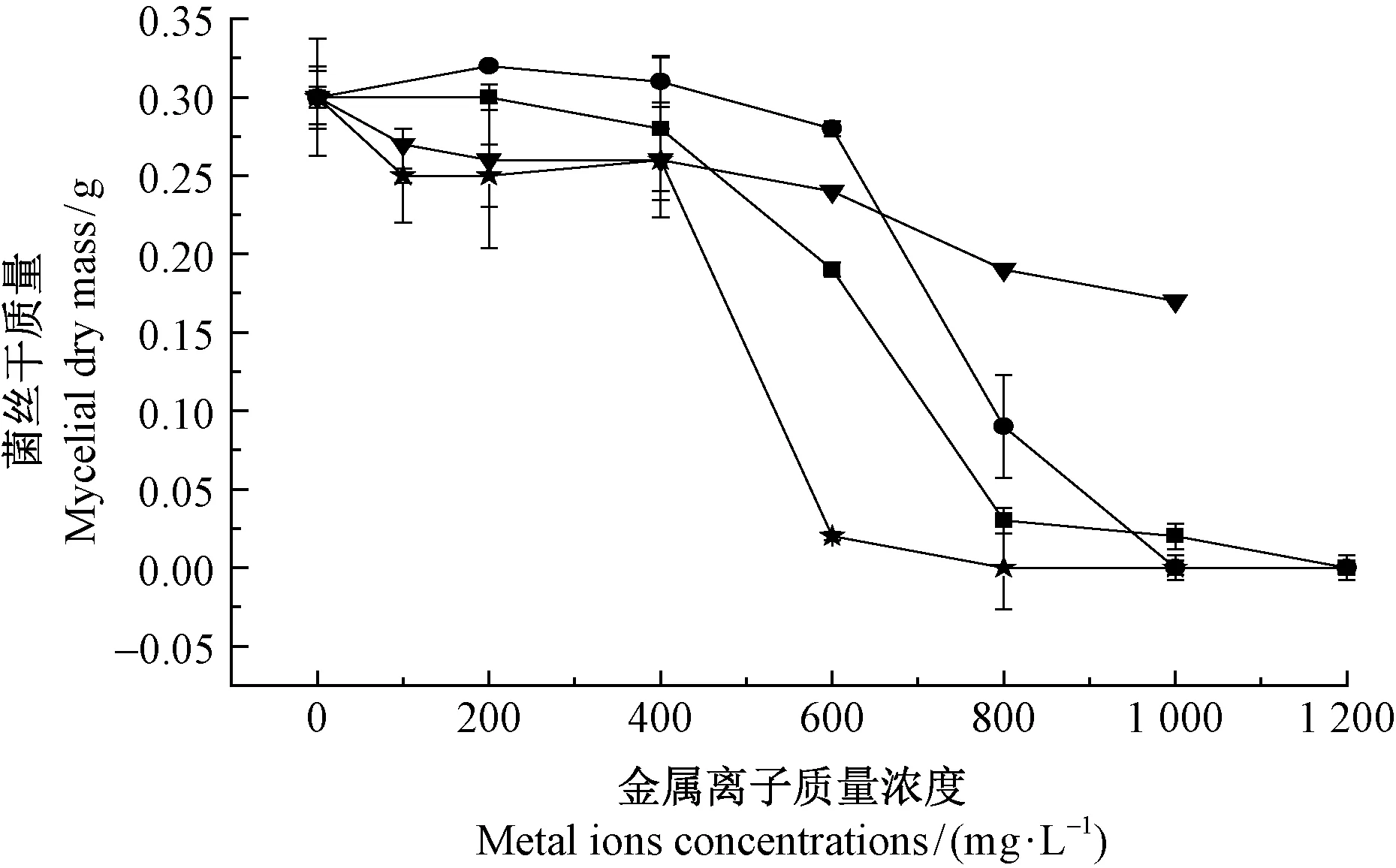
图2 不同金属离子浓度下菌株lys2015f5生物量的变化Fig.2 The change of fungi strain lys2015f5 with different metal ions concentrations
2.1.2 重金属离子对2株真菌的毒性 表1中毒力方程表明: 菌株lys2015f1和lys2015f5的生长抑制率均与重金属离子的对数浓度成正相关,相关系数(r)最小为0.709 5、0.818 6,菌株生长抑制率和重金属离子对数浓度有较高相关性。
重金属Hg2+、Cu2+、Zn2+、Pb2+对菌株lys2015f1的EC50值分别是158.07、464.02、229.33、209.59 mg·L-1,由EC50评估的4种重金属对菌株生长抑制能力为Hg2+gt;Pb2+gt;Cu2+gt;Zn2+,lys2015f1菌株对Zn2+耐受能力最强,为耐受能力最小Hg2+的2.94倍,菌株对Pb2+和Cu2+的耐受能力较接近; Hg2+、Zn2+、Cu2+、Pb2+对菌株lys2015f5的EC50值分别是580.47、572.88、231.85、2 284.01 mg·L-1,由EC50评估的4种重金属对菌株生长抑制率为Cu2+gt;Zn2+gt;Hg2+gt;Pb2+。
由图3可知,lys2015f1菌株对重金属Hg2+、Zn2+、Pb2+耐受能力均显著小于lys2015f5(Plt;0.05),其中Pb2+差别最明显,Cu2+差别不显著。在本试验相同培养、测定条件下,lys2015f5菌株的重金属(Hg2+、Zn2+、Cu2+、Pb2+)EC50值分别是lys2015f1菌株的3.67、1.23、1.01、10.89倍。
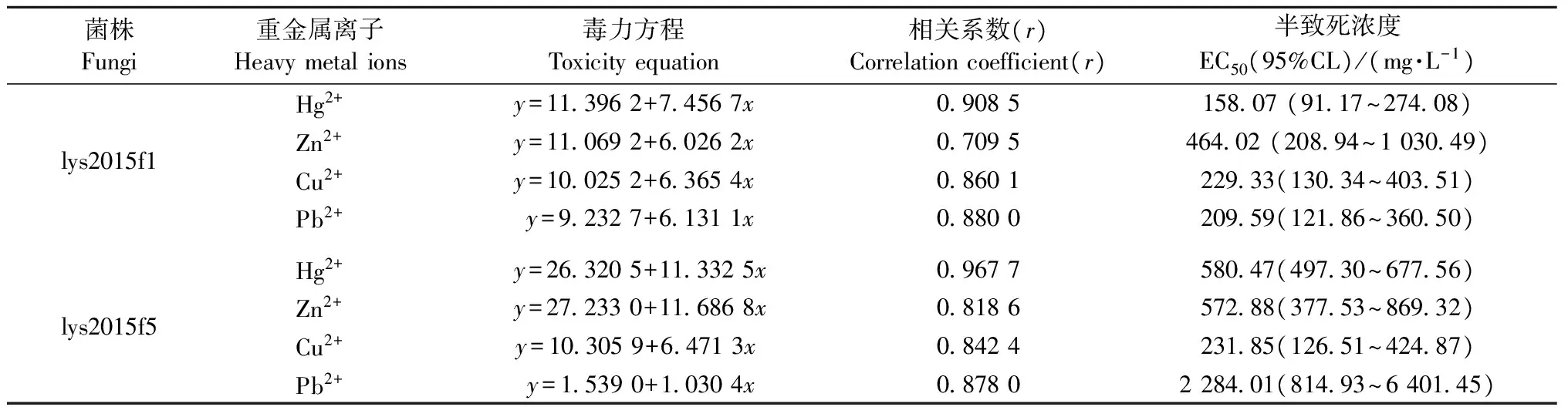
表1 重金属对菌株的毒力效应①Tab.1 Toxicity of Heavy metals against fungi
①x:重金属离子浓度的自然对数值;y:菌株生长抑制率。x:the natural logarithm of the concentration of heavy metal ions;y: the growth inhibition rate.
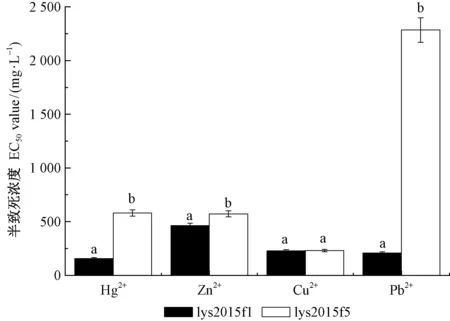
图3 2株菌株的各重金属EC50值的对比Fig.3 The EC50 value of each heavy metalion on two fungi strains
2.2真菌对重金属的吸附特征
2.2.1 菌丝球投加量对重金属吸附的影响 在pH值为5、初始重金属离子浓度为100 mg·L-1、吸附时间为720 min、温度为28 ℃条件下,菌丝球投加量对重金属吸附的影响结果如图4所示。随着菌丝干质量浓度的增加,菌丝对重金属的吸附速率呈上升状态。在菌丝浓度为0~1 g·L-1时,这种增加趋势表现明显。在此浓度范围内,随着菌丝浓度的增加,重金属吸附位点增多,菌丝有更大可能同金属离子发生吸附作用,故而增大吸附速率(Ozeretal., 2009)。当菌丝浓度大于1 g·L-1时,吸附速率变动趋势发生不同,在2组试验中Cu2+和Hg2+的吸附速率均呈下降趋势,这可能由于菌丝浓度过高,菌丝体相互聚集、吸附,菌丝吸附位点利用效率降低,这说明菌丝对重金属的吸附力并非随菌丝投加量的增加而不断增加,在此过程中存在最佳的吸附浓度,若超过此浓度,菌丝的吸附速率不仅会下降,还造成菌丝的浪费(叶佩青等, 2012)。综合分析,确定1 g·L-1菌丝干质量为本试验最佳菌丝投放量。
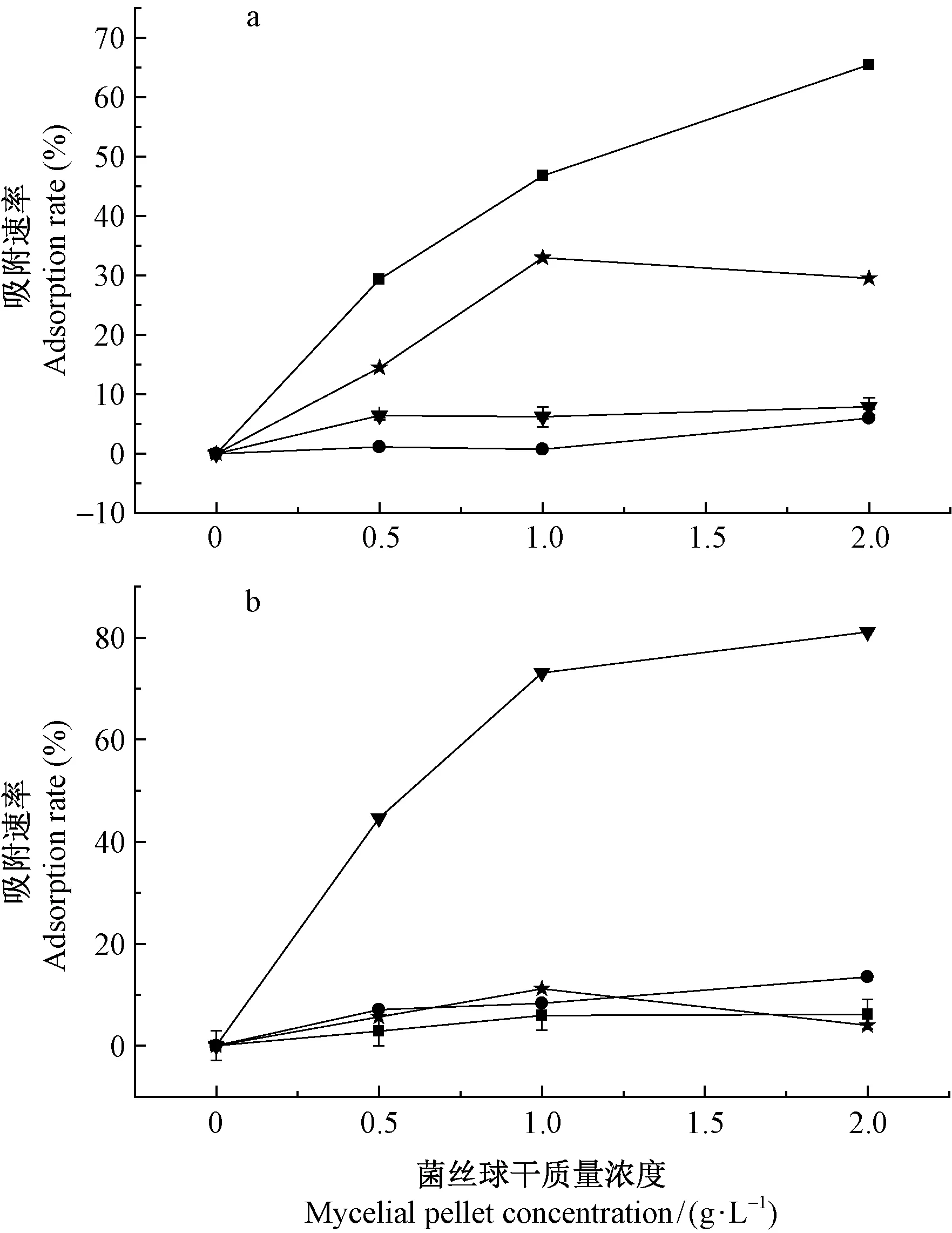
图4 不同干质量浓度下菌株lys2015f1(a)和lys2015f5(b)的重金属吸附效率Fig.4 The effects of different dosages of mycelia pellet lys2015f1(a) and lys2015f5(b) on the adsorption rate to heavy metal
2.2.2 吸附时间对吸附效果的影响 在初始重金属离子浓度为100 mg·L-1、pH为5、菌丝球干质量投加量为1 g·L-1、28 ℃条件下,吸附时间对吸附效果的影响见图5,2株试验菌株对4种金属离子的吸附过程特征表现出较高的一致性。首先,在0~360 min的过程中,菌丝重金属吸附速率随时间的增加而迅速增加,之后吸附率的增加较为缓慢,当吸附时间为720 min时,吸附速率达到最大值。其中:lys2015f1菌株对Hg2+、Zn2+、Cu2+、Pb2+最大吸附速率分别是36.01%、18.98%、20.32%、36.38%, lys2015f5菌株对Hg2+、Zn2+、Cu2+、Pb2+最大吸附速率分别是43.32%、22.51%、30.71%、69.16%。吸附效果随时间变化的规律表明:在吸附初始阶段,重金属离子浓度较高,吸附过程主要发生菌体表面吸附位点和官能团对重金属离子的吸附,该过程可逆、吸附速率快、所用时间短; 随着吸附的进行,重金属离子浓度降低,菌丝表面大部分吸附位点被占据,吸附速率变缓(Srivastavaetal., 2006; 李兰松等, 2013)。下一阶段,由于细胞发生主动运输作用,金属离子慢慢进入菌体内部,并不断累积,发生不可逆的吸附过程,此过程吸附速率增加较为缓慢(黄志钧等, 2012)。当吸附时间为720 min时,吸附过程达到平衡。
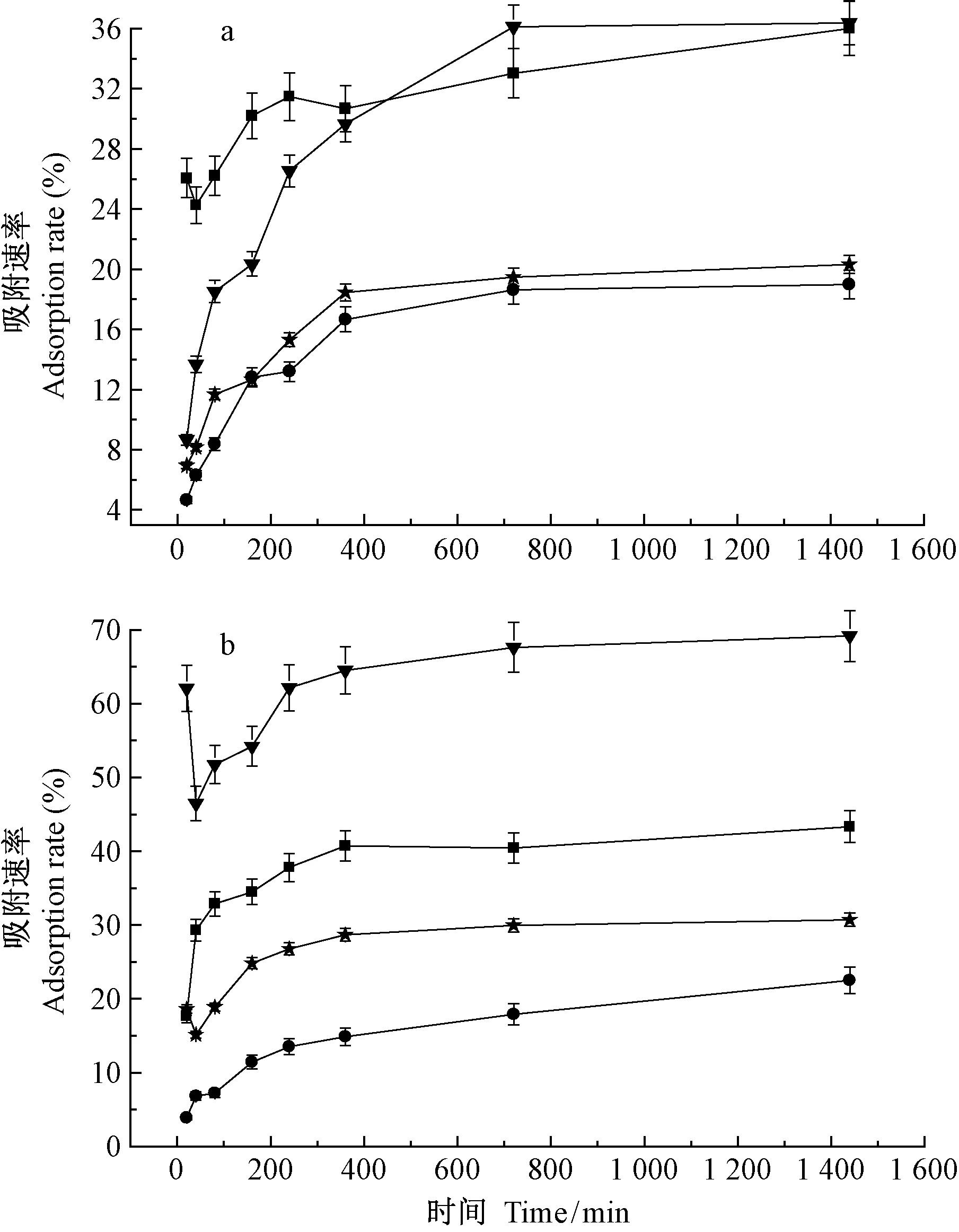
图5 不同吸附时间下菌株lys2015f1(a)和lys2015f5(b)重金属吸附速率Fig.5 Effects of time of fungi lys2015f1(a) and lys2015f5(b) on the adsorption rate
2株真菌的重金属吸附速率比较见图6,菌株lys2015f5对4种重金属的吸附速率均显著高于
lys2015f1,结合菌株耐性测试结果可知,菌株lys2015f5对重金属耐性和吸附性指标均高于lys2015f1(Plt;0.05)。就这4种金属离子而言,2株菌株的最大吸附速率对比排序一致,为Pb2+gt;Hg2+gt;Cu2+gt;Zn2+。

图6 菌株lys2015f1和lys2015f5重金属吸附速率Fig.6 The adsorption rate of fungi lys2015f1 and lys2015f5
2.2.3 吸附动力学模型特征 依据菌株lys2015f1和lys2015f5吸附Pb2+、Cu2+、Hg2+、Zn2+试验数据进行准一级吸附动力学模型、准二级吸附动力学模型的拟合(表2)。同准一级动力学模型对比,准二级动力学模型R2值均大于0.9,最小值为0.93。由此可见,准二级动力学模型对数据的拟合程度好于准一级动力学模型。
另外,通过显著性分析发现,实际平衡吸附量和准一级理论平衡吸附量(qe)存在显著差异,与准二级理论吸附量差异不显著(Plt;0.05)(图7)。由此可知,2株菌株对重金属的吸附过程,更加吻合二级反应规律。因准二级反应动力学模型的理论基础为化学吸附假设(Daveetal., 2009),表明本试验吸附的限速步骤是由化学反应控制,吸附速率与反应液中重金属离子浓度、吸附剂表面活性位点浓度相关。
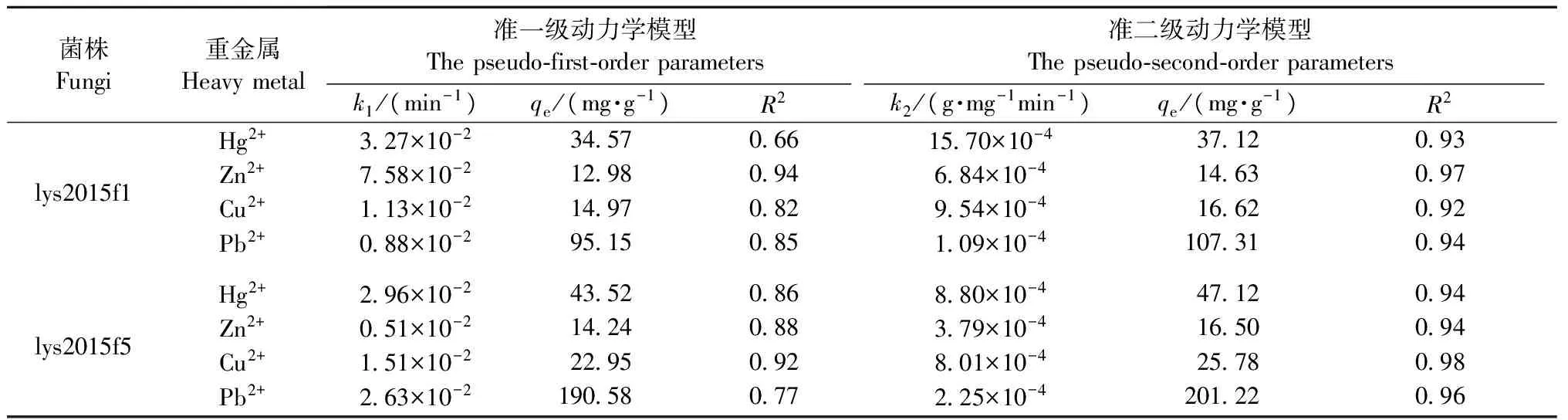
表2 菌株吸附重金属的准一级、准二级动力学模型相关参数①Tab.2 Parameters of the pseudo-first-order and pseudo-second-order kinetic models for the biosorption of heavy metals by fungi
①qe:平衡吸附量拟合值(mg·g-1) The equilibrium absorption capacity(mg·g-1);k1:准一级吸附速率常数(min-1) The pseudo-first-order rate constant(min-1);k2:准二级吸附速率常数(g·mg-1min-1) The pseudo-second-order rate constant(g·mg-1min-1);R2:线性拟合判定系数The correlation coefficient.

图7 菌株lys2015f1(A)和lys2015f5(B)准一级、二级、实际最大吸附量Fig.7 The peseudo-first-order,pseudo-second-order and the fact maximal adsorption capacity of lys2015f1 (A) and lys2015f5(B)
吸附速率常数k2,可反应吸附过程速率。在相同试验条件下,2株菌株对以上4种重金属吸附速率,为Hg2+gt;Cu2+gt;Zn2+gt;Pb2+。lys2015f1菌株吸附重金属Hg2+、Cu2+、Zn2+、Pb2+的反应速率是lys2015f5菌株的1.78、1.19、1.80、0.48倍。
3 讨论
杜爱雪等(2008)筛选出的青霉菌对Zn2+、Cu2+、Pb2+耐性的顺序分别为Zn2+gt;Cu2+gt;Pb2+,而本试验草酸青霉的lys2015f5菌株耐性顺序为Pb2+gt;Hg2+gt;Zn2+gt;Cu2+,在Pb2+上略有差异。原因分析可能为试验所用Pb2+的药剂不同,本研究所用(CH3COO)2Pb为可溶,而杜爱雪等试验所用PbCl2为微溶。
对于青霉菌属真菌在重金属吸附方面的研究比较多,涉及离子包括Zn2+、Cd2+、Pb2+、Cr2+、Cu2+、Ni2+、Hg2+等。本试验经准二级吸附动力学模拟,计算出Hg2+最大吸附量为47.12 mg·g-1,与Say等(2003)54.8 mg·g-1较为接近; Zn2+吸附试验结果为16.50 mg·g-1,略高于前人研究的6.5、6.8、13 mg·g-1; Cu2+的最大吸附量为25.78 mg·g-1,基本符合其他研究数据范围(9~92 mg·g-1); Pb2+的最大吸附量为201.22 mg·g-1,符合其他研究数据范围(96~298 mg·g-1),且差异不大(Niuetal., 1993;Tanetal., 2003; Dengetal., 2005; 徐雪芹等, 2008; 王建龙等, 2010)。
木霉属真菌在自然界中广泛分布,其生长迅速,适应力强,对营养要素要求低,因此具有很高的应用潜力,但木霉属菌用于吸附重金属方面的研究明显少于青霉属菌。本试验结果表明,菌株lys2015f1(绿色木霉)对在试验涉及的几种重金属的耐性和吸附性均小于菌株lys2015f5(草酸青霉)。胡亮等(2007)利用在含锌重金属废液中分离、筛选的绿色木霉C-1,进行Zn2+吸附试验,研究相关因素对吸附速率的影响。结果显示,菌丝体经酸或碱预处理后, Zn2+吸附能力得到显著提升; 当溶液Zn2+初始浓度在60 mg·L-1、干菌量为3 g·L-1、pH值为5.5的条件下,常温吸附60 min后,污水可以达到2 mg·L-1的相关排放标准。本试验表明,绿色木霉对Hg2+、Cu2+、Zn2+、Pb2+的耐受程度可基本满足生物修复的实际需要。此外,绿色木霉还可促进植物生长、防治植物病虫害、降解土壤内有机物等作用,可见其在重金属污染生物修复方面具有较大的潜力。
我国具有丰富的树木资源,很多树种被证实具有很好的重金属耐受性和吸附性。李庚飞等(2013)对潼关县黄金矿区6种代表性树木进行分析,分别测定枝、根、叶和根际土壤镉、铜和锌的浓度含量。结果显示,刺槐(Rabiniapseudoacacia)对Zn的转移系数为1.40,富集系数为10.61,属Zn的超富集植物; 构树(Broussonetiapapyrifera)对Cu的转移系数0.87,富集系数为0.56,在所测树种中Cu富集能力最强。在对Cd的吸收中,桑(Morusalba)树的转移系数可达到8.90,刺槐为1.44。国内应用林木修复重金属污染土壤的研究起步较晚,但如瑞典、美国等有对镉、铅的污染土壤利用柳树修复的相关工程案例(Berndesetal., 2004)。绿色木霉和草酸青霉能分泌有机酸,降低土壤pH,提高重金属生物活性,增强树木对重金属的吸收能力。同时2种微生物可以将难溶性无机磷转化为可溶性磷,提高土壤肥力,并抑制多种植物病害的发生,有助于增强林木对重金属污染的修复作用(Gongetal., 2014)。
本试验系统分析研究了2株菌株对4种重金属的耐受性和吸附性,2株菌株的试验条件一致,相似指标具有可比性。本试验研究为绿色木霉和草酸青霉用于重金属污染修复提供了科学的参考。但因条件所限,本研究还有诸多不足:试验中只验证了单一因子变量,没有对菌种混合修复、重金属的复合污染等方面进行研究; 在2株微生物的吸附重金属机制、促进植物修复重金属污染机制等领域,也有待进一步探寻; 此外,本试验为实验室论证阶段,没有进行较大规模室外试验,对2株微生物在室外复杂条件下的应用效果,还有待研究。
4 结论
草酸青霉和绿色木霉对重金属Hg2+、Cu2+、Zn2+、Pb2+耐受性的变化趋势可分为2个阶段。在金属离子浓度小于100 mg·L-1时,重金属离子浓度对菌株生物量影响较小。在此阶段,金属离子会优先与微生物表面结合,对菌株毒害作用相对较小;当离子浓度大于200 mg·L-1时,对绿色木霉生物量增长的抑制作用显著增强;当离子浓度大于400 mg·L-1时,对草酸青霉生物量的抑制显著增强。在此阶段,金属离子通过主动运输作用进入微生物细胞内部,并不断积累,对菌株的毒害作用不断增强。微生物的生长、代谢活动受到抑制,直到裂解死亡。
通过EC50分析草酸青霉和绿色木霉对4种重金属耐受性。Hg2+、Cu2+、Zn2+、Pb2+对草酸青霉的EC50值分别为580.47、231.85、572.88、2 284.01 mg·L-1,EC50值较大表示菌株对该种重金属的耐受能力较强,因此,草酸青霉对4种重金属的耐性能力排序为Pb2+gt;Hg2+gt;Zn2+gt;Cu2+;Hg2+、Cu2+、Zn2+、Pb2+对绿色木霉的EC50值对分别为158.07、229.33、464.02、209.59 mg·L-1,绿色木霉对4种重金属的耐性能力排序为Zn2+gt;Cu2+gt;Pb2+gt;Hg2+。
重金属吸附试验结果显示,草酸青霉和绿色木霉对4种重金属最大吸附速率排序一致,均为Pb2+gt;Hg2+gt;Cu2+gt;Zn2+。通过数据分析可知,草酸青霉对Hg2+、Cu2+、Zn2+、Pb2+的吸附速率显著高于绿色木霉(Plt;0.05)。对2菌株的吸附过程进行函数拟合,可知菌株吸附重金属的反应过程更加符合准二级吸附动力学模型的变化规律。通过该模型得出草酸青霉对Hg2+、Cu2+、Zn2+、Pb2+的最大理论吸附量为47.12、25.78、16.50、201.22 mg·g-1,绿色木霉的理论最大吸附量分别是37.12、16.62、14.63、107.31 mg·g-1。
杜爱雪,曹理想,张仁铎. 2008. 高抗铜青霉菌的筛选及其对重金属的吸附. 应用与环境生物学报,14 (5): 650-653.
(Du A X, Cao L X, Zhang R D.2008. Screening ofPenicilliumstrain with high copper resistance and its adsorption of heavy metals. Chinese Journal of Applied and Environmental Biology, 14 (5):650-653. [in Chinese])
冯 宏,李永涛,张 干, 等. 2013.强抗镉真菌月状旋孢腔菌对重金属的吸附作用.应用与环境生物学报, 19 (4): 694-698.
(Feng H, Li Y T, Zhang G,etal. 2013, Metal biosorption byCochlioboluslunatuswith high cadmium resistance. Chinese Journal of Applied and Environmental Biology, 19 (4): 694-698. [in Chinese])
胡 亮,王吉坤,王鲁民. 等. 2007. 绿色木霉对Zn2+的吸附特性研究. 化学与生物工程,24(8):38-40.
(Hu L, Wang J K, Wang L M,etal. 2007. Study on biosorption characteristics ofTrichodermavridefor Zn2+. Chemistry and Bioengineering, 24(8): 38-40. [in Chinese])
黄志钧,李大平. 2012. 重金属铜离子抗性菌株的筛选和吸附性能.应用与环境生物学报,6(6): 964-970.
(Huang Z J, Li D P. 2012, Cu2+biosorption by a highly copper resistant bacterium isolated from soil. Chinese Journal of Applied and Environmental Biology, 6(6): 964-970.[in Chinese])
李庚飞, 程书强.2013.金矿周围树木对土壤重金属的吸收. 东北林业大学学报, 41(1):55-58.
(Li G F, Cheng S Q.2013.Study on absorption of heavy metals by several trees around the gold area. Journal of Northeast Forestry University, 41(1):55-58. [in Chinese])
李兰松,杨永珍,贾虎生.等. 2013. 铜抗性菌株的筛选及其对Cu2+的吸附性能.化工学报, 9(9):3381-3389.
(Li L S, Yang Y Z, Jia H S,etal. 2013. Isolation and Cu2+biosorption of metal-tolerant bacterium. Journal of Chemical Industry and Engineering, 9(9): 3381-3389. [in Chinese])
刘少文.2016.抗汞真菌的筛选鉴定及应用潜力的研究. 北京: 中国林业科学研究院硕士学位论文.
(Liu S W. 2016. Screening and identification of mercury resistant fungi and study of its application potential. Beijing:MS thesis of Chinese Academy of Forestry. [in Chinese])
彭 强,宗 浩. 2011. 微生物治理土壤重金属污染的研究进展. 中国科技博览, 38(26):15.
(Peng Q, Zong H. 2011. Research progress of microbial treatment of heavy metal pollution in soil. China Science and Technology, 38(26):15. [in Chinese])
王 超. 2013. 近海岸指示菌及耐受菌的筛选和生理特性研究.青岛:青岛科技大学硕士学位论文.
(Wang C. 2013, The isolate and research of biological nature of sensitive and tolerant strains from off shore. MS thesis of Qingdao University of Science and Technology. [in Chinese])
王国惠. 2007. 霉菌菌丝球对重金属Cr(Ⅵ)的吸附特性. 中山大学学报:自然科学版,46(3): 112-116.
(Wang G H. 2007. Adsorption of heavy metal chromium by mycelia pellets. Acta Scientiarum Naturalium Universitatis Sunyatseni, 46(3): 112-116.[in Chinese])
王建龙,陈 灿. 2010. 生物吸附法去除重金属离子的研究进展. 环境科学学报,30(4): 673-701.
(Wang J G, Chen C. 2010, The research of bioadsorption of heavy metal irons. Acta Scientiae Circumstantiae, 30(4):673-701. [in Chinese])
徐雪芹,李小明,杨 麒. 等. 2008. 丝瓜瓤固定简青霉吸附废水中Pb2+和Cu2+的机理. 环境科学学报,28(1): 95-100.
(Xu X Q, Li X M, Yang Q,etal. 2008, Biosorption of lead and copper ions byPenicilliumsimplicissimumimmobilized on a loofa sponge immobilized biomass. Acta Scientiae Circumstantiae, 28(1): 95-100. [in Chinese])
叶佩青,檀 笑,詹志薇. 2012. 解脂假丝酵母对重金属工业废水的吸附特性. 生态科学,30(5): 541-546.
(Ye P Q, Tan X, Zhan Z W. 2012, Biosorption of waste water containing heavy metals bycandidalipolytica. Ecological Science, 30(5): 541-546. [in Chinese])
Abedin R M A. 2014. Optimization and statistical evaluation of copper and nickel biosorption capabilities by dry biomass ofPenicilliumoxalicumJQ624873. Life Science Journal, 11(2): 61-67
Adamo P, Mingo A, Coppola I,etal. 2014. Plant colonization of brown field soil and post-washing sludge: effect of organic amendment and environmental conditions. International Journal of Environmental Science amp; Technology, 12(6): 1811-1824.
Berndes G, Fredrikson F, Borjesson P. 2004. Cadmium accumulation and Salix-based phytoextraction on arable land in Sweden. Agriculture Ecosystems amp; Environment, 103(1):207-223.
Dave S, Damani M, Tipre D C. 2009. Remediation byEichhorniaspp. and sulphate-reducing bacteria. Journal of Hazardous Materials, 173(3): 231-235.
Deng S B, Ting Y P. 2005. Characterization of PEI modified biomass and biosorption of Cu(Ⅱ), Pb(Ⅱ) and N(Ⅱ). Water Research, 39(10): 2167-2177.
Doi Y. 2006. Revision of the hypocrites with cultural observations XIII: the hypocreaceae of the Sagami Sea maritime forests, Japan. Memoirs of the National Science Museum, 27(42): 223-232.
Gong M, Du P, Liu X,etal. 2014. Transformation of inorganic P fractions of soil and plant growth promotion by phosphate-solubilizing ability ofPenicilliumoxalicum. Journal of Microbiology, 52(12): 1012-1019.
Kumar A, Bisht B. S, Joshi V.D,etal. 2011. Review on bioremediation of polluted environment: a management tool. International Journal of Environmental Sciences, 1(6): 1079-1093.
Niu H, Xu X S, Wang J H,etal1993. Removal of lead from aqueous solutions byPenicilliumbiomass. Biotechnology and Bioengineering, 42(6): 785-787.
Ozer A, Guruzb G, Calimli A,etal. 2009. Biosorption of copper(Ⅱ) ions onEnteromorphaprolifera: Application of response surface methodology (RSM) Chemical Engineering Journal, 146(3): 377-387.
Say R, Yilmaz N, Denizli A,etal. 2003. Removal of heavy metal ions using the fungusPenicilliumcanescens. Adsorptionence amp; Technology, 21(7):643-650.
Siddiquee S, Aishah S N, Azad S A,etal. 2013. Tolerance and biosorption capacity of Zn2+, Pb2+, Ni3+and Cu2+byFilamentousfungi(Trichodermaharzianum,T.aureovirideandT.virens). Advances in Bioscience amp; Biotechnology, 4(4):570-583.
Srivastava V C, Swamy M M, Mall I D,etal. 2006. Adsorptive removal of phenol by bagasse fly ash and activated carbon: equilibrium, kinetics and thermodynamics. Colloids amp; Surfaces A: Physicochemical amp; Engineering Aspects, 272(1/2): 89-104.
Tan T W, Cheng P. 2003. Biosorption of metal ions withPenicilliumchrysogenum. Applied Biochemistry and Biotechnology, 104, (2): 119-128.
Tyagi M, Fonseca M M R D, Carvalho C R D. 2011. Bioaugmentation and biostimulation strategies to improve the effectiveness of bioremediation processes. Biodegradation, 22(2): 231-241.
Wu F C, Tseng R L, Huang S C,etal. 2009. Characteristics of pseudo-second-order kinetic model for liquid-phase adsorption: a mini-review. Chemical Engineering Journal, 151(1): 1-9.
(责任编辑 朱乾坤)
ToleranceandBiosorptionCharacteristicsofPenicilliumoxalicumandTrichodermaviridetoMercury,Zinc,CopperandLead
Liu Shaowen Jiao Ruzhen Dong Yuhong Liu Caixia Sun Yan
(KeyLaboratoryofTreeBreedingandCultivationofStateForestryAdministrationStateKeyLaboratoryofTreeGeneticsandBreedingResearchInstituteofForestry,CAFBeijing100091)
【Objective】The study aims to research biosorption and tolerance of Hg2+, Zn2+, Cu2+, Pb2+byPenicilliumoxalicumandTrichodermaviride, and hopes to provide a scientific reference for its soil remediation. 【Method】 The heavy metal- tolerance of fungi was evaluated by measuring the growth inhibition rate of the two fungal varieties and the medial lethal concentration (EC50) of heavy metal ions. Firstly, a certain amount of mycelium balls were put into the heavy metal ion solution of known concentration. A few of hours later, the ion concentration was analyzed, and then the heavy metal adsorption efficiency and adsorption quantity were calculated, and the adsorption process was fitted with a function model.【Result】The results showed that biomass of the two strains decreased with increasing concentration of heavy metals, and the process could be divided into two stages. When the metal ions concentration was under 200 mg·L-1, the biomass did not obviously decline or slightly increased. When the concentration was higher than critical value (about 400 mg·L-1), the biomass dropped rapidly. The EC50value of strain lys2015f1 in Hg2+, Zn2+, Cu2+, and Pb2+solution was 158.07, 464.02, 229.33, and 209.59 mg·L-1, and it for strain lys2015f5 was 580.47, 572.88, 231.85, and 2 284.01 mg·L-1. Thus, the tolerance degree of strain lys2015f1 to heavy metals was in the order of: Zn2+gt;Cu2+gt;Pb2+gt;Hg2+, and the tolerance level of strain lys2015f5 was Pb2+gt;Hg2+gt;Zn2+gt;Cu2+. The adsorption process was more fitted to the pseudo-second-order kinetic model. According to the model rate constant k2value, the adsorption rate of two strains was obtained, and the two strains had the same order in adsorption rate for those metal ions of Pb2+gt;Hg2+gt;Cu2+gt;Zn2+. The theoretical value of the maximum adsorptions to (Hg2+, Zn2+, Cu2+, Pb2+) from this model for lys2015f1 was 37.12, 14.63, 16.62, and 107.31 mg·g-1, and for lys2015f5 was 47.12, 16.50, 25.78, and 201.22 mg·g-1. The rate limiting step of adsorption was controlled by chemical reactions. In the same conditions, the order of two strains for heavy metal adsorption rate was Hg2+gt;Cu2+gt;Zn2+gt;Pb2+.【Conclusion】The two strains have high heavy metal tolerance and adsorption. Combined with the functions of biological control, plant growth, degrading soil organic matter etc, the strains should have high potential abilities in remediation of heavy metals pollution.
Penicilliumoxalicum;Trichodermaviride; heavy metal resistance; biosorption
10.11707/j.1001-7488.20171011
2015-12-25;
2016-04-14
国家林业局引进国际先进林业科学技术项目“生化黄腐酸高效发酵菌种及生产工艺引进”(2013-4-54)。
*焦如珍为通讯作者。
S714
A
1001-7488(2017)10-0100-09

