护卵汤对慢性应激超排卵小鼠卵巢TGF-β1,P-Smad3及FSHR mRNA表达的影响
刘碧源,申可佳,申奏秦旋,付灵梅,熊 桀
(湖南中医药大学,湖南 长沙 410208)
护卵汤对慢性应激超排卵小鼠卵巢TGF-β1,P-Smad3及FSHR mRNA表达的影响
刘碧源,申可佳*,申奏秦旋,付灵梅,熊 桀
(湖南中医药大学,湖南 长沙 410208)
目的观察护卵汤对慢性应激超排卵小鼠卵巢转化生长因子-β1(transforming growth factor beta 1,TGF-β1)、信号蛋白P-Smad3及卵泡刺激素受体(follicle-stimulating hormone receptor,FSHR)mRNA表达的影响。方法建立慢性应激小鼠模型,造模成功后,随机分为模型组、护卵汤组和生长激素组,另设正常组。在超排卵第3天和注射绒毛膜促性腺激素(human chorionic gonadotropin,HCG)24 h后,检测各组卵巢TGF-β1、P-Smad3及FSHR mRNA表达。结果与模型组比较,在超排卵第 3天,护卵汤组和生长激素组TGF-β1、P-Smad3及 FSHR mRNA表达均显著升高(P<0.01或P<0.05);注射 HCG 24 h后生长激素组表达升高更明显(P<0.01)。结论护卵汤可能通过激活TGF-β/Smads信号通路,发挥促进卵泡发育和改善卵巢功能的作用。
护卵汤;慢性应激;超排卵;卵巢转化生长因子-β1;P-Smad3;卵泡刺激素受体
现代社会女性身兼家庭工作多重角色,承受的压力越来越大,长期焦虑、忧郁、愤怒等负面情绪作为应激,不断刺激下丘脑-垂体-卵巢轴,引起神经内分泌及卵巢功能紊乱,卵巢功能的受损引起女性生殖功能退化,出现月经失调、闭经、不孕等系列疾病,严重影响女性的生活质量并加速机体衰老进程。即使在辅助生殖技术如此发达的今天,仍有部分患者因卵巢功能衰退无法获得足够的高质量卵子而失去生育的机会,给患者身心及社会经济带来巨大的压力[1-2]。
护卵汤是全国名老中医尤昭玲教授所创,治疗卵巢功能障碍临床疗效好,深受患者欢迎[3-4]。我们的前期基础研究已证实护卵汤可改善超排卵大鼠卵巢功能,促进其排卵前卵巢微环境转化生长因子-β (transforming growth factor-beta,TGF-β)等蛋白的表达[5-9],在本研究中通过模拟人类应激造成卵巢功能紊乱的发病经过,从TGF-β/Smads信号通路进一步探讨护卵汤对卵巢功能的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 6周龄健康SPF级ICR雌性小鼠80只,体质量为22~25 g。第三周购入成年ICR雄性小鼠40只,均由湖南斯莱克景达实验动物有限公司提供,动物合格许可证号:SCXK(湘)2011-0003。
1.1.2 药物 护卵汤组方:熟地黄10 g,生地黄10 g,沙参 10 g,石斛 10 g,山药 10 g,莲子 10 g,桑椹子10 g,覆盆子10 g,菟丝子10 g,月季花10 g,莲子心3 g,肉苁蓉10 g,甘草3 g。以上饮片购自湖南中医药大学附属第一医院药房,购回后加水浸泡2 h,火上煎煮3次,将3次煎液混合浓缩成浓度1.49 g/mL的护卵汤,4℃冰箱保存供实验用。来曲唑(letrozole sheets,LE):由江苏恒瑞医药公司生产。生长激素(growth hormone,GH):由长春金赛药业公司生产。阿司匹林:购自沈阳奥吉娜药业公司。尿促性腺激素 (gonadotropins,Gn)和绒毛膜促性腺激素(human chorionic gonadotropin,HCG):丽珠制药厂生产。
1.1.3 主要试剂 PCR试剂盒购自KAPA Biosystems公司,逆转录试剂盒购自TAKARA公司。PCR引物由南京金斯瑞生物公司合成,其他常规试剂均为国药产品分析纯。
1.1.4 主要仪器 荧光定量PCR仪 (BIO-RAD公司,Real-Time System 型),凝胶成像系统(BIO-RAD公司,Universal Hood II型),水平电泳设备 (BIORAD 公司,DYC-31D 型),离心机(Eppendorf公司,5424 R型),超净工作台 (苏州净化公司,SW-CJ-2D 型)。
1.2 方法
1.2.1 慢性应激小鼠模型的建立[10]6周龄ICR雌性小鼠正常喂养1周后,称量并记录体质量。随机抽取20只小鼠为正常组,其余小鼠每天上午放入制动器内制动,共制动14 d;第一次制动时间从3 h开始,每天延长30 min,至最长制动时间为每天6 h,造成小鼠慢性应激状态。制动第10天开始,每天阴道涂片并用瑞氏染色观察阴道脱落细胞的情况,监测小鼠动情周期的变化。若发现动情周期紊乱无规律交替,或在某期明显延长或持续停留在间期记为动情周期异常,提示小鼠卵巢功能紊乱和/或减退[11-12]。第14天造模成功制动结束后,再次称量所有小鼠体质量。
1.2.2 给药及标本采集 造模成功后,小鼠随机分为护卵汤组、生长激素组和模型组,另设正常组。护卵汤组:从试验第1天开始灌胃护卵汤0.029 g/(kg·d)直至实验结束,1次/d。 生长激素组:从试验第 8 天开始腹腔注射 GH 0.0005IU/(kg·d),1 次/d,连续12 d;试验第15天加用阿司匹林0.01 mg/(kg·d)灌胃直至实验结束,1次/d。正常组和模型组:在同一时间灌胃或注射等量的生理盐水。4组小鼠均在试验第15天启动微刺激超排卵,其方案为:先用 LE 0.65 μg/(kg·d)灌胃,1 次/d,连续 5 d;第21 天腹腔注射 Gn 0.0195U/(kg·d),1 次/d, 连续7 d,于末次应用Gn后,雌雄鼠以2∶1比例合笼,次日晨检查阴栓,有阴栓者腹腔注射HCG 1.29U/(kg·d)一次。每组小鼠在超排卵启动后第3天和注射HCG 24 h后这两个时间段,分别处死10只小鼠获取卵巢放入液氮罐保存待检。
1.2.3 实时荧光定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR)检测卵巢 TGF-β1,FSHR,P-Smad3 mRNA的表达水平 用Trizol提取卵巢组织的总RNA,紫外分光光度计定量检测。总RNA逆转录成cDNA按照试剂盒说明书操作,然后进行PCR扩增。引物参照文献设计(见表1),以β-肌动蛋白(β-Actin)为内参分别扩增 TGF-β1,FSHR,PSmad3的基因。反应程序为:95℃预变性3 min;95℃变性5 s;56℃退火10 s;72℃延伸25 s;进行39循环后;65℃维持5 s;95℃维持50 s。数据采用仪器自带软件qbase plus分析,基因表达相对量用2-△△Ct表示,用扩增曲线、熔点曲线监测各标本 PCR反应的特异性。

表1 PCR引物序列及长度
1.3 统计学分析
2 结果
2.1 一般情况及动情周期观察
正常对照组从实验开始到实验结束外观及活动状态均无异常,体质量适度增加。其他组小鼠制动开始后逐渐出现进食减少,二便减少,行动迟缓,四肢无力,毛色晦暗无光并出现不同程度的脱落,制动结束后体质量较正常对照组明显减轻;对动情周期的观察发现,正常组小鼠均有规律变化的动情周期,模型组小鼠均出现不同程度的动情周期异常,提示慢性制动应激引起小鼠卵巢功能紊乱或减退。制动小鼠在制动结束后逐渐恢复进食及二便,行动变活泼,毛色恢复光泽,体质量增加,到实验结束时体质量与正常组无明显区别。
2.2 各组小鼠卵巢TGF-β1mRNA表达的比较
在超排卵第3天,模型小鼠卵巢组织中TGF-β1mRNA 表达明显低于正常组(P<0.01),随时间延长其mRNA表达逐渐恢复,但与正常组比较差异仍有统计学意义(P<0.05);与模型组比较,护卵汤组和生长激素组在该时间点 TGF-β1 mRNA表达均明显升高 (P<0.01)。 但注射 HCG 24 h 后护卵汤组其mRNA表达与模型组比较差异无统计学意义(P>0.05)。结果见表 2。
2.3 各组小鼠卵巢P-Smad3 mRNA表达的比较
与正常组比较,在超排卵第3天模型组小鼠卵巢组织中 P-Smad3 mRNA 表达明显降低(P<0.01),但在注射HCG 24 h后达到正常组水平。经过干预后,护卵汤组和生长激素组在超排卵第3天其mRNA 表达均较模型组明显升高(P<0.01);护卵汤组在注射HCG 24 h后P-Smad3 mRNA表达与模型组比较差异无统计学意义(P>0.05)。 见表 3。2.4 各组小鼠卵巢FSHR mRNA表达的比较
表2 各组小鼠卵巢TGF-β1 mRNA表达的比较 (±s,n=10)
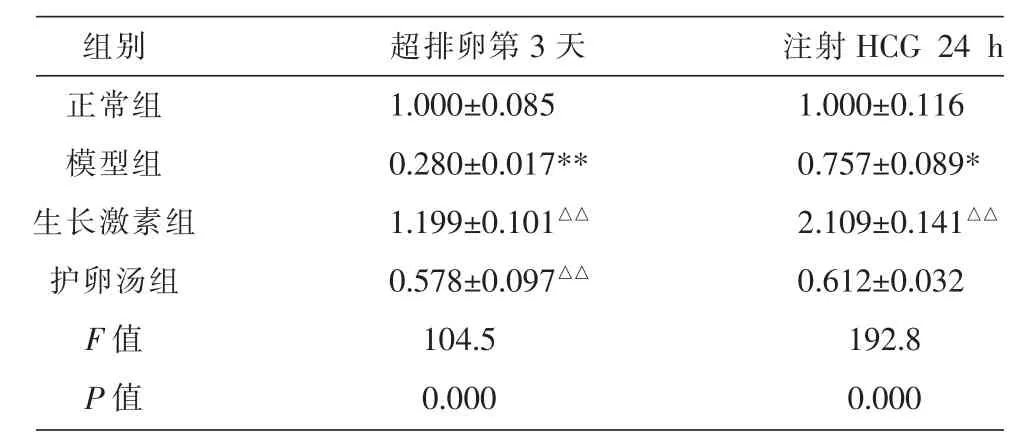
表2 各组小鼠卵巢TGF-β1 mRNA表达的比较 (±s,n=10)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,△△P<0.01。
组别正常组模型组生长激素组护卵汤组F值P值超排卵第3天1.000±0.085 0.280±0.017**1.199±0.101△△0.578±0.097△△104.5 0.000注射HCG 24 h 1.000±0.116 0.757±0.089*2.109±0.141△△0.612±0.032 192.8 0.000
表3 各组小鼠卵巢P-Smad3 mRNA表达的比较 (±s,n=10)
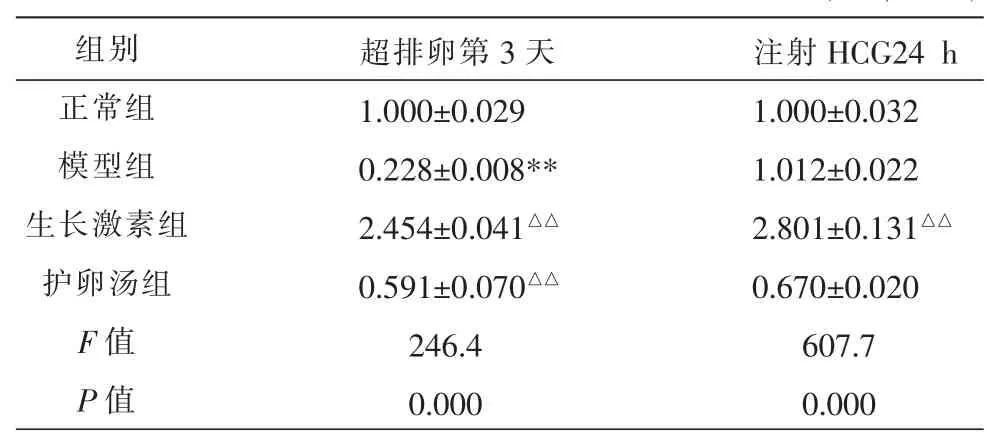
表3 各组小鼠卵巢P-Smad3 mRNA表达的比较 (±s,n=10)
注:与正常组比较,**P<0.01;与模型组比较,△△P<0.01。
组别正常组模型组生长激素组护卵汤组F值P值超排卵第3天1.000±0.029 0.228±0.008**2.454±0.041△△0.591±0.070△△246.4 0.000注射HCG24 h 1.000±0.032 1.012±0.022 2.801±0.131△△0.670±0.020 607.7 0.000
在两个时间点,模型组小鼠卵巢组织中FSHR mRNA 表达均明显低于正常组 (P<0.01);生长激素组其mRNA表达均显著高于模型组 (P<0.01)。在超排卵第3天,护卵汤组FSHR mRNA表达较模型组明显升高 (P<0.05), 但在注射 HCG 24 h后其表达与模型组比较差异无统计学意义(P>0.05)。 结果见表 4。
表4 各组小鼠卵巢FSHR mRNA表达的比较 (±s,n=10)

表4 各组小鼠卵巢FSHR mRNA表达的比较 (±s,n=10)
注:与正常对照组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。
组别正常组模型组生长激素组护卵汤组F值P值超排卵第3天1.000±0.080 0.458±0.032**2.071±0.075△△0.563±0.022△934.4 0.000注射HCG 24 h 1.000±0.044 0.635±0.084**2.454±0.173△△0.709±0.020 324.7 0.000
3 讨论
卵泡发育包括促性腺激素非依赖性阶段和促性腺激素依赖阶段。目前认为这种不依赖激素的调节主要由卵巢局部调控,包括卵泡颗粒细胞、卵泡膜细胞及卵母细胞表达分泌的各种细胞因子及其受体、激素类分子,以及具有支持营养作用的其他蛋白分子。有研究发现TGF-β1在始基卵泡的募集及始基卵泡池的维持方面起重要调控作用[13]。而TGF-β超家族对卵泡发育的调节作用是通过与卵泡细胞上相应受体结合,启动多条信号转导通路来传递生物信息。其中TGF-β/Smads信号通路已被证实在卵泡存在。Smads蛋白家族是TGF-β超家族受体作用的底物,将信息传递到细胞核内,调控相关靶基因的表达。通过定向敲除Smads蛋白,出现年龄依赖的不孕不育,并出现卵泡的闭锁增加,卵泡发育障碍,激素合成受阻,排卵障碍等。可见Smads蛋白家族在卵泡发育过程中发挥重要作用。其中Smad2/Smad3主要参与TGF-β的信号转导[14]。
本研究发现模型组小鼠卵巢组织 TGF-β1、FSHR及P-Smad3的mRNA表达明显低于正常组,提示慢性制动应激可能通过抑制卵巢TGF-β/Smads信号通路使小鼠卵巢功能受损;护卵汤组和生长激素组小鼠的相关指标表达较模型组明显增高,提示护卵汤和生长激素/阿司匹林可上调慢性制动小鼠超排卵过程中卵巢 TGF-β1、FSHR及 P-Smad3的mRNA表达。已证实TGF-β1可作用于卵巢颗粒细胞、卵泡膜细胞和卵母细胞,启动细胞内Smads信号通路,激活Smad2/Smad3使之磷酸化,活化的Smad2/Smad3与Smad4形成多聚体,进入核内调控靶基因的转录,最终可促进芳香化酶、FSHR和黄体生成素受体(LHR)等表达及雌二醇(E2)和孕酮(P)的分泌,从而调控卵泡的发育[15-16]。故本实验结果提示护卵汤和生长激素/阿司匹林可通过TGF-β1信号通路改善卵巢功能,促进卵泡发育。同时,实验发现生长激素组在注射HCG 24 h后小鼠卵巢TGF-β1、FSHR及P-Smad3的mRNA表达更高,但护卵汤的作用不明显,提示生长激素/阿司匹林对卵巢功能的改善可能更优于中药护卵汤,当然,这需要进一步的动物及临床实验去判断和验证。
[1]赵晓明.辅助生殖技术的有效性和安全性[J].上海交通大学学报(医学版),2012,32(8):965-967.
[2]Sesh Kamal Sunkara1,Arri Coomarasamy,Wiebke Arlt,et al.Should androgen supplementation be used for poor ovarian response in IVF?[J].Human Reproduction,2012,27(3):637-640.
[3]王 肖,尤昭玲.护卵汤对体外受精-胚胎移植长方案干预效应的临床研究[J].中国中西医结合杂志,2016,36(7):806-809.
[4]冯桂玲.护卵安胎方对IVF-ET短方案治疗POR干预效应的临床研究[D].长沙:湖南中医药大学,2013.
[5]申可佳,熊 桀,尤昭玲,等.护卵汤对GnRHa超排卵大鼠血清生殖激素的影响[J].湖南中医药大学学报,2012,32(12):55-57.
[6]申可佳,尤昭玲,熊 桀,等.护卵汤对GnRHa超排卵大鼠卵巢形态的影响[J].湖南中医药大学学报,2012,32(9):25-28.
[7]申可佳,熊 桀,尤昭玲,等.护卵汤对GnRHa超排卵大鼠卵巢细胞凋亡及活胎率的影响[J].湖南中医药大学学报,2013,33(1):99-101,107.
[8]申可佳,熊 桀,尤昭玲,等.护卵汤对GnRHa超排卵大鼠卵巢FSHR和LHR蛋白表达的影响[J].湖南中医药大学学报,2013,33(7):26-29.
[9]申可佳,熊 桀,尤昭玲,等.护卵汤对GnRHa超排卵大鼠卵巢细胞因子及受体的影响[J].湖南中医药大学学报,2013,33(2):8-10.
[10]申可佳,申奏秦旋,刘碧源,等.慢性制动应激建立卵巢早衰及卵巢低反应小鼠模型的研究[J].中国医药导报,2017,14(17):19-22.
[11]Kam K,Park Y,Cheon M,et a1.Effects ofimmobilization stress on estrogen-induced surges of luteinizing hormone and prolactin in ovariectomized rats[J].Endocrine,2000,12:279-87.
[12]连晓媛,丁 岩,陈 奇,等.重复制动应激对雌性大鼠卵巢功能的影响[J].中药新药与临床药理,2004,15(6):373-376.
[13]杨书红.MicroRNAs+在始基卵泡募集过程中的表达模式和调控机制的研究[D].武汉:华中科技大学,2012.
[14]曾惠芬,王庆文.转化生长因子-β及其Smad信号转导的研究进展[J].中国药物与临床,2010,10(10):1145-1147.
[15]申可佳,尤昭玲.中医药对卵巢TGF-β/Smad信号转导的干预及思考[J].湖南中医药大学学报,2013,33(10):104-106.
[16]Handan Celik,Devran Bildircin,Davut Guven,et al.Random anti-Mullerian hormone predicts ovarian response in women with high baseline follicle-stimulating hormone levels Anti-Mullerian hormone in poor responders in assisted reproductive treatment[J].Journal of Assisted Reproduction And Genetics,2012,29(8):797-802.
(本文编辑 杨 瑛)
Effects of Huluan Decoction on mRNA Expression of TGF-β1,P-Smad3 and FSHR in Super Ovulation Mice with Chronic Stress
LIU Biyuan,SHEN Kejia*,SHEN Zouqinxuan,FU Lingmei,XIONG Jie
(1.Affiliated Hospital of Hunan Academy of traditional Chinese Medicine,Changsha,Hunan 410006,China;(Hunan University of Chinese Medicine,Changsha,Hunan 410208,China)
ObjectiveTo investigate the effects of Huluan decoction on mRNA expression of TGF-β1,P-Smad3 and FSHR in super ovulation mice with chronic stress.MethodsChronic stress mice models were established.After modeling,the mice were randomly divided into model group,Huluan decoction group,growth hormone group,and normal group(no movement limit)was also assigned.On the third day of the super ovulation and after 24 hours of injection HCG,ovaries were taken from mice of each group for mRNA analysis of TGF-β1,P-Smad3 and FSHR.ResultsCompared with the model group,on the third day of the super ovulation,the mRNA expression levels of TGF-1,P-Smad3 and FSHR in growth hormone group and Huluan decoction group were significantly higher than those in the model group (P<0.01 orP<0.05),but growth hormone group increased significantly after 24 hours of the injection HCG (P<0.01).ConclusionHuluan decoction could activate TGF-beta/Smads signaling pathway to promote the follicular development and improve ovarian function in super ovulation mice with chronic stress.
Huluan decoction;chronic stress;super ovulation;TGF-β1;P-Smad3;FSHR
R285.5;R711.75
A
10.3969/j.issn.1674-070X.2017.11.006
本文引用:刘碧源,申可佳,申奏秦旋,付灵梅,熊 桀.护卵汤对慢性应激超排卵小鼠卵巢TGF-β1,P-Smad3及FSHR mRNA表达的影响[J].湖南中医药大学学报,2017,37(11):1192-1195.
2017-01-17
国家自然科学基金项目资助(81303003,81403427)。
刘碧源,女,副教授,主要从事医学免疫学的基础研究。
*申可佳,女,副教授,主要从事中西医结合治疗不孕不育的基础研究,E-mail:shen_kejia@163.com。

