既熟悉又陌生的疾病:大动脉炎
冯媛 吴振彪
既熟悉又陌生的疾病:大动脉炎
冯媛 吴振彪
大动脉炎是一种主要累及主动脉及其主要分支的大血管炎,属于少见病,东亚国家多发,病因及发病机制尚不十分清楚。40岁前女性多发,有较高的病死率及致残率。诊断主要依据临床特征及影像学证据。影像学检查在诊断及病情评估疗效判定中起关键作用。治疗主要是糖皮质激素联合免疫抑制剂。生物制剂对传统治疗无效者可能有效。部分患者需手术治疗。一些新的治疗靶点可能成为治疗的新突破。
大动脉炎 影像学 糖皮质激素 免疫抑制剂 生物制剂

吴振彪,第四军医大学西京医院临床免疫科主任,主任医师,博士研究生导师,中国医师协会风湿免疫分会委员,陕西省风湿免疫分会副主任委员,海峡两岸医药交流学会风湿免疫分会血管炎专业组副组长。担任《医学参考报-风湿免疫频道》《中国狼疮杂志》《中华临床医师杂志》《西部风湿病杂志》等编委及审稿人,承担国家级及军队、省部级课题10余项,发表论文60余篇,获国家、军队及省部级奖多项,获国家授权专利1项。
大动脉炎(Takayasu’s arteritis,TAK)是一种病因不明的主要累及主动脉及其主要分支,导致血管壁增厚,管腔狭窄、闭塞,甚至发生动脉瘤的少见的非特异性炎症性疾病,在血管炎的分类中属于大血管炎[1]。TAK是一种古老的疾病,早在1700—1800年就有报道一些无脉及主动脉病,1761年Morgagni在1例40岁女性尸检时发现大血管动脉瘤及狭窄[2]。1830年,日本Rokushu Yamamoto在他的橘黄医谈中第一次记载TAK:45岁男性,高热,1年后无脉,11年后死亡[3]。1905年眼科医师Takayasu等[4]在第12届日本眼科年会上第一次报道1例21岁女性,眼底视网膜中央血管异常,视力异常,无脉。1920年,第1例25岁女性活检证实TAK是累及动脉内膜、中膜及外膜的全程动脉炎症[3]。Yasuzo Niimi于1942年首次使用“Takayasu disease”这一病名[5]。1951年,Shimizu 等[6]首次总结报道了“Takayasus arteritis”的临床特征,并称之为“无脉症”。TAK是少见病,近年来越来越受到关注,虽然诊治水平有了很大的进展,但在诊断、病情评估、治疗等方面还存在很多困惑,迄今尚无国际公认的诊治指南。
1 流行病学特点及预后
TAK以青年女性多发,20~30岁是发病高峰。近年发现发病不受性别及年龄限制。不同国家、种族人群发病率不同。TAK多见于东亚、印度及地中海国家。随着我国诊治水平的提高,发现发病率并不低于其他东亚国家。法国的一项对比研究发现,白种人平均诊断年龄为39.3岁、北非人28.4岁、黑人28岁[7]。大部分TAK患者在40岁前发病,但也有部分患者40岁后发病。40岁以后发病者复发率低,胸痛、上肢痛、直立性低血压、眩晕、头痛发生率明显高于40岁前发病者。
TAK总体死亡率为3%~15%,近年来预后有了改善,平均10年生存率为97%,15年生存率为86%。Mayo Clinic一个长期随访发现死亡率较正常对照增加,标准化死亡率比为3.0。疾病特点、严重程度、不同药物治疗、手术等均会影响生存率[8]。
TAK致残率高,74%的患者正常活动受影响,23%~47%的患者最终完全残疾,60%的患者血管性跛行影响正常活动,复发次数与残疾相关。易导致残疾的危险因素有心力衰竭、神经系统缺血、中风、短暂性缺血。TAK患者心血管事件发生率明显高于对照人群,亚临床型动脉粥样硬化发生率高,是缺血的潜在危险因素[9]。
2 病因及发病机制
TAK的病因及发病机制尚不十分清楚,总的来说与自身免疫、内分泌、环境因素、遗传、炎症等相关。结核分支杆菌及病毒感染可能是重要诱因。Seko等[10]发现γδT细胞及αβT细胞、NK细胞在血管损伤中发挥重要作用。抗内皮细胞抗体(AECA)不仅可以激活内皮细胞释放IL-6、IL-8、TNF-α等炎症介质,还可能在体内增强补体依赖的细胞毒反应[11]。患者血液、尿液中雌激素增加,而雌激素与病情活动度有关,提示雌激素与TAK发病有关。人类白细胞抗原(HLA)与TAK密切相关,且有种族差异:日本患者主要是 HLA-A10、B39、B52、Bw52、B5、DR2 升高,韩国患者主要是 HLA-Bw52、Cw6、DR7、DQw2升高,墨西哥患者主要是HLA-B39、B44、B52升高,北美白人主要是DR1升高。日本一项针对96例患者的研究发现HLA-B52阳性时,发生TAK的风险高[12]。
目前认为TAK发生主要经过以下3个通路:(1)抗原引起血管细胞上原始HSP65的改变,导致Ⅰ类主要组织相容性复合体(MHC)上抗原的表达。Ⅰ类MHC活化NK细胞、γδT和CD8+T细胞,促使大量穿孔素(PTX)释放,继而导致细胞损伤以及细胞因子、趋化因子的释放。趋化因子可以募集多余的炎性细胞,包括巨噬细胞和CD4+T细胞,进而产生和释放TNF-α和IL-6。(2)树突状细胞将抗原提呈给CD4+T细胞,促使IFN的释放,募集巨噬细胞,导致TNF-α和IL-6的释放和浸润。(3)B细胞可以识别抗原,并提呈到CD4+T细胞,B细胞和T细胞互相作用,导致TNF-α和IL-6的分泌。TNF-α可导致肉芽肿的形成,增加黏附分子的表达,活化趋化因子,募集炎症因子及分泌IL-6,继而激活Th17通路,增加细胞间黏附分子(ICAM)和血管细胞黏附分子(VCAM)的表达,促进B细胞分化为浆细胞[13]。这些炎症反应及炎症因子(IL-6、TNF-α、IFN、IL-17)等作用于血管内膜、中层及外膜,最终导致管壁增厚、管腔狭窄、闭塞甚至动脉瘤形成。
3 TAK病理特点
TAK是一种全身性动脉炎,主要累及主动脉、肺动脉及其主要分支。血管滋养血管严重炎症是TAK特征性改变。最早的病理改变是血管内膜及中膜的炎性肉芽肿。浸润细胞主要是γδT细胞、NK细胞,巨噬细胞及细胞毒T细胞、辅助T细胞。HSP65及其反应的γδT细胞在血管中膜及滋养血管大量表达是区别于动脉硬化的病理改变之一。炎症最终导致内膜钙化,是TAK慢性阶段的特征。97%累及主动脉弓,46%有腹主动脉病变,仅2%有腹主动脉病变而无胸主动脉受累[14]。
4 TAK诊断
TAK早期症状不典型,没有特异度高的血清学标志物,早期诊断难,误诊、延迟诊断率高。疑似TAK的症状体征有年轻患者不明原因的ESR、C反应蛋白(CRP)水平升高,颈动脉痛,年轻患者不明原因的高血压,双臂压力差超过10mmHg,外周脉博减弱或缺失,肢体跛行,动脉杂音,心绞痛等。
随着对TAK临床特点认识的加深,一些学者相继提出了多个分类诊断标准。1978年Ishikawa首次提出TAK分类诊断标准,1988年进行了修订。1990年美国风湿病学会(ACR)制定的分类标准是目前应用较多的标准。该标准提出TAK诊断需满足以下6项指标中的至少3项:(1)发病年龄<40岁(出现TAK相关症状年龄<40岁);(2)四肢跛行[活动时一个或多个肢体(尤其是上肢)肌肉疲劳加重与不适];(3)肱动脉搏动减弱(单侧或双侧肱动脉脉搏减弱);(4)血压差>10mmHg(双臂上臂收缩压相差>10mmHg);(5)锁骨下动脉或主动脉杂音(单侧或双侧锁骨下动脉或腹主动脉听诊有血管杂音);(6)动脉血管异常(动脉造影提示主动脉、主动脉主要分支或上下肢近心端大动脉的节段性狭窄或闭塞,除外动脉粥样硬化、肌纤维发育不良)。该标准灵敏度为90.5%,特异度为97.8%。尽管该标准国际上广泛应用,但存在以下不足:(1)限定发病年龄<40岁不妥,尽管大部分TAK患者发病年龄20~40岁,>40岁发病是少数但并不少见,40岁以上发病约为17.5%~32.0%;(2)该标准建立主要是和小血管炎对照,而未与动脉粥样硬化及先天性动脉病鉴别。
2010年 欧洲抗风湿病联盟(EULAR)/PRINTO/PRES正式发布了2008年制定的18岁以下TAK分类标准:在满足必要标准前提下,满足其他标准至少1条即可诊断。必要标准:血管造影异常[常规照影、CT血管造影(CTA)、磁共振血管造影(MRA)]证实的主动脉或肺动脉及其主要分支动脉瘤/扩张、狭窄、闭塞或动脉壁非纤维增生导致增厚(常为局灶或节段性)。其他标准:(1)动脉搏动减弱、缺失或四肢跛行;(2)四肢收缩血压差>10mmHg;(3)主动脉和(或)其主要分支有血管杂音或触及震颤;(4)收缩压、舒张压>正常上限95%;(5)急性时相反应产物升高(ESR>20mm/h或CRP高于正常)。该标准灵敏度为 100%,特异度为99.9%[10,15]。TAK根据受累部位,分为6型,见表1。
5 TAK病情活动度评估
病情活动度监测对于判断病情、评估疗效至关重要,但目前病情活动度监测较困难。常用的监测病情活动度的指标有临床症状及体征、血清学指标和影像学表现。

表1 TAK分型
5.1临床症状及体征 通过体检发现新的血管症状、体征是评估病情活动度的最简单也是第一个手段。体检与影像学表现并不一定相符。血管杂音、无脉、双侧肢体血压差异常这3项体征任意一项阳性的灵敏度为52%~71%,特异度为59%~86%。如果2项异常,则特异度提高至88%~100%,但灵敏度则降至6%~30%。出现缺血的症状甚至体征时,也并不总是提示有动脉炎症(需有影像学及病理检查证实)[16]。
5.2 血清学指标 (1)TAK病情活动时通常WBC及PLT 升高;(2)ESR、CRP 升高;(3)PTX-3 水平与病情活动度相关;(4)AECA滴度变化可反映疗效;(5)病情活动者基质金属蛋白酶(MMP)-9升高;(6)最近一些研究提示TAK患者IL-6、IL-8、IL-18高于健康对照者,且与病情活动度相关,尚需深入研究证实。
尽管ESR、CRP是最常用的判断病情是否活动的实验室指标,但其灵敏度及特异度均不高。研究显示病情活动的患者中72%ESR升高,28%ESR正常;在临床上判断病情不活动的患者中,44%ESR升高[17-18]。
5.3 影像学检查 影像学检查是TAK诊断、病情评估、疗效及预后判断的基石,包括超声、血管造影、CTA、MRA、正电子发射型计算机断层显像(PET)、PET/CT等。
5.4 TAK病情活动标准 自1990年始相继提出多个TAK病情活动标准。美国梅奥诊所于1990年提出TAK病情活动标准:满足以下2项及以上特征提示疾病活动:(1)全身症状(发热、肌痛、关节痛);(2)患者动脉病理标本提示活动期炎症(如淋巴浆细胞浸润、巨细胞浸润);(3)ESR 或 CRP 升高;(4)手术时发现动脉及周围软组织急性炎。1994年,Kerr’s提出另一个病情活动标准即Kerr’s标准(NIH标准),以下4项中有2项阳性即可定义为病情活动:(1)不能用其他原因解释的系统症状;(2)ESR 升高;(3)血管缺血或炎症的证据(跛行、无脉或减弱、血管杂音、血管疼痛、血压不对称);(4)典型血管造影异常。
目前尚无国际公认的TAK缓解标准,有学者提出缓解及改善或部分缓解及完全缓解标准。(1)缓解:无临床及实验室疾病活动证据,系列影像学评估无新发的血管损害。(2)改善或部分缓解:激素及免疫抑制剂较初始剂量减少50%,病情稳定。(3)完全缓解及持续缓解:无病情活动,连续影像学评估无新发血管损害,不用激素或免疫抑制剂治疗,或10mg/d泼尼松治疗6个月以上[8]。
6 影像学检查在诊治中的作用
影像学检查应用包括以下几个方面:(1)用于TAK诊断。检测TAK的大血管炎症,是目前最有价值的诊断手段,称之为“cornerstone”,监测发现主动脉及其主要分支和肢体动脉的病变。(2)用于评估疾病程度。(3)评估治疗效果。(4)介入治疗。(5)与其他疾病进行鉴别:如动脉周围炎、独立主动脉炎、IgG4相关疾病血管受累等。
6.1 不同影像学检查方法的特点
6.1.1 血管造影 血管造影是目前TAK诊断的金标准,具有可以广泛评估血管、可重复、对小血管分辨率高、观察管腔狭窄情况等优点,但也具有明显的缺点,包括有放射性、侵袭性;碘过敏、肾功能受损患者禁忌;不能观察血管炎症,仅能观察晚期血管壁狭窄等病变。
6.1.2 超声多普勒(CDUS) 可以观察血管壁情况,管腔是否有狭窄及动脉瘤形成,测定狭窄处内径及血管峰血流频谱改变。CDUS价格较低,无放射性,无需静脉穿刺,可重复检测,对中、小血管分辨率好,可以观察动脉壁的弹性、血流方向、钙质沉积/粥样斑块。但也具有以下缺点:全身图像采集缓慢,不同观察者差别较大,对主动脉、锁骨下动脉近端观察不佳,不能直接观察到是否存在炎症。
6.1.3 超声造影技术 运用发泡剂,微泡造影加强血管内分辨率,对动脉壁分辨率显著提高,可显示动脉管壁微循环情况及新生滋养血管情况。其原理是炎症活动期,滋养血管增生、扩张、充血,周围炎性细胞浸润;炎症非活动期,纤维母细胞增生,胶原纤维增多,明显纤维化,有功能的滋养血管密度减少。而发泡剂对活动期滋养血管显像增强,非活动期纤维化则不增强,故可以区分炎症是否活动。
6.1.3.1 CTA CTA是常用的评估TAK的影像学手段,与金标准血管造影相比,能发现95%动脉病变,对TAK诊断的灵敏度及特异度分别为95%和100%。CTA具有价格合理,图像采集快;分辨率为中等程度,达1mm;管腔显影好,可以评估全身动脉系统,可重复;炎症活动期管壁对比剂增强可观察到管壁炎症;也能显示管壁钙质沉积/粥样斑块等优点。但也具有放射性,碘过敏、肾功能受损患者禁忌,小血管分辨率有限,对远端血管显示较差,无标准技术指标,需要静脉穿刺等缺点。CTA既可发现静止病变,也可发现活动病变,可以监测疾病进程。
6.1.3.2 MRA MRA具有诸多优势,如管腔显影好,可以直接观察管壁炎症(管壁水肿、管壁增强),观察全身动脉,可以整体评估,微创,可重复,无放射性。但也有一些局限,如价格昂贵,肾功能受损、有幽闭恐惧症、身体有金属装置患者禁忌,全身图像采集缓慢,中小血管分辨率有限,不能显示钙质沉积/粥样斑块等。对TAK诊断的灵敏度及特异度均为100%,可以监测疾病活动度。一项24例患者的系列研究发现,94%的病情活动者存在MRA的管壁水肿。但临床病情不活动者中56%也存在水肿,管壁水肿与新发病灶并不相对应,16例患者中6例一直存在水肿,但随访未见病情进展[19],而3例患者在无水肿部位出现病变进展。传统对比剂gadoliniumbased contrast不能区分管壁炎症与纤维化,所以不能区分活动性与慢性病变。新型对比剂contrast gadofosveset在纤维化部位不增强,在炎症部位增强,可以显著提高对活动与不活动病变的鉴别。
6.1.3.3 PET/PET-CT 可以直接观察到炎症,判断病情是否活动,可以广泛评估全身血管,微创,可重复,是目前最早能检查到血管炎症活动的影像学手段,有利于病情评估,疗效判定。但具有一定放射性,价格昂贵,缺乏公认统一标准,不能广泛使用,无腔内可视性,无法分辨中小血管,无法评估血管壁增高或血管内径狭窄情况。可以根据炎症组织葡萄糖代谢增强进行半定量分析,有学者提出4分评分系统:0分:无摄入,1分:摄入少于肝脏,2分:摄入等于肝脏,3分:摄入高于肝脏,2~3分提示存在活动血管炎症[8,18-19]。
6.2 影像学检查在TAK诊断和管理中的应用建议2017年EULAR提出了影像学检查在大血管炎诊断和管理中的应用建议,共12条意见,涉及TAK的有3条。(1)对于疑似TAK患者,MRI评估血管壁炎症和/或腔内变化,条件允许情况下应该作为诊断TAK的首选影像学检查。(2)超声、CT和PET是TAK诊断的可选手段。超声对于胸主动脉评估价值有限。(3)巨细胞动脉炎(GCA)及TAK的诊断不推荐使用常规血管造影,因为前面提到的成像手段已经可以取代血管造影。关于病情监测,共2条建议:(1)怀疑GCA或TAK病情复发时,影像学检查可能有助于判断。但通常不建议患者在临床和生化指标缓解时常规进行影像学检查;(2)MRA、CTA和/或超声可用于GCA或TAK患者血管结构的长期监测,特别是检测血管狭窄、闭塞、扩张和/或动脉瘤。检查的频率以及方法应该根据个体决定[20]。
总之,影像学检查在TAK诊治中均有重要价值。不同影像学检查方法有不同特点,临床工作中要合理选用。血清学及影像学检查在TAK诊断中的价值[21]见表2。
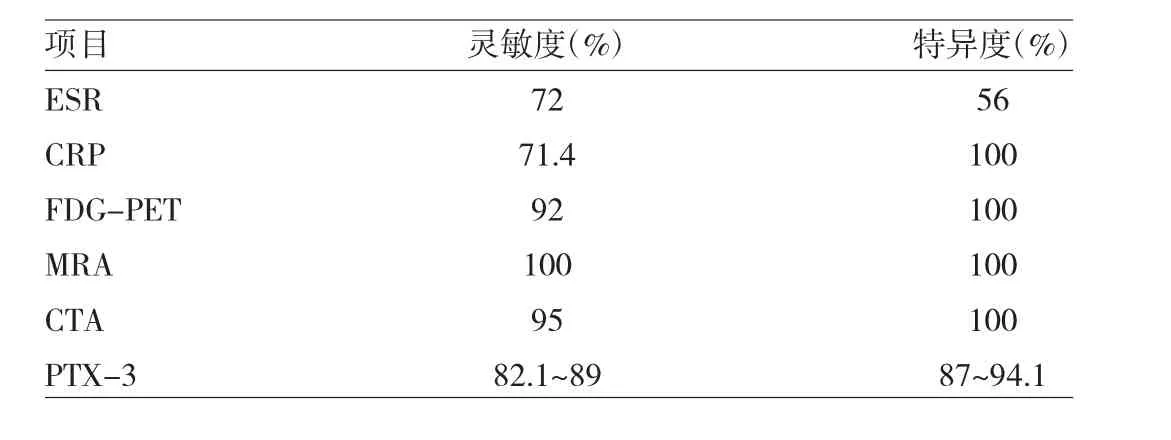
表2 血清学及影像学检查在TAK诊断中的价值
7 TAK的治疗
TAK的治疗目前尚存在诸多问题,如高水平循证医学证据少,缺乏公认的疗效评价标准,炎症和血管结构损伤的程度分离,对传统药物及新型药物长期有效性和安全性知之甚少,无公认的诊治共识。2009年EULAR曾经推出大血管炎治疗推荐,但内容主要是针对GCA,证据等级低[22],近10年没有更新。糖皮质激素、免疫抑制剂、生物制剂及手术治疗依然是TAK治疗的主要手段。
7.1 糖皮质激素 糖皮质激素是TAK的一线治疗药物,但目前无RCT研究,均是经验报道。通常病情活动患者起始剂量0.5~1mg/(kg·d),高度活动者常用1mg/(kg·d),1~3个月后缓慢减量。但只有50%的患者对激素治疗有反应,激素减量后易复发。60%的患者用激素22个月获得第1次缓解。克利夫兰研究发现只有20%的患者用10mg激素维持治疗6个月后缓解[22]。更长队列研究显示29%~73%的患者需要加免疫抑制剂获得缓解[22]。最近研究发现HLA表型与激素治疗反应相关,HLA A24-B52-DR2阳性者易炎症进展,对激素抵抗[23]。
7.2 免疫抑制剂 免疫抑制剂如甲氨蝶呤(MTX)、硫唑嘌呤(AZA)、吗替麦考酚酸(MMF)、环磷酰胺(CYC)、环孢素 A(CSA)、他克莫司(FK-506)、来氟米特(LEF)等都被用于TAK的治疗,但多是小样本、经验性报道,无RCT研究。(1)MTX是多数医生首选的治疗TAK的二线药物。Pérez-Esteban等[22]报道 16例TAK患者用MTX联合激素治疗,81%缓解,44%在停激素或减激素前复发,重新治疗50%可以减停激素。(2)AZA也是常用的TAK治疗药物,但多为开放研究,一般用2mg/(kg·d),并与激素联合使用。(3)MMF既往常用于MTX、AZA效果不佳的患者,近年来一些研究显示其疗效较好,有成为优先选用免疫抑制剂的趋势。一项针对21例患者(10例AZA治疗效果不佳,11例新诊断)的研究报道,采用MMF联合激素治疗,能显著降低ESR、CRP,减少激素用量[24]。(4)CYC尽管是首次用于TAK治疗的免疫抑制剂,多是小样本开放研究,但由于其复发率高及生殖毒性显著,在TAK中甚少使用。一般用1~2mg/(kg·d)。(5)其他药物:一些报道显示 CSA、FK-506对难治的TAK有效。一项评估LEF在难治性或对传统方案不能耐受的TAK患者疗效的前瞻性开放研究显示,15例患者(其中14例为正在接受激素和免疫抑制剂治疗但是病情仍处于活动期,另外1例患者对目前的治疗方案不耐受)使用LEF 20mg/d,至少持续6个月,能有效治疗传统激素和其他免疫抑制剂难治或不能耐受的活动性TAK,改善疾病活动度和急性期反应物,减少激素用量,且安全性良好[25]。咪唑立宾是一种新的化学合成药物,在日本被批准为治疗移植排斥反应,与MMF有相似的作用机制,但很少发生骨髓移植肝毒性。最近有报道对MTX联合英夫利昔单抗治疗失败的TAK,用咪唑立宾联合他克莫司治疗有效[26]。
这些免疫抑制剂如何选择呢?日本一项针对22例患者的研究提示我们:MTX作为首选免疫抑制剂的为55%,曾经使用的为82%;CSA作为首选免疫抑制剂的为23%,曾经使用的为55%;AZA作为首选免疫抑制剂的为14%,曾经使用的为32%;CTX作为首选免疫抑制剂的为4%,曾经使用的为9%;FK-506作为首选免疫抑制剂的为4%,曾经使用的为45%[8,27-29]。
7.3 生物制剂 TNF-α、IL-6等炎症因子在TAK的发病过程中发挥着重要作用,患者及动物研究均发现TAK患者B细胞异常活化。这些研究发现给TAK的生物治疗以启迪。众多学者相继应用TNF-α拮抗剂(TNFi)、IL-6受体拮抗剂及抗CD20单克隆抗体等治疗TAK,取得了很好疗效。TNFi是最初用于难治的传统方法治疗无效的TAK患者的生物制剂,70%~90%患者得到缓解,激素用量减少。其多与MTX联合,最多使用的是英夫利昔单抗,其他药物证据不多,但停药后易复发。IL-6受体拮抗剂(托珠单抗)治疗TAK非常有效,目前17个研究报道有效率达100%,78%的患者影像学表现改善,对于难治(包括TNFi治疗无效)的患者有效,40%可以停激素[25]。第四军医大学西京医院临床免疫科近2年用托珠单抗治疗13例患者,平均年龄26.29岁,其中病史>3年8例,<3年5例,托珠单抗治疗4周后有明显好转,用药20周后症状完全消失;治疗16~20周,动脉CTA示:部分动脉管壁增厚消失或较前变薄,管腔狭窄较前有所好转,狭窄率约10%~20%,获得影像学改善。活动性TAK患者外周血B细胞及记忆性B细胞显著高于病情稳定的患者,推测抗CD20单抗治疗应该有效。小样本研究发现美罗华治疗难治性TAK 1年后,18F-fluorodeoxy-glucose PET显示血管炎明显改善[30-31]。
7.4 手术治疗 约70%的TAK患者需手术治疗,包括血管重建及支架。不同研究中心报道手术率约为12%~50%。但TAK手术面临诸多困难,再狭窄率高,复发风险高,炎症指标不正常或用激素及免疫抑制剂者相关外科手术操作者意愿低。总体来说支架术后再狭窄率为5%~31%,经皮血管成形术/支架再狭窄率高达12%~71.4%。疾病稳定及使用激素及免疫制剂复发率低。再狭窄的危险因素包括:有传统的心血管病风险,如血脂升高、高血压;长期使用糖皮质激素;病情活动等[32]。
7.5 新的药物治疗靶点 对TAK患者的大样本分析提示 IL-2、IL-12、IL-17/IL-23、IFN-γ 和 MMP-1β 在TAK患者中显著高于健康对照组及其他血管炎患者,病情活动患者高于病情稳定患者,提示这些因子可能是未来靶向治疗的靶点之一。
8 展望
尽管TAK的诊治尚存在诸多问题及困境,如炎症与血管结构损伤的程度常常相分离,病情评估及疗效判定难,高水平研究少,缺乏RCT研究,无国际公认的指南或推荐,但近年来对该病认识逐渐加深,诱导缓解及维持治疗及达标治疗的理念也渐渐引入。新的影像学检查手段及新的治疗药物包括生物制剂给TAK诊治带来了希望。
[1] Jennette J C,Falk R J,Bacon P A,et al.2012 revised international Chapel Hill consensus conference nomenclature of vasculitides[J].Arthritis Rheum,2013,65(1):1-11.doi:10.1002/art.37715.
[2] Zhang H,Yang L,Jiang X.Chapter 17-Takayasu's Arteritis[M]//Udi Nussinovitch.The Heart in Rheumatic,Autoimmune and Inflammatory Diseases,Amsterdam:Elsevier Inc,2017:389-415.
[3] Numano F,Okawara M,Inomata H,et al.Takayasu's arteritis[J].Lancet,2000,356(9234):1023-1025.doi:10.1016/S0140-6736(00)02701-X.
[4] Takayasu M.A case of paradoxical changes in the central retinal arteries[J].J Jpn OphthalmolSoc,1908,12:554-555.
[5] JCS Joint Working Group.Guideline for management of vasculitis syndrome(JCS 2008)[J].Jpn Circ Soc Circ J,2011,75(2):474-503.[6] Shimizu K,Sano K.Pulseless disease[J].J Neuropathol Clin Neurol,1951,1(1):37-47.
[7] Arnaud L,Haroche J,Limal N,et al.Takayasu arteritis in France:a single-center retrospective study of 82 cases comparing white,North African,and black patients[J].Medicine(Baltimore),2010,89(1):1-17.doi:10.1097/MD.0b013e3181cba0a3.
[8] Alibaz-Oner F,Direskeneli H.Update on Takayasu's arteritis[J].Presse Med,2015,44(6 Pt 2):e259-265.doi:10.1016/j.lpm.2015.01.015.
[9] de Souza A W,de Carvalho J F.Diagnostic and classification criteria of Takayasu arteritis[J].J Autoimmun,2014,48-49:79-83.doi:10.1016/j.jaut.2014.01.012.
[10] Seko Y.Takayasu arteritis:insights into immunopathology[J].Jpn Heart J,2000,41(1):15-26.
[11] Eichhorn J,Sima D,Thiele B,et al.Anti-endothelialcellantibodies in Takayasu arteritis[J].Circulation,1996,94(10):2396-2401.[12] Wen D,Du X,Ma C S.Takayasu arteritis:diagnosis,treatment and prognosis[J].Int Rev Immunol,2012,31(6):462-473.doi:10.3109/08830185.2012.740105.
[13] Hoffman C.Update on use of biologics in Takayasu arteritis[J].Curr Opin Rheumatol,2014,26:7-15.
[14] Isobe M.Takayasu arteritis revisited:Current diagnosis and treatment[J].Int J Cardiol,2013,168(1):3-10.doi:10.1016/j.ijcard.2013.01.022.
[15] Ozen S,Pistorio A,Iusan S M,et al.EULAR/PRINTOPRES criteria for Henoch-Schnlein purpura,childhood polyarteritis nodosa,childhood Wegener granulomatosis and childhood Takayasu arteritis:Ankara 2008.Part II:final classification criteria[J].Ann Rheum Dis,2010,69(5):798-806.doi:10.1136/ard.2009.116657.
[16] Grayson P C,Tomasson G,Cuthbertson D,et al.Association of vascular physical examination findings and arteriographic lesions in large vessel vasculitis[J].J Rheumatol,2012,39(2):303-309.doi:10.3899/jrheum.110652.
[17] Alibaz-Oner F,Aydin S Z,Direskeneli H.Advances in the diagnosis,assessment and outcome of Takayasu's arteritis[J].Clin Rheumatol,2013,32(5):541-546.doi:10.1007/s10067-012-2149-3.
[18] Prieto-González S,Espígol-Frigolé G,García-Martínez A,et al.The expanding role of imaging in systemic vasculitis[J].Rheum Dis Clin North Am,2016,42(4):733-751.doi:10.1016/j.rdc.2016.07.009.
[19] Muratore F,Pipitone N,Salvarani C,et al.Imaging of vasculitis:State of the art[J].Best Pract Res Clin Rheumatol,2016,30(4):688-706.doi:10.1016/j.berh.2016.09.010.
[20] Dejaco C.Eular recommendations for the use of imaging in the diagnosis and management of large vessel vasculitis in clinical practice[Z].EULAR,2017:SP0095.
[21] O'Connor TE,Carpenter H E,BidariS,et al.Role of inflammatory markers in Takayasu arteritis disease monitoring[J].BMC Neurol,2014,14:62.doi:10.1186/1471-2377-14-62.
[22] Pérez-Esteban S,González-Gay M A,Castan eda S.Therapeutic update in large vesselvasculitides[J].Rev Clin Esp(Barc),2013,213(7):338-346.doi:10.1016/j.rce.2013.03.008.
[23] Mukhtyar C,Guillevin L,Cid M C,et al.EULAR recommendations for the management of large vessel vasculitis[J].Ann Rheum Dis,2009,68(3):318-323.doi:10.1136/ard.2008.088351.
[24] Keser G,Direskeneli H,Aksu K.Management of Takayasu arteritis:a systematic review[J].Rheumatology(Oxford),2014,53(5):793-801.doi:10.1093/rheumatology/ket320.
[25] de Souza A W,da Silva M D,Machado L S,et al.Short-termeffect of leflunomide in patients with Takayasu arteritis:anobservationalstudy[J].Scand J Rheumatol,2012,41(3):227-230.doi:10.3109/03009742.2011.633553.
[26] Shimizu M,Ueno K,Ishikawa S,et al.Successful multitarget therapy using mizoribine and tacrolimus for refractory Takayasu arteritis[J].Rheumatology(Oxford),2014,53(8):1530-1532.doi:10.1093/rheumatology/keu028.
[28] Maffei S,Di Renzo M,Bova G,et al.Takayasu's arteritis:a review of the literature[J].Intern Emerg Med,2006,1(2):105-112.
[29] Ohigashi H,Tamura N,Ebana Y,et al.Effects of immunosuppressive and biological agents on refractory Takayasu arteritis patients unresponsive to glucocorticoid treatment[J].J Cardiol,2017,69(5):774-778.doi:10.1016/j.jjcc.2016.07.009.
[30] Ferfar Y,Mirault T,Desbois A C,et al.Biotherapies in large vessel vasculitis[J].Autoimmun Rev,2016,15(6):544-551.doi:10.1016/j.autrev.2016.02.012.
[31] Koster M J,Matteson E L,Warrington K J.Recent advances in the clinical management of giant cell arteritis and Takayasu arteritis[J].Current Opinion in Rheumatology,2016,28(3):24-34.doi:10.1097/BOR.0000000000000265.
[32] Saadoun D,Garrido M,Comarmond C,et al.Th1 and Th17 Cytokines Drive Inflammation inTakayasu Arteritis[J].Arthritis Rheumatol,2015,67(5):1353-1360.doi:10.1002/art.39037.
更正声明
《浙江医学》2017年第39卷第20期中文目录中《二甲双胍对糖尿病合并慢性阻塞性肺疾病预后的影响和临床分析》作者名“陆磊、郭治宇、张浩”改为“周秋华、范春晓、郭磊”。
编辑部
10.12056/j.issn.1006-2785.2017.39.21.2017-2296
710032 西安,第四军医大学西京医院临床免疫科
吴振彪,E-mail:Wuzhenbiao@fmmu.edu.cn
2017-09-21)
陈丽)

