大花黄牡丹种子浸提液对白菜种子萌发及幼苗保护酶活性的影响
, , , , , (.四川农业大学风景园林学院, 四川 温江 630; .西藏自治区农牧科学院蔬菜研究所, 拉萨 85003)
大花黄牡丹种子浸提液对白菜种子萌发及幼苗保护酶活性的影响
张翔宇1,邓岚2,张夕恒1,雷霞1,陈相宇1,刘光立1
(1.四川农业大学风景园林学院, 四川 温江 611130; 2.西藏自治区农牧科学院蔬菜研究所, 拉萨 850032)
以大花黄牡丹(Paeonialudlowii)山南居群和林芝居群的种子为实验材料,研究种皮、胚乳水浸提物对白菜种子萌发、幼苗生长及保护酶活性的影响,探讨大花黄牡丹种子休眠的原因。结果表明,大花黄牡丹的种皮、胚乳中含有抑制白菜种子萌发及幼苗生长的物质,且抑制作用随着大花黄牡丹种子浸提液浓度的升高而增强;相同浓度条件下,胚乳浸提液的抑制作用均高于种皮浸提液;测试时间不同,白菜幼苗酶活性的实验数据变化基本一致。山南居群的胚乳浸提液能直接抑制白菜幼苗POD酶活性,间接影响SOD和CAT酶活性;林芝居群的胚乳浸提液能直接抑制白菜幼苗POD和CAT酶活性,间接影响SOD酶活性。本研究认为,大花黄牡丹种子中抑制物质的存在是种子休眠的重要原因之一,且内源抑制物主要存在于胚乳中。
大花黄牡丹; 种子休眠; 萌发; 白菜; 保护酶;
大花黄牡丹(Paeonialudlowii)为芍药科(Paeoniaceae)芍药属(Paeonia)牡丹组的丛生灌木[1],是我国西藏特有的重要药用及观赏植物[2],分布在西藏山南、林芝地区海拔2 900~3 200 m的河谷开阔地带及山坡林缘[3-4]。大花黄牡丹是珍贵的花卉种质资源,具有纯粹且能稳定遗传的黄色,在芍药属中,其植株最高大、开花最多且显著[5];大花黄牡丹也是名贵的藏药材资源,它的根部、皮和花瓣均可入药。由于自然植被的破坏和人为的采掘,大花黄牡丹分布范围逐渐变窄,加之自然更新能力差,野生数量减少等原因,大花黄牡丹被列为濒危植物[6]。
植物种子休眠的原因主要包括种皮障碍、内源萌发抑制物和种胚发育状况[7]。在紫斑牡丹(P.rockii)种子休眠研究中发现,其种子含有影响种子后熟和发芽以及抑制胚根和子叶生长的化学物质[8]。逆境(如低温、干早、强光辐射、化学药剂等)能影响植物体内活性氧代谢系统的平衡,即增加活性氧,如超氧阴离子自由基、过氧化氢(H2O2)、羟自由基,如果这些氧自由基不能及时清除,将会导致生物膜脂上不饱和脂肪酸的过氧化或膜脂脱脂作用,从而破坏膜结构,最后导致植物细胞死亡。但是机体内有一套抗氧化酶如过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽还原酶等能清除这些氧自由基,从而保护细胞免遭损害。在这些抗氧化酶中,过氧化物酶(POD)与超氧化物歧化酶(SOD)为最重要。此外,过氧化氢酶(CAT)通常定位于一种被称为过氧化物酶体的细胞器中,植物细胞中的过氧化物酶体参与了光呼吸(利用氧气并生成二氧化碳)和共生性氮固定(将氮气(N2)解离为活性氮原子)。
本实验拟以大花黄牡丹的山南和林芝2种居群种子为研究对象,初步研究种子内源抑制物质的活性及其对植物主要保护酶活性的影响,根据白菜幼苗保护酶中的SOD、POD和CAT活性的高低,作为判断白菜幼苗抗逆性强弱的指标,为大花黄牡丹休眠机制的进一步研究提供依据。
1 材料与方法
1.1 材 料
大花黄牡丹的山南居群、林芝居群种子分别采自西藏南部山南、东南部林芝地区,于2015年9月初,在果实黄熟时期,晴天采集后阴干脱粒,种子去除杂质后低温避光储存备用。校园周边售卖的白菜(Brassicapekinensis)种子作为该实验生物活性测定的材料。实验在四川农业大学成都校区实验室进行。
1.2 种子浸提液的制备
分别选取2种不同居群的饱满的大花黄牡丹种子,人工剥取的种皮和胚乳分别放于40 ℃烘干箱中烘干至恒重,用种子粉碎机分别粉碎。各称取10.00 g分别置于100 mL三角瓶中,加入约80 mL去离子水,用3层保鲜薄膜封口后置于20 ℃无光培养箱内浸提24 h,将浸提液在4 000 r/min条件下离心10 min,将过滤得到的上清液定容至100 mL,即为0.1 g/mL的实验粗提液, 均于4 ℃冰箱中保存备用。
1.3 种子内源抑制物质活性测定
选取饱满,大小形态相近的白菜种子,将白菜种子用0.5%高锰酸钾溶液浸泡30 min消毒后,用蒸馏水冲洗后浸泡,选择能沉在水底的种子风干备用。用去离子水将种皮、胚乳粗提液分别配制成浓度为0,0.025,0.05,0.075 g/mL和0.1 g/mL的培养液。在直径9 cm的培养皿中铺入2层滤纸,分别加入不同浓度的培养液7 mL。每皿放置50粒白菜种子,每处理5个重复。置于25 ℃恒温光照培养箱中培养,进行白菜种子生长实验。24 h统计种子发芽率(以突破种皮为发芽标准), 48 h测定胚根长度,72 h测定下胚轴长度[9]。
1.4 白菜幼苗保护酶活性的测定
将胚乳粗提液用去离子水配制成浓度为0,0.01,0.02,0.04 g/mL和0.08 g/mL的培养液。按1.3中所述的方法培养白菜种子,参照熊庆娥[10]的方法,在24,48 h和72 h均测定白菜幼苗的超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)3种保护酶的活性。
实验数据的统计和分析采用Excel和SPSS 13软件。
2 结果与分析
2.1 大花黄牡丹种子浸提液对白菜种子萌发和幼苗生长的影响
图1~图3为大花黄牡丹种皮、胚乳浸提液对白菜种子发芽率、胚根和下胚轴长度影响。由图1可看出,加入种皮浸提液对白菜种子发芽率几乎无影响;胚乳浸提液的加入,对白菜种子萌发有明显的抑制作用,发芽率随着浸提液浓度的增加而降低。
由图2可见,对照处理白菜幼苗胚根长度最大,白菜幼苗的胚根长度随着浸提液浓度升高而降低;相同浓度的胚乳浸提液对白菜幼苗胚根的影响显著高于种皮浸提液。
由图3可知,大花黄牡丹种皮浸提液的加入,使得白菜幼苗下胚轴长度先降低后升高再降低,整体呈下降趋势。加入胚乳浸提物,白菜幼苗下胚轴长度随着浓度的升高而降低;浓度相同条件下,种皮浸提液对白菜幼苗下胚轴的抑制作用显著低于胚乳浸提液。
由图1~图3可看出,相同浓度的种皮、胚乳浸提液对白菜胚根的抑制作用均强于对白菜发芽率和幼苗下胚轴的抑制作用。
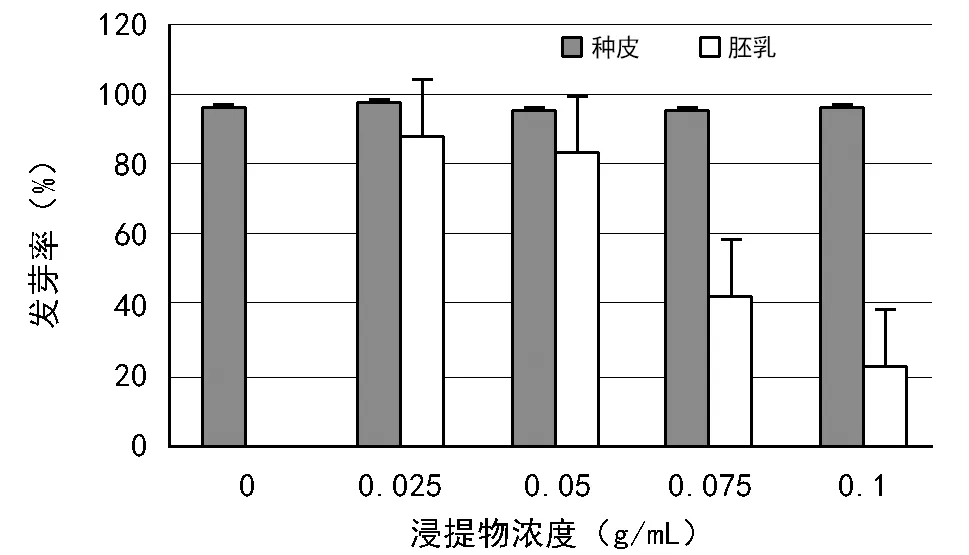
注:数据为均值±标准差。图1 大花黄牡丹种皮、胚乳浸提液对白菜种子发芽率的影响
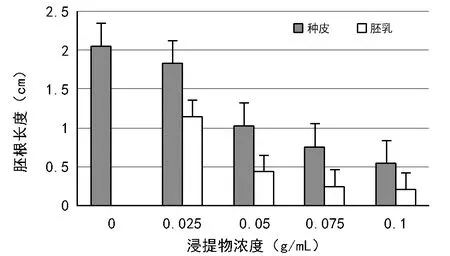
图2 大花黄牡丹种皮、胚乳浸提液对白菜幼苗胚根生长的影响
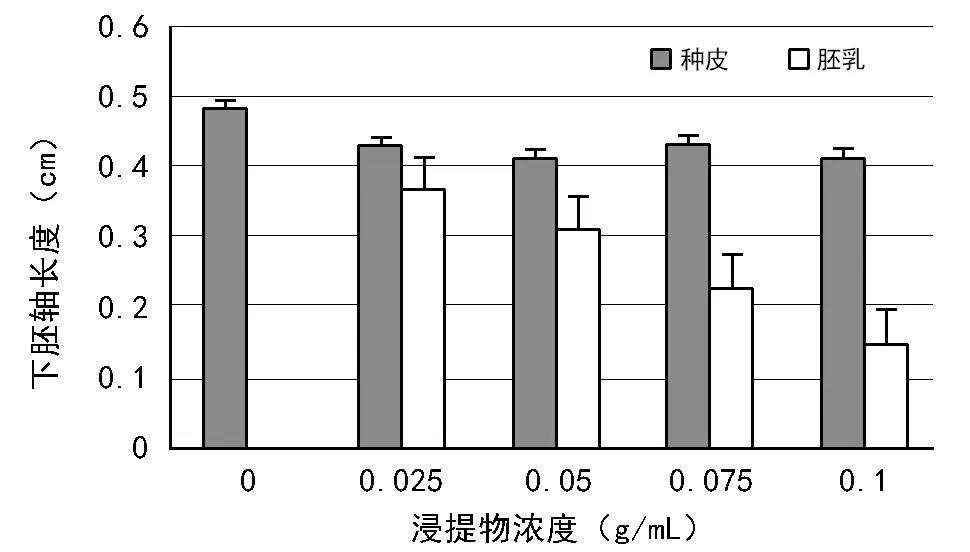
图3 大花黄牡丹种皮、胚乳浸提液对白菜幼苗下胚轴生长的影响
2.2 大花黄牡丹胚乳浸提液对白菜幼苗几种保护酶活性的影响
图4~图6分别是大花黄牡丹胚乳浸提液对白菜幼苗SOD、POD和CAT活性的影响。由图4可知,白菜幼苗中SOD活性随着胚乳浸提液浓度的升高总体呈现先升高后降低的趋势。山南居群中,不同测定时间SOD活性变化差异较为明显,1 d测定的SOD先降低后升高再降低,0.01 g/mL时酶活性最低,0.04 g/mL时酶活性最高;2 d测定的SOD先升高再降低,0浓度时酶活性最低,0.02 g/mL时酶活性最高,3 d测定的SOD先升高后降低再升高,浓度为0时酶活性最低,0.08 g/mL时酶活性最高(图4)。林芝居群中,SOD活性表现为先升高后降低,在浸提物浓度为0.02 g/mL时活性最高,在0浓度时活性最低。尽管不同测定时间SOD活性也有变化,但1,2 d和3 d测定的SOD变化趋势是一致的(图4)。
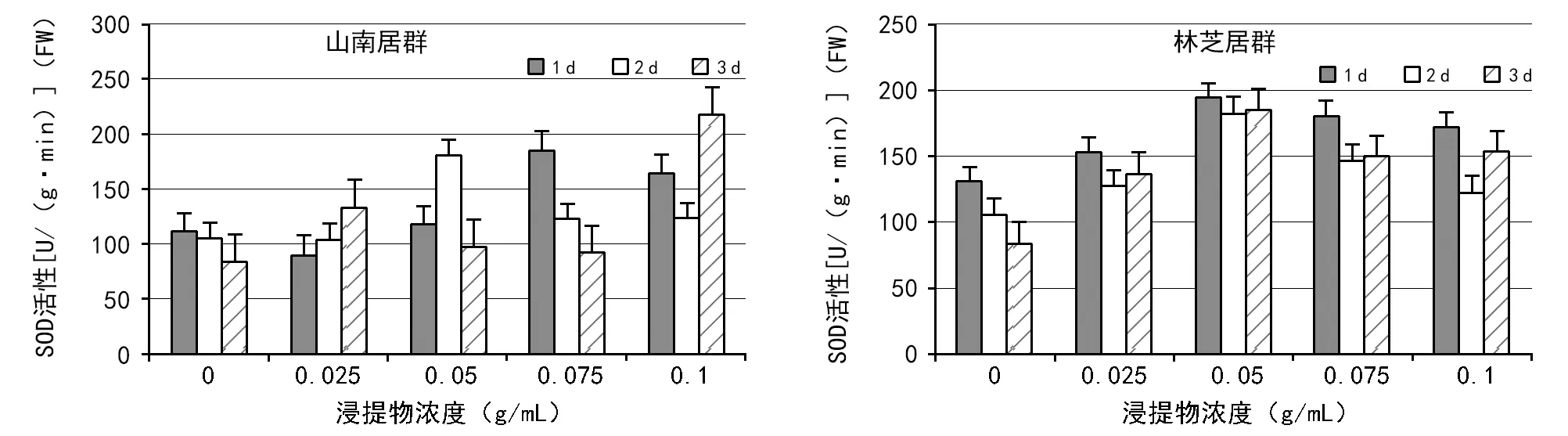
图4 2种居群的大花黄牡丹胚乳浸提液对白菜幼苗中SOD活性的影响
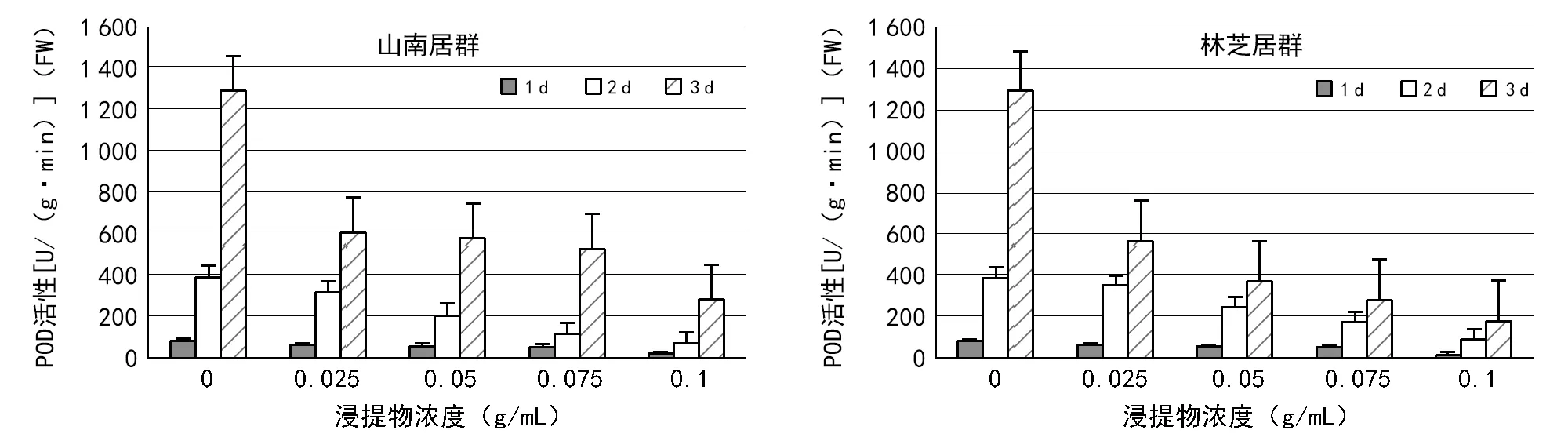
图5 2种居群的大花黄牡丹胚乳浸提液对白菜幼苗中POD活性的影响
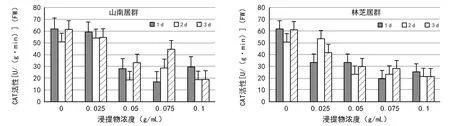
图6 2种居群的大花黄牡丹胚乳浸提液对白菜幼苗中CAT活性的影响
在不同的测定时间内,2种居群的胚乳浸提液培养的白菜幼苗,随着浸提物浓度的升高,POD活性显著降低。相比山南居群,林芝居群胚乳浸提液对白菜幼苗POD的抑制作用更显著(图5)。山南居群的胚乳浸提液培养的白菜种子,CAT活性随着浸提物浓度的升高,整体呈现先降低后升高再降低的趋势(图6)。林芝居群的胚乳浸提液培养的白菜种子,CAT活性均随着浸提物浓度的升高而降低(图6)。相同浓度条件下,1,2,3 d测定的CAT变化趋势,2种居群的胚乳浸提液处理结果近似。
3 讨论与结论
逆境因子可能造成植物体内活性氧代谢失调,从而对植物造成伤害。研究表明,在对多种高等作物的化感作用实验中,受体植物SOD和CAT酶活性受到多酚类化合物的抑制作用,导致其体内活性氧增多,从而造成膜脂过氧化,膜的结构受到破坏[11]。连续种植4年的凤丹(P.ostiiT.)根际发现了多种酚酸类物质[12]。杨勇等研究表明,四川牡丹胚乳中的内源物质可能是有机酸和酚类物质[13]。因此,尽管实验没有进一步研究大花黄牡丹种子胚乳浸提液中的成分,但推测可得,大花黄牡丹种子浸提液中影响白菜幼苗生长和保护酶活性的成分可能也是有机酸和酚类化合物。有研究表明,温水浸泡、GA3浸泡和种皮挫伤对野生黄牡丹(Paeonialutea)种子胚根的生长有促进作用[14]。GA3和低温都有利于凤丹幼苗的生长。因此,大花黄牡丹种子的休眠具有复杂性、综合性。
在白菜种子萌发及幼苗生长的实验中,大花黄牡丹2种居群的种子浸提液对白菜种子发芽率、幼苗胚根生长及下胚轴伸长均有抑制作用,并且抑制作用随着浸提液浓度的增加而增强,且胚乳浸提液的抑制作用更明显。可推测大花黄牡丹种子的发芽抑制物主要存在于胚乳中。大花黄牡丹种子浸提液对白菜幼苗胚根的伸长抑制作用明显强于对白菜种子发芽率和幼苗的下胚轴伸长的抑制。在白菜种子萌发的过程中,大花黄牡丹种子浸提液在胚根的伸长阶段发挥较强的抑制作用,但抑制的具体过程及原理还不清楚,有待进一步研究。
研究表明,加入大花黄牡丹胚乳浸提液,白菜幼苗POD活性随胚乳浸提物浓度的增加而降低,且不同时间测定的POD酶变化趋势一致,因而胚乳浸提物能够抑制白菜幼苗POD酶活性;加入大花黄牡丹胚乳浸提液,白菜幼苗CAT活性整体随胚乳浸提液浓度的增加而降低。白菜幼苗SOD酶活性总体表现为先升高后降低的趋势,说明胚乳浸提物不会直接抑制SOD酶活性,这与宋会兴等[15]的研究结果一致。原因可能是胚乳浸提液抑制了POD和CAT酶活性,植物体内活性氧增多,使得植物启动应激机制,SOD酶活性增加[13]。但随着活性氧在植物体内的不断累积,植物受到严重迫害,使得SOD酶活性随之失活[16-18]。
山南居群的胚乳浸提液能直接抑制白菜幼苗POD酶活性,间接影响SOD和CAT酶活性;林芝居群的胚乳浸提液能直接抑制白菜幼苗POD和CAT酶活性,间接影响SOD酶活性。2种居群的SOD活性的变化差异较大,同时测定SOD酶活性的时间不同,使得SOD酶活性的转折点不同;0.04 g/mL山南居群的种皮浸提液使白菜幼苗中CAT活性略微升高,与林芝居群的实验数据不同。这可能因为两地的气候环境的不同(山南市属温带干旱性气候,南部边境地带属高原亚寒带半干旱气候;林芝地区为特殊的热带湿润和半湿润气候)而造成内源抑制物的组成成分或含量的不同,但因为对内源抑制物成分和抑制机制的不确定,不能进一步证明内源抑制物质是否会随着环境的变化而改变的问题。2种居群的数据中,SOD酶活性转折点不同,但整体趋势一致;随着胚乳浸提液浓度的增加,2种居群的CAT酶活性总体表现为先升高后降低的趋势。因此,初步判定大花黄牡丹种子发芽抑制物的基本组成成分或基本抑制机制不随环境气候的改变而改变。
种子繁殖是大花黄牡丹唯一的繁殖途径[19]。牡丹组植物种子均具有休眠萌发特性,包括上胚轴及下胚轴休眠,且上胚轴休眠更为突出[20-21]。早在13世纪初,便提出种子推迟发芽与抑制物质有关[22]。自1859年首次从欧洲花楸果实中分离出一种强抑制物——花楸酸[23]以来,发芽抑制物质的研究已经成为种子休眠机理研究的重点。产生于植物种子内部或外部的物质(一些有机酸、酯类、醛类、生物碱、脱落酸等)通过抑制种子的酶活性、抑制呼吸、阻碍胚生长等,间接抑制种子的萌发[24]。本实验结果表明,大花黄牡丹种子内存在抑制白菜种子萌发及幼苗生长的物质,且胚乳抑制作用更明显,主要抑制白菜幼苗胚根伸长。大花黄牡丹胚乳内含有可以直接影响幼苗CAT和POD酶活性,间接影响SOD酶活性的物质,不同种群之间表现相似。初步推断内源抑制物质可能是有机酸和酚类化合物,但尚需要进一步的研究抑制物质的成分、性质及其抑制大花黄牡丹种子萌发的机理。
[1]杨小林,罗健,鲍隆友.濒危植物大花黄牡丹种群结构与分布格局[J].西南林学院学报,2006,26(6):6-9.
[2]Hong D Y.Paeonia(Paeoniaceae)in Xizang(Tibet)[J].Novon,1997,7(2):156-161.
[3]徐凤翔,郑维列.西藏野生花卉[M].北京:中国旅游出版社,1999:28-29.
[4]周生军.鲍隆友.濒危植物大花黄牡丹的野生资源现状与栽培研究[J].中国林副特产,2009(2):93-94.
[5]邢震,张启翔,次仁.西藏大花黄牡丹生境概况初步调查[J].江苏农业科学,2007(4):250-253.
[6]汪松,解炎.中国物种红色名录(第一卷)[M].北京:高等教育出版社,2004:8.
[7]卡恩.种子休眠和萌发的生理生化[M].北京:农业出版社,1989:37-40.
[8]周仁超,姚崇怀,潘俊,等.紫斑牡丹种子休眠和萌发特性初步研究[J].湖北农业科学,2002(1):59-60.
[9]吴啸业.红豆杉种子抑制物质的初步研究[J].植物生理学通讯,1985(4):23-26.
[10]熊庆娥.植物生理学实验教程[M].四川:科学技术出版社,2003:68,31,55,127.
[11]Roshchina V V,Roshchina V D.eds.The excretory function of higher plant[J].New York:Springerling,1993:213-215.
[12]覃逸明,聂刘旺,黄雨清,等.凤丹自毒物质的检测及其作用机制[J].生态学报,2009,29(3):1 153-1 161.
[13]杨勇,刘光立,宋会兴,等.四川牡丹胚乳浸提液对油菜种子萌发与幼苗生长的影响[J].西南农业学报,2013,26(1):89-92.
[14]娄方芳.赵林森.李宗艳.昆明西山野生黄牡丹种子休眠与萌发特性初步研究[J].西南林学院学报,2007,27(5):34-37.
[15]宋会兴,刘光立,高素萍,等.四川牡丹种子浸提液内源抑制物活性初探[J].园艺学报,2012,39(2):376-380.
[16]Shalata A,Tal M.The effects of salt stress on lipid peroxidation and antioxidants in the leaf of the cultivated tomato and its wild salt-tolerant relativeLycopersiconpennellii[J].Plant Physiology,1998,104:169-174.
[17]Deltoro V I,Gimeno C,Calatayud A,et al.Effects of SO2fumigations on photosynthetic CO2gas exchange,chlorophyll a fluorescence emission and antioxidant enzymes in lichensEverniaprunastriandRamalinafarinacea.Plant Physiology,1999,105:648-654.
[18]Scandalios L G.Oxygen stress and superoxide dismutase[J].Plant Physiology,1993,101:7-12.
[19]成仿云,李嘉珏,陈德忠.中国野生牡丹自然繁衍特性研究[J].园艺学报,1997,24(2):180-184.
[20]刘心民,程逸远,张雾,等.牡丹种子萌发特性与播种繁殖技术研究进展[J].河南林业科技,2005,12(4):38-40.
[21]曾端香,尹伟伦,赵孝庆,等.牡丹繁殖技术[J].北京林业大学学报,2000,22(3):90-95.
[22]孔祥海.抑制物质与种子休眠[J].龙岩师专学报,2002,20(6):50-52.
[23]Evenari M.Germination Inhibitors[J].The Botomical Review,1949,15(3):153-194.
[24]熊愈辉. 发芽抑制物质研究综述[J].湖州师专学报,1998,20(5):25-31.
[2]谭长银,余霞,邓楚雄,等.镉污染土壤的植物修复及修复植物的能源利用潜力[J].经济师,2011(8):52-53.
[3]张承,龙友华,和桂秋,等.生长调节剂浸种对桔梗种子萌发及生长的影响[J].中药材,2015,28(1):22-25.
[4]刘周莉,何兴元,陈玮.镉胁迫对金银花生理生态特征的影响[J].应用生态学报,2009,20(1):40-44.
[5]方振东.我国草本植物中重金属富集、超富集植物筛选研究进展[J].内蒙古草业,2009(1):43-47.
[6]高陈玺,李川.彭娟,等.植物提取修复矿区重金属污染土壤研究现状[J].重庆工商大学学报(自然科学版),2013(4):55-58,71.
[7]李韵诗,冯冲凌.吴晓芙,等.重金属污染土壤植物修复中的微生物功能研究进展[J].生态学报,2015,35(20):6 881-6 890.
[8]Wei G H,Fan L M,Zhu W F,et al.Isolation and characterization of the heavy metal resistant bacteria CCNWRS 33-2 isolated from root nodule of Lespedeza cuneata in gold mine tailings in China[J].Journal of Hazardous Materials,2009,162(1):50-56.
[9]黄文.产表面活性剂根际菌协同龙葵修复镉污染土壤[J].环境科学与技术,2011,34(10):48-52.
[10]林忠平,胡雷.植物抗逆性与水杨酸介导的信号传导途径的关系[J].植物学报,1997,39(2):185-188.
[11]金一锋,陈阳,董亚楠,等.外源水杨酸对草地早熟禾种子萌发及幼苗抗旱性的影响[J].种子,2015,34(4):21-22.
[12]刘素纯,萧浪涛,廖柏寒,等.水杨酸对铅胁迫下黄瓜幼苗叶片膜脂过氧化的影响[J].生态环境,2006,15(1):45-49.
[13]张永平,范红伟,杨少军,等.外源水杨酸对镉胁迫下甜瓜幼苗生长、光合作用和活性氧代谢的缓解效应[J].植物生理学报,2014,50(10):1 555-1 562.
[14]丁佳红,薛正莲,杨超英.水杨酸对铜胁迫下水稻幼苗膜脂过氧化作用的影响[J].黑龙江农业科学,2013(1):14-18.
[15]陈钧辉,李俊,张太平,等.生物化学实验[M].北京:科学出版社,2013:16-17.
[16]高俊凤.植物生理学实验技术[M].西安:世界图书出版社,2000:195-199.
[17]张龙翔,张庭芳,李令嫒.生化实验方法与技术(2版)[M].北京:高等教育出版社,1997:179.
[18]陈珍,朱诚.水杨酸在植物抗重金属元素胁迫中的作用[J].植物生理学通讯,2009,45(5):497-502.
[19]吴顺,罗光宇,蔡燕.水杨酸对铅胁迫下小白菜种子萌发和幼苗生长的缓解效应[J].种子,2010,29(11):29-31.
[20]邢继岩.水杨酸处理对铅胁迫下花椰菜生长特性及生理生化指标的影响[J].安徽农业科学,2009,37(12):5 449-5 450,5 467.
[21]苏雅婧.外源水杨酸对铅胁迫下小麦幼苗生长及糖代谢的影响[D].太原:山西大学,2015:15-16.
Effects of Crude Extracts ofPaeonialudlowiiSeeds on Germination and Activities of Antioxidant Enzyme ofBrassicapekinensis
ZHANGXiangyu1,DENGLan2,ZHANGXiheng1,LEIXia1,CHENXiangyu1,LIUGuangli1
2016-10-20
西藏自治区自然科学基金“西藏牡丹种子萌发最适条件的研究”(13-15)。
张翔宇(1995—),女,四川眉山人;在读本科生;E-mail:964670742@qq.com。
刘光立,E-mail:liuguangli@sicau.edu.cn。
抑制作用
10.16590/j.cnki.1001-4705.2017.02.083
S 685.11
A
1001-4705(2017)02-0083-05

