凯里杜鹃的种子特性及萌发试验研究
, , , , , (.贵州大学生命科学学院, 贵阳 55005; .贵州省植物园, 贵阳 550004)
凯里杜鹃的种子特性及萌发试验研究
杨鹏1,蒋影2,顾毓兴1,桂豹1,赵财1,吴洪娥2
(1.贵州大学生命科学学院, 贵阳 550025; 2.贵州省植物园, 贵阳 550004)
为研究提高凯里杜鹃种子发芽率的途径与方法,以雷公山地区采集的野生凯里杜鹃种子为试材,通过种子形态观察,测定长宽、千粒重及吸水率,研究不同贮藏方式、不同光照时间及不同浓度赤霉素(GA3)处理对种子的发芽率及发芽势的影响,结果表明,凯里杜鹃种子极小,千粒重仅为(0.113 4±0.000 06)g,吸水吸胀主要集中在前4 h,在一定浓度范围内(0~1 000 mg/L),GA3处理及贮藏方式(室温干藏与低温沙藏)均对种子的发芽率及发芽势影响不大,而光照对其影响较大,其中全光照更有利于种子的萌发。
凯里杜鹃; 种子特性; 种子萌发
凯里杜鹃(Rhododendronwestlandii)又名南海杜鹃[1],是杜鹃花科(Ericaceae)常绿灌木或小乔木植物,主要产于贵州西部地区海拔1 340~1 540 m的山谷密林中,高4~5 m,胸径15 cm;当年生枝条为棕褐色,多年生枝条呈灰褐色;叶革质,宿存,近于轮生,呈长圆形或长圆状披针形,长8~14 cm,宽2.5~4 cm,顶端锐尖,基部楔形或宽楔形,边缘微反卷,上面绿色,中脉微凹陷,下面淡白色,中脉凸出,侧脉不显著[2]。目前关于凯里杜鹃植物的研究主要集中于叶表皮结构的解剖,王玉国等[3]、唐光大等[4]对杜鹃花属不同植物的叶表皮结构进行了解剖观察,结果表明,凯里杜鹃叶表皮形态特征较为特殊,具有一定的分类学意义。
凯里杜鹃具有极高的观赏价值,很适合庭院、公园等绿化造景,目前有关凯里杜鹃的无性繁殖技术尚未见报道[5]。本实验通过观察凯里杜鹃种子的形态,测定种子的千粒质量和吸水率,研究种子不同贮藏方式、不同浓度赤霉素及光照时间处理对凯里杜鹃种子发芽率和发芽势的影响,旨在探讨凯里杜鹃种子的萌发特性,探索提高凯里杜鹃种子发芽率的途径与方法,以期为凯里杜鹃的种质保存和开发利用提供科学依据,为凯里杜鹃的驯化引种、苗木生产等提供参考。
1 材料与方法
1.1 材 料
供试的凯里杜鹃种子采集于贵州省雷山县雷公山自然保护区,实验地点为贵州大学生物技术实验室。实验器材包括:光照培养箱(常州澳华仪器有限公司,300 D)、电子天平(上海菁海仪器有限公司,FA 1004 N)、电热恒温水浴锅(天津市泰斯特仪器有限公司,DK-98-Ⅱ)、电子显微镜(Olympus,BX 53)。
1.2 方 法
1.2.1 种子形态特性观察及测定
随机选取30粒饱满均匀的种子,用电子显微镜观察种子形态,用cellsens standard软件拍照保存并用该软件自带的测量工具测定种子长度及宽度,然后分别取其平均值。千粒重测定用四分法随机取净种子1 000粒于分析天平称重,8次重复取平均值。
1.2.2 种子吸水率测定
取100粒种子(去除干瘪种子),置于装有蒸馏水的烧杯中,在电热恒温(25 ℃恒温下)水浴锅中使其吸水,每隔4 h将种子取出用吸水纸吸干种子表面水分后称量,直到种子重量恒定,3次重复。
吸水量△W=Wt-W(Wt为吸水t时间后种子的重量,W为吸水前的重量,单位为g);
种子吸水率(%)=△W/W×100%。

图1 凯里杜鹃种子形态图
1.2.3 贮藏方式对种子萌发的影响
将采集到的种子带回实验室后,一部分室温干藏,另一部分低温(4 ℃)沙藏,100 d后将种子取出,先用0.5%KMnO4溶液消毒5 min,再用蒸馏水冲洗至无色,放入垫有脱脂纱布和滤纸的培养皿中,每皿100粒,置于光照培养箱,设置每天光照12 h进行培养(温度25 ℃,湿度85%),每天喷施1~2次蒸馏水保持种子湿润,所有处理均设3次重复。播种后每天观察种子发芽情况,以胚根长度超过种子直径1/2作为萌发标准,连续3 d无种子萌发视为萌发结束。
1.2.4 光照时间、光照时间与GA3共同作用对种子萌发影响
播种前将室温干藏的种子用0.5%KMnO4溶液消毒5 min,再分别用不同浓度(200,400,600,800,1 000 mg/L)的GA3处理15 min,对照组用蒸馏水代替GA3,将不同浓度GA3和蒸馏水处理的种子分为3个组,每组设置3次重复,分别用全光照、半光照(光照时间12 h)及全黑暗方式培养,统计各处理发芽率及发芽势。光照时间对种子萌发的影响以对照组统计数据为分析依据。
1.2.5 数据统计及分析
每24 h观察记录种子发芽数,在播种后的第11天记录各处理种子的发芽势,待种子萌发结束后统计其发芽率及发芽势。
发芽率(%)=萌发种子总数/供试种子总粒数×100%。
发芽势(%)=萌芽始11 d内萌发种子粒数/供试种子总粒数×100%。
试验数据采用Microsoft Excel 2007软件进行处理,并采用SPSS 20.0软件进行单因素方差统计分析。
2 结果与分析
2.1 种子的形态特征
由图1可以看出,凯里杜鹃种子呈长椭圆形,种皮颜色为红褐色,表面上呈不规则的细条纹,种子两端有翅;种子细小扁平,长(2.07±0.75)mm、宽(0.41±0.04)mm,千粒重(0.113 4±0.000 06)g。
2.2种子吸水率
凯里杜鹃种子的吸水率在0~4 h内吸水迅速(图2),高达12.9%,可见这一阶段为吸胀期;4~24 h种子吸水变缓,这一阶段为吸水缓冲期,24 h时达到最大值(14.14%);24 h后种子吸水饱和。可见,凯里杜鹃种子的萌发过程中,种皮不是阻碍种子萌发的主要原因,前4 h就能达到总吸水率的91%,浸种24 h后达到饱和状态,所以在种子萌发过程中,前24 h内应保证供给种子充足的水分。
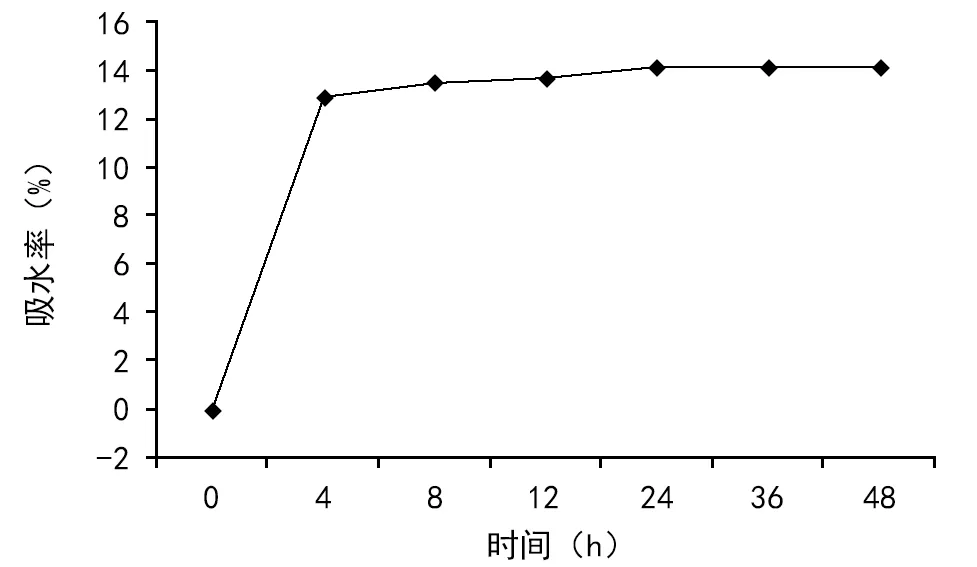
图2 凯里杜鹃种子吸水率
2.3 贮藏方式对凯里杜鹃种子萌发的影响
由表1可看出,室温干藏的发芽率高于低温干藏,但低温干藏的发芽势要高于室温干藏;发芽率及发芽势的单因素方差分析统计结果(表2,表3)表明,2种贮藏方式的种子发芽率及发芽势差异均不显著(pgt;0.05),说明室温干藏和低温干藏对凯里杜鹃种子的萌发影响不大。
表1 不同贮藏方式处理对种子的萌发影响

贮藏方式发芽率(%)发芽势(%)室温干藏20±8.72Aa8.72±7.23Aa低温干藏18.33±8.39Aa10±6.08Aa
注:不同大写字母为0.01水平差异显著,小写字母表示0.05水平差异显著。
表2 不同藏方式处理对种子发芽率的单因素方差分析
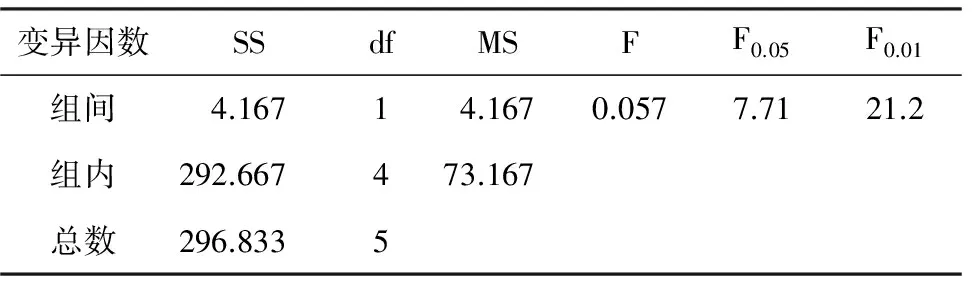
变异因数SSdfMSFF0.05F0.01组间4.16714.1670.0577.7121.2组内292.667473.167总数296.8335
2.4 光照时间对凯里杜鹃种子萌发的影响
由表4可看出,凯里杜鹃种子的发芽率及发芽势与光照时间呈正相关,黑暗培养的种子几乎不萌发,全光照处理的发芽率和发芽势都显著高于半光照处理的,说明凯里杜鹃种子是典型的喜光型种子。发芽率及发芽势的单因素方差分析结果(表5,表6)显示,全光照与半光照处理种子的发芽率及发芽势均呈显著性差异(plt;0.05),表明全光照处理能够极大促进凯里杜鹃种子的萌发。
表3 不同藏方式处理对种子发芽势的单因素方差分析
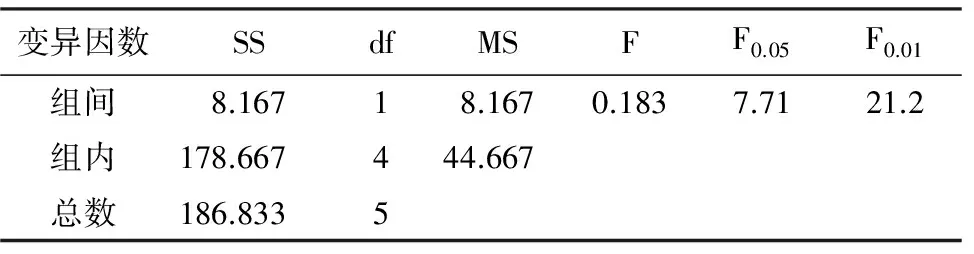
变异因数SSdfMSFF0.05F0.01组间8.16718.1670.1837.7121.2组内178.667444.667总数186.8335
表4 光照时间对凯里杜鹃种子萌发的影响

光照时间发芽率(%)发芽势(%)全光照45.67±5.1323.33±4.62半光照20±8.728.72±7.23全黑暗11
表5 全光照及半光照处理对凯里杜鹃种子发芽率的单因素方差分析
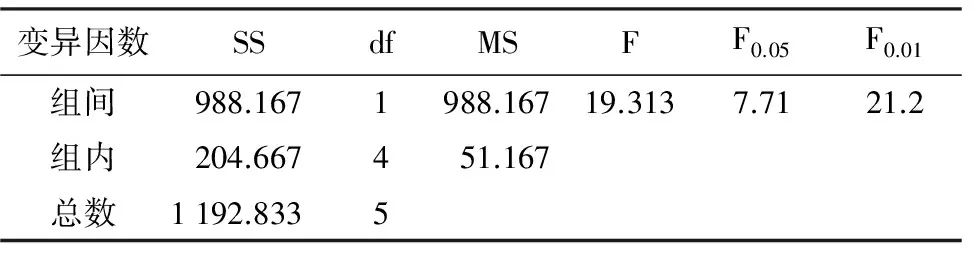
变异因数SSdfMSFF0.05F0.01组间988.1671988.16719.3137.7121.2组内204.667451.167总数1192.8335
表6 全光照及半光照处理对种子发芽势的单因素方差分析
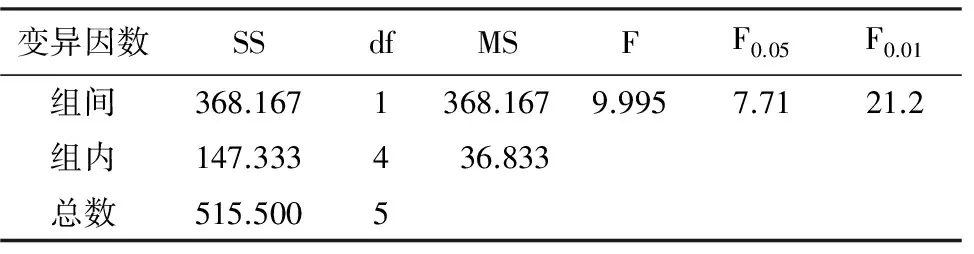
变异因数SSdfMSFF0.05F0.01组间368.1671368.1679.9957.7121.2组内147.333436.833总数515.5005
2.5 光照时间及GA3共同处理对种子萌发的影响
由图3可看出,在全光照处理试验组中,当GA3浓度为800 mg/L时,凯里杜鹃种子发芽率和发芽势均达到最大值,分别为40.33%和24%,但与对照组相比,发芽率降低了11.68%;半光照组中,GA3浓度为1 000 mg/L时,种子发芽率达到最大值(19%),当GA3浓度为800 mg/L时,种子的发芽势达到最大值(14.33%),表明高浓度的赤霉素对凯里杜鹃种子的萌发有促进作用,但多重比较表明,全光照组中,GA3浓度为200 ,400 mg/L时,发芽率与对照组呈显著差异(plt;0),半光照处理中,GA3浓度为200 mg/L时,发芽势较对照组呈显著差异(plt;0),其余处理均无显著差异(pgt;0),说明赤霉素处理对凯里杜鹃种子的刺激打破休眠作用不大,进一步证明光照时间是促进凯里杜鹃种子萌发的主要因素。
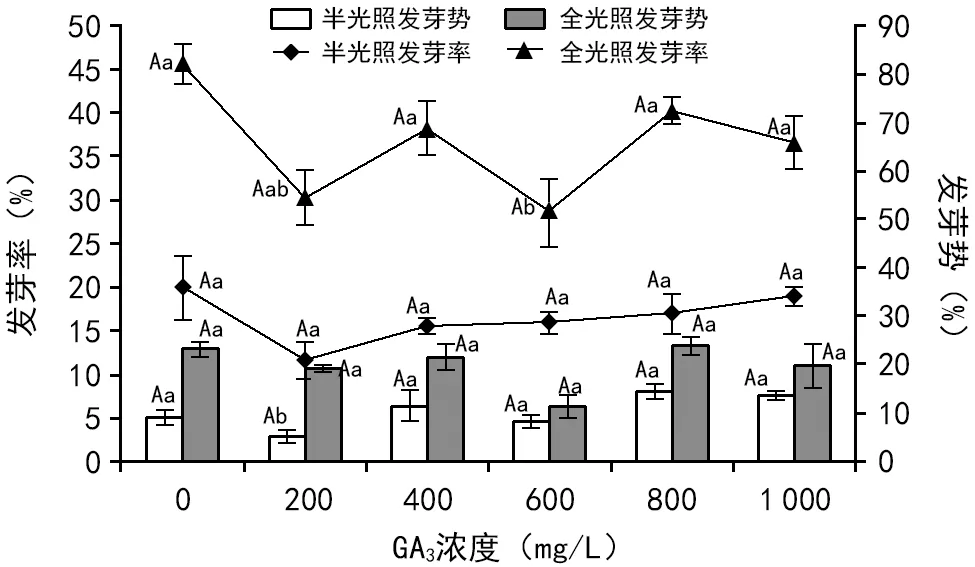
注:不同大写字母为0.01水平差异显著,小写字母表示0.05水平差异显著。图3 光照时间及GA3共同作用对种子萌发的影响
3 讨 论
3.1 种子特性与种子萌发的关系
凯里杜鹃种子属于极细小的种子型,其内容物及营养物质含量不高,种子播种萌发后需及时补充营养物质以保证正常萌发[6];从种子的吸水率来看,凯里杜鹃种子的吸水主要集中在前4 h内,且24 h达吸水饱和状态,说明其种皮透性较好,由此可见,凯里杜鹃种子的萌发前浸泡24 h为宜。
3.2 光照时间及贮藏环境与种子萌发的关系
种子萌发需要适宜的环境条件,光照时间对种子顺利萌发尤为重要,适宜的光照条件能较快打破种子休眠,促进种子萌发,赵冰等对秀雅杜鹃种子的萌发试验研究表明,全光照处理不利于秀雅杜鹃种子的萌发[7];樊丛令等研究表明,日光照8 h比黑暗处理最终发芽率高[8]。本研究结果表明,全光照处理效果最佳,长光照处理能打破凯里杜鹃种子的休眠。
3.3 GA3处理与种子萌发的关系
GA3作为一种激素处理常用来打破种子休眠,能促进细胞分裂和分化组织发生,促进早期幼苗生长,在生产实践中应用较多[9-10]。有研究表明,GA3可影响胚轴生长及促进子叶的伸展[11]。刘仁阳等[12],陈雪梅等[13]研究表明,当浓度为400 mg/L、浸种24 h时,雷山杜鹃种子发芽率达到最大值;黄承玲等研究表明,当GA3浓度为500 mg/L时能明显促进大白杜鹃种子的萌发[14];刘林等利用GA3对紫斑杜鹃和山花杜鹃种子进行处理,结果表明,紫斑杜鹃种子以600 mg/L GA3浸种效果最好,而三花杜鹃种子以400,600 mg/L GA3处理效果最佳[15]。本研究结果表明,高浓度(800~1 000 mg/L)的GA3能提高凯里杜鹃种子的发芽率和发芽势,但与对照组相比,发芽率和发芽势的差异都不显著,这可能是因为凯里杜鹃种子种皮的蜡质层含量与GA3的渗透率具有一定的关系,具体原因需进一步研究。
[1]高连明,李德铢.国产杜鹃花属马银花亚属(杜鹃花科)五个新异名[J].植物分类学报,2006,44(5):604-607.
[2]陈训,巫华美.中国贵州杜鹃花[M].贵阳:贵州科技出版社,2003.
[3]王玉国,李光照,张文驹,等.中国杜鹃花属的叶表皮特征及其系统学意义[J].植物分类学报,2007,45(1):1-20.
[4]唐光大,吴海求,庄雪影.杜鹃花属5种植物叶表皮结构解剖及分类意义初探[J].湖北民族学院学报(自然科学版),2010,28(4):371-374.
[5]ARTHUR R,HUI WH.A New Triterpene from the Hong Kong Ericaceae:an Epoxyglutinane fromRhododendronwestlandii[J].Journal of the Chemical Society,1961:551-554.
[6]黄承玲,王灵军,黄家湧,等.3种高山杜鹃种子特性研究[J].种子,2014,33(8):82-84.
[7]赵冰,董进英,张冬林.温度、光照和赤霉素浓度对秀雅杜鹃种子萌发的影响[J].种子,2014,33(5):26-30.
[8]樊丛令,陈训,邢晋宁.不同处理对露珠杜鹃种子萌发的影响[J].种子,2011,30(4):106-108.
[9]卢春霞,罗小玲,陈霞.赤霉素的研究进展[J].世界科技研究与发展,2012,34(1):45-49.
[10]KHATANA K J,JADAV R G,NEHETE D S.Influence of GA3on germination and growth of acid lime cv.KAGZILIME seed (CitrusaurantifoliaSwingle)under field as well as net house conditions[J].the Asian Journal of Horticulture,2015,10(1):11-16.
[11]Al-HAWEZY S M N.The role of the different concentrations of GA3on Seed Germination and Seedling Growth of Loquat (EriobotryajaponicaL.)[J].Journal of Agriculture and Veterinary Science,2013,4(5):3-6.
[12]刘仁阳,欧静,陈训,等.赤霉素浸种对雷山杜鹃种子萌发的影响[J].贵州科学,2013,31(2):69-71.
[13]陈雪梅,欧静,陈训,等.雷山杜鹃种子特性及萌发试验研究[J].江苏农业科学,2014,42(8):184-186.
[14]黄承玲,周洪英,陈训,等.GA3浸种对大白杜鹃种子萌发的影响[J].植物生理学通讯,2010,46(8):793-796.
[15]刘林,张良英,牛歆雨,等.GA3对2种杜鹃种子萌发特性的影响[J].种子,2015,34(7):5-7.
Studies on Seed Characteristics and Seed Germination ofRhododendronwestlandii
YANGPeng1,JIANGYing2,GUYuxing1,GUIBao1,ZHAOCai1,WUHonge2
2017-01-26
贵州科学院青年科学基金“雷公山野生杜鹃种质资源保育研究”(黔科院J合字[2014]05号);国家自然科学基金“中国贵州野生杜鹃群落天然更新障碍机理研究”(31460136);贵州科学院科技计划专项“贵州省植物园植物保育展示平台建设”(黔科院科专合字[2014]04号)。
杨 鹏(1991—),男(土家族),贵州思南人;硕士研究生,主要从事植物分子生物学研究;E-mail:894734163@qq.com。
吴洪娥,助理研究员,主要从事观赏植物资源保育与利用研究;E-mail:wuhonge163@163.com。
10.16590/j.cnki.1001-4705.2017.05.084
S 685.21
A
1001-4705(2017)05-0084-04

