QuEChERS-GC-MS法检测当归中9种除草剂残留
方旭元,夏高峰,石巧巧,何 灿,杨晓云,徐汉虹
(华南农业大学 农学院,广东 广州 510642)
QuEChERS-GC-MS法检测当归中9种除草剂残留
方旭元,夏高峰,石巧巧,何 灿,杨晓云,徐汉虹
(华南农业大学 农学院,广东 广州 510642)
【目的】建立当归中除草剂的残留分析方法。 【方法】阿特拉津、异恶草酮、乙草胺、扑草净、异丙甲草胺、二甲戊灵、丁草胺、丙草胺和乙氧氟草醚9种除草剂残留分析采用QuEChERS方法结合气相色谱-质谱联用仪。样品用乙腈提取,采用N–丙基乙二胺(PSA)和石墨化炭黑(GCB)净化,选择离子监测模式(SIM)进行检测,外标法定量。对影响提取和净化的参数进行优化。 【结果】在0.01~5.00 mg·L–1的范围内,各除草剂的峰面积与质量浓度呈良好的线性关系。在添加量分别为0.01和0.10 mg·kg–1的水平下,9种除草剂在当归样品中的平均回收率为74.58%~96.37%,相对标准偏差均低于 11.73%,各除草剂的检出限范围为 0.52~6.60 μg·kg–1。 【结论】该方法简单、快速、有效,能够用于实际当归样品中多种除草剂的残留检测。
QuEChERS;除草剂;当归;气相色谱-质谱;农药残留
当归Angelica sinensis是伞形科当归属一种多年生草本植物,其干燥的贮藏根是我国一味重要中药材,药用历史悠久。当归具有补血、和血、调经止血、润肠滑肠的功效,为医家常用,素有“十方九归”之称[1-2]。近些年来,中药材中农药残留问题日趋严重。已有针对我国中药材农药残留的现状以及发展的研究,并提出了控制建议[3-5];张庆生等[6]对比了我国与周边各国在中药材农药残留方面存在的各类问题,对了解中药材上农药残留的发展及研究起到了重要作用。我国虽为中药材生产大国,但农药残留检测技术相对落后,并未建立起完善的限量标准[7]。
QuEChERS(Quick,easy,cheap,effective,rugged and safe)方法自2003年被开发出来[8],受到了广泛关注和重视,以QuEChERS为基础加以修饰的农药残留分析方法逐渐应用到多个研究领域。QuEChERS 方法已被美国分析化学家协会和欧盟采用为蔬菜和水果样品中农药残留分析的方法[9-10]。该技术通常结合高效液相色谱与质谱联用、气相色谱与质谱(GC-MS)联用进行农药残留分析。本研究采用QuEChERS-GC-MS方法结合超声辅助萃取,建立了当归中9种除草剂的残留分析方法,对影响萃取和净化的条件进行系统的筛选,优化检测条件,并评价方法的准确度、精密度和基质效应。
1 材料与方法
1.1 材料
Agilent 6890N-5975气相色谱-质谱联用仪(美国Agilent公司);DB-5MS毛细管柱(30 m×0.25 mm×0.25 μm)(美国 Agilent公司);GY-FS-06 多功能粉碎机(江西赣云食品机械有限公司);Anke TDL-4离心机(上海安享科学仪器厂);SK 2200 HP超声波清洗器(上海科导超声仪器有限公司)。
阿特拉津、扑草净、二甲戊灵、异恶草酮和乙氧氟草醚购自上海市农药研究所,乙草胺、丙草胺、丁草胺和异丙甲草胺购自德国Dr. Ehrenstorfer公司,以上农药标准品质量浓度均为 100 mg·L–1;N–丙基乙二胺(PSA)及石墨化炭黑(GCB)购自北京艾杰尔科技有限公司;乙腈为色谱纯,其余试剂为分析纯,购自天津市富裕精细化工有限公司。
1.2 方法
1.2.1 样品前处理 当归样品购于中药店,多功能粉碎机将其粉碎均匀,然后转移至干净的样品袋中,做好标签,保存于冰箱中,待用。准确称取5.0 g上述当归样品于50 mL聚四氟乙烯离心管中,加入
10.0 mL双蒸水和10.0 mL乙腈,涡旋1 min后超声辅助萃取20 min,再加入4.0 g无水MgSO4和1.0 g NaCl,4 000 r·min–1离心 3 min,吸取 1.5 mL 上清液移至2 mL圆底离心管中,2 mL离心管中预先称好50.0 mg PSA、10.0 mg GCB和150.0 mg无水MgSO4。涡旋 1 min 后,在 10 000 r·min–1离心1 min,吸取上清液过0.22 μm滤膜,待机。
1.2.2 标准溶液的配制及标准曲线的绘制 用分度吸量管分别量取阿特拉津、异恶草酮、乙草胺、扑草净、异丙甲草胺、二甲戊灵、丁草胺、丙草胺和乙氧氟草醚各1.00 mL于10 mL容量瓶中,用色谱乙腈定容混匀,得到10 mg·L–1的混合标准工作液。量取一定量的混合标准工作液,用色谱乙腈逐级稀释配制成质量浓度分别为 5.00、1.00、0.50、0.10、0.05和0.01 mg·L–1的系列标准溶液。以各农药的质量浓度为横坐标,峰面积为纵坐标,作溶剂标准曲线。再以当归空白基质提取液为溶剂逐级稀释10 mg·L–1的混合标准工作液,配制成质量浓度分别为 5.00、1.00、0.50、0.10、0.05 和 0.01 mg·L–1的空白基质匹配标准溶液,作空白基质标准曲线,用以评价农药检测过程中的基质效应。当归空白基质提取液的制备方法参照样品前处理过程。上述所有溶液均在4 ℃条件下避光保存。
1.2.3 气相色谱-质谱联用仪条件 GC条件:进样口温度设为270 ℃;载气为高纯氦气(φ为99.999%);柱流量为 1.0 mL·min–1;采用程序升温:初始温度120 ℃,保持 1 min,接着以 30 ℃·min–1升温至 200 ℃,保持 1 min,最后以 5 ℃·min–1升温至 250 ℃;进样模式为不分流进样。MS条件:离子源为电子轰击源(EI),电子能量为70 eV,离子源温度为230 ℃;四级杆温度为150 ℃;传输线温度为280 ℃;采用选择性离子监测(SIM)模式。
1.2.4 添加回收试验 准确称取5.0 g不含供试除草剂的当归样品,向其中加入一定量的除草剂混合标准溶液,使其添加量分别为0.01和0.10 mg·kg–1。静置一段时间后,用所建立的方法对其进行检测,计算平均加标回收率和相对标准偏差,重复5次。
2 结果与分析
2.1 提取和净化条件的选择
对提取溶剂的种类、体积、超声时间和净化材料用量进行优化,得出最佳试验条件。
2.1.1 提取溶剂的选择 溶剂会对农药残留分析结果产生很大影响。将正己烷、丙酮和乙腈作为提取溶剂进行了调查与筛选,分析试验结果发现正己烷对目标农药的提取效率较低,平均添加回收率为69%;丙酮和乙腈对上述9种除草剂同时提取的效果都好,添加回收率分别为80%和89%。但丙酮容易大量溶解当归中的油脂和色素,可能会为后续净化带来困难。综合考虑,选取乙腈作为当归样品中9种除草剂的提取溶剂。
2.1.2 提取溶剂体积的选择 提取溶剂的体积在农药残留分析中也很关键,如果提取溶剂体积过少,虽然会大幅度提高目标农药的质量浓度,但是可能导致目标农药提取不完全而影响提取效率;如果提取剂体积过多,虽然能够大幅度地提取出目标农药,但是却大大稀释了目标农药的质量浓度,使其可能低于仪器检出限,从而不被检出,另外,过多使用有机溶剂还会造成不必要的浪费和环境问题。本试验分别考察了不同体积(5.0、10.0和15.0 mL)的乙腈对提取效果的影响,分析结果发现,当乙腈的体积为5.0 mL时,平均添加回收率为70%,提取效果不是很理想,原因可能是提取溶剂体积较少,目标农药未被完全提出。当乙腈体积加大到10.0和15.0 mL时,添加回收率分别为92%和89%,考虑到经济效益和环境效益,最终选择10.0 mL为乙腈提取体积。
2.1.3 超声时间的选择 本试验采用超声辅助萃取结合QuEChERS方法对当归中的9种除草剂进行提取和净化,其中超声时间的长短也极大地影响了试验结果。本试验对超声时间(10、20和30 min)分别进行了考察,试验结果表明,在超声时间为20 min时,添加回收率为94%,随着超声时间的延长,回收率趋于稳定,并没有得到明显提高,考虑到时间因素,最终确定超声萃取辅助的时间为20 min。
2.1.4 净化材料的选择 当归基质中化学成分主要为挥发性油脂、有机酸和多糖[11],本试验分别采用N–丙基乙二胺(PSA)、石墨化炭黑(GCB)和C18粉末作为净化剂材料对净化过程做了研究,结果发现PSA和GCB的净化组合便能够满足当归基质的净化需求,净化后的样品不干扰对9种除草剂的定性和定量,所以本试验最终选择50 mg PSA和10 mg GCB作为当归样品的净化剂。
2.2 检测条件的优化
先对除草剂混合标准溶液进行全扫描,得出各目标农药的保留时间,分别选出合适的目标离子用来定性和定量,原则上选择丰度较大的离子。其次对空白当归样品按前处理条件进行处理,然后按GC-MS条件上机检测,通过色谱图可看出空白样品中并不含有该9种除草剂,这也就表明此空白样品可以作为添加回收试验的材料。
表1为各农药的保留时间和特征离子汇总表,是通过对混合标样全扫描后得出来的,其中第1组同时监测阿特拉津和异恶草酮的目标离子,第5组同时监测丁草胺和丙草胺的目标离子。图1为样品0.10 mg·kg–1时的混合标样色谱图,由图1可以看出仪器对9种除草剂的响应值,其次可以明确知道9种除草剂的出峰顺序依次是阿特拉津、异恶草酮、乙草胺、扑草净、异丙甲草胺、二甲戊灵、丁草胺、丙草胺和乙氧氟草醚。
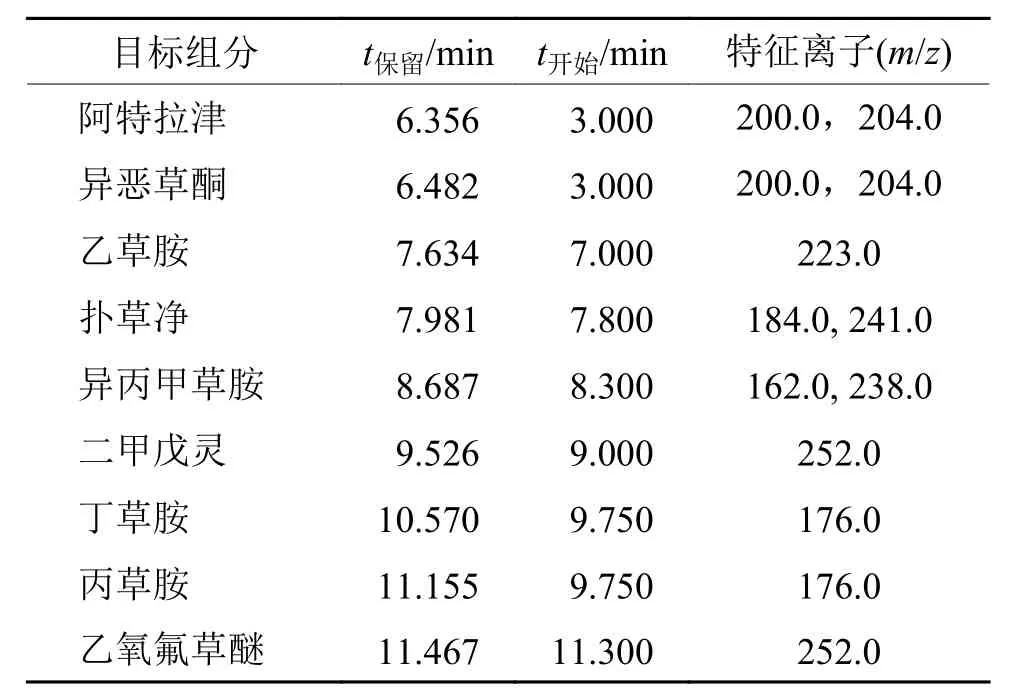
表1 9种除草剂的保留时间和特征离子Tab. 1 Retention time and characteristic ions of nine herbicides

图1 除草剂混合标样色谱图Fig. 1 Chromatograms of mixed standard solution
2.3 方法验证
2.3.1 线性范围、相关系数及检测限 将配好的各浓度的当归空白基质匹配标准溶液上机检测,以质量浓度(x)为横坐标,峰面积(y)为纵坐标,作基质标准曲线,从而得到9种除草剂的线性回归方程、线性范围及相关系数。如表2所示,9种除草剂的质量浓度在0.01~5.00 mg·L–1的范围内与峰面积均呈良好线性关系,说明方法可行,相关系数均大于0.998 2,方法的检出限是通过3倍信噪比(S/N=3)时对应的质量浓度计算得出。

表2 方法的检出限、相关系数、线性范围Tab. 2 Limit of detection, correlation coefficient and linear range of this method
2.3.2 方法的准确度和精密度 在各项最优条件下,对空白当归样品进行加标回收试验。试验结果如表3所示,在添加水平为0.01 mg·kg–1时,当归样品中9种除草剂的平均回收率为74.58%~86.89%,相对标准偏差均低于11.73%;在添加水平为0.10 mg·kg–1时,当归样品中的9种除草剂平均回收率为85.65%~96.37%,相对标准偏差均低于8.74%。以上结果说明,该方法的准确性和重复性都能够满足农药残留分析的要求。
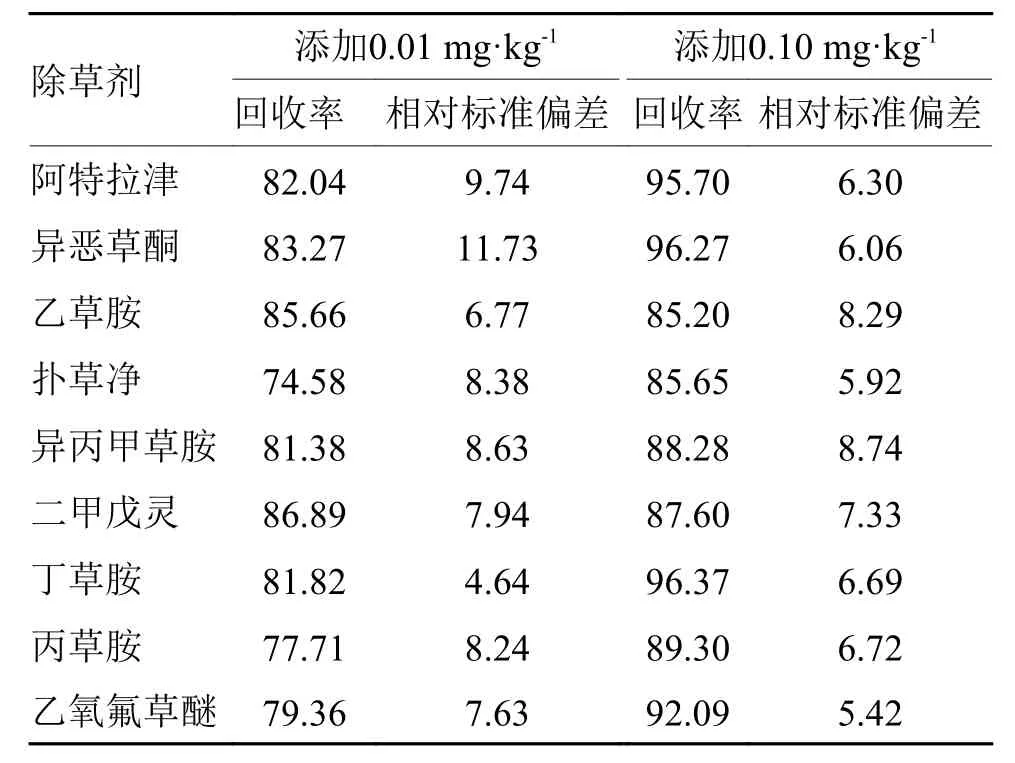
表3 9 种除草剂在当归样品中的回收率和相对标准偏差Tab. 3 Recovery rates and relative standard deviations of nine herbicides in Angelica sinensis %
2.3.3 基质效应的评价 基质效应的定义很广,欧盟农残分析质量控制委员会将基质效应定义为样品中的一种或多种非目标分析物对目标分析物的浓度和质量准确测定产生影响和干扰的一种现象。进行农药残留分析时,往往存在基质效应[12]。目前针对基质效应,最常用的解决方法是基质匹配法,即利用不含目标分析物的空白基质的提取液来配制标准溶液,它可以不同程度地消除和补偿基质效应[13]。基质效应用以下公式来表示[14]:
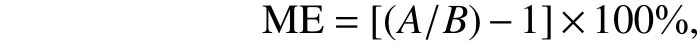
式中,ME为基质效应数值,A和B分别代表基质匹配标准溶液曲线的斜率和溶剂标准曲线的斜率。当ME值为–20%~20%时,说明基质效应较弱;当ME值在–50%~ –20%和20%~50%时,说明基质效应中等;当ME值大于50%或小于–50%时,说明基质效应较强[15]。
本试验采用基质匹配法分别评估当归基质中的9种除草剂的基质效应,结果发现9种除草剂都呈现出弱基质效应,ME值范围为−18.27%~ −3.89%。
2.3.4 实际样品的检测 随机对广州一些中药店进行抽样,总共收集10份当归样品,运用本试验建立的方法对所抽当归样品中的上述9种除草剂进行了检测,结果显示9种除草剂均未被检出。
3 结论
本研究采用QuEChERS方法结合气–质联用仪建立了当归中9种除草剂的残留分析方法,各除草剂的浓度和峰面积在线性范围内线性关系良好,样品的平均回收率为74.58%~96.37%,相对标准偏差均低于11.73%,能够满足农药残留分析的要求。该方法简单、快速、有效,可以用于实际当归样品中多种除草剂的检测。试验中所有影响样品提取和净化效果的各项参数均采用因素控制变量法得出,相对简单、节省时间,但是并没有考察各因素之间的相互影响以及是否有主次之分,所以具有一定的局限性,因此可以考虑采用正交试验进行进一步拓展深入研究。
[1]宋秋月, 付迎波, 刘江, 等. 当归的化学成分研究[J]. 中草药, 2011, 42(10): 1900-1904.
[2]马瑞君, 王钦, 陈学林, 等. 当归的研究进展[J]. 中草药,2002, 33(3): 280-282.
[3]李耿, 杨洪军, 边宝林. 中药农药残留的研究现状述评[J]. 中国实验方剂学杂志, 2005, 11(4): 71.
[4]薛健, 金红宇, 田金改, 等. 中药农药残留问题研究与思考[J]. 中草药, 2007, 38(10): 1578.
[5]丁平, 田友清. 近30年中药农药残留研究状况与探讨[J]. 安徽医药, 2009, 13(7): 815.
[6]张庆生, 石上, 张树杰. 中、日、韩有关中药农药残留与重金属控制概况[J]. 中医药学报, 2005, 33(6): 1.
[7]苗青, 孔维军, 魏建和, 等. 中药材中农药残留现状及控制措施评析[J]. 农药学学报, 2012, 14(4): 363-370.
[8]ANASTASSIADES M, LEHOTAY S J, POCURULL E,et al. Fast and easy multi-residue method employing acetonitrile extraction/partitioning and dispersive solid-phase extraction for the determination of pesticide residues in produce[J]. J AOAC Int, 2003, 86(2): 412-431.
[9]LEHOTAY S J, TULLY T, GARCA A V, et al. Determination of pesticide residues in foods by acetonitrile extraction and partitioning with magnesium sulfate: Collaborative study[J]. J AOAC Int, 2007, 90(2): 485-520.
[10]PAYA P, ANASTASSIADES M, MACK D, et al. Analysis of pesticide residues using the quick easy cheap effective rugged and safe (QuEChERS) pesticide multiresidue method in combination with gas and liquid chromatography and tandem mass spectrometric detection[J]. Anal Bioanal Chem, 2007, 389(6): 1697-1714.
[11]李曦, 张丽宏, 王晓晓, 等. 当归化学成分及药理作用研究进展[J]. 中药材, 2013, 36(6): 1023-1027.
[12]SCHENCK F J, LEHOTAY S J. Does further clean-up reduce the matrix enhancement effect in gas chromatographic analysis of pesticide residues in food?[J]. J Chromatogr A, 2000, 868(1): 51-61.
[13]ERNEY D R, PAWLOWSKI T M, POOLE C F. Matrixinduced peak enhancement of pesticides in gas chromatography: Is there a solution?[J]. HRC-J High Res Chrom,1997, 20(7): 375-384.
[14]RAJSKI L, LOZANO A, UCLES A, et al. Determination of pesticide residues in high oil vegetal commodities by using various multi-residue methods and clean-ups followed by liquid chromatography tandem mass spectrometry[J]. J Chromatogr A, 2013, 1304: 109-120.
[15]MELO A, CUNHA S C, MANSILHA C, et al. Monitoring pesticides residues in greenhouse tomato by combining acetonitrile-based extraction with dispersive liquidliqiud microextraction followed by gas-chromatography-mass spectrometry[J]. Food Chem, 2012, 135(3):1071-1077.
Detection of nine herbicide residues in Angelica sinensis by QuEChERS-GC-MS
FANG Xuyuan, XIA Gaofeng, SHI Qiaoqiao, HE Can, YANG Xiaoyun, XU Hanhong
(College of Agriculture, South China Agricultural University, Guangzhou 510642, China)
【Objective】To establish a method for analyzing herbicide residues in Angelica sinensis.【Method】The residues of nine herbicides, including fenamine, clomazone, acetochlor, prometryn,metolachlor, pendimethalin, butachlor, pretilachlor and oxyfluorfen were analyzed by QuEChERS combined with GC-MS. Samples were extracted with acetonitrile and cleaned up using primary secondary amine (PSA)and graphitized carbon black (GCB). Nine herbicides were detected using the selective ion monitoring (SIM)mode and quantified with external standards. Parameters which influenced extraction and purification efficiency were optimized. 【Result】There were good linear relationships between herbicide concentration and detected peak area within the range from 0.01 to 5.00 mg·L-1for all nine herbicides. The average recovery rates of nine herbicides in A. sinensis were from 74.58% to 96.37% at the addition levels of 0.01 and 0.10 mg·kg-1, with relative standard deviation less than 11.73%. The detection limits of nine herbicides were from 0.52 to 6.60 μg·kg-1.【Conclusion】This detection method is simple, fast and effective, and can be used practically to detect a variety of herbicides in A. sinensis samples.
QuEChERS; herbicide; Angelica sinensis; GC-MS; pesticide residue
S482.4
A
1001-411X(2017)06-0079-05
方旭元, 夏高峰, 石巧巧, 等. QuEChERS-GC-MS法检测当归中9种除草剂残留[J]. 华南农业大学学报, 2017, 38(6): 79-83.
2016-11-22 优先出版时间:2017-11-06
优先出版网址:http://kns.cnki.net/kcms/detail/44.1110.S.20171106.1412.026.html
方旭元 (1993—),男,硕士研究生,E-mail: 1181847495@qq.com; 通信作者: 杨晓云 (1966—),男,副教授,博士,E-mail: yxyhyxy@scau.edu.cn
广州市科技计划项目(1515000259)
【责任编辑 霍 欢】

