贵州桂花种质资源遗传多样性的ISSR分析
, , , , ,
(1.贵州大学贵州省森林资源与环境研究中心, 贵阳 550025;2.贵州大学林学院, 贵阳 550025)
贵州桂花种质资源遗传多样性的ISSR分析
罗仙英,桂敬飞,严治,明毅,田雨风,范付华
(1.贵州大学贵州省森林资源与环境研究中心, 贵阳 550025;2.贵州大学林学院, 贵阳 550025)
通过ISSR分子标记,对贵州不同地区的54份桂花种质进行了遗传多样性研究。选取11条多态性引物用于正式扩增,获得清晰、重复性好的DNA谱带93条,多态位性谱带80条,占总扩增带的86%,平均每个引物扩增8.45条;应用810和830的引物组合,构建了桂花种质的ISSR指纹图谱,可以有效区分所有供试材料;利用NTSYS和POPGENE 32进行数据分析,计算出相似系数与遗传距离,构建了54个样本的聚类树状图;以遗传相似系数0.69为阈值把54份供试桂花材料分为4类,聚类结果与地域及海拔具有一定相关性。因此,ISSR技术能够有效地用于桂花种质资源的鉴别及遗传关系的解析。
桂花; ISSR分子标记; 遗传多样性; 聚类分析
桂花(OsmanthusfragransLour.) 原产我国西南部喜马拉雅山东段,为木犀科(Oleaceae)木犀属(OsmanthusLour.) 常绿灌木或小乔木,叶对生,花期一般为8月上旬—10月上旬,花簇生,香味浓郁。桂花为中国十大传统名花之一,栽培历史悠久,观赏价值高,应用广泛,也是常见的保健食品。桂花在长期的进化过程中,受不同环境及栽培方式等的影响,发生了丰富的遗传变异,拥有众多遗传资源。根据花期、花色等性状,通常将桂花分为四季桂、金桂、丹桂、银桂等4个品种群,随着长期的自然杂交及人工选育,各品种群形成了丰富多样的栽培种,迄今共记载了逾166个桂花品种[1]。贵州年平均气温在15.3 ℃左右,7月平均温度22.8~30.9 ℃,1月平均温度0 ℃以上,地处中国西南部气候温和,适于桂花的种植。但是,贵州桂花的品种鉴定及其开发利用尚处于滞后阶段,研究其资源遗传多样性对遗传改良和优异种质资源保护具有重要意义。关于桂花遗传多样性的研究已有一些报道,但鲜有对贵州本地桂花资源的评价研究[2-5]。本研究利用ISSR分子标记技术对贵州野生桂花分布较为集中地区的部分桂花种质进行了遗传多样性及亲缘关系评价,并构建了相应的指纹图谱,以期为贵州省桂花种质创新、开发利用及保护提供参考。
1 材料和方法
1.1 材 料
此次所试材料采集于贵州不同的地理环境,共收集了54份野生桂花资源(表1),它们在形态特征上具有明显的差异,选取其嫩叶置于保鲜袋中,带回实验室加入液氮后置于-80 ℃冰箱中保存。
表1 供试贵州桂花种质
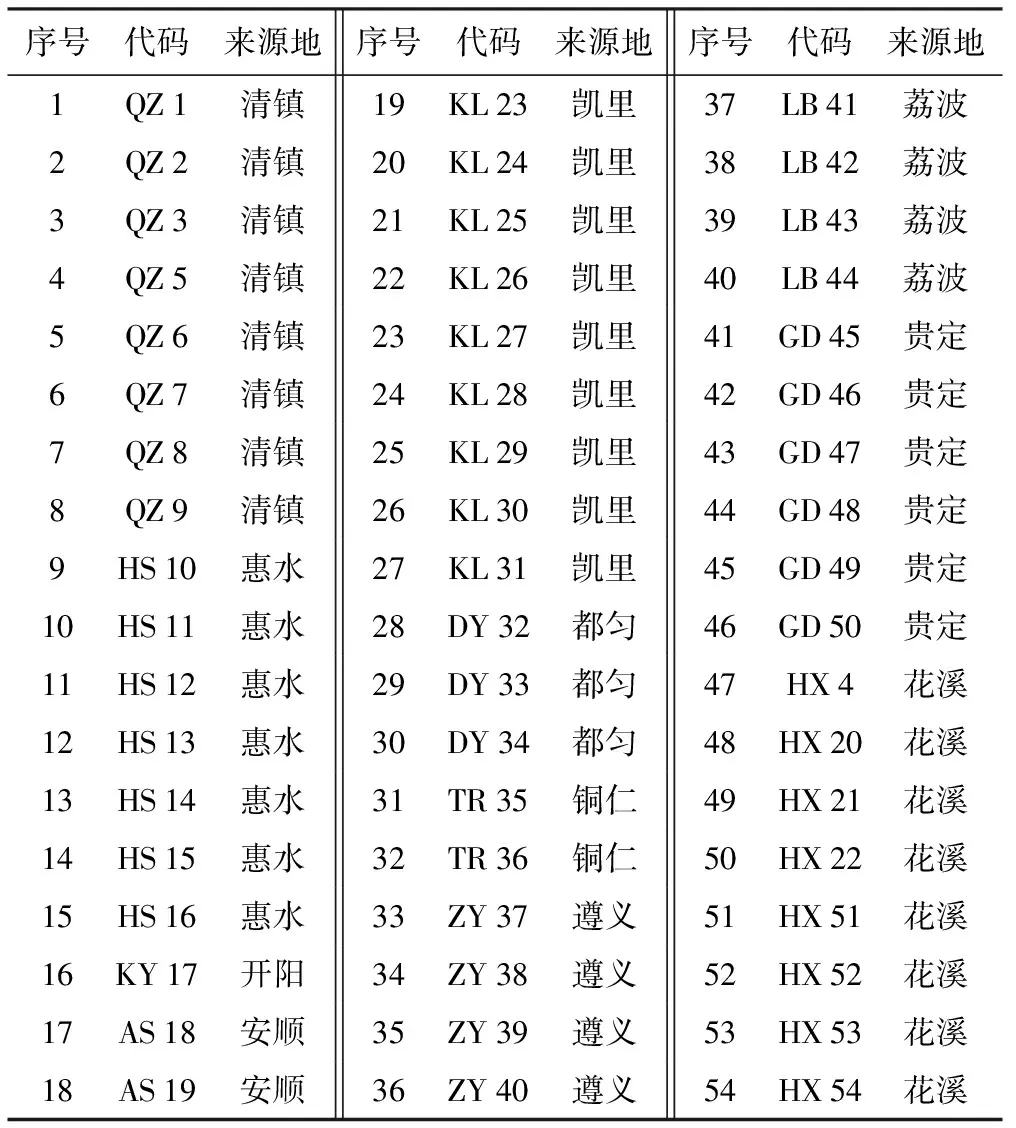
序号代码来源地序号代码来源地序号代码来源地1QZ1清镇19KL23凯里37LB41荔波2QZ2清镇20KL24凯里38LB42荔波3QZ3清镇21KL25凯里39LB43荔波4QZ5清镇22KL26凯里40LB44荔波5QZ6清镇23KL27凯里41GD45贵定6QZ7清镇24KL28凯里42GD46贵定7QZ8清镇25KL29凯里43GD47贵定8QZ9清镇26KL30凯里44GD48贵定9HS10惠水27KL31凯里45GD49贵定10HS11惠水28DY32都匀46GD50贵定11HS12惠水29DY33都匀47HX4花溪12HS13惠水30DY34都匀48HX20花溪13HS14惠水31TR35铜仁49HX21花溪14HS15惠水32TR36铜仁50HX22花溪15HS16惠水33ZY37遵义51HX51花溪16KY17开阳34ZY38遵义52HX52花溪17AS18安顺35ZY39遵义53HX53花溪18AS19安顺36ZY40遵义54HX54花溪
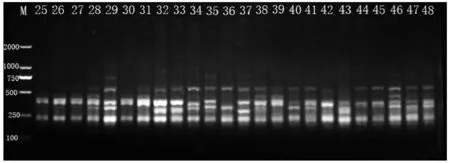
图1 引物823对部分供试材料的扩增结果
1.2 DNA的提取及检测
采用新型植物基因组DNA提取试剂盒(DP 320,天根生化科技有限公司)提取54份样品基因组DNA,提取步骤参照试剂盒里的说明书。用1.0%的琼脂糖凝胶电泳检测DNA完整性及大致浓度,存放于-20 ℃冰箱中备用。
1.3 PCR的扩增及检测
参照范付华等[6-7]的方法,稍作修改,选取UBC公司公布的ISSR引物序列,经过筛选,选出合适的引物及每个引物的最佳退火温度。经优化体系,PCR 反应体系为10μL,含5μL Mix,0.5μL引物,3.5μL dd H2O及1μL DNA模板。扩增程序为95 ℃预变性3 min;95 ℃变性45 s,根据不同引物选择最优温度复性45 s,72 ℃延伸1 min,34个循环;最后72 ℃延伸5 min。用含GeneGreen染料的1.8%琼脂糖凝胶对PCR产物进行电泳检测,上样量为5μL,恒压90 V,电泳50 min,之后用凝胶成像系统观察并拍照。
1.4 数据处理
按分子标记的有无记录成二进制数据,录入Excel表格,具有明显谱带的位置记为1,无带或带不清晰的位置记为0。将结果导入POPGENE 32(Version 1.32)软件进行遗传多样性分析;采用NTSYSpc 2.1软件UPGMA聚类法对所得数据进行分析,绘出54份桂花材料的聚类分析树状图[8]。
2 结果与分析
2.1 ISSR 引物PCR扩增多态性
用筛选的多态性好、稳定性高的11条ISSR引物对供试桂花材料进行PCR扩增(表2),共获得93个位点,其中多态性位点数80个,多态性位点比率为86%;每个引物扩增出的位点在5~13个之间,平均每个引物扩增位点8.45个,多态性位点7.27个;可统计的谱带大小主要集中在170~1 400 bp之间。其中,多态性比率达到100%的引物有814、830、891;引物810的多态性位点比率最低,为77%。图1为ISSR引物823对部分供试材料的PCR扩增图谱。
2.2 桂花种质资源遗传多样性分析
用POPGENE 32软件对所有供试材料进行分析,结果表明,桂花的平均观察等位基因数、有效等位基因、Nei’s遗传多样性指数、Shannon多样性信息指数分别是1.989 2、1.481 3、0.291 1、0.446 5,其多态位点百分率达到98.92%。对不同地理来源桂花的分析结果显示,凯里采集地的平均观察等位基因数为1.548 4,有效等位基因数1.310 6,Nei’s遗传多样性指数为0.177 8,Shannon多样性信息指数0.268 0;荔波地区桂花平均观察等位基因数、有效等位基因数分别为1.376 3、1.279 7,Nei’s遗传多样性指数、Shannon多样性信息指数分别0.155 3、0.225 6;清镇桂花种质平均观察等位基因数、有效等位基因、Nei’s遗传多样性指数、Shannon多样性信息指数分别1.645 2、1.407 3、0.232 1、0.344 0。
表2 ISSR引物及其扩增结果
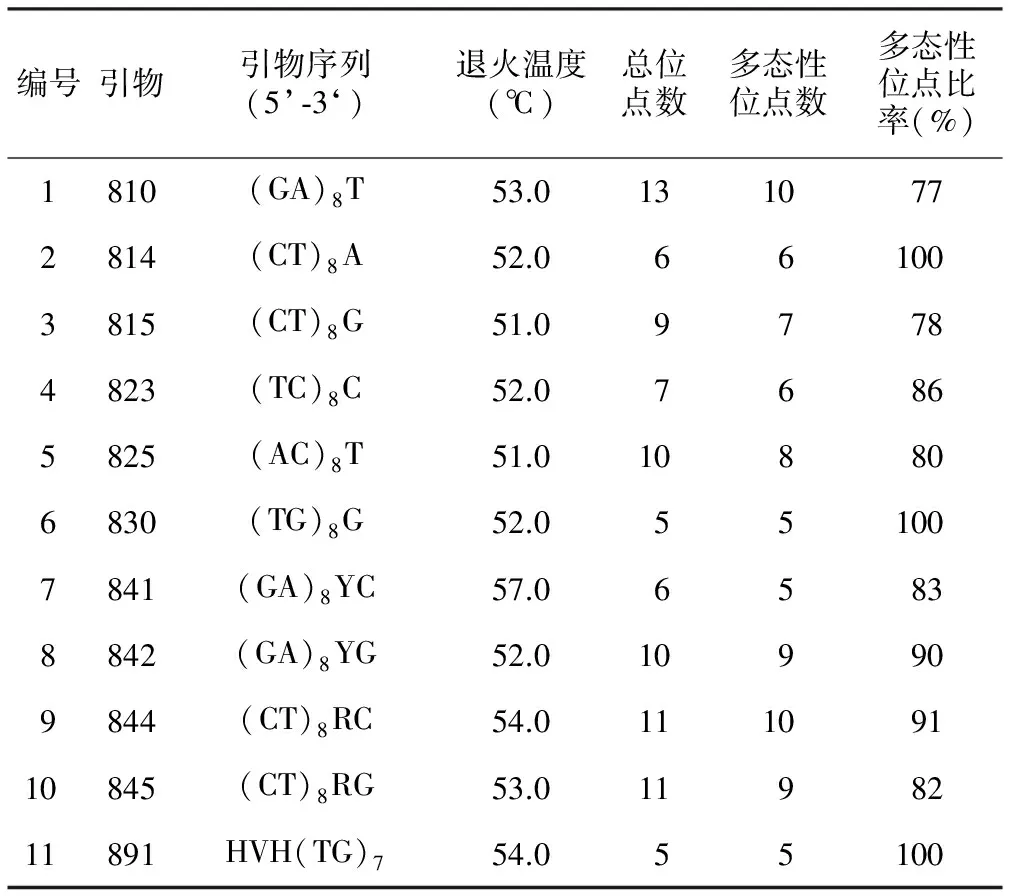
编号引物引物序列(5’⁃3‘)退火温度(℃)总位点数多态性位点数多态性位点比率(%)1810(GA)8T53.01310772814(CT)8A52.0661003815(CT)8G51.097784823(TC)8C52.076865825(AC)8T51.0108806830(TG)8G52.0551007841(GA)8YC57.065838842(GA)8YG52.0109909844(CT)8RC54.011109110845(CT)8RG53.01198211891HVH(TG)754.055100
2.3 供试种质的DNA指纹图谱
根据每个供试材料的DNA扩增图谱中ISSR标记位点条带的有无或缺失用0和1进行数字化统计,结果由0和1的排列形成数字符串,构建数字指纹图谱。其中,引物810和830的组合所扩增的谱带在不同供试材料中表现出明显差异,由此建立的DNA指纹图谱能将其完全区分开来(表3)。通过对54个桂花供试材料的ISSR扩增带数进行分析,检测到QZ 7拥有2条特异性谱带,为引物810的750 bp和950 bp
表3 供试桂花材料的ISSR特征数字指纹
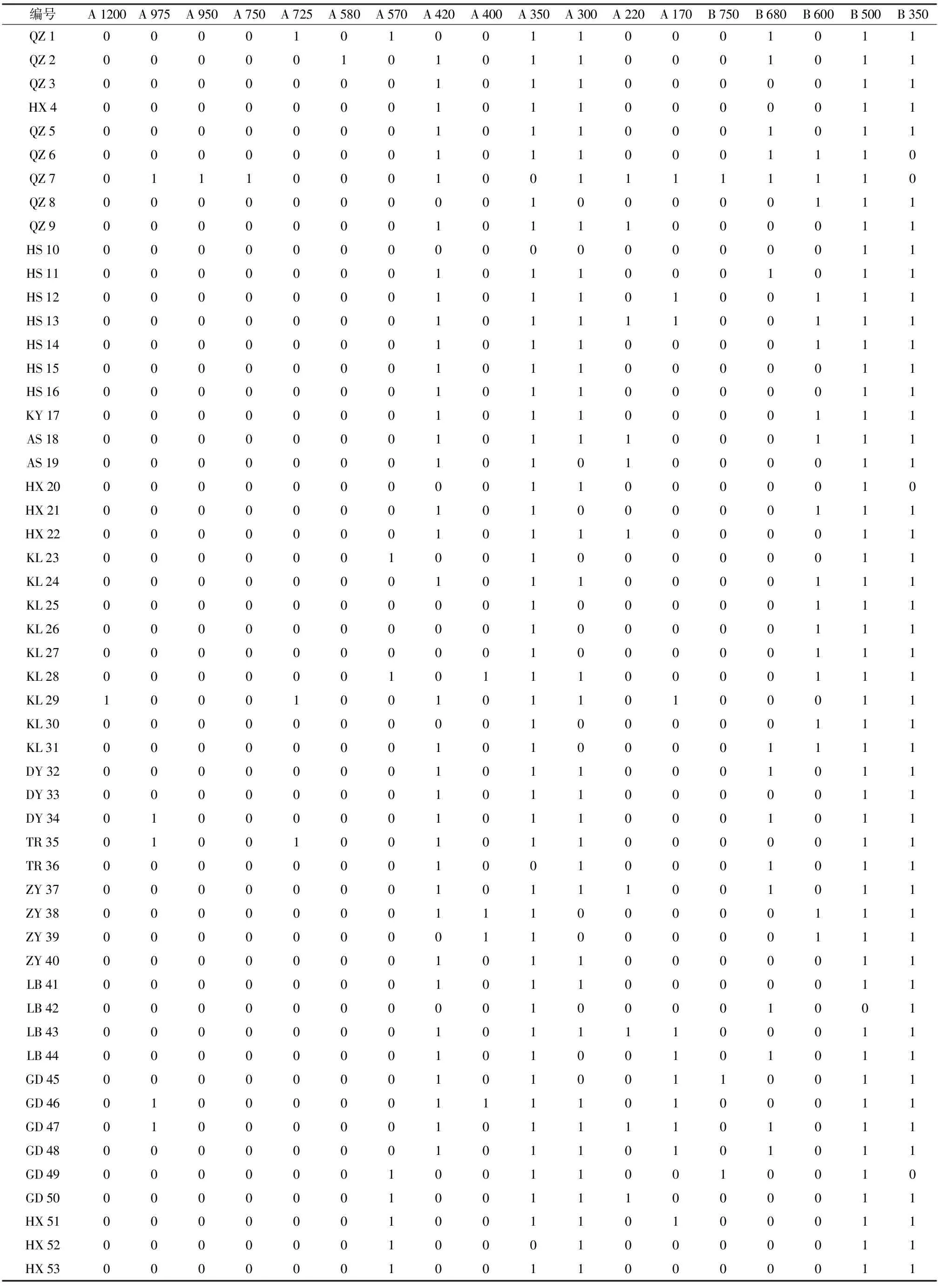
编号A1200A975A950A750A725A580A570A420A400A350A300A220A170B750B680B600B500B350QZ1000010100110001011QZ2000001010110001011QZ3000000010110000011HX4000000010110000011QZ5000000010110001011QZ6000000010110001110QZ7011100010011111110QZ8000000000100000111QZ9000000010111000011HS10000000000000000011HS11000000010110001011HS12000000010110100111HS13000000010111100111HS14000000010110000111HS15000000010110000011HS16000000010110000011KY17000000010110000111AS18000000010111000111AS19000000010101000011HX20000000000110000010HX21000000010100000111HX22000000010111000011KL23000000100100000011KL24000000010110000111KL25000000000100000111KL26000000000100000111KL27000000000100000111KL28000000101110000111KL29100010010110100011KL30000000000100000111KL31000000010100001111DY32000000010110001011DY33000000010110000011DY34010000010110001011TR35010010010110000011TR36000000010010001011ZY37000000010111001011ZY38000000011100000111ZY39000000001100000111ZY40000000010110000011LB41000000010110000011LB42000000000100001001LB43000000010111100011LB44000000010100101011GD45000000010100110011GD46010000011110100011GD47010000010111101011GD48000000010110101011GD49000000100110010010GD50000000100111000011HX51000000100110100011HX52000000100010000011HX53000000100110000011
注:A代表ISSR引物810,B代表引物830,编号顺序与表1相同。
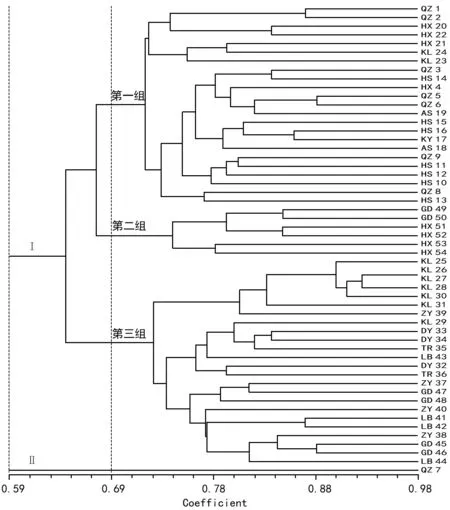
图2 桂花54份供试材料的UPGMA聚类分析树状图
左右的特异性条带,这些特异性条带可以将QZ 7从所有供试材料鉴别出来。
2.4 ISSR 遗传相似性系数和聚类分析
54份供试材料的遗传相似系数在0.473~0.978之间,其中QZ 7与ZY 40遗传相似系数最小,KL 26、KL 27遗传相似性系数最大。供试材料的聚类分析树状图见图2,以遗传相似系数0.59为阈值,可将材料分为2大类。第Ⅰ类包含53个样本,占总供试样本的98.14%。第Ⅱ类只有QZ 7采来的一个样本,而且这个样本与清镇的其它样本遗传相似系数相差很大。
以遗传相似系数0.69 为阈值,可把第Ⅱ类的 53个桂花品种分为3个组。其中第1组共有23个样本,包括清镇剩余全部样本、花溪区桐木岭方向的3个样本、惠水的7个样本、安顺,开阳的所有样本以及凯里市大风洞乡桐油坪村的2个样本;其中惠水的遗传相似系数在HS 10和HS 13 2个材料中最小,为0.68,最大的遗传相似系数出现在HS 15和HS 16中,为0.839。第2组包括了贵定样本(GD 49、GD 50)、花溪样本(HX 51、HX 52、HX 53、HX 54);第3组包含了凯里(KL 25、KL 26、KL 27、KL 28、KL 29、KL 30、KL 31)、遵义、都匀、铜仁、贵定(GD 45、GD 46、GD 47、GD 48)及荔波等地的24个样本。
从遗传相似性系数表中查找出,花溪所有供试材料中,遗传相似系数系数最小为0.58,来自于HX 52和HX 21,最大的相似系数为0.85,在HX 51和HX 52间出现。荔波与遵义的桂花种质遗传相似系数在0.63~0.82之间。根据图2结果显示,从总体来看桂花的遗传多样性受地域及海拔的影响,相同地点采集的桂花样本具有较近的亲缘关系,列如KL 26、KL 27采于2棵较近的桂花树,其相似系数达到98%。
3 结论与讨论
目前,国内外已采用SRAP[9]、RAPD[10]、及SSR[11]等方法用于桂花遗传多样性评价和品种鉴定,但这些分子标记存在着诸如操作复杂、开发成本高、稳定性差等缺陷,很少用于大规模的遗传分析。ISSR是由Zietkiewicz等基于SSR提出的可用于检测简单重复序列之间DNA序列差异的分子标记[12]。ISSR扩展产物多态性远远比RFLP、RAPD、SSR丰富,可以覆盖被测对象更多的基因组信息,因此在种质资源鉴定和遗传多样性评价中得到广泛应用[5-8,13-14]。本次研究供试桂花54份材料ISSR分子标记揭示了桂花种质间存在较丰富的遗传多样性,其多态性比率为98.92%,聚类分析图中显示,QZ 7与另外的53个样本的GS(相似系数)遗传差异较大,其原因为该样本与其他样本采集距离和海拔相差较大;另外采集样本时发现,该样本植株尚处开花期,完全不同于其它材料,而当时所处月份为5月,因而判断其为四季桂。四季桂作为一个独特的类群,其分类地位一直引人关注。从图3可以看出,作为实验中唯一能确定的四季桂个体,与其它品种群桂花遗传差异较大,这与前人的研究结论一致[14-15],也再次印证四季桂与秋桂类的遗传距离较远,且稳定可靠。地理来源相同的部分种质资源有相对聚合的现象,与其亲缘关系较近有关,但品种差异也是影响桂花亲缘关系的一个重要因素。
种质资源遗传多样性评价能为人工育种、种质创新及利用提供有力的依据。遗传多样性的高低反映了遗传背景的复杂程度及该物种存在的历史远近[16]。本实验采用11条ISSR引物,对54份贵州野生桂花种质进行PCR扩增,从分子水平上表现出较为丰富的遗传多样性,表明贵州野生桂花的生长历史长远,并且具有复杂的遗传变异。本次研究中,同一地理来源的桂花种质没有严格聚在相同的大类中,但桂花花期、叶形等形状上表现有一定的趋同。导致这一现象的原因可能是 1) 引物数量相对较少,使得标记位点和决定性状的关键基因连锁程度较低甚至不具有连锁性; 2) 采集样本虽来自同一地区,但所处海拔、土壤条件、坡位、气候等环境因子的差异也可能导致遗传基因的变异。另外,前期研究表明,相同品种群的桂花遗传背景相对一致[6],可以预判,不同地理来源但聚在相同大类的桂花种质可能为同一品种群。因此为了获得更加准确可靠的信息,需要结合多种分子、酶学及形态学标记综合分析。
[1]向其柏,刘玉莲.中国桂花品种图志[M].杭州:浙江科学技术出版社,2008.
[2]尚富德,伊艳杰,张彤.河南17个桂花品种的RAPD分析[J].园艺学报,2004,31(5):685-687.
[3]邱英雄,胡绍庆,陈跃磊,等.ISSR-PCR技术在桂花品种分类研究中的应用[J].园艺学报,2004,31(4):529-532.
[4]韩远记,董美芳,袁王俊,等.桂花品种资源的遗传多样性分析[J].植物学通报,2008,25(5):559-564.
[5]李梅,侯喜林,单晓政,等.部分桂花品种亲缘关系及特有标记的ISSR分析[J].西北植物学报,2009,29(4):674-682.
[6]范付华,夏辉,王振启,等.咸宁地区部分桂花品种的ISSR分析[J].湖北大学学报(自然科学版),2014,36(3):272-276.
[7]范付华,杨勇胜,李庆宏,等.利用ISSR分析技术鉴定贵州枇杷新种质的研究[J].北京林业大学学报,2012,34(4):52-57.
[8]张俊杰,马旭,廖源,等.昆明56个桂花品种ISSR分析[J].西部林业科学,2015,44(3):45-52.
[9]李梅,侯喜林,郝日明.基于SRAP分子标记的桂花品种亲缘关系研究[J].园艺学报,2009,36(11):1 667-1 675.
[10]Liu LC,Xiang QB,Liu YL.The application of RAPD makers in diversity detection and cultivars identification ofOsmanthusfragrans[J].Journal of Nanjing Forestry University,2004,28:76-82.
[11]段一凡,王贤荣,梁丽丽,等.桂花品种SSR荧光指纹图谱的构建[J].南京林业大学学报(自然科学版),2014,38(S 1):1-6.
[12]Zietkiewiez E,Rafalski A,Labuda D.Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20:176-183.
[13]胡绍庆,邱英雄,吴光洪,等.桂花品种的ISSR-PCR分析[J].南京林业大学学报,2004,28(S 1):71-75.
[14]段一凡,王贤荣,梁丽丽,等.古桂遗传多样性与亲缘关系的ISSR分析[J].福建林学院学报,2011,31(4):335-339.
[15]韩远记,董美芳,袁王俊,等.部分桂花栽培品种的AFLP分析[J].园艺学报,2008,35(10):137-142.
[16]陈兆贵,邓汉超,赵淑平.47份水稻品种资源的ISSR遗传多样性分析[J].基因组学与应用生物学,2009,28(3):498-520.
Genetic Diversity Analyses ofOsmanthusfragransLour.in Guizhou with ISSR Markers
LUOXianying,GUIJingfei,YANZhi,MINGYi,TIANYufeng,FANFuhua
2017-01-17
贵州大学大学生SRT计划“贵州桂花种质资源的遗传多样性及亲缘关系分析”(贵大SRT字[2015]088号)。
罗仙英(1995—),女,本科,林学专业,E-mail:1570880469@qq.com。
范付华,副教授,E-mail:fanfuhua1982@163.com。
10.16590/j.cnki.1001-4705.2017.06.062
S 685.13
A
1001-4705(2017)06-0062-05

