辣椒砧木种质资源对疫病的抗性及遗传初步分析
, , ,2, , , ,
(1.广西大学农学院, 南宁 530004; 2.贵州省农业科学院, 贵阳 550009)
辣椒砧木种质资源对疫病的抗性及遗传初步分析
傅慧珍1,钟川1,牟玉梅1,2,阳燕娟1,于文进1,韦辉1,陈建华1
(1.广西大学农学院, 南宁 530004; 2.贵州省农业科学院, 贵阳 550009)
以从国外引进的辣椒砧木种质资源为研究对象,采用游动孢子灌根法对幼苗进行疫病抗性鉴定;选择不同抗性水平且抗性表型稳定的5份砧木种质进行完全双列杂交,鉴定F1代对疫病的抗性,以病情指数为表型指标分析抗性杂种优势,通过Griffing法分析抗病性的配合力和遗传参数,探讨砧木种质抗病性状的数量遗传特点。结果表明:15份供试辣椒砧木种质中,3份种质对疫病表现中抗,其余种质均表现感病;20个F1杂交组合中,有2个杂交组合对疫病表现中抗,有3个组合表现杂种优势;辣椒砧木种质抗疫病性状符合“加性-显性-上位性”数量遗传模型,且加性效应占主导地位,同时可能受细胞质基因的影响,表现核质互作效应。本研究筛选出3份辣椒砧木种质和2个F1杂交组合对疫病表现中抗,其中种质D 15可作为抗疫病育种骨干亲本,研究结果可为合理利用辣椒砧木种质开展抗疫病育种提供参考。
辣椒砧木; 疫病; 抗性鉴定; 杂种优势; 遗传分析
辣椒疫病是毁灭性土传病害,由辣椒疫霉菌(PhytophthoracapsiciL.)引起,在我国及世界各椒类产地均有大面积发生,病害严重时减产达50%甚至绝收[1]。嫁接防病技术在辣椒等茄果类蔬菜生产上已得到应用,面积逐年扩大,取得了显著防病增收效果[2],因此选育抗病砧木是实施嫁接防病栽培的基础。
辣椒对疫病的抗性表现受基因型和环境条件影响,抗性遗传特点呈现多样化特点,受单基因控制、多基因控制、寡基因控制均有报道。国外报道最常用的抗疫病辣椒育种材料是墨西哥当地小果型辛辣品种 CM 334,研究发现,CM 334抗疫病性状的遗传受1对显性基因控制[3-4],而李智军等对辣椒P 038抗疫病性状遗传研究中发现,其抗性遗传由2对相互独立且不完全显性的互补基因控制[5];再者,Gilortega认为,辣椒SCM-334中有3个抗病等位基因位点[6]。国内外抗性遗传分析研究说明,辣椒基因组中存在着丰富多样的疫病抗病性基因,并且辣椒抗疫病的性状表达机制十分复杂,使用不同的病原菌株、抗性鉴定方法或判定标准得出的结论不尽相同[7]。
本研究采用室内人工接种方法鉴定辣椒砧木种质资源对疫病的抗性水平,从中选取5份不同抗性水平的种质进行完全双列杂交配制F1代,以病情指数为抗性表型指标,分析辣椒砧木种质对疫病的抗性遗传规律,为辣椒抗疫病育种提供参考。
1 材料与方法
1.1 材 料
供试的15份辣椒砧木种质编号分别为CJ 5、CJ 7、CJ 8、D 15、D 25、D 35、E 05、F 05、G 15、G 25、I 05、J 01、J 02、J 03、J 04,其中有3份砧用辣椒种质资源是国内收集的,编号分别是CJ 5、CJ 7、CJ 8,其余12份种质资源均是从日本引进,所有供试种质都是经自交6代以上,为纯合的自交系。种质资源栽培地点为广西南宁市广西大学校内教学科研基地,主要性状如表1所示,以高感疫病的辣椒栽培品种为接种对照(ck)。
供试的疫霉菌从田间发病的辣椒植株分离,纯化后采用PDA培养基保存作为接种源。
结合种质资源的田间综合性状,选择不同抗性水平的5份种质(D 15、D 35、F 05、G 15、G 25)作为亲本,按照完全双列杂交配制获得20个F1组合,用同样方法对F1代进行疫病抗性鉴定。
1.2 方 法
1.2.1 疫霉菌培养
从辣椒疫病发病田块采集具有典型症状的植株病茎,选取病健交接处的组织2~3块,先用75%酒精擦拭3~4 s进行表面消毒,再用1%升汞浸泡消毒3 min,经无菌水多次清洗之后,置于胡萝卜培养基(CA)平板上培养,温度为28 ℃左右,2 d后挑取菌落边缘无污染的少许菌丝,转接至马铃薯培养基(PDA)上,在同样环境条件下培养2~3 d,纯化后保存于16 ℃恒温箱中。
表1 供试辣椒砧木种质主要性状
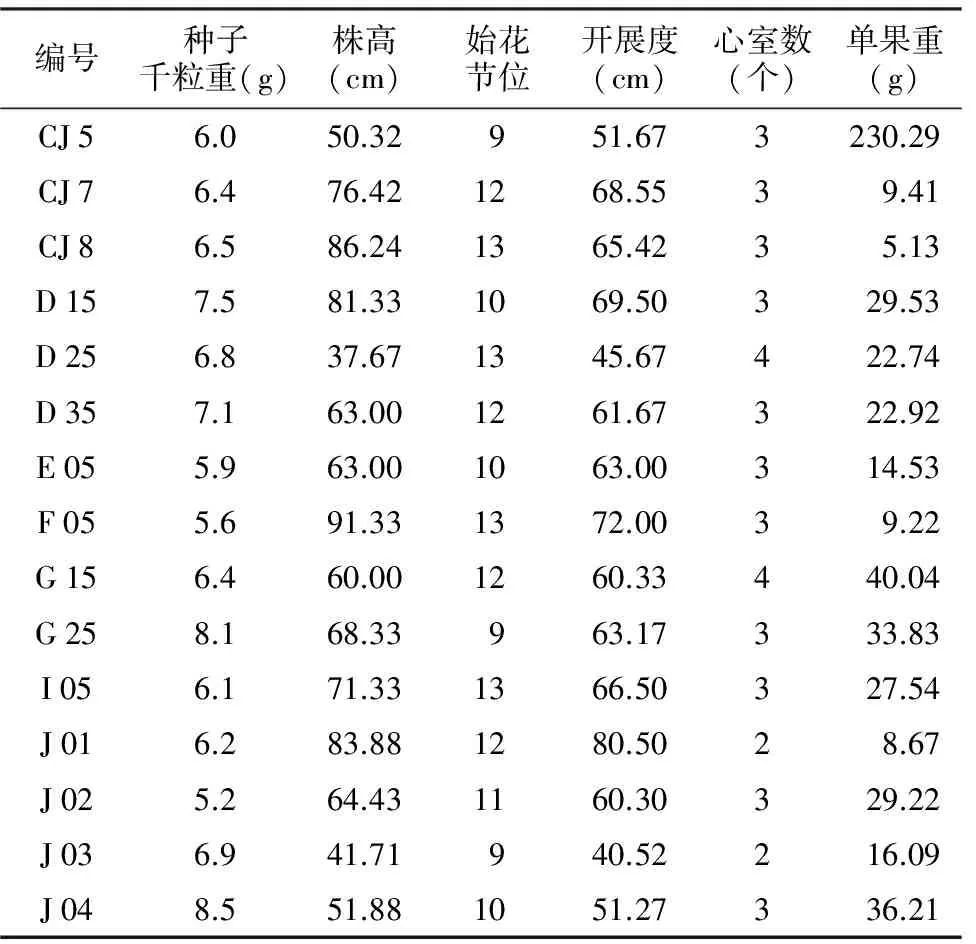
编号种子千粒重(g)株高(cm)始花节位开展度(cm)心室数(个)单果重(g)CJ56.050.32951.673230.29CJ76.476.421268.5539.41CJ86.586.241365.4235.13D157.581.331069.50329.53D256.837.671345.67422.74D357.163.001261.67322.92E055.963.001063.00314.53F055.691.331372.0039.22G156.460.001260.33440.04G258.168.33963.17333.83I056.171.331366.50327.54J016.283.881280.5028.67J025.264.431160.30329.22J036.941.71940.52216.09J048.551.881051.27336.21
注:株高和开展度为定植后35 d的株高和开展度。
接种前,取保存的菌丝转接至PDA上置于温度为28~30 ℃的人工气候箱培养,5~7 d后菌丝长满培养皿,接着用毛笔蘸取无菌水压盖菌丝,使菌丝湿润并贴在培养基上,再次放入人工气候箱光照培养,1~2 d后用无菌水将孢子囊洗脱并收集孢子囊悬浮液,将得到的悬浮液在4 ℃下放置1 h后常温下放置0.5 h,使孢子囊破裂释放游动孢子,之后用双层纱布过滤3次获得孢子悬浮液,用血球计数板测定游动孢子的浓度,用无菌水调整浓度为2×104游动孢子/mL作为接种液。
1.2.2 育苗及疫霉菌接种
供试的辣椒砧木种子经过温汤浸种消毒,催芽后采用72孔穴盘育苗,待幼苗长至3~4片真叶时移栽至10 cm×10 cm的塑料杯内,置于人工气候培养箱内继续生长,待长到8~10叶期参照郑小波[8]的伤根灌根法进行接种,接种量为3 mL/株,每个编号接种30株,3次重复。接种后置于(26±2)℃的人工气候箱培养,每天光照14 h/黑暗10 h,光照强度7 000 lx。接种后每7 d调查植株发病情况,观察记录发病情况,参照易图勇等[1]辣椒疫病灌根接种法分级标准:0级,无任何症状;1级,幼苗茎基部微有变黑,叶片不萎蔫或可恢复性萎蔫;2级,幼苗茎基部变黑达1~2 cm,叶片不可恢复性萎蔫,下部少量叶片脱落;3级,幼苗茎基部变黑超过2 cm,叶片明显萎蔫或落叶明显;4级,幼苗根茎部变黑、溢缩,除生长点外全部叶片脱落或整株萎蔫;5级,整株植株枯死。每次调查记录后计算发病率和病情指数,至病情稳定。发病率(%)=发病株数/接种株数×100%;病情指数(DI)(%)= ∑[(病级×该病级株数)/(最高病级×接种株数)]×100%。病情指数(DI)判定抗性水平:免疫(I):DI=0、高抗(HR):0lt;DI ≤10、抗病(R):10lt;DI ≤30、中抗(MR):30lt;DI≤50、感病(S):DIgt;50。
1.3 统计分析
以接种后28 d的病情指数作为抗性表型数据,参照赵曾菁[9]的统计分析方法,用SSP等软件进行数据处理,用Griffing法进行方差分析,计算一般配合力和特殊配合力,分析抗病性遗传规律。
2 结果与分析
2.1 辣椒砧木种质及F1代对疫病的抗性表型
2.1.1 辣椒砧木种质对疫病的抗性表型
供试辣椒砧木种质植株在人工控制环境的条件下,发病率在41.7%~100.0%之间,病情指数在35.83%~100.00%之间(表2),说明不同砧木种质对疫病的抗性差异大,供试的15份种质中编号D 15、G 15、J 04的病情指数分别为43.33%、48.00%、35.83%,对疫病抗性表现为中抗水平(MR),占供试种质数的20.00%,其余种质病情指数为59.33%~100.00%,均表现为感病(S),发病率最低为41.7%,最高为100.0%,其中J 03和ck发病率及病情指数均为100%。由此可见,供试的大部分种质资源对疫病表现感病。
2.1.2 辣椒砧木种质 F1代对疫病的抗性表型
5份辣椒砧木种质双列杂交得到的20个F1组合中,2个中抗疫病种质(D 1、G 1)正反交的2个组合(D 15×G 15、G 15×D 15)表现中抗水平,病情指数分别为33.33%和38.33%,占杂交组合数的10.0%;其余杂交组合均表现感病,其中7个组合的病情指数和发病率均为100%(表3)。表现中抗水平的2个组合的发病率和病情指数比亲本低,其他感病组合中,有1个组合(D 35×G 25)的发病率和病情指数均比亲本低,有8个组合的发病率和病情指数均比亲本高,有9个组合的发病率与病情指数在双亲之间,有1个组合的发病率高于亲本,病情指数在双亲之间。 以上结果说明不同抗感亲本杂交F1代的抗病性表现多样性。
表2 辣椒砧木种质资源对疫病的抗性表型
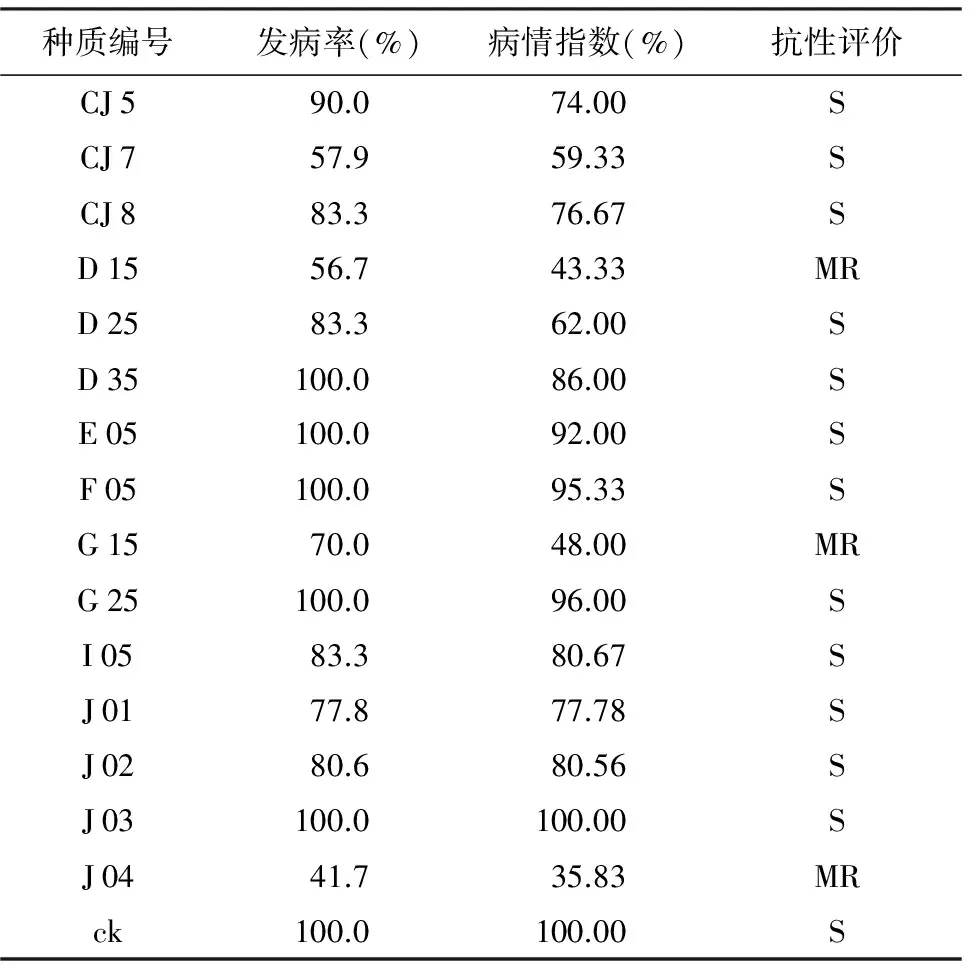
种质编号发病率(%)病情指数(%)抗性评价CJ590.074.00SCJ757.959.33SCJ883.376.67SD1556.743.33MRD2583.362.00SD35100.086.00SE05100.092.00SF05100.095.33SG1570.048.00MRG25100.096.00SI0583.380.67SJ0177.877.78SJ0280.680.56SJ03100.0100.00SJ0441.735.83MRck100.0100.00S
表3 辣椒砧木种质F1代对疫病的抗性表型
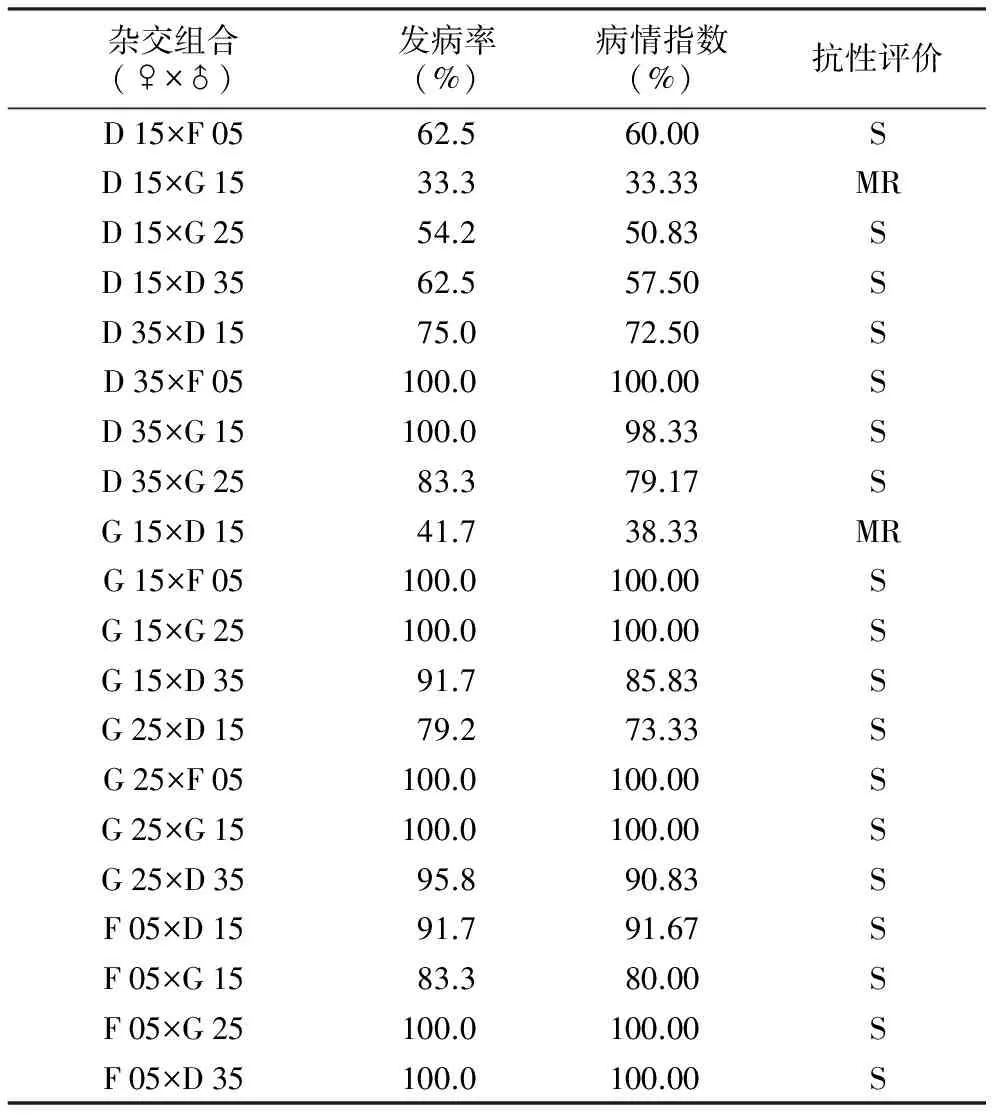
杂交组合(♀×♂)发病率(%)病情指数(%)抗性评价D15×F0562.560.00SD15×G1533.333.33MRD15×G2554.250.83SD15×D3562.557.50SD35×D1575.072.50SD35×F05100.0100.00SD35×G15100.098.33SD35×G2583.379.17SG15×D1541.738.33MRG15×F05100.0100.00SG15×G25100.0100.00SG15×D3591.785.83SG25×D1579.273.33SG25×F05100.0100.00SG25×G15100.0100.00SG25×D3595.890.83SF05×D1591.791.67SF05×G1583.380.00SF05×G25100.0100.00SF05×D35100.0100.00S
表4 辣椒砧木种质F1代疫病病情指数方差分析结果
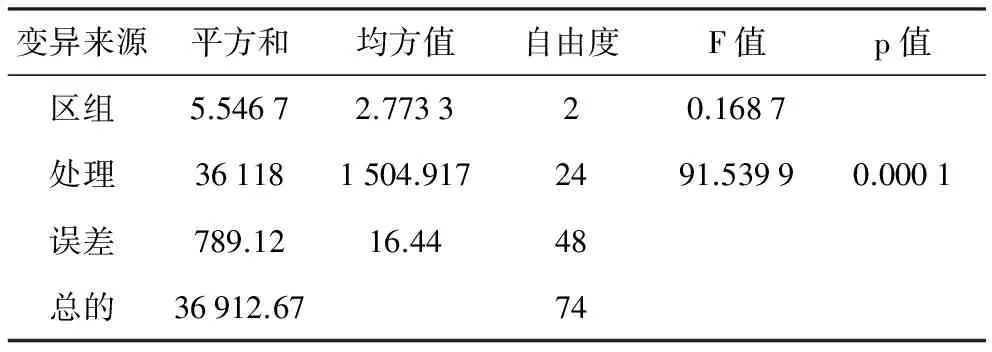
变异来源平方和均方值自由度F值p值区组5.54672.773320.1687处理361181504.9172491.53990.0001误差789.1216.4448总的36912.6774
利用病情指数进行抗病性方差分析结果(表4)表明,F1代组合间抗病差异极显著(plt;0.01)。进一步说明不同抗感亲本杂交的F1组合间抗病性状表现差异大,遗传基础在亲本间存在显著性差异,亲本抗病性状的遗传效应在不同杂交组合中的贡献大小不一。
表6 辣椒砧木种质对辣椒疫病抗性的配合力方差分析
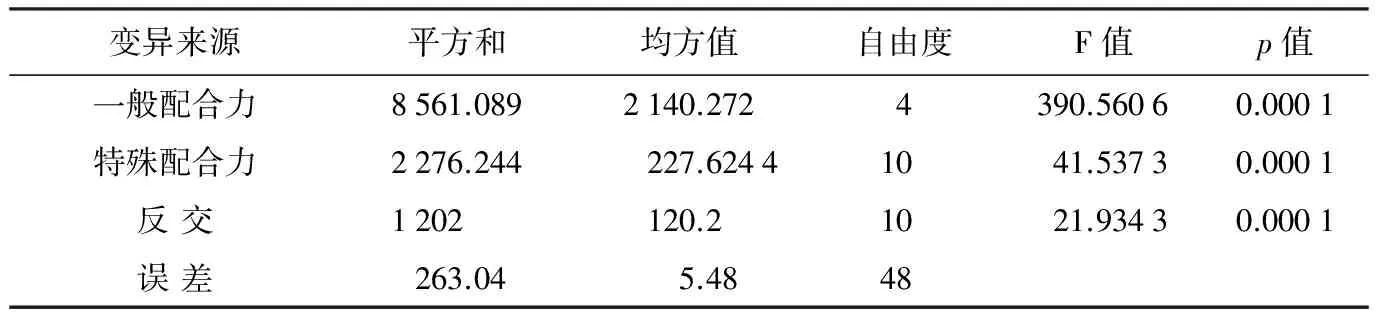
变异来源平方和均方值自由度F值p值一般配合力8561.0892140.2724390.56060.0001特殊配合力2276.244227.62441041.53730.0001反交1202120.21021.93430.0001误差263.045.4848
表7 估计遗传参数

显性方差(VH)加性方差(VD)广义遗传力(h2B%)狭义遗传(h2N%)遗传方差(VC)表型方差(VE)环境方差(VP)132.2288384.645296.9272.12516.8741533.314116.44
2.2 辣椒砧木种质对疫病抗性的杂种优势分析
表5 辣椒砧木种质对疫病抗性的杂种优势
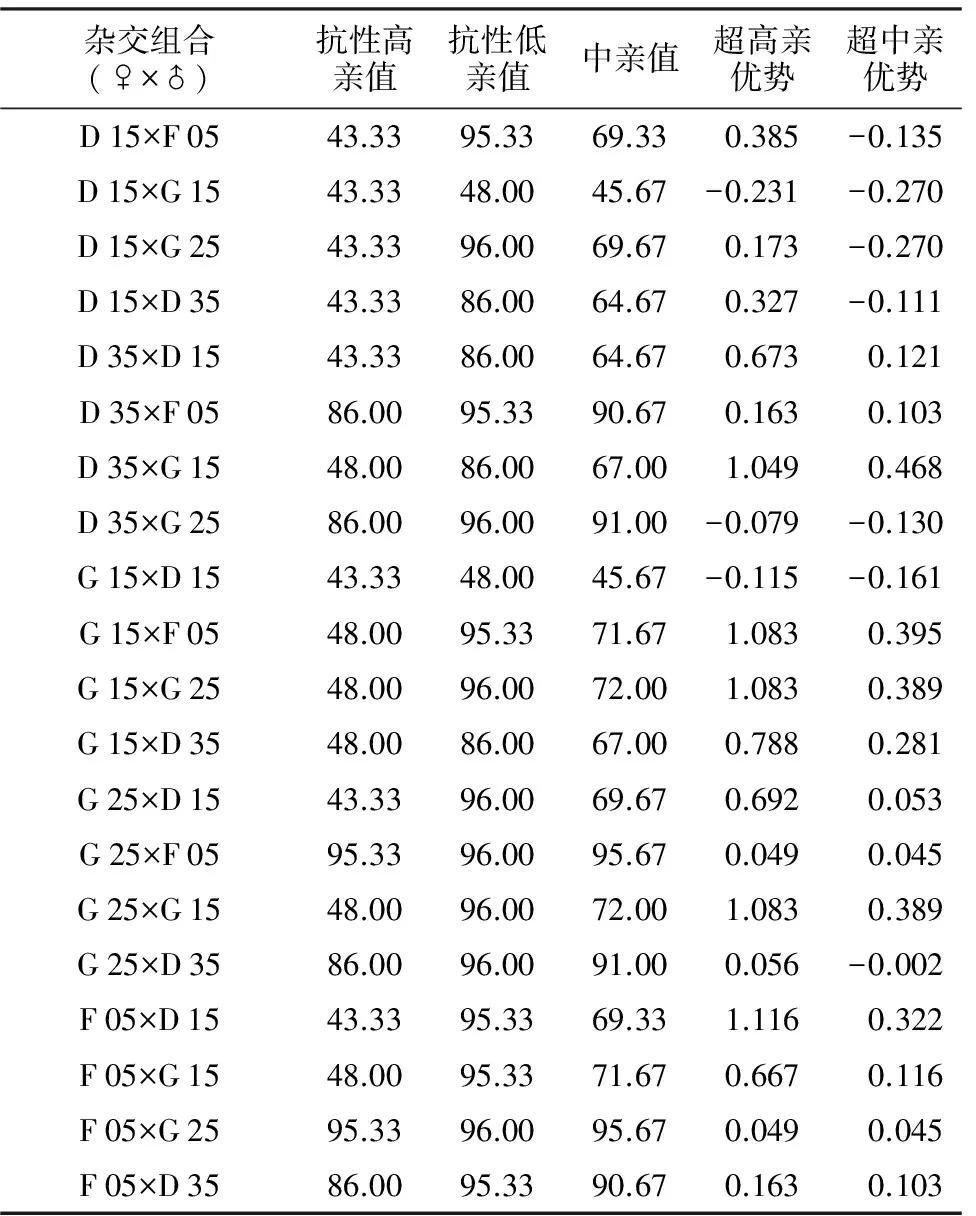
杂交组合(♀×♂)抗性高亲值抗性低亲值中亲值超高亲优势超中亲优势D15×F0543.3395.3369.330.385-0.135D15×G1543.3348.0045.67-0.231-0.270D15×G2543.3396.0069.670.173-0.270D15×D3543.3386.0064.670.327-0.111D35×D1543.3386.0064.670.6730.121D35×F0586.0095.3390.670.1630.103D35×G1548.0086.0067.001.0490.468D35×G2586.0096.0091.00-0.079-0.130G15×D1543.3348.0045.67-0.115-0.161G15×F0548.0095.3371.671.0830.395G15×G2548.0096.0072.001.0830.389G15×D3548.0086.0067.000.7880.281G25×D1543.3396.0069.670.6920.053G25×F0595.3396.0095.670.0490.045G25×G1548.0096.0072.001.0830.389G25×D3586.0096.0091.000.056-0.002F05×D1543.3395.3369.331.1160.322F05×G1548.0095.3371.670.6670.116F05×G2595.3396.0095.670.0490.045F05×D3586.0095.3390.670.1630.103
病情指数越低说明抗病性越强,F1的抗病性表现负向效应的亲本为优[9]。该研究参试的20个杂交组合中,抗病性表现负向超高亲优势的组合有3个(D 15×G 15,G 15×D 15,D 35×G 25),表现杂种优势,占杂交组合数的15.0%;抗病性表现负向超中亲优势的组合有7个(D 15×F 05,D 15×G 15,D 15×G 25,D 15×D 35,D 35×G 25,G 15×D 15,G 25×D 35),表现一定的杂种优势(表5)。以上10个杂交组合中以D 15为亲本的组合占6个。比较不同母本家系,D 15、D 35、G 15家系中各有1个杂交组合表现负向超高亲优势,以D 15为母本的杂交组合均表现负向超中亲优势,说明D 15可作为辣椒抗疫病育种的骨干亲本,且适合作母本。
2.3 辣椒砧木种质对疫病抗性的配合力分析及遗传参数估计
利用Griffing配合力分析方法对亲本和杂交F1组合的病情指数进行配合力方差分析,结果表明一般配合力、特殊配合力达极显著性水平(plt;0.01)(表6),且一般配合力均方值为特殊配合力均方值的3.761倍,说明辣椒砧木种质对疫病的抗性遗传受加性效应和非加性效应的影响,加性效应的作用大于非加性效应,符合“加性-显性-上位性”数量遗传模型。此外,反交的差异也达极显著水平(plt;0.01),说明细胞质基因可能影响辣椒砧木种质对疫病的抗性表达,变现核质互作效应。
根据以上配合力方差分析结果进行遗传参数估算结果(表7)表明,加性方差明显大于显性方差,说明加性效应在辣椒对疫病抗性的基因中起主要作用;环境方差为16.44,说明环境易影响对疫病的抗性表达。此外,广义遗传力、狭义遗传力均较高,分别为96.92%、72.12%,说明亲本抗性水平影响后代的抗性表型,应在较低世代中选择抗性转育。
3 讨论与结论
自Kimble和Grogan[10]在1960年首次发现并报道部分辣椒种质对疫霉菌具有一定抗性以来,国内外学者相继开展抗源筛选工作,结果表明抗疫病辣椒种质并不丰富,很少有高抗种质。王兰兰等[11]对16份辣椒种质进行苗期人工接种鉴定,发现3份种质抗疫病,没有高抗种质。李林等[12]对山东省29份主栽辣椒品种进行了疫病抗性鉴定,仅得到2份抗病品种;何烈干等[13]鉴定了70份辣椒材料对疫病的抗性,获得13份高抗材料;谭清群等[14]对贵州省24个辣椒品种进行疫病抗性鉴定,筛选出高抗品种12个;杨新成等[15]也对20份辣椒材料进行筛选,获得3份高抗材料。辣椒疫霉菌在不同的菌株有多种不同的毒力,某辣椒品种在某地对疫病表现抗病,在另一地点可能表现感病[7]。本研究对来源国内外的15份砧用辣椒种质资源进行了苗期人工接种疫霉菌,鉴定出3份从日本引进的种质表现为中抗水平,占参试种质的20%,丰富了我国抗疫病辣椒种质资源。
本研究结果表明,砧用辣椒种质对疫病的抗性遗传是以加性效应为主的“加性-显性-上位性”遗传模型,受隐性基因控制,且受细胞质影响。陈晓莹[16]在辣椒品系 28-201(C.frutescens)的研究中也发现,抗疫病性状受一个隐性基因控制,而另一品系的抗病性则受单一显性基因控制。目前,从大部分的报道来看,关于辣椒对疫病抗性的研究结果是抗性受多基因控制,为数量遗传性[17-20]。Poehard等[21]采用土壤灌根接种对辣椒品系“PM 217×Yolo Wonder”进行了研究,发现抗疫病性状遗传是受多基因控制的。Lefebvre和Palloix[22]研究认为,辣椒“Perennial”对疫霉菌的抗性遗传也受多基因控制,并且存在上位性效应和加性效应。而张晓芬等[23]对甜椒N 1345抗疫病性状的研究表明,其抗病性状由“加性-显性-上位性”且效应相等的2对主基因控制,且抗病对感病表现为显性,无微效基因作用。
本研究以病情指数作为抗性表型指标,采用Griffing分析方法对疫病抗性的数量遗传特点进行初步探讨,结果表明,砧用辣椒种质亲本的抗性强弱对后代的抗性表现影响作用大,因此抗性转育选择低世代进行较好。本研究筛选出3份辣椒砧木种质和2个F1杂交组合对疫病表现中抗,其中种质D 15可作为辣椒抗疫病育种的骨干亲本,研究结果为合理利用辣椒砧木种质开展抗疫病育种提供了参考。
[1]易图永,张宝玺,谢丙炎,等.辣椒疫病三种接种方法的比较[J].中国蔬菜,2003(2):16-18.
[2]陈斌,张晓芬,杜和善,等.辣椒砧木品种格拉芙特的嫁接栽培技术[J].辣椒杂志,2015(2):20-29.
[3]徐小万,曾莉,曹必好,等.辣椒疫病抗性资源“CM 334”的抗性遗传分析[J].植物保护,2011,37(5):184-186.
[4]李永新,巩振辉,李大伟,等.辣椒疫病抗性相关的共显RGA-STS标记的开发及应用[J].西北农业学报,2011(6):123-127.
[5]李智军,龙卫平,郑锦荣,等.2个辣椒疫病抗性资源的抗性遗传分析[J].华南农业大学学报,2008(29):30-33.
[6]Gilortega R,Palazon EC,Zueco Cuartero J.Genetics of resistance to Phytophthora capsici in the pepper line“SCM 334”[J].Plant Breeding,1991,107:50-55.
[7]巢娟,戴思慧,肖杰.辣椒疫病及其抗病性遗传研究述评[J].作物研究,2014,28(2):221-225.
[8]郑小波.疫霉菌及其研究技术[M].北京:中国农业出版社,1997:10-132.
[9]赵曾菁,牟玉梅,傅慧珍.辣椒砧木种质资源对青枯病抗性的数量遗传初步分析[J].南方农业学报,2015,46(12):2 135-2 139.
[10]Kimble KA,Grogan RG.Resistance to phytophthora root rot in peppers[J].Plant Disease Report,1960,44:872-873.
[11]王兰兰,程鸿.辣椒苗期抗疫病鉴定及抗性机制的研究[J].甘肃农业技术,1996(3):37-39.
[12]李林,齐军山,李长松,等.主要辣椒品种对疫病、根腐病的抗性鉴定[J].山东农业科学,2001(2):29-30.
[13]何烈干,马辉刚,陈学军,等.辣椒种质疫病抗性鉴定及防治药剂的筛选[J].江西农业大学学报,2014,36(5):1 054-1 060.
[14]谭清群,袁洁,杨学辉,等.贵州省辣椒新品种对疫病和青枯病的抗性鉴定研究[J].种子,2014,33(11):82-85.
[15]杨新成,胡明文,李正丽,等.辣椒抗疫病育种材料鉴选[J].贵州农业科学,2011,39(5):131-132.
[16]陈晓莹.辣椒疫病抗性基因的SSR分子标记[D].广州:华南农业大学,2009.
[17]Bartual R,Carbonell EA,MARSAL JI,et al.Gene-action in the resistance of peppers (Capsicum-annuum) to Phytophthora stems blight(PhytophthoracapsiciL.)[J].Euphytica,1991,54:195-200.
[18]Thabuis A,Palloix A,Pxieger S,et al.Comparative mapping of Phytophthora resistance loci in pepper germplasm: evidence for conserved resistance loci across Solanaceae and for a large genetic diversity[J].Theor Appl Genet,2003,106:1 473-1 485.
[19]Kim HJ,Nahm SH,Lee HR,et al.BAC-derived markers converted from RFLP linked to Phytophthora capsici resistance in pepper (CapsicumannuumL.)[J].Theor Appl Genet,2008,118:15-27.
[20]张孝峰.番茄分子遗传图谱的构建及抗灰霉病QTL的定位[D].呼和浩特:内蒙古农业大学硕士论文,2006(5).
[21]Pochard E,Molot PM,Dominguez G,et al.Etude dedeux nouvelles sources de resistance a Phytophthora capsici Leon.chezle piment: confirmation del'existence de trois composantes distinctes dansla resistance[J].Agronomie,1987,3(4):333-342.
[22]Lefebvre V,Palloix A.Both epistatic and additive events of QTL are involved in polygenic induced resistance to disease:a case study,the interaction pepper-Phytophthora capsici Leonian.Theor Appl Genet,1996,93:503-511.
[23]张晓芬,韩华丽,陈斌,等.甜椒育种材料N 1345的疫病抗性遗传分析[J].植物遗传资源学报,2011,12(5):816-819.
(本栏目责任编辑:周介雄)
Resistance Identification and Genetics Analysis For the PhytophthoraBlight in Pepper Rootstock Germplasm
FUHuizhen1,ZHONGChuan1,MOUYumei1,2,YANGYanjuan1,YUWenjin1,WEIHui1,CHENJianhua1
(1.College of Agricultural,Guangxi University,Nanning 530004,China;2.Guizhou Academy of Agricultural,Guiyang 550009,China)
The resistances of pepper materials to phytophthora blight where were from aboard were identified by means of root-irrigating method.After that,five pepper rootstock germplasms with different levels of the resistances to phytophthora blight and stable performance were crossed in a completely diallel cross design.The resistances to phytophthora blight in these F1generations were also identified too.The disease index were used as the resistant quantitative phenotypic index and the Griffing method was used to estimate the quantitative genetic parameters,and analyzed the combining ability and heterosis.The results showed that three pepper rootstock germplasms had mid-resistances to pepper phytophthora blight in the fifteenth pepper rootstock germplasm,while others were susceptible.And two hybrid combinations had mid-resistances,too.What’s more,three showed heterosis in the twenty hybrid combinations.The genetic model of the resistance to the phytophthora blight in pepper was following the additive-dominance- epistasis genetic mode and the additive effect play a leading role.The resistance to the phytophthora blight in pepper might also influenced by the genes of cytoplasm and had nuclear-cytoplasmic interaction effect.Therefore,three parental rootstock gemplasms and two hybridizations which were mid-resistance to phytophthora blight were selecting out in the research.The rootstock gemplasm D 15 can be used as the backbone parent in the breeding for the pepper rootstocks with high resistance to the phytophthora blight.Objective to provide reference for rational utilization of pepper rootstock germplasm for resistance to phytophthora blight.
pepper rootstock; phytophthora blight; resistance identification; heterosis; genetics analysis
2017-01-24
广西科学研究与技术开发计划项目(桂科合10100019-10,桂科合14123001-11)。
傅慧珍(1990—),女,广西合浦人;在读硕士研究生,主要从事辣椒砧木抗病性育种研究;E-mail:1259069513@qq.com。
钟 川,助理研究员,主要从事园艺植物遗传育种及抗性机制研究工作;E-mail:825964063@qq.com。
10.16590/j.cnki.1001-4705.2017.06.045
S 641.3
A
1001-4705(2017)06-0045-05

