羌活种子浸提液对3种作物种子萌发及幼苗生长的化感作用
, , , , ,
(1.四川师范大学生命科学学院, 成都 610101; 2.成都大学药学与生物工程学院, 成都 610106;3.四川金土地中药材种植集团有限公司, 成都 611130)
羌活种子浸提液对3种作物种子萌发及幼苗生长的化感作用
何诗虹1,王跃华2,张韵诗2,彭世明3,何新友2,刘洪明2
(1.四川师范大学生命科学学院, 成都 610101; 2.成都大学药学与生物工程学院, 成都 610106;3.四川金土地中药材种植集团有限公司, 成都 611130)
[目的]探讨提高羌活种子快速萌发的最佳方法。[方法]通过室内生物测定法,研究在不同温度下提取羌活种子浸提液,并配制成不同浓度处理小白菜、黑麦和芹菜3种作物种子,以观察其对3种作物种子的萌发和幼苗生长的化感作用。[结果]实验结果表明,在35 ℃条件下提取的羌活种子浸提液对3种作物种子萌发及幼苗生长各指标的抑制作用最强,其次为25 ℃,而15 ℃最弱;对3种作物的萌发率、发芽势、根长、地下鲜重的测定结果均显示,随着浸提液浓度的增加其抑制作用显著增强;对苗高和地上鲜重2个指标的研究发现,小白菜和芹菜幼苗的生长随浸提液浓度升高,呈现出“低促高抑”的现象。另外,3种作物幼苗根系的SOD酶及小白菜和黑麦的POD酶活性都随浸提液浓度的增加表现为持续增高,而芹菜根系POD酶活性却呈“先升后降”趋势。[结论]:适宜温度下浸泡羌活种子有助于减少羌活种子的化感物质,提高萌发率,低浓度有促进小白菜和芹菜幼苗生长的作用,而较高浓度对3种作物幼苗具有一定的损伤作用。
羌活种子; 化感; 黑麦; 小白菜; 芹菜; SOD; POD
羌活(NotopterygiumincisumTing ex H.T.Chang)为伞形科植物羌活的干燥根茎和根,作为传统中药材,用于风寒感冒,头痛等病症[1]。由于羌活药效好,市场需求量增大,人们开始大量采挖野生羌活,使得自然界中的野生羌活急剧减少,目前,羌活已被列入国家三级濒危保护植物。在自然条件下,羌活种子萌发率低,仅为0.52%[2]。因此,深入研究影响羌活种子萌发率的原因就显得十分重要。
化感作用指一些植物通过向周边环境中释放化学物质以影响周围和自身植物的种子萌发、生长发育和次生代谢产物的产生[3-4]。超氧化物歧化酶(SOD)和过氧化物酶(POD) 是植物细胞中防御活性氧自由基毒害的保护酶系统,维持植物体内活性氧自由基代谢的动态平衡[5]。本研究通过分析羌活种子不同浸提液对黑麦、小白菜和芹菜种子的萌发、幼苗生长及根生长的SOD酶和POD酶活性的影响,以探讨羌活种子快速萌发的最佳方法。
1 材 料
1.1 供试材料
羌活种子于2015年9月份采集于红原种植基地。
1.2 受试材料
黑麦草、小白菜和芹菜购买于成都市龙泉驿大面镇种子市场。
1.3 试验仪器及试剂
1.3.1 仪 器
恒温振荡培养箱(THZ-98 A),上海一恒科技有限公司;酶标仪(Spectra Max M 2),美国Molecular Devices公司;冷冻高速离心机(J-25)Beckman coulter. Inc;电子天平;Denver Instrument T-203,北京赛多利斯系统仪器有限公司。
1.3.2 试 剂
核黄素、甲硫氨酸、NBT、愈创木酚、30% H2O2、EDTA-Na2、NaH2PO3、Na2HPO3。
2 方 法
2.1 羌活种子水浸提液制备
选取9月份采集后于室内阴干的羌活种子粉碎后过5号筛,分别取3份羌活种子粉末50 g于3个500 mL锥形瓶中,并加入适量蒸馏水密封,再分别置于15,25 ℃和35 ℃恒温摇床中振荡48 h后过滤,将滤液置于500 mL容量瓶中用蒸馏水定容,并配制成100 g/L的母液,然后将母液分别稀释成80,60,40,20 g/L 4个质量浓度的浸提液,置于4 ℃冰箱保存备用。
2.2 种子萌发及幼苗生长实验
实验所用的黑麦、小白菜和芹菜种子用0.01% HgCl2表面消毒10 min,无菌水反复冲洗3~5次。选取50粒大小饱满相同的种子,放在铺有2层滤纸的灭菌培养皿中,分别加入羌活种子浸提液浓度为20,40,60,80 g/L和100 g/L各15 mL,以蒸馏水作空白对照,每处理 3 次重复。将培养皿置于室内,在室温下培养。每天观察和记录种子发芽数,按需补充相同量的浸提液及蒸馏水。于培养第7天统计黑麦和小白菜种子的发芽率,第14天统计芹菜种子的发芽率,并完成3种作物幼苗生长情况的各指标测定。
2.3 指标测定方法及数据处理
2.3.1 种子发芽指标测定
黑麦和小白菜种子选择在培养第4天统计发芽势,第7天统计发芽率;芹菜在播种第10天统计发芽势,第14天统计发芽率。
发芽势(%)=发芽种子数达到最高峰时萌发的种子数/播种种子总数×100%;
发芽率(%)=发芽终止时全部正常发芽的种子数/播种种子总数×100%。
2.3.2 生长指标测定
每皿随机选择15株幼苗,测其苗高和根长,计算平均值。
将作物幼苗按地上部分和地下部分分开称取鲜重。
2.3.3 化感指数计算
参照Williamson等[6]的方法进行化感作用评价,即采用化感效应指数(RI,简称化感指数)评估化感作用强度。
RI=1-C/T(T≥C),RI=T/C-1(Tlt;C),其中C为对照值,T为处理值。RIgt;0表示为促进作用,RIlt;0表示为抑制作用,RI的绝对值代表化感作用的强度。
2.3.4 超氧化物歧化酶(SOD)活性和过氧化物酶(POD)活性的测定
超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)光化还原法;过氧化物酶(POD)活性测定采用愈创木酚法[7]。
表1 羌活种子15 ℃浸提液对3种作物种子萌发及幼苗生长的影响
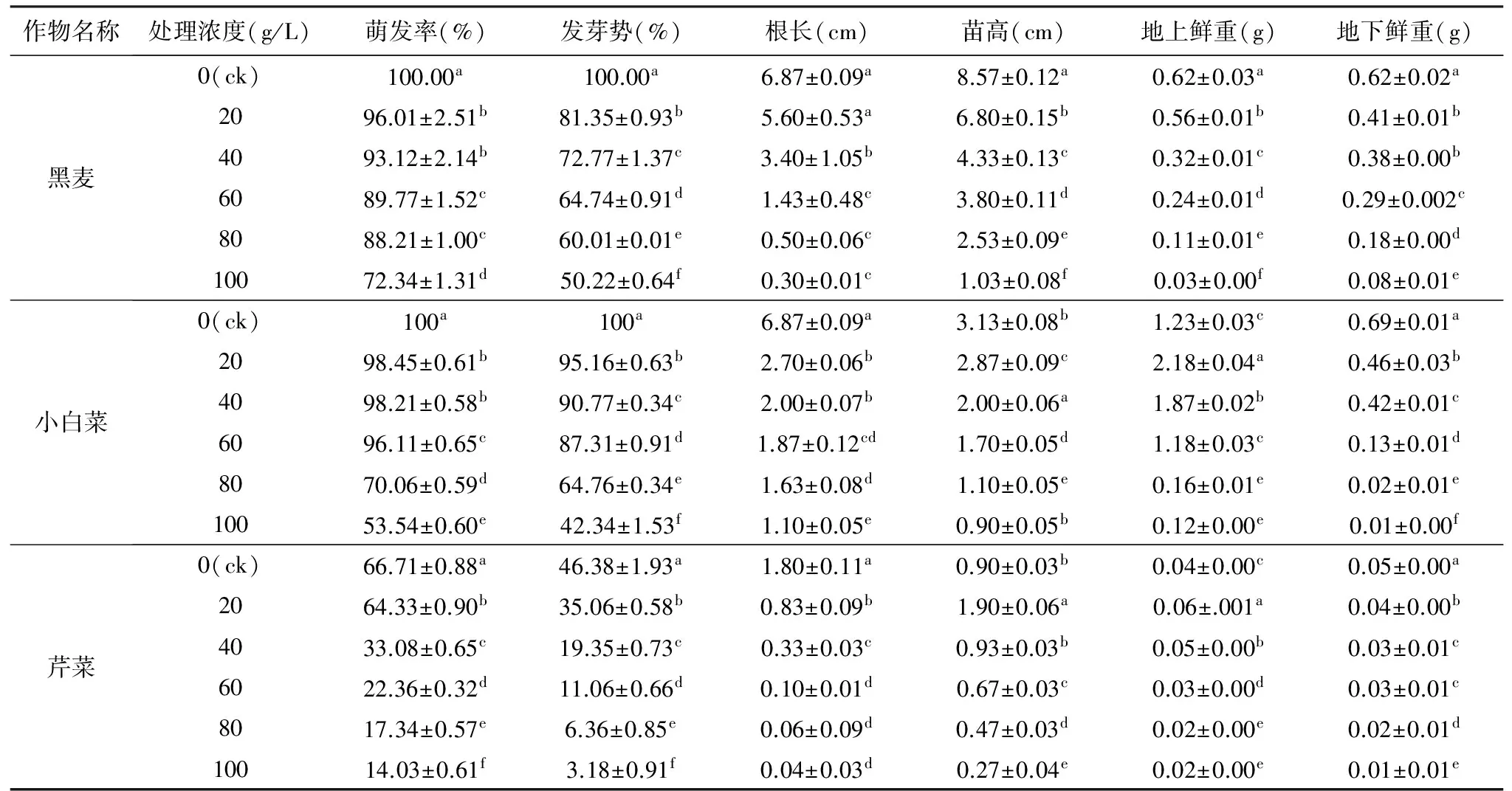
作物名称处理浓度(g/L)萌发率(%)发芽势(%)根长(cm)苗高(cm)地上鲜重(g)地下鲜重(g)黑麦0(ck)100.00a100.00a6.87±0.09a8.57±0.12a0.62±0.03a0.62±0.02a2096.01±2.51b81.35±0.93b5.60±0.53a6.80±0.15b0.56±0.01b0.41±0.01b4093.12±2.14b72.77±1.37c3.40±1.05b4.33±0.13c0.32±0.01c0.38±0.00b6089.77±1.52c64.74±0.91d1.43±0.48c3.80±0.11d0.24±0.01d0.29±0.002c8088.21±1.00c60.01±0.01e0.50±0.06c2.53±0.09e0.11±0.01e0.18±0.00d10072.34±1.31d50.22±0.64f0.30±0.01c1.03±0.08f0.03±0.00f0.08±0.01e小白菜0(ck)100a100a6.87±0.09a3.13±0.08b1.23±0.03c0.69±0.01a2098.45±0.61b95.16±0.63b2.70±0.06b2.87±0.09c2.18±0.04a0.46±0.03b4098.21±0.58b90.77±0.34c2.00±0.07b2.00±0.06a1.87±0.02b0.42±0.01c6096.11±0.65c87.31±0.91d1.87±0.12cd1.70±0.05d1.18±0.03c0.13±0.01d8070.06±0.59d64.76±0.34e1.63±0.08d1.10±0.05e0.16±0.01e0.02±0.01e10053.54±0.60e42.34±1.53f1.10±0.05e0.90±0.05b0.12±0.00e0.01±0.00f芹菜0(ck)66.71±0.88a46.38±1.93a1.80±0.11a0.90±0.03b0.04±0.00c0.05±0.00a2064.33±0.90b35.06±0.58b0.83±0.09b1.90±0.06a0.06±.001a0.04±0.00b4033.08±0.65c19.35±0.73c0.33±0.03c0.93±0.03b0.05±0.00b0.03±0.01c6022.36±0.32d11.06±0.66d0.10±0.01d0.67±0.03c0.03±0.00d0.03±0.01c8017.34±0.57e6.36±0.85e0.06±0.09d0.47±0.03d0.02±0.00e0.02±0.01d10014.03±0.61f3.18±0.91f0.04±0.03d0.27±0.04e0.02±0.00e0.01±0.01e
注:同列数据中字母不同表示plt;0.05差异显著。下同。
2.3.5 数据处理
实验数据用Excel 2003处理,用SPSS 17.0软件对其进行DUNCANa统计检验。
3 结果与分析
3.1 不同温度下羌活种子浸提液对3种作物种子萌发及幼苗生长的影响
3.1.1 在15 ℃下羌活种子浸提液对3种作物种子萌发及幼苗生长的影响
由表1可知,15 ℃下羌活种子浸提液对3种作物种子的萌发率、发芽势、幼苗根长、地下鲜重表现出较强的抑制作用,小白菜和芹菜的苗高及地上鲜重在浓度为20 g/L和40 g/L处理下高于对照组,当浓度≥60 g/L时低于对照组,表现为“低促高抑”的现象,说明化感物质在低浓度时有促进作物生长的作用。黑麦种子萌发率各浓度与对照组之间差异显著,但在浓度为20 g/L和40 g/L之间,以及60 g/L和80 g/L之间时差异不显著,这说明在浸提液浓度变化不明显时对作物各指标抑制作用也不明显,但随浸提液浓度增加,使得受试种子受到的抑制作用也逐渐增强,故而引起差异性;另外在处理浓度变化下,黑麦其他指标及另外2种作物各指标之间表现出的显著性与不显著性原因同上述黑麦,且同种植株不同器官表现出的化感作用不同,结果表明,15 ℃下的羌活种子浸提液中所含的化感物质量少。
3.1.2 在25 ℃下羌活种子浸提液对3种作物种子萌发及幼苗生长的影响
由表2可知,25 ℃下羌活种子浸提液对3种作物种子的萌发率、发芽势、幼苗根长及地下鲜重表现出较为强烈的抑制作用;小白菜和芹菜的苗高及地上鲜重在浓度为20 g/L时大于对照组,表现为促进作用,在浓度≥40 g/L时,苗高和地上鲜重的值低于对照组,表现为抑制作用;当浓度≥80 g/L时,芹菜的各项指标均为0,这是由随着浸提液浓度增加抑制了芹菜种子萌发导致的;这说明25 ℃下的羌活种子浸提液中的化感物质含量比15 ℃下的多,起到的抑制作用较强。
3.1.3 在35 ℃下羌活种子浸提液对3种作物种子萌发及幼苗生长的影响
由表3可知,35 ℃下羌活种子浸提液对3种作物种子的萌发率、发芽势、幼苗根长、地下鲜重表现出强烈的抑制作用;小白菜和芹菜的苗高及地上鲜重在浓度为20 g/L时只表现出轻微的促进作用。当浓度为100 g/L时,黑麦的各项指标均为0,说明该浓度下的浸提液完全抑制了黑麦种子萌发;当浓度≥80 g/L时,小白菜苗高及地上鲜重为0,这是由该浓度下的浸提液抑制了小白菜地上物质积累导致的;当浓度≥60 g/L时,芹菜的各项指标均为0,这与上述黑麦的情况相似;结果表明,35 ℃下的羌活种子浸提液中含的化感物质含量相比25 ℃下浸提液中的化感物质更多,抑制作用更强,这与曹子林等[8]的结果相似。
表2 羌活种子25 ℃浸提液对3种作物种子萌发及幼苗生长的影响
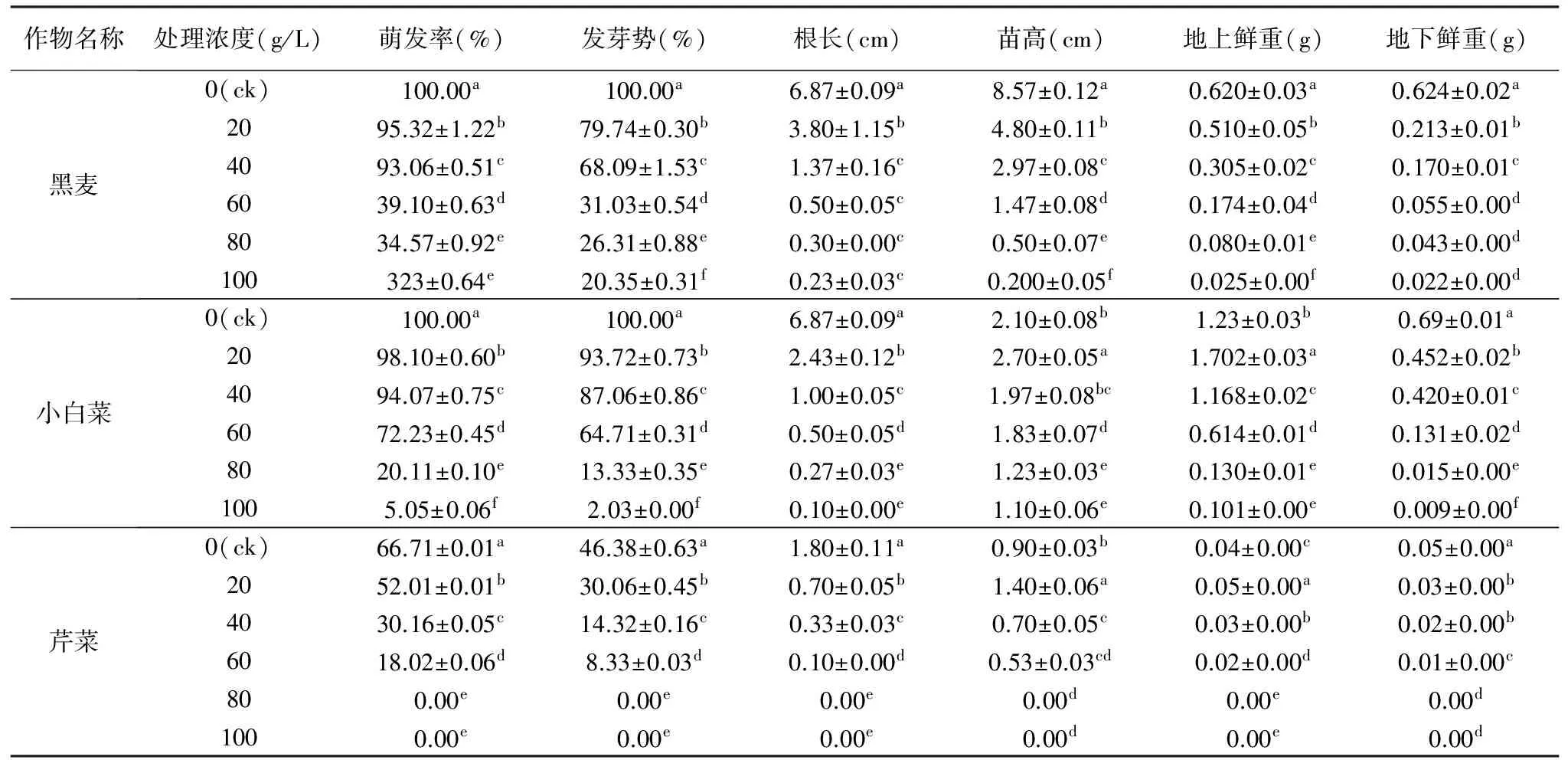
作物名称处理浓度(g/L)萌发率(%)发芽势(%)根长(cm)苗高(cm)地上鲜重(g)地下鲜重(g)黑麦0(ck)100.00a100.00a6.87±0.09a8.57±0.12a0.620±0.03a0.624±0.02a2095.32±1.22b79.74±0.30b3.80±1.15b4.80±0.11b0.510±0.05b0.213±0.01b4093.06±0.51c68.09±1.53c1.37±0.16c2.97±0.08c0.305±0.02c0.170±0.01c6039.10±0.63d31.03±0.54d0.50±0.05c1.47±0.08d0.174±0.04d0.055±0.00d8034.57±0.92e26.31±0.88e0.30±0.00c0.50±0.07e0.080±0.01e0.043±0.00d100323±0.64e20.35±0.31f0.23±0.03c0.200±0.05f0.025±0.00f0.022±0.00d小白菜0(ck)100.00a100.00a6.87±0.09a2.10±0.08b1.23±0.03b0.69±0.01a2098.10±0.60b93.72±0.73b2.43±0.12b2.70±0.05a1.702±0.03a0.452±0.02b4094.07±0.75c87.06±0.86c1.00±0.05c1.97±0.08bc1.168±0.02c0.420±0.01c6072.23±0.45d64.71±0.31d0.50±0.05d1.83±0.07d0.614±0.01d0.131±0.02d8020.11±0.10e13.33±0.35e0.27±0.03e1.23±0.03e0.130±0.01e0.015±0.00e1005.05±0.06f2.03±0.00f0.10±0.00e1.10±0.06e0.101±0.00e0.009±0.00f芹菜0(ck)66.71±0.01a46.38±0.63a1.80±0.11a0.90±0.03b0.04±0.00c0.05±0.00a2052.01±0.01b30.06±0.45b0.70±0.05b1.40±0.06a0.05±0.00a0.03±0.00b4030.16±0.05c14.32±0.16c0.33±0.03c0.70±0.05c0.03±0.00b0.02±0.00b6018.02±0.06d8.33±0.03d0.10±0.00d0.53±0.03cd0.02±0.00d0.01±0.00c800.00e0.00e0.00e0.00d0.00e0.00d1000.00e0.00e0.00e0.00d0.00e0.00d
表3 羌活种子35 ℃浸提液对3种作物种子萌发及幼苗生长的影响
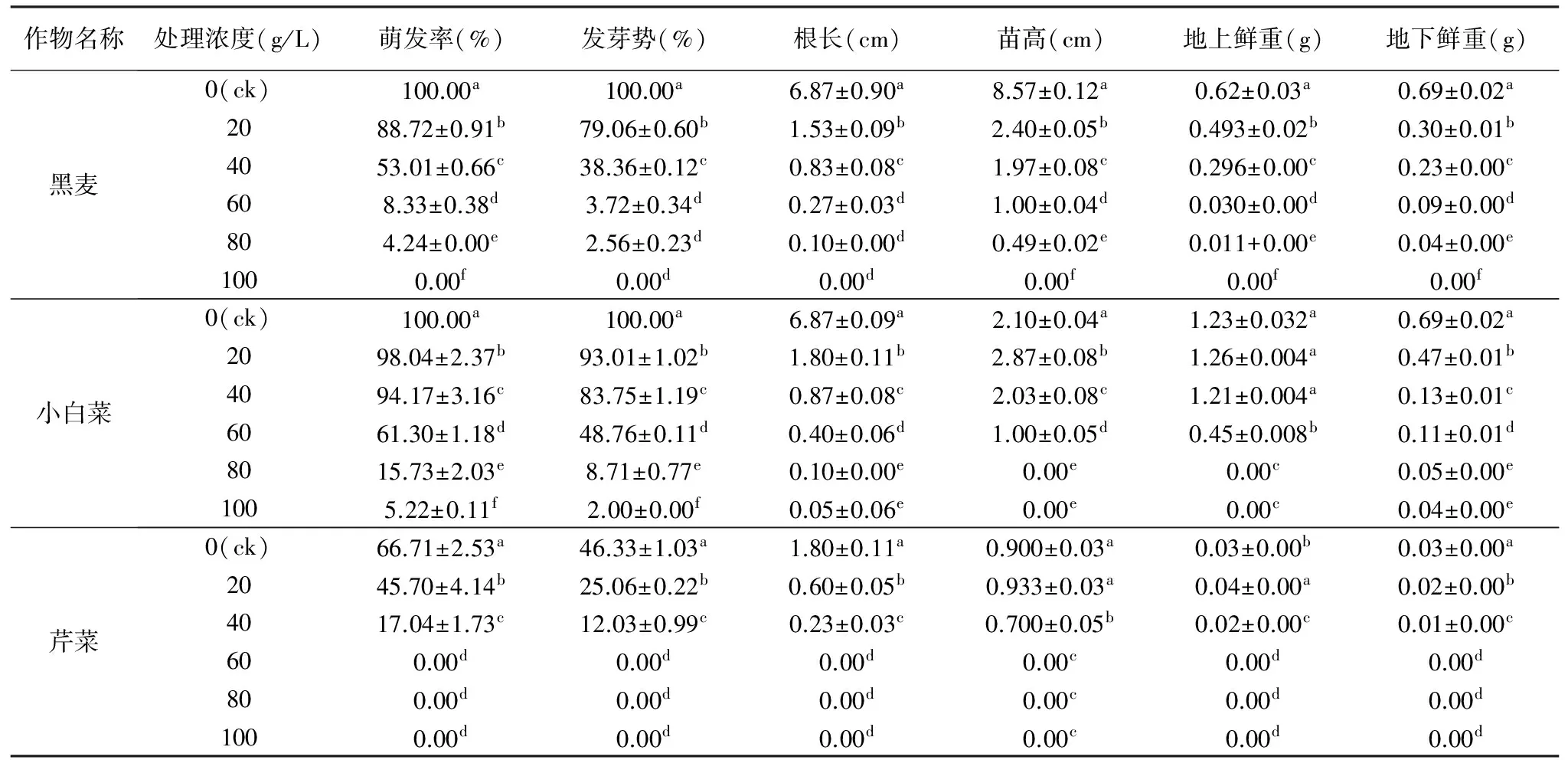
作物名称处理浓度(g/L)萌发率(%)发芽势(%)根长(cm)苗高(cm)地上鲜重(g)地下鲜重(g)黑麦0(ck)100.00a100.00a6.87±0.90a8.57±0.12a0.62±0.03a0.69±0.02a2088.72±0.91b79.06±0.60b1.53±0.09b2.40±0.05b0.493±0.02b0.30±0.01b4053.01±0.66c38.36±0.12c0.83±0.08c1.97±0.08c0.296±0.00c0.23±0.00c608.33±0.38d3.72±0.34d0.27±0.03d1.00±0.04d0.030±0.00d0.09±0.00d804.24±0.00e2.56±0.23d0.10±0.00d0.49±0.02e0.011+0.00e0.04±0.00e1000.00f0.00d0.00d0.00f0.00f0.00f小白菜0(ck)100.00a100.00a6.87±0.09a2.10±0.04a1.23±0.032a0.69±0.02a2098.04±2.37b93.01±1.02b1.80±0.11b2.87±0.08b1.26±0.004a0.47±0.01b4094.17±3.16c83.75±1.19c0.87±0.08c2.03±0.08c1.21±0.004a0.13±0.01c6061.30±1.18d48.76±0.11d0.40±0.06d1.00±0.05d0.45±0.008b0.11±0.01d8015.73±2.03e8.71±0.77e0.10±0.00e0.00e0.00c0.05±0.00e1005.22±0.11f2.00±0.00f0.05±0.06e0.00e0.00c0.04±0.00e芹菜0(ck)66.71±2.53a46.33±1.03a1.80±0.11a0.900±0.03a0.03±0.00b0.03±0.00a2045.70±4.14b25.06±0.22b0.60±0.05b0.933±0.03a0.04±0.00a0.02±0.00b4017.04±1.73c12.03±0.99c0.23±0.03c0.700±0.05b0.02±0.00c0.01±0.00c600.00d0.00d0.00d0.00c0.00d0.00d800.00d0.00d0.00d0.00c0.00d0.00d1000.00d0.00d0.00d0.00c0.00d0.00d
3.2 羌活种子浸提液对3种作物化感效应的影响比较
3.2.1 羌活种子浸提液对3种作物种子萌发的化感效应比较
为进一步探讨羌活种子浸提液对3种作物种子萌发和幼苗生长的化感作用影响,重点选取了3种作物的种子萌发率、幼苗的根长和苗高进行深入分析。
从图1可知,羌活种子浸提液对3种作物种子萌发率均表现为抑制作用(RIlt;0)。图1 a中,15 ℃浸提液对黑麦、小白菜及芹菜种子萌发分别在浓度为80,60,20 g/L时抑制作用增加,这说明浸提液对不同作物的化感作用不同;图1 b中,25 ℃浸提液对黑麦和白菜种子萌发均在浓度gt;40 g/L后抑制作用明显增加,芹菜种子在浓度为80 g/L时受抑制作用达到最大(RI=-1);图1 c中,35 ℃浸提液对3种作物的种子萌发抑制作用显著增加,黑麦和芹菜种子分别在浓度为100 g/L和60 g/L时受抑制作用达到最大(RI=-1);结果表明,35 ℃羌活种子浸提液对各种子萌发的抑制作用最强,对芹菜的抑制作用最大。
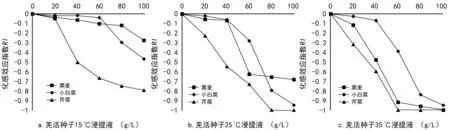
图1 不同温度下羌活种子浸提液对3种作物种子萌发率的化感作用
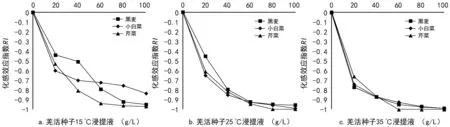
图2 不同温度下羌活种子浸提液对3种作物幼苗根长的化感作用
3.2.2 羌活种子浸提液对3种作物幼苗根长的化感效应比较
从图2可知,羌活种子浸提液对3种作物根长均表现出明显的抑制作用(RIlt;0)。图2 a中,15 ℃浸提液对黑麦幼苗根长在浓度为80 g/L时抑制作用明显,随浓度的增加对芹菜幼苗根长的抑制作用明显强于其它2种作物;图2 b中,25 ℃浸提液对3种作物根长的抑制作用在浓度为60 g/L时明显增强,当浓度为80 g/L时,芹菜幼苗根长受抑制作用达到最大(RI=-1);图2 c中,35 ℃浸提液对3种作物根长的抑制作用在浓度为20 g/L时显著增强,黑麦和芹菜幼苗根长分别在浓度为100 g/L和60 g/L时受抑制作用达到最大(RI=-1);结果表明,35 ℃羌活种子浸提液中含的化感物质最多,抑制幼根的生长作用最大,且浸提液对芹菜幼苗根长的抑制作用强于黑麦和小白菜。
3.2.3 羌活种子浸提液对3种作物幼苗苗高的化感效应比较
从图3可知,羌活种子浸提液对3种作物幼苗苗高随作物不同而出现促进和抑制的现象,其中对黑麦幼苗苗高则一直表现为抑制作用(RIlt;0),这表明不同作物的化感作用不同,这与桂富荣等[9]研究紫茎泽兰化感作用结果相似。图3 a中,15 ℃浸提液对小白菜和芹菜幼苗苗高在浓度为20 g/L和40 g/L时表现为促进作用(RIgt;0),但是对芹菜幼苗苗高在浓度为40 g/L时只有轻微的促进作用;图3 b中,25 ℃浸提液对幼苗苗高的抑制作用逐渐增强,小白菜和芹菜幼苗苗高在浓度为20 g/L时表现为促进作用(RIgt;0),但在浓度≥40 g/L时表现为抑制作用(RIlt;0),且芹菜幼苗苗高在浓度为80 g/L时受到抑制作用达到最大(RI=-1),这是由种子未萌发导致的;图3 c中,35 ℃浸提液对黑麦、小白菜和芹菜幼苗苗高分别在浓度为100,80 g/L和60 g/L时抑制作用达到最大(RI=-1),小白菜和芹菜苗高浓度为20 g/L时仍表现为促进作用(RIgt;0),但促进作用明显降低。结果表明,35 ℃浸提液对各幼苗苗高的抑制作用最强,小白菜和芹菜幼苗苗高在浸提液处理下,表现出“低促高抑”的现象。
3.3 不同温度下羌活种子水浸提液对3种作物幼根酶活性的影响
3.3.1 不同温度下的羌活种子浸提液对3种作物幼根的SOD酶活性的影响
为进一步探明羌活种子浸提液中的化感物质对3种作物幼根的影响;本实验测定了各幼根的SOD酶活性,由图4可知,3种作物幼根的SOD酶活性都随着羌活种子浸提液浓度的增加而上升。图4 a中,15 ℃浸提液中浓度为100 g/L时,各幼根的SOD酶活性明显增大,这是因为在高浓度下,幼根受到的抑制作用增大,SOD在岐化超氧物阴离子自由基生成过氧化氢和分子氧时保护了细胞免受氧化损伤,这与勾晓华等[10]的研究结果类似;图4 b,25 ℃浸提液中浓度≥60 g/L时,各幼根SOD酶活性上升趋势明显增大,但芹菜在浓度≥80 g/L后无法测得SOD酶活性;图4 c,35 ℃浸提液中,芹菜在浓度≥60 g/L时,黑麦在浓度为100 g/L时也无法测得SOD酶活性数据,这是因为,随着浸提液浓度的增加化感物质物抑制了种子的萌发,甚至导致种子发生霉变腐烂。
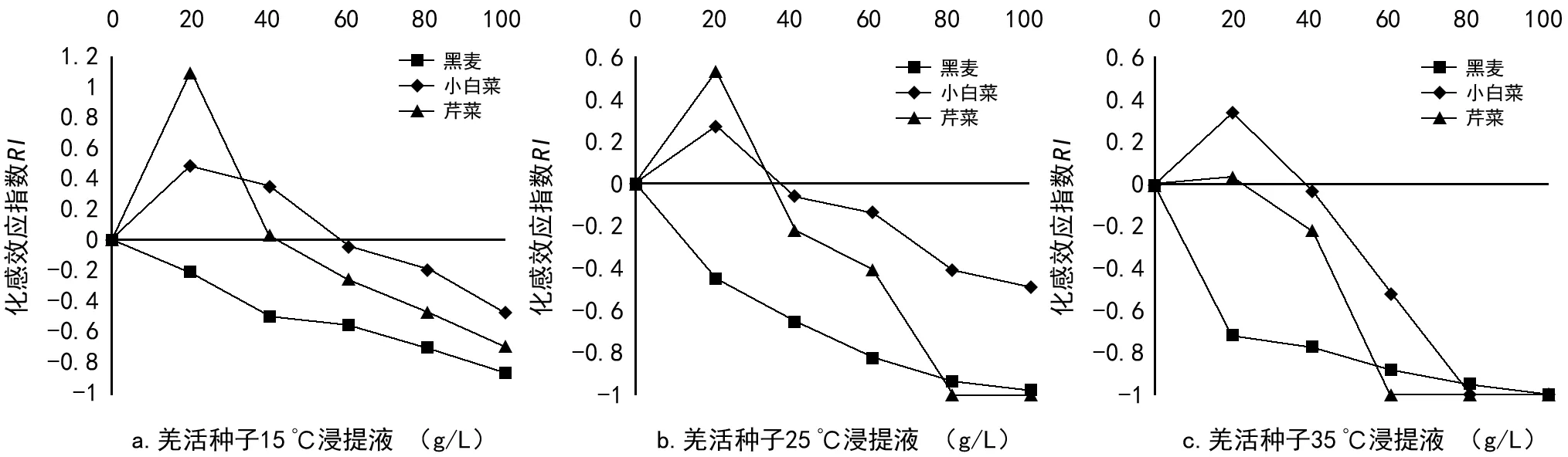
图3 不同温度下羌活种子浸提液对3种作物幼苗苗高的化感作用
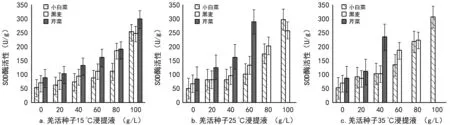
图4 不同羌活种子浸提液对3种作物幼根SOD酶活性的影响
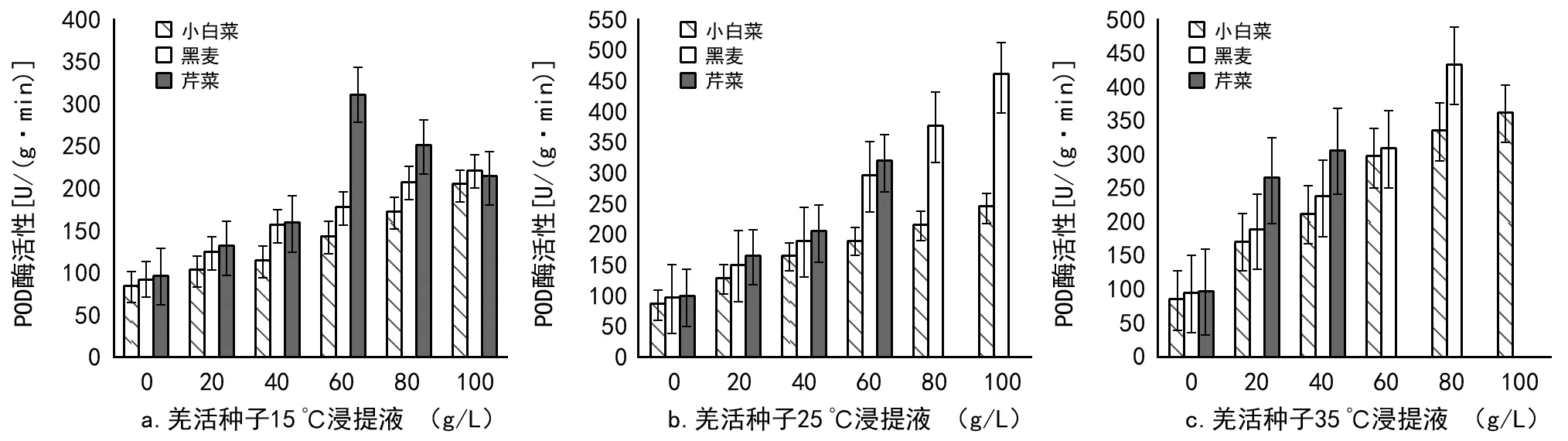
图5 不同羌活种子浸提液对3种作物幼根的POD酶活性的影响
3.3.2 不同温度下的羌活种子浸提液对3种作物幼根的POD酶活性的影响
为进一步说明羌活种子浸提液对3种作物幼根的生长影响,本实验还测定了各幼根POD酶活性。由图5可知,随作物及浸提液浓度不同,各幼根POD酶活性表现各异。图5 a,15 ℃浸提液中,当浓度lt;80 g/L后,芹菜幼根代谢受到影响,POD酶活性升高;当浓度gt;80 g/L后,其POD酶活性下降,这是由于高浓度时芹菜根受到的危害增大,使得POD无法修复造成的[11]。图5 b,3种作物幼根POD酶活性均明显升高,说明25 ℃浸提液中的化感物质对幼根产生了较强的损伤作用;图5 c,3种作物幼根POD酶活性显著升高,这说明35 ℃浸提液中的化感物质对幼根产生了强烈的损伤作用;此外,图5 b和图5 c中黑麦和芹菜幼根POD酶活性缺失的数据,原因同图4 b和图4 c中缺失的数据。
4 结论与讨论
4.1 结 论
化感物质是经自然途径进入环境的化学物质,在自然条件下,水是唯一的能够将植物体中的化感物质溶解出来的溶剂[12]。因此本研究用水作为溶剂,以受试种子萌发、幼苗生长及幼根酶活性为指标进行实验,结果表明,浸提液温度对3种作物种子萌发及幼苗生长各指标抑制强度表现为35 ℃时对作物种子萌发及幼苗生长的抑制作用最强,25 ℃次之,15 ℃表现最弱,且随着浓度的增加抑制作用增强。
小白菜和芹菜的苗高和地上鲜重在浸提液作用下,表现出“低促高抑”的现象。3种作物幼根的SOD随着羌活种子浸提液浓度的增加幼根受损作用增大,酶活性上升;黑麦和小白菜幼根的POD酶活性也随着浸提液浓度的增加而上升,而芹菜幼根的POD酶活性在15 ℃浸提液处理下呈“先升后降”的现象。
通过以上实验结果可知,提取温度和处理浓度是化感物质含量多少的主要影响因素。因此采用本实验中的35 ℃摇床蒸馏水浸种48 h,有利于溶解更多的羌活种子本身所含的抑制物,且稀释倍数越大,化感物质含量越少,这在生产实践中有助于减少羌活种子本身所含的抑制物。
4.2 讨 论
在目前的研究中,羌活种子萌发一直是生产实践中急需克服的难题。通过对3种作物种子萌发率、根长和苗高的RI值对比,本研究还发现化感效应对同种植株不同器官也存在差异,其中化感物质对胚根的抑制强度最大。
本研究结果证明,羌活种子浸提液中含有一定的化感物质。李彩琴等[13]研究表明,宽叶羌活种子自身存在较强的内源物质,但并未探讨是何种物质,而张恩和等[14]研究表明,羌活种子繁殖低的一个内在原因是存在内源抑制物ABA(脱落酸)。但通过本实验,笔者发现羌活种子浸提液散发独特的气味,推断含有羌活种子挥发油,且实验用羌活种子粉末过5号筛,故在摇床提取浸提液时挥发油会更多的溶解在水中。同时甄润德等[15]认为,细叶亚菊挥发油对垂穗披碱草种子的萌发率、株高、根长都有不同程度的抑制作用,表明挥发油对作物种子的萌发及生长存在抑制作用。此外,张桂芝等[16]通过GC-MS分析羌活挥发油成分得知,该挥发油主要包括α-蒎烯,β-蒎烯等,而主要成分α-蒎烯能够做抗氧化剂,在空气中自动氧化聚合变稠,正由于这样,其氧化后可能引起本实验培养皿中的浸提液变稠,使浸提液腐败至种子腐烂。本实验过程中,处理组虽定期补加或更换浸提液,但相比对照组而言,培养皿中的浸提液仍有变稠的情况,且浸提液提取温度越高,浓度越大,培养皿中浸提液变稠的情况越厉害,所以推测,α-蒎烯可能是直接影响羌活种子浸提液,间接影响作物种子萌发及阻碍幼苗生长的主要物质。但羌活挥发油中所含的其他物质是否与α-蒎烯共同作用,对细胞膜产生损伤,可采用MTT法体外抗肿瘤实验进行研究验证。另外,浸提液中可能还有其他物质与挥发油共同作用,也还有待继续研究。最终研究结果以便能在生产实践中更好地达到去除抑制物,提高羌活种子萌发率。
[1]《中华人民共和国药典》(一部)[M].北京:中国医药科技出版社,2010.
[2]方子森,陈小莉,张恩和.野生羌活的生态环境与驯化栽培[J].中草药,2004,35(9):1 071-1 073.
[3]Alsaadawi I S.Allelopathic inlfuence of decomposing wheat residues in agroecosy-stems[J].J Crop Prod,2001,4:185-196.
[4]Oussama Oueslati.Allelopathy in two durum wheat (TriticumdurumL.) varieties[J].Agriculture,Ecosystems and Environment,2002.
[5]张红,王进闯.麻疯树(Jatrophacurcas)叶浸提液对万寿菊(TageteserectaL.)幼苗生长和抗氧化酶活性的影响(英文)[J].Agricultural Science amp; Technology,2011,39(33):20 404-20 406.
[6]Willamson G B,Richarddson D R.Bioassay for allelopathy:measuring treat response with independent controls[J].J Chem Ecol,1998,14(1):181.
[7]刘萍,李明军.植物生理学实验技术(21世纪生物学基础课系列实验教材)[M].北京:科学出版社,2007.
[8]曹子林,王晓丽,王林.蓝桉枝叶不同温度水提液的化感作用[J].西北林学院学报,2012,27(1):142-146.
[9]桂富荣,蒋智林,金吉斌,等.紫茎泽兰化感作用对9种草本植物种子萌发的影响[J].生物安全学报,2011(4):331-336.
[10]勾晓华,王勋陵.氟化氢对植物叶片中SOD酶活力和MDA含量的影响[J].西北植物学报,1995(5):71-76.
[11]韦美玉,陈世军.紫茎泽兰叶片对2种辣椒幼苗POD、SOD及抗坏血酸代谢的化感效应[J].安徽农业科学,2009,37(25):11 937-11 938.
(转下页)
(接上页)
[12]王欣然,彭晓邦,蔡靖,等.杜仲叶水提液对3种作物的化感效应研究[J].西北林学院学报,2010,25(4):157-160.
[13]李彩琴,陈垣,郭凤霞.宽叶羌活种子浸提液对白菜种子萌发及幼苗生长的抑制活性[J].甘肃农业大学学报,2008(5):84-86.
[14]张恩和,陈小莉,方子森,等.野生羌活种子休眠机理及破除休眠技术研究[J].草地学报,2007,15(6):509-514.
[15]甄润德,张树源,白雪芳,等.细叶亚菊挥发油中抑制垂穗披碱草化合物的分离与鉴定[J].植物生理学报,1996,22(3):311-314.
[16]张桂芝,朱佳丽,孟庆华.羌活饮片挥发油化学成分GC-MS数字化指纹图谱研究[J].中成药,2011(12):2 034-2 037.
Allelopathy ofNotopterygiumSeed Extracts on Three Kinds of CropSeeds Germination and Seedling Growth
HEShihong1,WANGYuehua2,ZHANGYunshi2,PENGShiming3,HEXinyou2,LIUHongming2
(1.College of Life Science,Sichuan Normal University,Chengdu 610101,China;2.College of Pharmacy and Biological Engineering,Chengdu University,Chengdu 610106,China;3.Sichuan Jintudi Cultivation of Chinese Herbal Medicines Group co.,Ltd,Chengdu 611130,China)
[Objective]To explore the best way to improve the rapid germination ofNotopterygiumseeds.[Method] By means of bioassay in laboratory,usingNotopterygiumseeds extracts under the different temperature,and formulated into different concentration to treat withBrassicachinensisL.,rye and celery three kinds of crop seeds,to observe allelopathy of the three kinds of crop seeds germination and seedlings growth.[Result]The experimental results show that,under the condition of 35 ℃ to extract the extracts ofNotopterygiumseeds on three kinds of crop seeds germination and seedlings growth of each index has the strongest inhibitory,followed by 25 ℃,15 ℃ is the weakest;The germination rate,germination potential,root length and fresh weight underground of the three crops all show that the inhibition effect are significantly increase with the increase of the concentration of the extracts;The two indicators of seedlings height and fresh weight on the ground of theBrassicachinensisL. and celery seedlings show that follow the increase of the concentration of extracts,they present the phenomenon of “low to promote and high to suppress”.In addition,three kinds of crop seedlings roots of SOD enzyme activity and POD enzyme activity ofBrassicachinensisL. and rye both show a continuous increase with the increase of the concentration of the extracts,while POD enzyme activity of the celery roots show First rise and then fall.[Conclusion] Soak theNotopterygiumseeds at a suitable temperature can help to reduce the allelochemicals ofNotopterygiumseeds to promote germination,and low concentration can promote the growth ofBrassicachinensisL. and celery seedlings,while higher concentrations have some damage on three kinds of crop seedlings.
Notopterygiumseeds; allelopathy; rye;BrassicachinensisL.; celery; SOD; POD
2017-02-07
四川省科技支撑计划项目(2015 SZ 0034)。
何诗虹(1990—),女,四川南充人;在读硕士研究生,研究方向:植物生物技术;E-mail:862364068@qq.com。
王跃华(1963—),女,教授,硕士生导师,主要从事药用植物生物技术研究;E-mail:1961689636@qq.com。
10.16590/j.cnki.1001-4705.2017.06.035
S 567
A
1001-4705(2017)06-0035-08

