4种杂草浸提液对柳枝稷种子萌发的化感作用研究
, , 徐凯, , , , ,
(1.吉林省农业科学院, 长春 130124; 2.中国科学院东北地理与农业生态研究所, 吉林 长春 130102)
4种杂草浸提液对柳枝稷种子萌发的化感作用研究
高阳1,安雨2,徐安凯1,王志锋1,王多伽1,任伟1,于洪柱1,栾博宇1
(1.吉林省农业科学院, 长春 130124; 2.中国科学院东北地理与农业生态研究所, 吉林 长春 130102)
采用室内生物测定法,研究不同浓度梯度下白草(Pennisetumflaccidum)、赖草(Leymussecalinus)、硬质早熟禾(Poasphondylodes)和猪毛蒿(Artemisiascoparia)地上部分和根系浸提液对柳枝稷(Panicumvirgatum)种子萌发的化感作用,以期为揭示柳枝稷与本土杂草之间的相互作用机制提供借鉴意义。结果表明:不同浓度的白草、赖草和硬质早熟禾浸提液处理均抑制了柳枝稷的种子萌发和幼苗生长,尤其是对发芽指数、胚芽长度和幼苗生物量的影响较大。同时,地上部分浸提液的抑制作用强于根系。在0.1 g/mL白草、赖草和硬质早熟禾地上部分浸提液处理下,柳枝稷胚芽长分别降低了81.13%、86.42%和90.19%。猪毛蒿浸提液在低浓度下抑制作用较小,甚至提高柳枝稷胚根和胚芽长度,表明其浸提液中某些化感物质起到促进作用。4种杂草浸提液在0.1 g/mL浓度下的综合化感效应值分别高达-5.89,-6.17,-5.17和-6.15。综上所述,不同杂草对柳枝稷的影响存在明显差异,生产实践中要根据不同物种和密度采取相应防治措施,以保证柳枝稷良好生长。
杂草浸提液; 柳枝稷; 发芽指数; 幼苗生物量
柳枝稷(Panicumvirgatum)属多年生禾本科牧草,表现出较强的水土保持功能[1]。另外,柳枝稷是一种优良的生物能源植物,源产于北美,在多数地区和国家均可种植[2]。柳枝稷营养丰富、产量高,可用作饲草生产;根系发达,具有较高的液态气体值和较低的含灰量和残渣,可以通过发酵、气化和燃烧等工艺获得较高的能量产出,是理想的生物燃料和生产能源材料。早在20世纪90年代,美国能源部已经将柳枝稷作为新型生物能源开展大量研究并投入生产[3]。随着柳枝稷水土保持、优质牧草、新型生物质能源等方面的研究开展,柳枝稷在国内外的种植面积也得到进一步扩大[2-4],柳枝稷的田间管理及其相关研究工作需进一步加强。
田间杂草是作物生长和草地培育的主要危害之一。通常认为, 田间杂草以其生长迅速的特点占领空间,与种植作物争夺阳光、水分和养分而取得生长优势[5]。除资源竞争外, 杂草还可以通过释放、分泌化感物质直接或间接地抑制作物的生长[6]。研究表明,反枝苋(Amaranthusretroflexus)、一年蓬(Erigeronannuus)、猪殃殃(Galiumaparine)、阿拉伯婆婆纳(Veronicapersica)、藿香蓟(Ageratumconyzoides)等杂草产生的化感物质能够抑制或促进小麦(Triticumaestivum)、玉米(Zeamays)、油菜(Brassicanapus)等作物生长[7-10]。其中部分杂草还可以对紫花苜蓿(Medicagosativa)、早熟禾(Poaannua)、苇状羊茅(Festucaarundinacea)和多年生黑麦草(Loliumperenne)等牧草产生化感作用[10-12],而杂草对柳枝稷的化感作用尚未可知。
在柳枝稷的生长过程中,尤其是建植初期,容易受到田间杂草的危害, 严重影响其生长发育。在前期的工作中,笔者调查了西北半干旱地区柳枝稷行间杂草生长情况,分析了杂草与柳枝稷的资源竞争作用[13]。本试验根据上述调查结果,选择白草(Pennisetumflaccidum)、赖草(Leymussecalinus)、硬质早熟禾(Poasphondylodes)和猪毛蒿(Artemisiascoparia)4种伴生杂草为供体材料,采用室内生物测定法,研究上述杂草植株浸提液对柳枝稷种子萌发和幼苗生长的化感作用, 以期揭示杂草与柳枝稷的相互作用关系, 为柳枝稷草地的建植和田间管理提供科学依据。
1 材料与方法
1.1 试验材料
白草、赖草、硬质早熟禾和猪毛蒿的植株采自陕西省榆林市定边县农业示范园内,柳枝稷品种Illinois USA来源于日本宇都宫大学杂草科学中心一前宣正教授。
1.2 试验方法
1.2.1 样品制备
于8月份植物生长后期,采集白草、赖草、硬质早熟禾和猪毛蒿植株地上部及根系,自来水冲洗干净,放置低温冰箱(-34 ℃)24 h ,低温冻干,粉碎,过100目筛,备用。
1.2.2 浸提液的制备
分别称取白草、赖草、硬质早熟禾和猪毛蒿地上部和根系粉碎样品10 g,加蒸馏水100 mL置超声波清洗器震荡30 min后过滤, 滤液即为0.1 g/mL浸提液。将0.1 g/mL浸提液稀释5倍和20倍,得到浓度分别为0.02 g/mL和0.005 g/mL的浸提液。
1.2.3 种子表面消毒
选取成熟饱满的受体种子为试材,置于1%的NaClO溶液中消毒1 min,再将其置于75%的酒精溶液消毒3 min,无菌水冲洗4~5次,超净工作台内晾干备用。
1.2.4 生物测定试验
在培养皿中放置2层经高温灭菌的滤纸,均匀放置20 粒受体种子,随后加入3 mL浸提液,其中对照处理加入3 mL 蒸馏水,每处理设3次重复。将培养皿置于25 ℃的恒温培养箱中,72 h后统计胚根长、胚芽长和发芽率。
1.3 数据处理
依据Leather和Einhellig[14]培养皿滤纸法进行生物测定, 受体植物的发芽率和发芽指数按以下公式计算:
发芽率(%)=G/N×100%
……(1)
发芽指数=∑Gt/Dt
……(2)
式中,G为发芽的受体种子,N为受体种子总数;Gt为每次观察的发芽数,Dt是第t次观察的天数。
化感指数RI按照Williamson和Richardson[15]的化感作用评价方法计算:当T≥C时,化感指数RI=1-C/T;当T
表1 不同杂草浸提液处理下柳枝稷发芽率和发芽指数

供体植物浓度(g/mL) 发芽率(%) 发芽指数 地上部浸提液根系浸提液地上部浸提液根系浸提液白草P.flaccidum0.00546.67±9.0752.33±6.815.76±1.24∗∗5.59±0.81∗∗0.0237.00±0.01∗49.67±5.775.08±0.57∗∗5.48±0.80∗∗0.132.33±4.04∗41.33±5.13∗3.36±0.92∗∗4.20±0.51∗∗赖草L.secalinus0.00545.00±2.8352.33±8.085.14±0.64∗∗5.74±0.50∗∗0.0244.33±5.1349.67±5.775.46±1.14∗∗5.07±0.55∗∗0.123.00±3.52∗47.00±5.00∗1.62±0.14∗∗5.08±0.56∗∗硬质早熟禾P.sphondylodes0.00546.67±13.5045.67±2.31∗5.53±0.76∗∗4.55±0.51∗∗0.0243.33±8.5048.00±1.734.76±0.64∗∗5.42±0.86∗∗0.140.00±3.00∗47.00±0.00∗3.43±0.54∗∗7.23±0.61∗∗猪毛蒿A.scoparia0.00559.00±19.0552.33±4.0411.20±0.3111.00±1.270.0248.67±5.0444.33±8.08∗9.39±0.17∗9.54±1.13∗0.130.00±4.23∗42.33±5.03∗1.95±0.20∗∗5.96±0.22∗∗对照(ck)61.00±13.1161.00±13.1112.44±1.4712.44±1.47
注:“*”表示p<0.05水平下与对照差异显著,**表示p<0.01水平下与对照差异显著。下同。
采用SPPS 18.0软件对试验数据进行统计分析,采用单因素方差分析不同处理间的差异显著性,多重比较采用最小显著差异法(LSD)。根据杂草浸提液对柳枝稷萌发和幼苗生长的综合化感效应对杂草种类进行聚类分析,聚类方法采用组间联接系统聚类法。采用Excel 2007制图。
2 结果与分析
2.1 杂草浸提液对柳枝稷种子萌发的影响
随着杂草地上部分浸提液浓度的提高,柳枝稷发芽的抑制作用逐渐增强,柳枝稷发芽率和发芽指数不断降低(表1)。在0.005 g/mL浓度下,4种杂草处理下柳枝稷的发芽率均与对照无显著差异(p>0.05)。随着浓度的升高,柳枝稷发芽率呈下降趋势。0.1 g/mL浓度处理下,各处理的柳枝稷发芽率均低于对照(p<0.05),尤其是赖草地上部分浸提液,其所处理的柳枝稷发芽率较对照降低了60.66%。杂草根系浸提液对柳枝稷发芽率的影响与地上部分相似,随着浓度的升高而抑制作用增强,高浓度下柳枝稷发芽率显著低于对照(p<0.05)(表1)。但白草、赖草和猪毛蒿根系浸提液处理下柳枝稷的发芽率高于相同浓度下相对应的地上部分浸提液,表明根系浸提液的抑制作用明显低于地上部分。而硬质早熟禾根系浸提液处理下柳枝稷的发芽率,与地上部分差异较小。总体而言,杂草根系对柳枝稷发芽率的抑制作用较小,各处理下柳枝稷的发芽率均保持40%以上。
杂草地上部分对柳枝稷发芽指数影响较大,除猪毛蒿外,其他3种杂草处理的发芽指数比对照处理降低了50%以上,差异达到极显著水平(p<0.01)。这表明上述3种杂草地上部分浸提液可以抑制柳枝稷的发芽速率,而猪毛蒿地上部分浸提液在低浓度下抑制作用较弱,高浓度表现出强烈的抑制作用,其处理的柳枝稷发芽指数仅为1.95。杂草根系对柳枝稷的发芽指数抑制作用与相应的地上部分浸提液处理变化规律相似,但高浓度下杂草根系处理的柳枝稷发芽指数略高于地上部分浸提液处理。
2.2 杂草浸提液对柳枝稷胚根长和胚芽长的影响
白草、赖草和硬质早熟禾的地上部分浸提液均极显著降低了柳枝稷的胚根长和胚芽长(表2)(p<0.01)。在上述3种杂草地上部分浸提液0.005 g/mL浓度处理下,柳枝稷胚根长分别降低了27.78%、42.36%和40.28%。随着浓度的增加,对柳枝稷胚根长的抑制作用不断加强,在0.1 g/mL浓度下,柳枝稷胚根长分别降低了44.44%、64.58%和69.44%。而猪毛蒿地上部分浸提液处理时,柳枝稷的胚根长在低浓度下得到极显著提高,达到2.13 cm,而在高浓度下则极显著低于对照处理,这表明猪毛蒿对柳枝稷胚根发育具有较强的化感作用。杂草根系浸提液对柳枝稷胚根长的影响同地上部分浸提液相似,表现为随着浓度增加而加强。猪毛蒿根系浸提液在中、低浓度下对柳枝稷胚根长具有一定促进作用,但影响不显著(p>0.05)。相同浓度下,赖草、硬质早熟禾和猪毛蒿的根系浸提液处理的柳枝稷胚根长要高于地上部分浸提液处理。而白草的则是根系浸提液处理略低于地上部分浸提液处理,表明白草根系对柳枝稷胚根长的影响更大。
杂草浸提液对柳枝稷胚芽发育的影响较大,在0.1 g/mL浓度白草、赖草和硬质早熟禾地上部分浸提液处理下,柳枝稷胚芽长分别降低了81.13%、86.42%和90.19%。但低、中浓度的猪毛蒿地上部分和根系浸提液对柳枝稷胚芽的作用不显著,高浓度下柳枝稷的胚芽长度仅为对照的4.65%和20.75%。
表2 不同杂草浸提液处理下柳枝稷胚根长和胚芽长

供体植物浓度(g/mL) 胚根长(cm) 胚芽长(cm) 地上部浸提液根系浸提液地上部浸提液根系浸提液白草P.flaccidum0.0051.04±0.17∗∗0.84±0.10∗∗0.65±0.09∗∗0.62±0.11∗∗0.020.98±0.13∗∗0.77±0.03∗∗0.72±0.03∗∗0.58±0.06∗∗0.10.80±0.20∗∗0.60±0.08∗∗0.50±0.06∗∗0.42±0.13∗∗赖草L.secalinus0.0050.83±0.03∗∗0.92±0.09∗∗0.66±0.07∗∗0.68±0.05∗∗0.020.87±0.14∗∗0.85±0.09∗∗0.58±0.06∗∗0.51±0.09∗∗0.10.51±0.03∗∗0.73±0.07∗∗0.36±0.06∗∗0.43±0.07∗∗硬质早熟禾P.sphondylodes0.0050.86±0.14∗∗0.89±0.08∗∗0.60±0.07∗∗0.66±0.04∗∗0.020.73±0.17∗∗0.83±0.11∗∗0.57±0.05∗∗0.72±0.04∗∗0.10.44±0.13∗∗0.86±0.07∗∗0.26±0.05∗∗0.62±0.15∗∗猪毛蒿A.scoparia0.0052.13±0.13∗∗1.63±0.142.81±0.372.37±0.340.021.57±0.111.90±0.112.64±0.132.79±0.500.10.26±0.05∗∗0.68±0.05∗∗0.12±0.02∗∗0.55±0.09∗∗对照(ck)1.44±0.191.44±0.192.65±0.252.65±0.25
2.3 杂草浸提液对柳枝稷幼苗生物量的影响
在影响柳枝稷胚根和胚芽长度的同时,杂草地上部分和根系浸提液均能降低柳枝稷幼苗的生物量(图1)。在0.005 g/mL杂草地上部分浸提液处理下,柳枝稷幼苗单株生物量在16.10~21.70 mg之间变化。随着浓度的增加,柳枝稷幼苗单株生物量逐渐降低,在0.02 g/mL和0.1 g/mL浓度下,其变化范围分别为14.20~19.93 mg和8.00~14.90 mg。
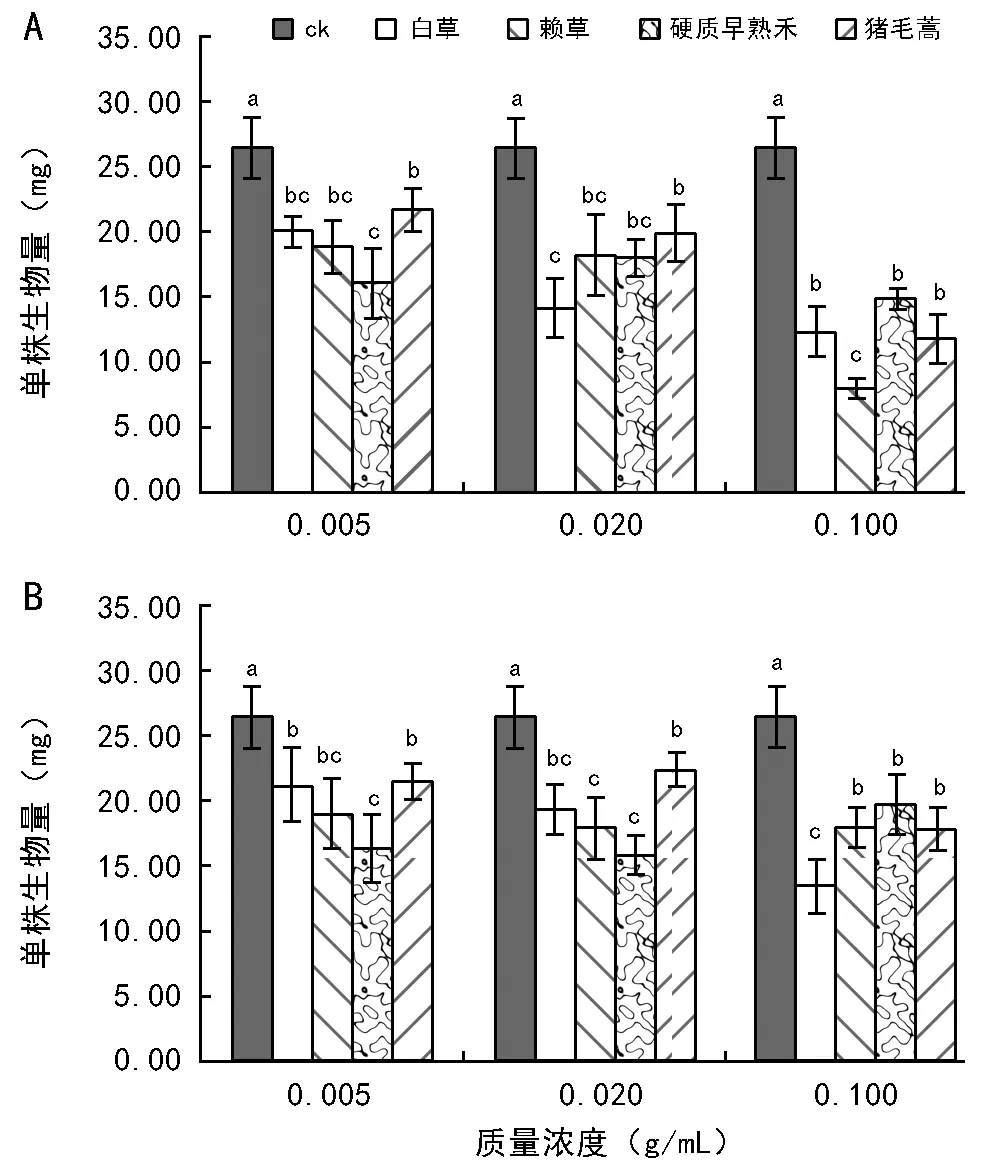
注:图中相同浓度下不同小写字母表示在p<0.05水平下差异显著。图1 不同杂草地上部分(A)和地下部分(B) 浸提液处理下柳枝稷幼苗生物量
根系浸提液对柳枝稷幼苗生物量的影响稍弱,均高于相对应的地上部分浸提液处理。在0.005 g/mL和0.02 g/mL浓度下,硬质早熟禾根系浸提液处理下柳枝稷幼苗生物量最低,分别为16.40 mg和15.87 mg。而0.1 g/mL浓度下,赖草根系浸提液处理下柳枝稷单株生物量最低,为13.50 mg。综合而言,猪毛蒿对柳枝稷幼苗生物量的形成影响略小,而其他3种杂草对柳枝稷幼苗生物量的影响较大。
2.4 杂草浸提液对柳枝稷综合化感作用评价
综合评价结果显示,4种杂草对柳枝稷的萌发和幼苗生长表现出一定的抑制作用,这种抑制作用随浸提液浓度的波动而有所变化(表3)。白草、赖草和猪毛蒿的抑制作用均随着浓度的增加而加强。在0.005 g/mL浓度下,上述3种杂草的综合化感效应分别为-4.13,-4.40和-0.49,而在0.1 g/mL浓度下的综合化感效应分别达到-5.89,-6.17和-6.15。尤其是猪毛蒿,在中、低浓度下综合化感效应值明显低于其他杂草,但其高浓度下的综合化感效应骤然升高,较中、低浓度下分别提高了8.18倍和11.55倍。而硬质早熟禾的综合化感效应值随浸提液浓度变化较小,高浓度仅比低浓度提高了9.30%。通过分析4种杂草对柳枝稷的综合化感效应可以看出,高浓度的杂草抑制作用强烈,进而会影响柳枝稷的正常生长和发育。
表3 4种杂草对柳枝稷综合化感效应值

质量浓度(g/mL)综合化感效应白草赖草硬质早熟禾猪毛蒿0.005-4.13-4.40-4.73-0.490.02-4.76-4.67-4.87-0.670.1-5.89-6.17-5.17-6.15
3 讨论与结论
种子正常萌发是建植草地的重要前提,发芽率的降低必然会影响到牧草的个体数量和生产性能[16]。本研究结果表明,柳枝稷种子的萌发受到杂草浸提液的抑制作用,可能是由于浸提液会降低种子吸胀吸水能力。种子只有充分吸水后其内部储藏的淀粉、蛋白质等物质才能活化,并进行分解和转运,各种酶也是在吸水以后开始发挥作用[17]。高浓度的化感物质又能阻止酶的活化及物质代谢的正常进行,导致种子发芽率降低。同时,柳枝稷发芽指数受抑制的程度明显大于发芽率(表1),发芽指数的降低,将导致发芽时间延长,出苗延后,严重影响柳枝稷对地上和地下资源的竞争能力[18]。因此,高密度的杂草会产生强烈化感效应影响柳枝稷发芽,在田间生产中应采取一定措施保证其顺利出苗。
受体植物对化感作用的响应在幼苗生长期往往比种子萌发期更敏感[14]。在本研究中,白草、赖草、硬质早熟禾对柳枝稷胚根和胚芽长度均表现出抑制作用,尤其对胚根长度的影响最为明显。这是由于牧草种子萌发早期根部生长旺盛,而通常生长最旺盛的部位更易受到胁迫因子的影响[19]。因此,化感作用作为一种胁迫因子,对柳枝稷胚根长度的影响大于其它部位。胚根和胚芽的伸长受到影响,加之发芽率的降低,必然导致幼苗生物量的减少(图1)。然而,猪毛蒿浸提液在低浓度下表现出促进胚根和胚芽长度的作用,这表明其浸提液中某种或某几种化感物质的组合可以起到促进作用。目前,已知猪毛蒿植株体内水溶性化合物包括肉桂酸、阿魏酸、邻羟基苯甲酸、香草酸、龙胆酸、咖啡酸和原儿茶酸等[20]。据报道,低浓度的阿魏酸对棉花等作物的幼苗生长具有促进作用[21]。
本研究中,4种杂草地上部分浸提液对柳枝稷种子萌发和幼苗生长的抑制作用均强于根系,这种结果可能如Turk 等[22]指出的,水溶性植物毒性物质主要来源于植物地上部,通过茎叶淋溶、挥发等方式进行化感表达。化感表达的方式包括:影响激素的合成和利用,影响矿物质吸收、膜的透性和蛋白质的合成,改变受体植物细胞的分裂、伸长和亚显微结构,进而影响受体植物组织生长和发育[23]。同时,杂草的化感作用随着浸提液浓度的提高而逐渐增强,即表现出一定的浓度效应。这种浓度效应可能是由于质量浓度的变化导致化感物质的作用位点发生转移,作用位点与质量浓度之间的关系有待于进一步研究证实。
综上所述,伴生杂草白草、赖草、硬质早熟禾和猪毛蒿对柳枝稷的化感作用在不同草种间、部位间和浓度间存在差异。但在高浓度下4种杂草浸提液对柳枝稷的发芽和幼苗生长均表现出较高的抑制率,在生产实践中应加强杂草管理,预防造成损失。目前,柳枝稷自身的化感作用研究较多,而杂草与柳枝稷间的化感作用研究较为缺乏,对于杂草的化感物质具体成分的研究报道更少,上述问题有待于进一步研究验证。
[1]Nielsen E L.Analysis of variation in Panicum virgatum[J].Journal of Agricultrue Research,1944,69:327-353.
[2]Wolf D D,Fiske D A.Planting and managing switchgrass for forage,wildlife,and conservation.Blacksburg[M].Virginia Polytechnic Institute and State University,1995:1-12.
[3]Kim S,Dale B E.Cumulative energy and global warming impact from the production of biomass for biobased products[J].Journal of Industrial Ecology,2003,7:147-162.
[4]Ma Y Q,An Y,Shui J F,et al.Adaptability evaluation of switchgrass (PanicumvirgatumL.) cultivars on the Loess Plateau of China[J].Plant Science,2011,181:638-643.
[5]郭水良,李扬汉.杂草的基本特点及其在丰富栽培地生物多样性中的作用[J].资源科学,1996(3):48-52.
[6]欧巧明,陈玉梁,马丽荣,等.基于生态位理论的作物——杂草化感作用及其关系探讨[J].草业学报,2010,19(2):235-240.
[7]张燕,慕小倩.外来杂草反枝苋对农作物的化感作用及其风险评价[J].西北植物学报,2008,28(4):771-776.
[8]方芳,茅玮,郭水良.入侵杂草一年蓬的化感作用研究[J].植物研究,2005,25(4):449-452.
[9]何红花,慕小倩,董志刚.杂草猪殃殃对小麦的化感作用[J].西北农业学报,2007,16(5):250-255.
[10]吴海荣,强胜.外来杂草波斯婆婆纳的化感作用研究[J].种子,2008,27(9):67-70.
[11]尹亚丽,李红旭,王俊,等.杂草对紫花苜蓿的化感作用[J].草业科学,2009,26(12):131-135.
[12]韦美玉,陈世军,刘丽萍.入侵杂草对多年生黑麦草种子萌发的化感作用[J].种子,2007,26(11):24-26.
[13]安雨,马永清,税军峰,等.栽培柳枝稷不同生长时期对伴生杂草生物量及密度的影响[J].草地学报,2013,21(4):689-696.
[14]Leather G R,Einhellig F A.Bioassays in the study of allelopathy[A].In:Putnam A R,Tang C S.The science of allelopathy.Wiley:New York,1986:133-145.
[15]Williamson G B,Richardson D.Bioassays for allelopathy:measuring treatment responses with independent controls[J].Journal of chemical ecology,1988,14:181-187.
[16]郑丽,冯玉龙.紫茎泽兰叶片化感作用对10种草本植物种子萌发和幼苗生长的影响[J].生态学报,2005,25(10):2 782-2 787.
[17]宋亮,潘开文,王进闯.化感活性物质影响种子萌发作用机理的研究进展[J].世界科技研究与发展,2006,28(4):52-57.
[18]马瑞君,王明理,赵坤,等.高寒草场优势杂草黄帚橐吾水浸液对牧草的化感作用[J].应用生态学报,2006,17(5):845-850.
[19]曾任森,骆世明.香茅、胜红蓟和三叶鬼针草植物他感作用研究[J].华南农业大学学报,1993,16(4):69-72.
[20]金海洙,金锺熙.猪毛蒿对其他植物生长的他感作用[J].烟台大学学报(自然科学与工程版),2001,14(3):180-184.
[21]王璞,赵秀琴.几种化感物质对棉花种子萌发及幼苗生长的影响[J].中国农业大学学报,2001,6(3):26-31.
[22]Turk M A,Tawaha A M. Inhibitory effect s of aqueous extracts of black mustard on germination and growth of lentil[J].Pakistan Journal of Agronomy,2002,1(1):28-30.
[23]Rice E L.Allelopathy[M].2 nd ed.New York:Academic Press,1984:1-50.
Study on Allelopathy Effect of Four Different Weed Extract on Seed Germination of Switchgrass (Panicumvirgatum)
GAOYang1,ANYu2,XUAnkai1,WANGZhifeng1,WANGDuojia1,RENWei1,YUHongzhu1,LUANBoyu1
(1.Jilin Academy of Agricultural Sciences,Changchun 130124,China; 2.Northeast Institute of Geography and Agroecology,Chinese Academy of Sciences,Changchun Jilin 130102,China)
Experimental bioassay method was adopted to measure allelopathy effects of extract at different concentrations from aerial part and root ofPennisetumflaccidum,Leymussecalinus,PoasphondylodesandArtemisiascopariato seed germination and seedling growth of switchgrass (Panicumvirgatum).The study will provide significant reference to reveal the interaction mechanism between switchgrass and native weeds in the process of cultivation.The results showed thatPennisetumflaccidum,LeymussecalinusandPoasphondylodesextract at different concentrations suppressed germination and seedling growth of swicthgrass, especially for the germination index, coleoptile length and seedling biomass per plant.Their inhibition effects effect of the aerial part was stronger than that of the root.Under the treatment of 0.1 g/mL aerial part extract of the three kinds of weed, the coleoptile length of switchgrass was reduced by 81.13%,86.42% and 81.13% respectively.However,A.scopariaextract showed small inhibition effect at low concentration, and even increased the radicle and coleoptile length of switchgrass,which indicated some promote allelochemicals in the extract. The synthetical effects of the above four kinds of weed extract at the concentration of 0.1 g/mL were -5.89,-6.17,-5.17 and -6.15.To conclude,there were differences among species and concentrations in the allelopathy of associated weeds to switchgrass.Therefore,different prevention measures according to the different species and density should be taken to ensure the growth of switchgrass.
weed extract; switchgrass; germination index; seedling biomass
2017-02-16
国家重点研发计划课题(2016 YFC 0500606);吉林省农业科学院博士后启动基金资助项目;现代农业产业技术体系资助项目(CARS-35-02);公益性行业(农业)科研专项(201303060、201403048-4);国家自然科学基金资助项目(41401102、41601053)。
高 阳(1985—),女,河北容城人;助理研究员,博士,主要从事牧草育种和栽培生态研究工作;E-mail:gaoyang2302@126.com。
徐安凯(1959—),男,吉林蛟河人;研究员,博士,主要从事牧草育种和种质资源研究工作;E-mail:xuankai0167@163.com。
10.16590/j.cnki.1001-4705.2017.08.020
S 543+.9
A
1001-4705(2017)08-0020-06

