咪达唑仑对山羊不同脑区单胺类神经递质影响的研究
高 利, 郭 岑, 李欣然, 朱汉民, 陈宇航, 张思学
(1.东北农业大学动物医学学院 , 黑龙江 哈尔滨 150030; 2.内蒙古扎鲁特旗农牧业局北镇兽医院 , 内蒙古 通辽 028000)
咪达唑仑对山羊不同脑区单胺类神经递质影响的研究
高 利1, 郭 岑1, 李欣然1, 朱汉民1, 陈宇航2, 张思学1
(1.东北农业大学动物医学学院 , 黑龙江 哈尔滨 150030; 2.内蒙古扎鲁特旗农牧业局北镇兽医院 , 内蒙古 通辽 028000)
为了研究咪达唑仑对山羊各脑区单胺类神经递质的影响,探讨咪达唑仑的作用部位及机制。将25只山羊随机分为5组,分别为对照组、诱导组、麻醉组、恢复Ⅰ组和恢复Ⅱ组。连续观察山羊行为学变化,并于相应时间点采取脑组织,通过高效液相色谱(HPLC)法检测5-羟色胺(5-HT)、5-羟吲哚乙酸(5-HIAA)、去甲肾上腺素(NE)和多巴胺(DA)的含量。结果显示,咪达唑仑主要作用部位是大脑和脑干,使5-HT和5-HIAA的含量升高,NE和DA的含量降低。
咪达唑仑 ; 山羊 ; 5-HT ; 5-HIAA ; NE ; DA
咪达唑仑(Midazolam)作为新一代苯二氮卓类药物,临床疗效好,不良反应轻,成为目前发展较快的一类药物,常用作抗焦虑、催眠、镇静[1],在兽医临床多与其他药物合用来增强效果[2-3]。咪达唑仑的治疗效果和副作用是因为对GABAA受体的作用,但咪达唑仑并不直接激活GABAA受体,和其他苯二氮卓类药物一样,它增强了神经递质GABA对GABAA受体的作用,对中枢神经系统产生了抑制效应。5-HT、5-HIAA、DA和NE是机体内重要的单胺类神经递质,在中枢神经系统中起重要作用。反刍动物脑内单胺类神经递质含量的准确测定,对临床诊断和基础生理研究具有重要意义[4]。试验以山羊为研究对象,旨在研究咪达唑仑对山羊不同脑区单胺类神经递质的影响,根据不同脑区内单胺类神经递质在麻醉过程中的变化趋势,探讨咪达唑仑的作用部位及机制,为临床麻醉中合理有效地配伍麻醉药提供参考依据。
1 材料与方法
1.1 试验动物 临床检查健康的山羊25只,体重为12~16 kg,雌雄不限,购自哈尔滨市香坊区某养殖场,严格按照试验动物要求进行饲养管理。
1.2 试验仪器及药品 Waters 600高效液相色谱仪,Waters 2489UV检测器,Waters 2707自动进样器,色谱柱,购自美国Waters公司;5-HT、5-HIAA、NE、DA、色谱级甲醇、色谱级乙腈,均购自Sigma公司;纯度≥98.0%;咪达唑仑,纯度:99.8%,东北农业大学动物医学学院外科教研室提供。
1.3 试验分组 将山羊随机分为5组,即对照组、诱导组、麻醉组、恢复Ⅰ组和恢复Ⅱ组,每组5只。除对照组外的山羊按体重肌肉注射咪达唑仑14 mg/kg体重,对照组山羊按体重肌肉注射生理盐水1.31 mL/kg体重。行为学变化分组标准:诱导期组:站立不稳,倒地,翻正反射即将消失;麻醉期组:将动物腹面朝上放置,给予轻微刺激,动物仍不能翻回者为翻正反射消失;恢复Ⅰ期组:对麻醉后翻正反射消失的动物,给予轻微的刺激,动物即能自主翻回者,为翻正反射恢复;恢复Ⅱ期组:为翻正反射恢复后6 h。该期动物基本苏醒,能够自由走动,并主动饮水和觅食。
1.4 脑组织样品采取 处死山羊后,剪开头皮,同时除去硬脑膜并锯开头盖骨,小心分离出完整的脑组织,用4 ℃生理盐水冲洗,除去附着的血液。在冰板上快速取双侧大脑皮层、小脑、丘脑、脑干和海马,用滤纸吸干水分后放入冻存管中称重,然后-80 ℃冰箱中保存。
1.5 定量方法 采用RP-HPLC外标法测定,数据处理系统可自动计算峰面积或根据具体峰形进行手动积分。根据标准品的峰面积作出标准曲线,将每个待测样品的峰面积的平均值代入标准曲线,即可算出各自的浓度。
1.6 线性范围和相关系数 精密量取单胺混合标准储备液,用提取液分别稀释成2、5、10、50、100、200、500 ng/mL的对照液。取20 μL进样。以吸收峰的峰面积对应含量作线性回归,求得4种递质的回归方程和相关系数。
1.7 加样回收率 取1份已知浓度的丘脑组织匀浆液样品分成3份,分别加入等体积的低、中、高3种浓度单胺类混合标准液,按样品的处理方法制样并测定,所得的峰面积带入到相应的标准曲线回归方程中,得到所测单胺浓度,按下面公式计算各相应浓度的回收率:回收率(%)=测后单胺组织浓度/已知单胺组织浓度×100%。
1.8 精密度 (1)日内差测定:同一浓度水平的混合标准液于1 d内分别进行4次重复进样测定峰面积和变异系数;(2)日间差测定:对同一浓度水平的混合标准液分4 d 4次进样测定峰面积和变异系数。
1.9 最低检测限的测定 取空白样品,按照样品处理程序处理后上机测定。另取多份空白样品,分别加入不同的较低浓度(如0.25、0.5、1、2、5 ng/mL)的单胺混合标准液,按照样品处理程序处理后上机测定,对比两者,即可得出样品中各单胺递质的最低检测限。
1.10 数据分析 用平均值±标准差表示数据。所有结果通过SPSS 19软件数据分析系统做单因素方差分析,Pgt;0.05为差异不显著,Plt;0.05为差异显著。
2 结果
2.1 4种单胺类神经递质分离结果 在规定色谱条件下,4种单胺类神经递质得到有效分离,保留时间为:NE(4.05 min)、DA(6.92 min)、5-HT(11.03 min)、5-HTAA(14.21 min)。各峰无干扰及拖尾现象。所得标准品色谱图及样品色谱图见图1和图2。

图1 单胺类神经递质标准品色谱图

图2 丘脑中单胺类神经递质样品色谱图
2.2 线性范围 按指定色谱条件进样,以峰面积(Y)与标准品浓度(X)进行线性回归,回归方程Y=aX+b。结果表明,4种单胺类神经递质在2-500 ng/mL范围内浓度与峰面积呈线性相关,相关系数R2均达0.99。标准曲线回归方程及相关系数见表1。结果如下。

表1 线性方程和相关系数(R2)
2.3 加样回收率试验结果 回收率是反映从制样到HPLC测量等环节误差大小及间接反映测定准确程度的一个重要指标。由表中数据可知,NE、DA、5-HT和5-HTAA的平均回收率分别为94.73%、96.24%、100.23%和95.40%。结果表明,采用本试验的样品处理方法,回收率高且稳定,色谱条件可靠,符合试验要求。
2.4 最低检测浓度 以引起3倍基线噪音的含量为最低检测限,4种单胺类神经递质NE、DA、5-HT、5-HIAA的最低检测限分别是2 ng/mL、5 ng/mL、5 ng/mL和5 ng/mL。
2.5 精密度试验结果 结果表明,NE、DA、5-HT和5-HIAA 4种单胺类神经递质日内差变异系数分别为3.2%、3.5%、2.8%和3.7%;日间差变异系数分别为3.5%、3.1%、2.7%和3.8%。变异系数均在4.0%以下,表明该检测方法稳定、重现性良好。

表2 加样回收率结果
2.6 咪达唑仑对山羊不同脑区5-HT的影响 如表3所示,山羊肌肉注射咪达唑仑后麻醉组大脑和脑干内5-HT含量均显著升高,与对照组比较分别升高了42.55%(Plt;0.01)和46.58%(Plt;0.01);在恢复Ⅰ期和恢复Ⅱ期时,大脑和脑干内5-HT含量均显著恢复,同时与麻醉期比较差异显著或极显著(Plt;0.05或Plt;0.01)。其他脑区内5-HT含量无显著变化。

表3 咪达唑仑对山羊不同脑区5-HT的影响 (n=5,ng/mL)
注:a **:与对照组比较Plt;0.01, 差异极显著; *:与对照组比较Plt;0.05,差异显著;b ##:与麻醉期比较Plt;0.01,差异极显著; #:与对照组比较Plt;0.05,差异显著,下表同
2.7 咪达唑仑对山羊不同脑区5-HIAA的影响 如表4所示,山羊肌肉注射咪达唑仑后麻醉组大脑和脑干内5-HIAA含量均显著升高,与对照组比较分别升高了37.19%(Plt;0.01)和51.73%(Plt;0.01);在恢复Ⅰ期和恢复Ⅱ期时,大脑和脑干内的5-HIAA含量均显著恢复,同时与麻醉期比较差异显著或极显著(Plt;0.05或Plt;0.01)。其他脑区内5-HIAA含量无显著变化。
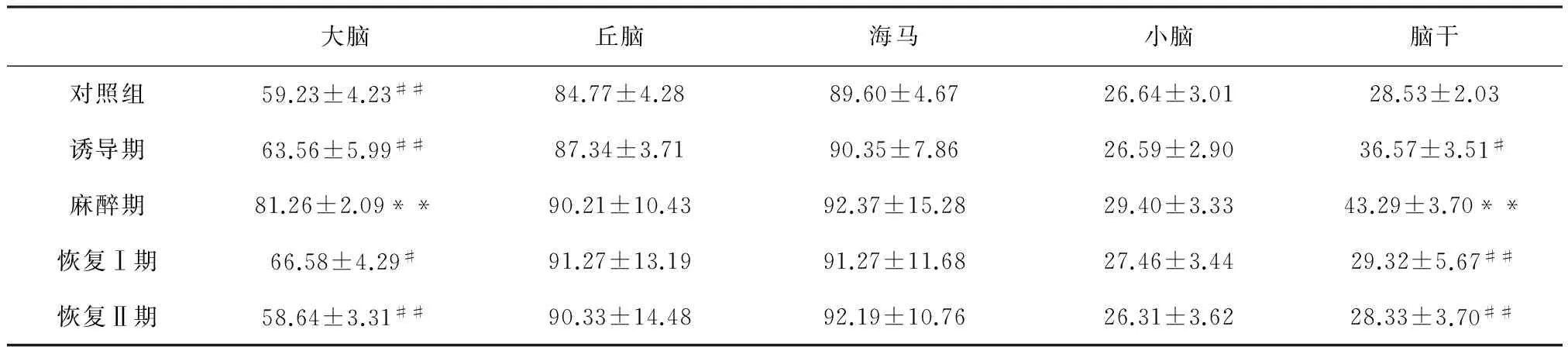
表4 咪达唑仑对山羊不同脑区5-HIAA的影响 (n=5,ng/mL)
2.8 咪达唑仑对山羊不同脑区NE的影响 如表5所示,山羊肌肉注射咪达唑仑后,麻醉组大脑和脑干内NE含量均显著降低,与对照组比较分别降低了37.71%(Plt;0.01)和31.92%(Plt;0.01);在恢复Ⅰ期和恢复Ⅱ期时,大脑和脑干内NE的含量均显著恢复,同时与麻醉组比较差异极显著(Plt;0.01)。其他脑区内NE含量无显著变化。
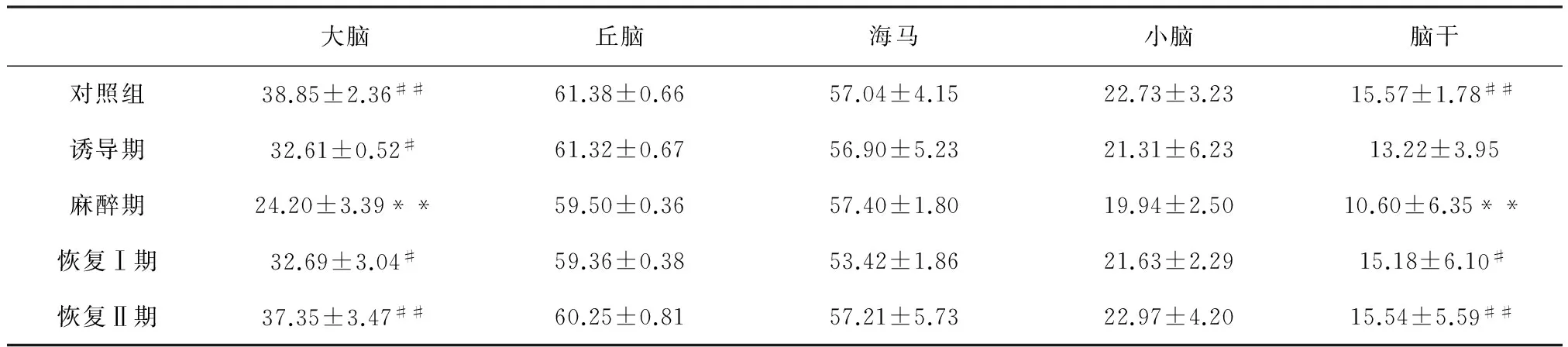
表5 咪达唑仑对山羊不同脑区NE的影响 (n=5,ng/mL)
2.9 咪达唑仑对山羊不同脑区DA的影响 如表6所示,山羊肌肉注射咪达唑仑后,麻醉组大脑和脑干内DA含量均显著降低,与对照组比较分别降低了44.80%(Plt;0.01)和35.81%(Plt;0.05);在恢复Ⅰ期和恢复Ⅱ期时,大脑和脑干内DA含量均显著恢复,同时与麻醉组比较差异极显著(Plt;0.01)。其他脑区内DA含量无显著变化。
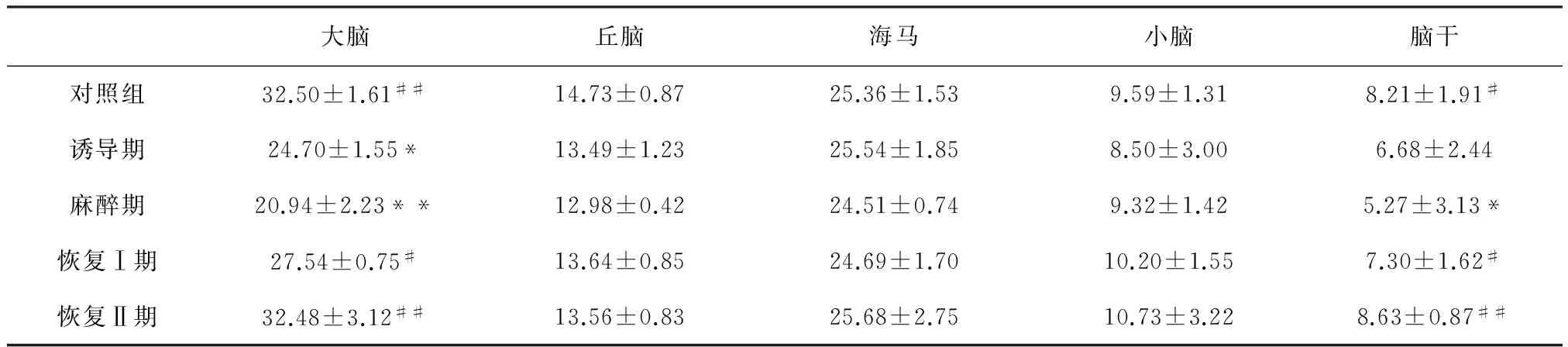
表6 咪达唑仑对山羊不同脑区DA的影响 (n=5,ng/mL)
3 讨论
组织液和体液中的单胺类神经递质及其代谢物的含量,能反映出生理和疾病的状态,而脑内单胺类神经递质含量的准确测定,对临床诊断和基础生理研究具有重要意义[4,5]。5-HT在大脑皮层、基底节和下丘脑的部分神经元上起抑制作用,而对深部的神经元常起到兴奋作用。其参与痛觉调节、觉醒-睡眠周期调节和下丘脑-垂体的神经内分泌调节等多种活动。姚尚龙[6]等研究异丙酚不同麻醉深度下兔脑5-HT代谢水平的改变,结果显示,大脑5-HT水平在麻醉后显著增加。上述研究与本试验麻醉期脑组织中5-HT含量的变化趋势相似。在恢复II期时脑组织中5-HT含量恢复至正常水平,推测咪达唑仑的作用时间短和顺行性遗忘作用与其相关。有研究表明,给予大鼠吗啡可使中枢神经系统5-HT的含量增加50%,阿片类药物可以阻碍GABA能神经元对于5-HT神经元的抑制,从而导致5-HT释放增多。但关于苯二氮卓类药物对5-HT的影响变化未见报道,所以本试验中咪达唑仑使5-HT含量升高原因是否与5-HT受体有联系尚需进一步研究。
脑内5-HIAA是由5-HT经单胺氧化酶的氧化作用生成,在体内5-HIAA随着5-HT含量的变化呈现一定规律性的变化。刘红亮[7]等应用全麻药异丙酚麻醉大鼠,观察大脑皮层5-HT和其代谢产物5-HIAA的变化,结果发现,持续静脉注射异丙酚可引起5-HT和5-HIAA的升高,停止注射后又很快降至用药前的基础水平。本试验结果显示,麻醉期5-HIAA在大脑和脑干中的含量显著升高,恢复II期时5-HIAA含量恢复至正常水平。不同的麻醉镇静药物如吗啡、羟甲芬太尼等对脑内单胺类神经递质含量的影响研究多证明麻醉药物可使脑内5-HIAA的含量升高。结合本次研究我们认为咪达唑仑可增加大脑和脑干中5-HIAA的释放作用,并提高神经元兴奋性,但作用机制是否与BZ受体激动剂激活单胺氧化酶的活性有关还需进一步的研究。
NE主要由交感节后神经元和脑内肾上腺素能神经末梢合成和分泌,主要激动α受体,具有很强的血管收缩作用,可保证对重要器官的血液供应。山羊肌肉注射咪达唑仑后,山羊大脑和脑干NE的含量在麻醉期显著降低,在恢复II期时恢复至正常水平,其他脑区NE的含量没有显著变化。沈浩等[8]研究咪唑安定、丙泊酚对下丘脑室旁核去甲肾上腺素释放和心率变异性的影响,发现可引起NE含量的显著下降。本试验结果与上述文献报道相似,咪达唑仑可降低山羊大脑和脑干中NE的含量,分析原因可能是咪达唑仑作用于蓝斑核的GABAA受体,导致NE能神经元受到抑制,从而使NE释放减少。
DA是一种神经传导物质,用来帮助细胞传送脉冲的化学物质,其参与调节肌紧张以及精神活动。DA是合成NE的前体,抑制DA的释放会导致NE的合成减少。山羊肌肉注射咪达唑仑后,大脑和脑干DA的含量在麻醉期显著降低,此变化趋势与张燕等[9]报道的小型猪复合麻醉剂对大鼠脑中单胺类神经递质含量的影响相似。在恢复I期时大脑和脑干内DA的含量都恢复至正常水平,其恢复的原因可能是由于BZ(苯=氮卓类化合物)受体激动剂与神经元中的Cl-同时作用于离子通道靶位,并加快药物进出于离子通道的速率所导致。
4结论
咪达唑仑的作用部位主要是在大脑和脑干,使大脑和脑干内5-HT和5-HIAA的含量升高,大脑和脑干内NE和DA的含量降低,提示单胺类神经递质参与咪达唑仑全身麻醉作用的调控。
[1] Rajeev J, Rajeev K Y. Voltammetric behavior of sedative drug midazolam at glassy carbon electrode in solubilized systems[J].J Pharm Anal, 2012,2: 123-129.
[2] 陈鸿,潘宁玲. 全身麻醉诱导时咪唑安定与氯胺酮催眠相互作用的研究[J]. 临床麻醉学杂志,2010,26(10):851-853.
[3] 李强,张卫,谢积胜. 咪达唑仑联合氯胺酮在巴马香猪腮腺核磁共振检查中的麻醉效果[J]. 广西医学,2015,37(9):1 219-1 221
[4] Chen P E, Geballe M T, Stansfeld P J,etal. Structural features of the glutamate binding site in recombinant NR1/NR2A N-methyl-D-aspartate receptors determined by site-directed mutagenesis and molecular modeling[J]. Mol Pharmacol,2005,67(5): 1 470-1 484.
[5] Gonzalez M M,Aston-Jones G. Light deprivation damages monoamine neurons and produces a depressive behavioral phenotype in rats[J]. Proc Natl Acad Sci U S A, 2008, 105(12): 4 898.
[6] 姚尚龙, 陈建颜. 不同麻醉深度下兔脑5-羟色胺代谢水平的变化[J]. 中华麻醉学杂志, 2003, 23(5): 358-360.
[7] 刘红亮. 异丙酚中枢神经递质作用机制[J]. 国外医学麻醉学与复苏分册, 2003, 19(2): 337-340.
[8] 沈浩, 龚蔚, 等. 咪唑安定、丙泊酚对下丘脑室旁核去甲肾上腺素释放和心率变异性的影响[J]. 同济大学学报: 医学版, 2009, 2, 44-47.
[9] 张燕, 王洪斌, 范宏刚. 噻环乙胺及小型猪复合麻醉剂(XFM)对大鼠不同脑区单胺类神经递质的影响[J]. 中国兽医科学, 2010, 40(1): 93-97.
Effectsofmidazolamonmonoamineneurotransmittersindifferentencephalicregionsofgoats
GAO Li1, GUO Cen1, LI Xin-ran1, ZHU Han-min1, CHEN Yu-hang2, ZHANG Si-xue1
(1.College of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China ; 2.Veterinary Hospital of north village, husbandry bureau of Jarud Banner, inner Mongolia,Tongliao 028000,China)
To study the effects of midazolam on monoamine neurotransmitters in different encephalic regions of goats, and then investigate the anesthetic mechanism of midazolam on the brain, 25 goats were divided randomly into control group, induction group, maintenance of anesthesia group, recovery-from-anesthesia I group, recovery-from-anesthesia II group. In different anesthetic periods, and the content of amino acid neurotransmitters in different encephalic regions of goats were detected by high performance liquid chromatography (HPLC). The results showed that midazolam main site of the brain and brain stem, and the content of 5-HT and 5-HIAA was increased, and reducing the content of NE and DA was reduced.
Midazolam ; Goats ; 5-HT ; 5-HIAA ; NE ; DA
S857.144
A
0529-6005(2017)10-0102-05
2017-04-10
黑龙江省教育厅项目(12531016)
高利(1972-),男,教授,博士,研究方向为动物临床麻醉,E-mail:gaoli43450@163.com

