P16蛋白在口咽癌和口腔癌中的表达及临床意义
王凤泽 薛洋 温娇 周峻 刘源 魏建华
P16蛋白在口咽癌和口腔癌中的表达及临床意义
王凤泽 薛洋 温娇 周峻 刘源 魏建华
目的分析口咽癌和口腔癌中P16蛋白表达情况及临床意义。方法采用免疫组织化学染色法检测70 例口咽癌和60 例口腔癌中P16蛋白的表达情况,分析其与患者临床病理学指标的相关性及临床意义。结果口咽癌中P16蛋白的阳性率为22.9%(16/70),与P16阴性组相比,患者的年龄、吸烟、病理分化、N分期和TNM临床分期具有统计学意义(Plt;0.05);口腔癌中P16蛋白的阳性率为8.3%(5/60),与P16阴性组相比,病理分化和TNM临床分期有统计学意义(Plt;0.05)。结论口咽癌中P16蛋白阳性率明显高于口腔癌,HPV感染是口咽癌和口腔癌不可忽视的诱发因素。
口咽鳞癌(OPSCC); 口腔鳞癌(OSCC); HPV; P16
口咽癌是一类主要发生在舌根、咽侧壁、软腭、扁桃体等部位的鳞状细胞癌。口腔癌主要发生在口腔黏膜如舌、颊粘膜、硬腭和牙龈等的鳞癌。其中口腔癌在口腔恶性肿瘤中最常见,严重影响患者的生命质量[1]。口咽癌和口腔癌的发病是由多因素导致的,普遍认为,吸烟和饮酒是其中的重要原因[2]。然而随着患者吸烟量和饮酒量的减少,并没有发现生存率有明显的提高,有报道显示15%~20%的口咽癌和口腔癌患者不吸烟不饮酒,表明存在影响肿瘤发病的其他致病危险因素[3]。近年来,越来越多的研究表明人类乳头瘤病毒(human papillomavirus, HPV)在宫颈癌的致病中起到重要作用,超过90%的宫颈癌与HPV感染有关[4]。同样,早在1983 年Syrjanen就指出HPV感染与头颈部鳞癌相关,随后的研究在口咽、下咽等部位的鳞癌中都发现了HPV感染,因此HPV的作用愈来愈受重视[5]。本研究通过对口腔癌和口咽癌患者标本中HPV感染的标志物P16蛋白进行检测,与患者临床病理学指标进行统计学分析,探讨其临床意义。
1 材料与方法
1.1 基本资料
70 例口咽癌标本和60 例口腔癌标本来自第四军医大学口腔医院。入组标准:①所有病理标本均通过HE染色确诊为鳞状细胞癌;②详细病案记录分析的指标完整;③具有完整的蜡块进行切片检测。
1.2 实验试剂
I抗:鼠抗人P16单克隆抗体(产品编号:ab117443,Abcam,美国),II抗:生物素-链霉卵白素免疫组化检测试剂盒(产品编号:SP9002,北京中杉金桥生物技术公司),DAB显色试剂盒(产品编号:ZLI-9108,北京中杉金桥生物技术公司)。
1.3 免疫组化
所有鳞癌组织均通过4%甲醛液固定并进行石蜡包埋,每个标本取4 μm厚连续切片5 张。所有石蜡切片常规免疫组织化学染色检测P16蛋白表达,采用0.01 mol/L柠檬酸钠缓冲液高压锅抗原修复,PBS代替I抗进行空白对照。
1.4 结果判断
所有结果由2 名有经验的病理科医师进行双盲判断。免疫组化阳性结果解读:细胞质呈现红棕或棕褐染色为阳性表达,按参考文献[6]的标准评分。
1.5 统计学分析
采用SPSS 19.0进行统计学分析,计数资料用χ2检验和Fisher确切概率法,Plt;0.05具有统计学意义。
2 结 果
2.1 口咽癌中P16表达情况分析
70 例口咽癌中P16蛋白阳性16 例,阴性54 例,阳性率为22.9%(16/70),P16阳性表达(图 1)。
P16蛋白表达阳性和阴性口咽癌患者临床参数比较:P16阳性组与阴性组相比,年龄、吸烟、病理分化、淋巴结转移和TNM临床分期有统计学意义(Plt;0.05,表 1),但P16阳性组中女性和T1+T2者的比例高,没有统计学意义(Pgt;0.05,表 1)。
2.2 口腔癌中P16表达情况分析
60 例口腔癌中P16阳性者5 例,阴性55 例,阳性率为8.3%(5/60)。P16阳性表达(图 1)。
P16阳性组与阴性组相比,病理学分化,TNM临床分期有统计学意义(Plt;0.05,表 1);但P16阳性组中女性、年龄小于60 岁、吸烟指数小于20、T1+T2和N0者的比例相对较高,无统计学意义(Pgt;0.05,表 1)。
表 1 口咽癌和口腔癌中P16与临床病理学指标之间的关系[n(%)]

Tab 1 Relationship between clinicopathological parameters and P16 status for OPSCC and OSCC [n(%)]
注: ①:Plt;0.05
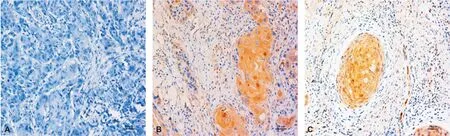
A: 阴性对照; B: 口咽癌组织中P16表达; C: 口腔癌中P16表达
图 1 P16在口咽癌和口腔癌中的表达(IHC, ×200)
A: Control; B: P16 expression in OPSCC sample; C: P16 expression in OSCC sample
Fig 1 Expression of P16 in OPSCC and OSCC(IHC, ×200)
3 讨 论
HPV是小型环状双链DNA病毒属,分为高危型和低危型。高危型主要与头颈部鳞癌、食管癌、宫颈癌及外阴癌相关,主要分型为HPV16、18、33;低危型主要与眼、呼吸道、生殖道乳头状瘤相关,主要分型为HPV6、11[7]。HPV具有嗜组织性,无法编码DNA 聚合酶。主要借助宿主细胞周期蛋白增殖,其基因组以游离态为主,可以整合到人类基因组中,在整合的过程中,E6、E7 基因被整合到宿主DNA中[8]。HPV E6 蛋白可以与P53结合并使其降解,失去对细胞周期的正常调控导致细胞恶性增殖。HPV E7 蛋白结合Rb,引起E2F 的释放和P16蛋白的过表达,致使细胞周期失控[9]。在HPV 感染的基础上,经过长期基因损伤的积累,会使正常细胞癌变,最终发展成为恶性肿瘤。
目前头颈部肿瘤常分为HPV阳性和HPV阴性2 种类型,在致病原因、病理学特征等多方面有很大区别。HPV阳性的头颈部肿瘤多与性伙伴多和口交等有关;HPV阴性的与吸烟和饮酒关系较大[10]。其中,在头颈部肿瘤中,口咽癌HPV 感染率最高且呈现上升趋势。
目前HPV检测的方法包括核酸原位杂交法、基因芯片和P16免疫组化等,检测阳性率有差别。其中,在宫颈癌中第一次应用P16免疫组化来检测HPV感染[11],同样已经有研究用P16免疫组化来检测头颈部肿瘤中HPV感染[12]。本实验P16免疫组化结果显示口咽癌中阳性率远高于口腔癌(22.9%vs8.3%),表明口咽癌与HPV更加密切,与现有研究结果一致[7]。
对口咽癌患者的基本信息(表 1)进行统计后发现:P16阳性组中吸烟指数小于20和小于60岁者多,具有统计学意义;女性患者多(18.8%vs14.8%),但无统计学意义(Pgt;0.05)。上述结果与现有报道相一致[13]。
在发病部位上,阳性组与P16阴性组相比,没有统计学意义(Pgt;0.05),其中舌根部位最多,可能因为入选样本量不够和入选病例中舌根癌比例相对较高(52.9%),高于现有报道[14-15],存在入组偏倚。在T分期、N分期和TNM临床分期方面,现有研究[14,16]表明P16阳性组T分期明显早于阴性组,且多为低分化,容易发生淋巴结转移和远处转移,多为III~IV期患者。本研究显示(表 1):P16阳性组多为低中分化,N+和III-IV期,均具有统计学意义,与上述研究相符;在T分期上,P16阳性组与阴性组相比没有统计学意义(χ2=0.527,Pgt;0.05),但是具有以下趋势:T1+T2患者比例要高于T3+T4期(81.3%vs72.2%)。
在宫颈癌和口咽癌中HPV感染的致病机制已经基本明了,但是在口腔癌中的致病机制尚不明了[17]。本研究中口腔癌共60 例,其中硬腭癌12 例,颊癌15 例,舌癌18 例和口底癌15 例。在口腔癌临床指标与P16表达的研究中:女性患者的比例高,与研究[7]相符。在年龄上,P16阳性组与阴性组相比, 小于60 岁人群居多(80%vs57.1%),与研究[18]一致。P16阳性组吸烟少者比例高(60%vs36.4%),符合研究[3,19],但与研究[20]不符,考虑可能是因为组内分层的标准不一样,存在入组偏倚。P16阳性组多为低中分化,具有统计学意义(χ2=7.375,Plt;0.05),符合现有研究[17]。然而,另有研究[19,21]发现HPV阳性口腔癌以高分化为主,与本研究不相符,考虑可能是因为样本量小和上述研究中入选的高分化病例占比高达88.5%,存在选择偏倚。
除上述因素,P16阳性组与阴性组相比,T1+T2者比例高,与研究[17,20]相符,无统计学意义。P16阳性组多为N0,不易发生淋巴结转移,与研究[17]相符。I~II期患者多,与研究[19,21]相符,具有统计学意义(χ2=6.325,Plt;0.05),表明P16蛋白在口腔癌的癌变、转移与发展中起到重要的作用,可以作为口腔癌早期诊断和预后评估的重要标志物。
综上所述,HPV感染对口咽癌和口腔癌的致病机制是全世界研究的热点,相比口腔癌,目前对口咽癌的研究更深入。本实验中口咽癌P16表达与临床指标的关系与现有研究基本一致,但是口腔癌与现有研究少有出入,将来通过加大样本量和多中心协作,相信会对HPV相关口腔癌的研究提供更多的数据支持。
[1] 蔡伯惠, 祝心威, 王润, 等. Nav1.6在口腔黏膜白斑及口腔鳞癌中的表达[J]. 实用口腔医学杂志, 2016, 32(5):670-673.
[2] Choi SY, Kahyo H. Effect of cigarette smoking and alcohol consumption in the aetiology of cancer of the oral cavity, pharynx and larynx[J]. Int J Epidemiol, 1991,20(4):878-885.
[3] Gillison ML, Koch WM, Capone RB, et al. Evidence for a causal association between human papillomavirus and a subset of head and neck cancers[J]. J Natl Cancer Inst, 2000,92(9):709-720.
[4] Hafed L, Farag H, Shaker O, et al. Is human papilloma virus associated with salivary gland neoplasms? An in situ-hybridization study[J]. Arch Oral Biol, 2012,57(9):1194-1199.
[5] Näsman A, Attner P, Hammarstedt L, et al. Incidence of human papillomavirus (HPV) positive tonsillar carcinoma in Stockholm, Sweden: An epidemic of viral-induced carcinoma?[J]. Int J Cancer, 2009,125(2):362-366.
[6] Chandarana SP, Lee JS, Chanowski EJ, et al. Prevalence and predictive role of p16 and epidermal growth factor receptor in surgically treated oropharyngeal and oral cavity cancer[J]. Head Neck, 2013,35(8):1083-1090.
[7] Kreimer AR, Clifford GM, Boyle P, et al. Human papillomavirus types in head and neck squamous cell carcinomas worldwide: A systematic review[J]. Cancer Epidemiol Biomarkers Prev, 2005,14(2):467-475.
[8] Zur Hausen H. Papillomaviruses and cancer: From basic studies to clinical application[J]. Nat Rev Cancer, 2002,2(5):342-350.
[9] Patil S, Rao RS, Amrutha N, et al. Analysis of human papilloma virus in oral squamous cell carcinoma using p16: An immunohistochemical study[J]. J Int Soc Prev Community Dent, 2014,4(1):61-66.
[10] Marur S, D' Souza G, Westra WH, et al. HPV-associated head and neck cancer: A virus-related cancer epidemic[J]. Lancet Oncol, 2010,11(8):781-789.
[11] Klaes R, Benner A, Friedrich T, et al. p16INK4a immunohistochemistry improves interobserver agreement in the diagnosis of cervical intraepithelial neoplasia[J]. Am J Surg Pathol, 2002,26(11):1389-1399.
[12] Chen ZW, Weinreb I, Kamel-Reid S, et al. Equivocal p16 immunostaining in squamous cell carcinoma of the head and neck: Staining patterns are suggestive of HPV status[J]. Head Neck Pathol, 2012,6(4):422-429.
[13] Andrews E, Seaman WT, Webster-Cyriaque J. Oropharyngeal carcinoma in non-smokers and non-drinkers: A role for HPV[J]. Oral Oncol, 2009,45(6):486-491.
[14] Nichols AC, Finkelstein DM, Faquin WC, et al. Bcl2 and human papilloma virus 16 as predictors of outcome following concurrent chemoradiation for advanced oropharyngeal cancer[J]. Clin Cancer Res, 2010,16(7):2138-2146.
[15] Blumberg J, Monjane L, Prasad M, et al. Investigation of the presence of HPV related oropharyngeal and oral tongue squamous cell carcinoma in Mozambique[J]. Cancer Epidemiol, 2015,39(6):1000-1005.
[16] Ralli M, Singh S, Yadav S P, et al. Assessment and clinicopathological correlation of p16 expression in head and neck squamous cell carcinoma[J]. J Cancer Res Ther, 2016,12(1):232-237.
[17] Lingen MW, Xiao W, Schmitt A, et al. Low etiologic fraction for high-risk human papillomavirus in oral cavity squamous cell carcinomas[J]. Oral Oncol, 2013,49(1):1-8.
[18] Reyes M, Rojas-Alcayaga G, Pennacchiotti G, et al. Human papillomavirus infection in oral squamous cell carcinomas from Chilean patients[J]. Exp Mol Pathol, 2015,99(1):95-99.
[19] Campisi G, Giovannelli L, Calvino F, et al. HPV infection in relation to OSCC histological grading and TNM stage. Evaluation by traditional statistics and fuzzy logic model[J]. Oral Oncol, 2006,42(6):638-645.
[20] Emmett S, Jenkins G, Boros S, et al. Low prevalence of human papillomavirus in oral cavity squamous cell carcinoma in Queensland, Australia[J]. ANZ J Surg, 2016.
[21] Kouketsu A, Sato I, Abe S, et al. Detection of human papillomavirus infection in oral squamous cell carcinoma: A cohort study of Japanese patients[J]. J Oral Pathol Med, 2016,45(8):565-572.
(收稿: 2016-11-03 修回: 2017-01-10)
TheclinicalsignificanceofP16expressioninoralandoropharyngealsquamouscellcarcinoma
WANGFengze1,XUEYang2,WENJiao3,ZHOUJun4,LIUYuan4,WEIJianhua1.
1. 710032Xi'an,DepartmentofProsthodontics, 2.DepartmentofOralBiology, 3.DepartmentofAnesthesiology, 4.StateKeyLaboratoryofMilitaryStomatologyamp;NationalClinicalResearchCenterforOralDiseasesamp;ShaanxiClinicalResearchCenterforOralDiseases,DepartmentofOralHistologyandPathology,SchoolofStomatology,TheFourthMilitaryMedicalUniversity,China
Objective: To analyze the expression and clinical significance of P16 in oral and oropharyngeal squamous cell carcinoma(OSCC and OPSCC).MethodsSpecimens from 70 patients with OPSCC and 60 with OSCC were immunostained by mouse anti-human P16 monoclonal antibody. The relationship between P16 status and clinicopathological parameters were investigated.ResultsThe positive rate of P16 staining in OPSCC was 22.9%(16/70). The expression of P16 was closely associated with age, smoking index, histotype, N stage and TNM clinical stage of OPSCC(Plt;0.05). The positive rate of P16 protein was 8.3%(5/60) in OSCC. The expression of P16 protein was associated with histotype and TNM clinical stage of OSCC(Plt;0.05).ConclusionThe positive propotion of P16 expression was higher in OPSCC than that in OSCC. HPV infection is a precipitating factor for OPSCC and OSCC.
Oropharyngealsquamouscellcarcinoma(OPSCC);Oralsquamouscellcarcinoma(OSCC);HPV;P16
710032 西安,军事口腔医学国家重点实验室,口腔疾病国家临床医学研究中心,陕西省口腔疾病临床医学研究中心,第四军医大学口腔医院颌面外科( 王凤泽魏建华) ,口腔生物学教研室( 薛洋) ,麻醉科( 温娇) ,组织病理学教研室( 周峻刘源)
魏建华E-mail: weiyoyo@ fmmu. edu. cn
R739.8
A
10.3969/j.issn.1001-3733.2017.02.010

