小鼠支气管肺泡灌洗术的改进
姚 茹,张锐虎,王 璐,陈朝阳*
(1.山西医科大学实验动物中心,太原 030001; 2.山西省实验动物与人类疾病动物模型重点实验室,太原 030001)
小鼠支气管肺泡灌洗术的改进
姚 茹1,2,张锐虎1,2,王 璐1,2,陈朝阳1,2*
(1.山西医科大学实验动物中心,太原 030001; 2.山西省实验动物与人类疾病动物模型重点实验室,太原 030001)
目的改进制备小鼠支气管肺泡灌洗液(BALF)的方法。方法动物分为3组,第1组和第2组采用传统方法:使用静脉留置针对小鼠全肺进行支气管肺泡灌洗术;第3组采用改进方法:使用自制注射器对小鼠全肺进行支气管肺泡灌洗术。每只动物灌洗3次,每次0.5 mL,并计时。支气管肺泡灌洗液离心,分离上清液准确测量其体积。结果灌洗液收集时间比较,第1组和第2组每只小鼠用时约10 min,第3组每只小鼠用时约4 min,差异有显著性(P< 0.05);小鼠支气管肺泡灌洗液体积测量比较,第3组分别多于第1组和第2组,差异有显著性(P< 0.05)。结论改进后的方法可简便、经济、高效地收集支气管肺泡灌洗液,特别适合初学研究者使用。
小鼠;支气管肺泡灌洗液;技术改进
小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)主要用于细胞总数和分类计数、T淋巴细胞亚群、可溶成分、尘粒和矿物质以及感染性病原体等方面的检测,进一步为有关疾病的特征、诊断及预后等提供依据,为收集足够的灌洗液,医学生物研究者采用很多方法,但仍没有得到支气管灌洗的统一标准方法[1-3]。第一种传统方法[4]是处死小鼠后,先将小鼠气管远心端结扎,再将静脉留置针插入气管,退出针芯,连接2 mL注射器直接进行抽取,每次1 mL,灌洗2次,此方法没有在套管进入气管处结扎,可能导致抽取过程中套管松开气管,造成实验失败。第二种传统方法[5]为麻醉处死小鼠,暴露气管,提前穿两根线于气管、食管之间,静脉留置套管针插入气管,将置于气管、食管间的线分别在气管近心端、远心端进行结扎,每次0.8 mL,灌洗2次,虽然此方法弥补了第一种方法的缺点,但两种方法都不宜结扎过紧,以免切断气管,也不宜过松,以免套管与气管固定不当造成脱落;静脉留置针需适当深入气管,以免退出针芯时带出套管;用时比较长;灌洗量较大导致肺内压力急剧升高,人为导致细胞渗出。
本实验在借鉴传统方法的基础上,采用自制灌洗液抽取注射器,建立了一种简便、快捷、经济、高效的BALF收集方法。
1 材料和方法
1.1实验动物
雄性SPF级BALB/c小鼠30只,体重为18~20 g,由山西医科大学动物中心提供 [SCXK (晋) 2015-001]。饲养坏境温度为22℃~25℃,湿度为50%~70%[SYXK(晋)2015-001]。本实验符合山西医科大学动物实验伦理学标准,实验中按实验动物使用的3R原则给予人道主义关怀。
1.2主要试剂与仪器
小鼠固定板,注射器,静脉留置针,剪刀,眼科弯镊,眼科镊,PBS溶液,外科缝合线,计时器。
1.3实验方法
1.3.1 自制插管装置
将一次性1 mL注射器针尖和针梗去掉,保留针栓,将3 cm长、直径1 mm的PE材质组成的长筒型塑料硬管的一端剪一斜面,便于气管插管,另一端呈空心圆状焊接于针栓上,最后将针栓嵌套于注射器乳头(图1)。
1.3.2 动物分组与肺泡灌洗
随机将动物分为3组,每组10只。颈椎脱臼法处死小鼠后,钝性剥离暴露气管。第1组按传统方法一收集支气管肺泡灌洗液:先将气管远心端结扎,将静脉留置针插入气管,连接2 mL注射器灌洗0.5 mL(图2A),轻轻按摩肺组织收集灌洗液,重复3次,并计时;第2组按传统方法二收集肺泡灌洗液:先穿两根外科缝线于气管、食管之间,将静脉留置套管针插入气管,分别在套管进入气管处、套管远端处结扎紧,连接1 mL注射器灌洗0.5 mL(图2B),停留30 s缓缓回抽,重复3次,并计时;第3组按改进后的方法收集肺泡灌洗液:暴露小鼠气管和胸腔,用眼科弯镊钝性分离气管和食管;眼科镊支撑在气管下方,使气管整体处于撑开状态,距环状软骨远端2~3个软骨环之间结缔组织膜处剪2~3 mm左右的切口;左手持眼科弯镊,提起少量气管壁,右手持自制注射器水平将塑料硬管插入气管;轻轻推动气管使塑料硬管充分到达左右支气管交叉处,可在胸腔暴露处观察是否到达,到达后,左右手持两把眼科镊一前一后夹住气管和嵌套的塑料硬管(图2C);注射器乳头衔接针栓,首次进行0.5 mL PBS溶液灌洗,观察双侧肺膨胀,停留30 s后慢慢抽取灌洗液,可见乳白色泡沫状液体,当感觉活塞抽不动有阻力时停止,转移至离心管,灌洗3次,最后一次抽取可用手轻揉双侧肺组织,使残留灌洗液也充分得到抽取,并计时。
1.3.3 计时方法
从动物处死固定后为起始点到3次抽取灌洗液结束计时为终点,每只动物操作时均计时。为保障操作熟练程度的一致性,所有操作过程均由同一人完成。
1.3.4 灌洗液体积测量
将三种方法收集的BALF立即进行离心(4℃,1400 r/min,10 min),分离上清液并准确测定体积。

图1 自制插管装置Fig.1 Self-made intubation device

注:A~C:分别为第1组、第2组、第3组收集支气管肺泡灌洗液的方法。图2 三组肺泡灌洗方法Note. A-C: The method of BALF collection in the first, second and third group, respectively.Fig.2 Three different methods of alveolar lavage
Tab.1Comparison of the time spent for BALF preparation in a mouse of different groups

组别Groups每只小鼠灌洗液制备用时/minTimespentforBALFpreparationofeachmouse第1组Thefirstgroup10±0.75*第2组Thesecondgroup12±0.88*第3组Thethirdgroup4±0.62
注:与第3组比较,*P< 0.05。
Note. Compared with the third group,*P< 0.05.

Tab.2Comparison of BALF volume of each mouse collected in different groups

组别Groups每只小鼠回收体积/mLRecoveryvolumeofBALFofeachmouse回收率/%Recoveryrate第1组Thefirstgroup1.03±0.25*68.7%*第2组Thesecondgroup1.13±0.22*75.4%*第3组Thethirdgroup1.34±0.1689.6%
注:与第3组比较,*P< 0.05。
Note. Compared with the third group,*P< 0.05.
1.4统计学方法
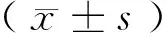
2 结果
2.1制备小鼠支气管肺泡灌洗液实验时间比较
第1组和第2组每只小鼠实验时间多于第3组,差异有显著性(P< 0.05),见表1。
2.2小鼠支气管肺泡灌洗液体积的比较
每只小鼠肺泡灌洗液体积为1.5 mL,第1组和第2组肺泡灌洗液回收体积少于第3组,差异有显著性(P< 0.05),见表2。
3 讨论
报道支气管肺泡灌洗方法的文献很多,但各有自身的操作缺点:需要结扎牢固避免液体从气管漏出,小鼠气管细且脆,结扎时太紧太松皆不可行,结扎质量难保证;且在抽取灌洗液时难免有滑脱现象;直型静脉留置针软管不易固定,易变形和堵塞;回抽负压太大可能损伤黏膜血管,负压太小则又可能抽取不全,影响回收率[6];小鼠气管短,需要把握好留置针送入气管情况;操作过程繁杂;操作过程耗时长,影响实验进程和实验指标测定结果[7]。
本实验改进后的方法操作过程简单,不使用静脉留置针,而采用自制的塑料硬管,无需结扎,使用眼科弯镊固定并采用1 mL注射器进行抽取,优化了传统操作的不足之处,每只小鼠完成操作用时约4 min,回收BALF体积明显多于采用传统方法的两组,回收率达到89.6%。本方法可简便获得医学研究检测相关的BALF,操作简单,易于掌握。与传统方法相比,本方法更为简便、经济、高效。传统方法需要购买静脉留置针,若进行大批量实验操作,则增加成本,在操作过程中若结扎松紧不适宜,则可能出现漏液现象,且未暴露胸腔,不便于把握适度的灌洗压力,压力过大可致肺破损,导致灌洗无效。本方法采用自制塑料硬管,较经济;操作过程中采用眼科镊固定,无结扎不当现象,较简便;自制塑料硬管不易变形,无需考虑回抽力度大、变形的可能,且暴露小鼠胸腔,可更加直观地观察送入插管部位和肺肿胀、破坏情况,相对省时高效。
本支气管肺泡灌洗术操作时需注意:①要充分暴露气管和胸腔,这样做可以更加清楚地观察是否插管成功,能够留出足够的空间进行插管,也能防止气管上端插管失败,继而进行下端插管,同时在灌洗时可通过观察肺肿大来判断灌洗液是否进入双侧肺。②全过程只需注意插管到左右支气管交叉处这一步骤,保证塑料硬管到达气管交叉口上至少2 mm即可,若气管切口太大或插管过程中断裂不影响后面操作。③全程操作无需结扎,用眼科镊固定好即可,眼科镊比结扎线更易固定、摩擦力受力点大。④注意注射器乳头与针栓衔接不宜过紧,以防第二次灌洗时不易分开。⑤若发现抽取少量时就感觉抽动有阻力,需观察左右支气管交叉处管口是否吸住气管壁,此时切不可用力抽动以防止气管破裂,可轻轻旋转塑料硬管口或稍进气管少许。
综上所述,本方法易于掌握、便于操作,可为广大研究者尤其是初学者提供参考。
[1] Liu F, Sun GQ, Gao HY, et al. Angelicin regulates LPS-induced inflammation via inhibiting MAPK/NF-κB pathways [J]. J Surg Res, 2013, 185(1): 300-309.
[2] Wan LM, Tan J, Wan SH, et al. Anti-inflammatory and anti-oxidative effects of dexpanthenol on lipopolysaccharide induced acute lung injury in mice [J]. Inflammation, 2016, 39(5): 1757-1763.
[3] 岳胜, 朱平, 岳磊, 等. 急性肺损伤大鼠呼吸膜AQP1和AQP5的表达 [J]. 中国比较医学杂志, 2016, 26(8): 70-74.
[4] 张效云, 辇晓峰, 王文栋. 制备小鼠支气管肺泡灌洗液方法的改进 [J]. 临床与实验病理学杂志, 2017, 33(1): 109-110.
[5] 酆孟洁, 邱晨, 刘雯雯. 支气管肺泡灌洗术在哮喘小鼠模型中的应用 [J]. 国际检验医学杂志, 2012, 33(19): 2305-2306.
[6] 邹叶强, 孟婕. 支气管肺泡灌洗术在小鼠肺纤维化模型中的应用 [J]. 中国社区医师, 2016, 32(32): 9-10.
[7] Xie YC, Dong XW, Wu XM, et al. Inhibitory effects of flavonoids extracted from licorice on lipopolysaccharide-induced acute pulmonary inflammation in mice [J]. Int Immunopharmacol, 2009, 9(2): 194-200.
Technicalimprovementofbronchoalveolarlavageinmice
YAO Ru1, 2, ZHANG Rui-hu1, 2, WANG Lu1, 2, CHEN Zhao-yang1, 2 *
(1.Laboratory Animal Center, Shanxi Medical University, Taiyuan 030001, China; 2.Key Laboratory of Laboratory Animal Science and Animal Models of Human Diseases, Taiyuan 030001)
ObjectiveTo improve the preparation of bronchoalveolar lavage fluid (BALF) in mice.MethodsBALB/c mice were divided into 3 groups. In the first and second groups, the whole lung lavage was performed with the traditional method, using a vein detained needle and lavaged with sterile saline. The mice in the third group got whole lung lavage by the improved method, namely, using a self-made plastic rigid pipe connected with a syringe. Each mouse was lavaged for 3 times, with 0.5 mL of sterile saline for each time, and the time consumption was recorded. The collected BALF was centrifuged, the supernatant was separated and its volume was measured accurately.ResultsThe time spent for BALF collection in each mouse in the third group was (4±0.62) min, significantly shorter than that of (10±0.75) and (12±0.88) min, respectively in the first and second groups (P< 0.05). The volume of BALF collected in each mouse of the third group was (1.34±0.16) mL, significantly higher than that of (1.03±0.25) and (1.13±0.22) mL, respectively in the first and second groups (P< 0.05).ConclusionsThe improved method of BALF collection described in our study is simple, economical and efficient, and is useful for beginners especially.
Mice; Bronchoalveolar lavage fluid; Technical improvement
山西省实验动物专项(编号:2015K02)。
姚茹(1993-),硕士研究生,研究方向:人类疾病动物模型。E-mail: m18734116230@163.com
陈朝阳(1972-),副教授,研究方向:人类疾病动物模型。E-mail: ccytycn@163.com
R-33
A
1671-7856(2017) 11-0080-04
10.3969.j.issn.1671-7856. 2017.11.016
2017-05-11

