芍药苷对增殖性瘢痕成纤维细胞增殖抑制作用及机制研究
王 雷,马园园,李亚玲,周粤闽
(河南大学附属淮河医院整形外科,河南 开封 475001)
芍药苷对增殖性瘢痕成纤维细胞增殖抑制作用及机制研究
王 雷,马园园,李亚玲,周粤闽
(河南大学附属淮河医院整形外科,河南 开封 475001)
目的探索芍药苷对增殖性瘢痕(HS)成纤维细胞增殖抑制作用及机制研究。方法0(对照组),200,400,800 μmol/L的芍药苷作用HS成纤维细胞24、48、72 h后,MTT法检测细胞活力,Hoechst染色法检测细胞凋亡,流式细胞术检测细胞周期,酶联免疫吸附试验(ELISA)检测细胞Ⅰ型胶原(COL Ⅰ)和Ⅲ型胶原(COL Ⅲ)含量,Western blot检测转化生长因子-β(TGF-β)/Smad信号通路相关蛋白及基质金属蛋白酶1(MMP1)、MMP13表达。结果200,400,800 μmol/L芍药苷能显著降低HS成纤维细胞活力(P< 0.01),使细胞核发白,皱染,使细胞周期阻滞在G1期(P< 0.01),能显著降低细胞中COLⅠ、COLⅢ含量(P< 0.01),下调MMP1、MMP13、TGF-β1、p-Smad2及p-Smad3表达(P< 0.01)。结论芍药苷能明显抑制HS成纤维细胞增殖及胶原合成,可能是通过抑制TGF-β1/Smad信号通路实现的。
芍药苷;增生性瘢痕;成纤维细胞;增殖;胶原合成
增生性瘢痕(hypertrophic scar,HS)是皮肤严重创伤、烧伤或者感染后,创面异常修复的必然结果,临床主要表现为创面皮肤增厚,高于正常皮肤,瘢痕挛缩并有瘙痒感,甚至影响患者外观,引起关节功能障碍,给患者造成巨大心理负担[1]。目前研究认为HS的发生机制是皮肤受损后,成纤维细胞被激活后大量增殖,进而促进细胞外基质胶原的大量合成及过度沉积[2, 3]。TGF-β1是一种具有多种功能的细胞因子,在创伤愈合过程中起着重要作用,不仅能够调控促进成纤维细胞增殖,凋亡及迁移,还能够促进成纤维细胞大量合成胶原,抑制细胞外基质蛋白酶(MMPs)的分泌及胶原的降解[4]。芍药苷是传统中药芍药的干燥根提取物,研究表明芍药苷能够通过抑制TGF-β1的表达及分泌,进而抑制胶原及细胞外基质的合成,从而抑制大鼠、小鼠肝、肾及肺纤维化[5-7]。进而提示芍药苷可能通过TGF-β1信号通路抑制HS的发生发展,成为HS的有效治疗药物,但相关报道较少,因此本研究将对此展开探讨。
1 材料和方法
1.1增生性瘢痕成纤维细胞的制备
本研究所需要的增生性瘢痕组织块由某整形科提供。所有研究对象均征得患者或者其家属同意并签署知情同意书,并由我院的伦理委员会通过。在无菌条件下用眼科剪剪去附着于组织块上的脂肪组织及表皮,接着用含有100 μg/mL的青霉素及链霉素的PBS洗涤组织块3次,接着用眼科剪继续将组织块剪成1 mm3左右的组织块,后将组织块平铺于25 cm2的培养瓶中,加入含有15%胎牛血清的DMEM培养基,于37℃、5% CO2培养箱中培养,在第3天用PBS将浮在培养基中的组织块洗去,并加入少量新鲜培养基,同时观察组织块中细胞游离出来的的情况,当培养瓶中细胞密度达到80%的时候,用0.25%的胰蛋白酶消化细胞,以1∶2的比例进行传代,取第3~5代细胞用于后续实验研究[8, 9]。
1.2主要试剂与仪器
芍药苷购自中国食品药品检定研究院;四甲基偶氮唑盐(MTT),DMEM培养基,胎牛血清,Ⅱ型胶原酶均购自美国Gibco公司;胰蛋白酶,细胞周期检测试剂盒,Hoechst染色试剂盒均南京凯基生物技术有限公司;COLⅠ、COL Ⅲ酶联免疫吸附试剂盒均购自武汉博士德生物技术有限公司;兔抗人TGF-β1、Sma2、p-Smad2、Smad3、p-Smad3、MMP1、MMP13、GAPDH多克隆抗体均购自美国Abcam公司。
MK3酶标仪购自美国Thermo公司;FACSCalibur流式细胞仪购自美国BD公司;TS100倒置荧光显微镜购自日本Nikon公司。
1.3实验方法
1.3.1 MTT法检测HS成纤维细胞活力
将6 × 103个HS成纤维细胞接种到96孔板,培养24 h后,0(对照组)、200、400、800 μmol/L的芍药苷作用HS成纤维细胞24、48、72 h后,每孔加入终浓度为5 mg/mL的MTT并孵育4 h后,弃上清液,再另外每孔加入150 μL的二甲基亚砜,振荡使结晶物溶解,于酶标仪波长560 nm处测A560值。
1.3.2 Hoechst染色检测HS成纤维细胞形态
将9 × 103个HS成纤维细胞接种到6孔板,培养24 h后,0(对照组)、200、400、800 μmol/L的芍药苷作用HS成纤维细胞48 h,PBS洗涤,加入4%多聚甲醛固定10 min,PBS洗涤,加入终浓度为10 μg/mL的Hoechst染色液,染色5 min,PBS洗涤后,于荧光显微镜下观察并拍照,凋亡的细胞荧光更强,细胞核发白,呈现皱染。
1.3.3 流式细胞术检测HS成纤维细胞周期
将9 × 103个HS成纤维细胞接种到6孔板,0(对照组)、200、400、800 μmol/L的芍药苷作用HS成纤维细胞48 h后,每组收集1 × 105个/mL细胞,再加入5 μL终浓度为10 mg/mL的RNase,吹打混匀后,37℃孵育1 h,继续加入PI染液,吹打混匀并于室温避光孵育30 min,1 h内在流式细胞仪进行细胞周期检测分析。
1.3.4 ELISA法检测HS成纤维细胞中COLⅠ、COLⅢ含量
将8 × 103个HS成纤维细胞接种到6孔板,0(对照组)、200、400、800 μmol/L的芍药苷作用HS成纤维细胞48 h后,利用0.25%胰蛋白酶消化并收集细胞,接着分别按照ELISA试剂盒说明书检测细胞中COLⅠ、COL Ⅲ含量。
1.3.5 Western blot检测HS成纤维细胞中TGF-β/Smad信号通路相关蛋白及MMP1、MMP13蛋白的表达
将9 × 103个HS成纤维细胞接种到6孔板,0(对照组)、200、400、800 μmol/L的芍药苷作用HS成纤维细胞48 h后,在4℃条件下刮下6孔板中细胞,离心并收集细胞,加入细胞裂解液,裂解30 min,离心收集上清液即是总蛋白。接着采用BCA试剂盒测定蛋白浓度。制作浓缩胶及分离胶,并水封静置30 min。蛋白样品上样,进行十二烷基苯磺酸钠凝胶电泳1~2 h,后湿法转膜30~50 min。5%脱脂奶粉封闭1 h,一抗溶液(兔抗人TGF-β1、Sma2、p-Smad2、Smad3、p-Smad3、MMP1、MMP13、GAPDH多克隆抗体,稀释度为1∶100)孵育,4℃过夜;二抗溶液室温孵育1~2 h。于凝胶成像系统中曝光。
1.4统计学方法

2 结果
2.1芍药苷对HS成纤维细胞活力的影响
如表1所示,0(对照组)、200、400、800 μmol/L的芍药苷作用HS成纤维细胞24、48、72 h后,经MTT实验发现,随着给药浓度的增加,细胞活力逐渐降低(P< 0.01)。
2.2芍药苷对HS成纤维细胞凋亡的影响
如图1所示,0(对照组)、200、400、800 μmol/L的芍药苷作用HS成纤维细胞48 h后,与对照组细胞凋亡率(3.25±0.32)%比较,200、400、800 μmol/L芍药苷组细胞凋亡率分别为(13.47±1.35)%、(26.69±2.67)%、(39.36±4.00)%,说明芍药苷能使细胞核皱缩,浓染,细胞凋亡显著。
2.3芍药苷对HS成纤维细胞周期的影响
如表2所示,0(对照组)、200、400、800 μmol/L的芍药苷作用HS成纤维细胞48 h后,经流式细胞实验发现,与对照组比较,200、400、800 μmol/L芍药苷能使HS成纤维细胞周期阻滞在G期(P< 0.01)。
2.4芍药苷对HS成纤维细胞中COLⅠ、COLⅢ含量的影响
如表3所示,0(对照组)、200、400、800 μmol/L的芍药苷作用HS成纤维细胞48 h后,经ELISA实验发现,与对照组比较,200、400、800 μmol/L芍药苷能降低HS成纤维细胞中COLⅠ、COL Ⅲ含量(P< 0.01),且呈剂量依赖关系。
Tab.1Effect of paeoniflorin at different doses on cell viability of the HS fibroblasts
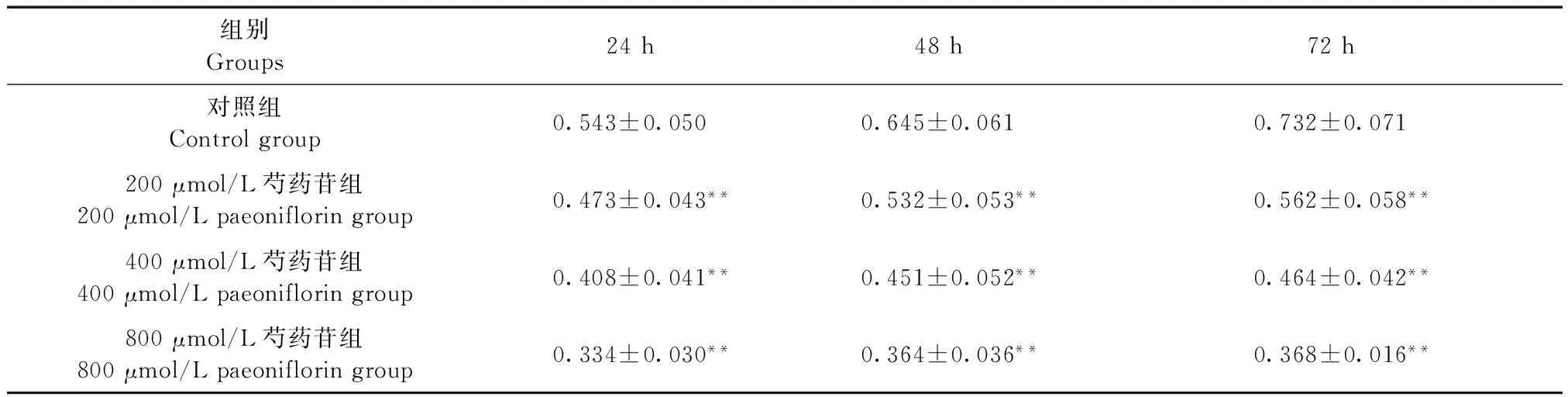
组别Groups24h48h72h对照组Controlgroup0.543±0.0500.645±0.0610.732±0.071200μmol/L芍药苷组200μmol/Lpaeonifloringroup0.473±0.043**0.532±0.053**0.562±0.058**400μmol/L芍药苷组400μmol/Lpaeonifloringroup0.408±0.041**0.451±0.052**0.464±0.042**800μmol/L芍药苷组800μmol/Lpaeonifloringroup0.334±0.030**0.364±0.036**0.368±0.016**
注:与对照组比较,**P< 0.01。
Note. Compared with the control group,**P< 0.01.
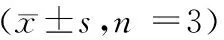
Tab.2Effect of paeoniflorin on cell cycle of the HS fibroblasts

组别GroupsG1期/%G1phaseS期/%SphaseG2期/%G2phase对照组Controlgroup41.53±4.1523.48±2.2435.99±3.60200μmol/L芍药苷组200μmol/Lpaeonifloringroup48.18±4.82**19.42±2.20**33.40±3.34**400μmol/L芍药苷组400μmol/Lpaeonifloringroup55.69±5.57**18.38±1.83**25.93±2.59**800μmol/L芍药苷组800μmol/Lpaeonifloringroup67.86±6.79**14.65±1.45**17.49±1.75**
注:与对照组比较,**P< 0.01。
Note. Compared with the control group,**P< 0.01.
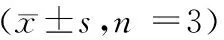
Tab.3Effect of paeoniflorin on the levels of COL I and COL III in HS fibroblasts
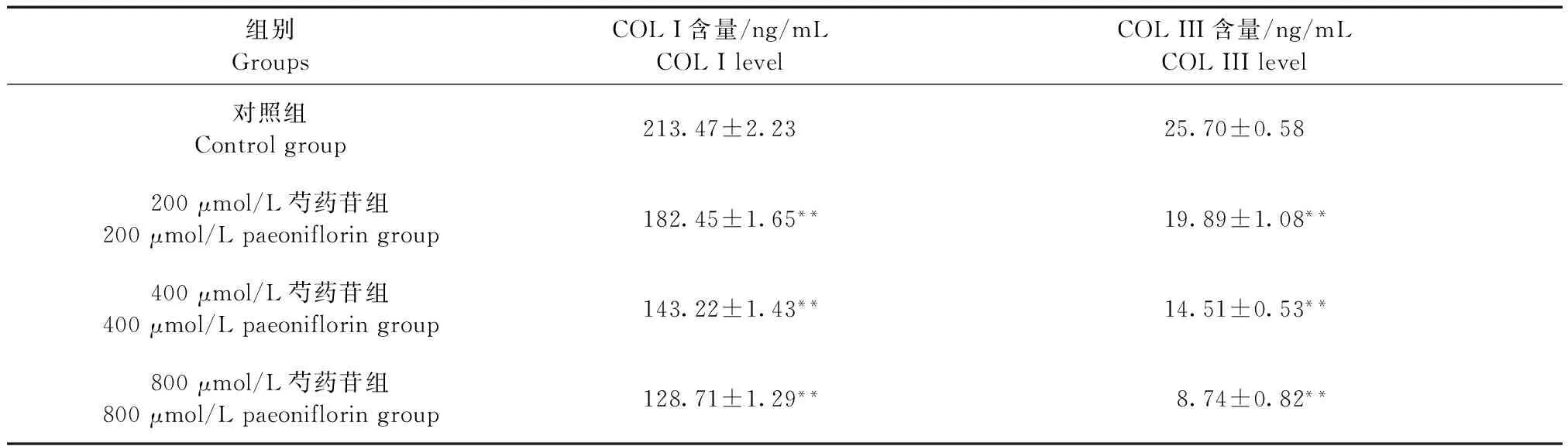
组别GroupsCOLI含量/ng/mLCOLIlevelCOLIII含量/ng/mLCOLIIIlevel对照组Controlgroup213.47±2.2325.70±0.58200μmol/L芍药苷组200μmol/Lpaeonifloringroup182.45±1.65**19.89±1.08**400μmol/L芍药苷组400μmol/Lpaeonifloringroup143.22±1.43**14.51±0.53**800μmol/L芍药苷组800μmol/Lpaeonifloringroup128.71±1.29**8.74±0.82**
注:与对照组比较,**P< 0.01。
Note. Compared with the control group,**P< 0.01.

注:A:对照组;B:200 μmol/L芍药苷组;C:400 μmol/L芍药苷组;D:800 μmol/L芍药苷组。图1 芍药苷对HS成纤维细胞凋亡的影响(× 200)Note. A: Control group; B: 200 μmol/L paeoniflorin group; C: 400 μmol/L paeoniflorin group; D: 800 μmol/L paeoniflorin group.Fig.1 Effect of paeoniflorin on cell apoptosis of the HS fibroblasts
2.5芍药苷对HS成纤维细胞中MMPs含量的影响
如图2所示,0(对照组)、200、400、800 μmol/L的芍药苷作用HS成纤维细胞48 h后,经Western blot实验发现,与对照组比较,200、400、800 μmol/L芍药苷能降低HS成纤维细胞中MMP1及MMP13表达量(P< 0.01),且呈剂量依赖关系。
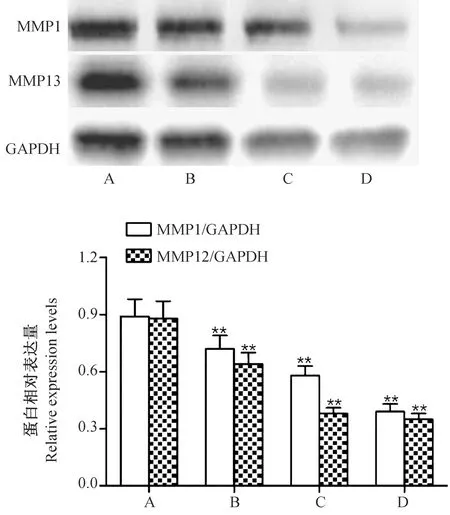
注:A:对照组;B:200 μmol/L芍药苷组;C:400 μmol/L芍药苷组;D:800 μmol/L芍药苷组。与对照组比较,** P< 0.01。图2 芍药苷对HS成纤维细胞中MMPs表达量的影响Note. A: Control group; B: 200 μmol/L paeoniflorin group; C: 400 μmol/L paeoniflorin group; D: 800 μmol/L paeoniflorin group. Compared with the control group,**P< 0.01.Fig.2 Effect of paeoniflorin on the expression levels of MMPs in HS fibroblasts
2.6芍药苷对HS成纤维细胞中TGF-β/Smad信号通路相关蛋白表达的影响
如图2所示,0(对照组)、200、400、800 μmol/L的芍药苷作用HS成纤维细胞48 h后,经Western blot实验发现,与对照组比较,200、400、800 μmol/L芍药苷能降低HS成纤维细胞中TGF-β1、p-Smad2及p-Smad3表达(P< 0.01),且呈剂量依赖关系。

注:A:对照组;B:200 μmol/L芍药苷组;C:400 μmol/L芍药苷组;D:800 μmol/L芍药苷组。与对照组比较,** P< 0.01。图3 芍药苷对HS成纤维细胞中TGF-β/Smad信号通路相关蛋白表达的影响Note. A: Control group; B: 200 μmol/L paeoniflorin group; C: 400 μmol/L paeoniflorin group; D: 800 μmol/L paeoniflorin group. Compared with the control group,**P< 0.01.Fig.3 Effect of paeoniflorin on the expression levels of TGF-β/Smad signaling pathway related proteins in HS fibroblasts
3 讨论
TGF-β包括TGF-β1、TGF-β2及TGF-β3,是创伤愈合过程中重要的细胞因子,其中TGF-β1研究最为广泛。Smad蛋白是TGF-β受体作用的唯一信使分子,包括受体型(Smad2、Smad3、Smad5等)、辅助型(Smad4)及抑制型(Smad6和Smad7)。TGF-β将外界信号传递给Smad2/3,使Smad2/Smad3磷酸化,接着与Smad4结合进入细胞核中调控靶基因的转录。而Smad6/7可以竞争性结合TGF-β受体抑制Smad2/Smad3的磷酸化。研究表明烧伤患者在康复以后常常出现瘢痕组织的增生,而且患者此时瘢痕组织中TGF-β1、Smad2、Smad3的表达量显著高于正常人[10]。而且临床试验证实抗TGF-β抗体对糖尿病肾纤维化作用显著,且副作用小[11]。另外Wang等[12]研究证实TGF-β多肽拮抗剂能显著的减轻HS成纤维细胞表型。这些研究研究说明通过拮抗TGF-β信号通路对HS的治疗具有显著的理论指导意义。
芍药属于毛莨科植物,具有止挛,活血化瘀等功效,被广泛应用于类风湿关节炎、神经退行性疾病、自身能免疫性疾病、心脑血管疾病等疾病的治疗中[13]。芍药苷是芍药主要的单体活性成分,具有抗炎镇痛、抗菌、抗氧化、抗肿瘤、抗抑郁等作用[14]。近些年研究还发现芍药苷具有抗纤维化作用,如胡宗涛等[5]研究表明芍药苷能下调TGF-β1、p-Smad3、p-Smad4及p-Smad7表达抑制大鼠放射性肝纤维化。Zeng等[6]研究证实芍药苷能够减轻肾间质纤维化模型小鼠的肺组织及肾间质纤维化作用,与通过下调p-Smad2及p-Smad3表达有关。Ji等[7]研究证实芍药苷能通过Smad通路抑制TGF-β诱导的A549细胞的纤维化。从而提示芍药苷可能能够通过调控TGF-β/Smad信号通路相关蛋白表达抑制HS成纤维细胞的增殖与胶原沉积。
因此本研究首先参考相关文献并根据预实验[14],采用0、200、400、800 μmol/L芍药苷作用HS成纤维细胞24、48、72 h,MTT结果表明200、400、800 μmol/L芍药苷能显著降低细胞活力,并呈时间及剂量依赖关系。接着Hoechst染色法进一步证实200、400、800 μmol/L芍药苷能使HS细胞核发白,皱染,说明细胞凋亡显著。然后利用流式细胞术检测芍药苷对HS细胞周期的影响,结果表明200、400、800 μmol/L芍药苷能使细胞周期阻滞于G1期,从而说明芍药苷能使细胞复制阻断于DNA复制前期,继而诱导细胞凋亡,最终抑制细胞凋亡。
细胞外基质的胶原不断合成及沉积是HS形成的重要原因之一,是源自于细胞外细胞降解酶的分泌不足所致的[2, 3]。细胞外基质主要成分是Ⅰ型胶原(ColⅠ)和Ⅲ型胶原(Col Ⅲ),这些胶原在HS形成过程不断合成并沉积加剧病情[11]。而MMPs是降解细胞外基质最为重要的蛋白水解酶,MMP1及MMP13是能够降解包括ColⅠ及Col Ⅲ在内几乎所有纤维类胶原的间质胶原酶。且通过抑制TGF-β/Smad信号通路能显著的下调MMP1及MMP13蛋白表达,进而抑制ColⅠ及Col Ⅲ合成,最终减轻小鼠心肌纤维化[9, 15]。所以本研究继续利用Western blot及ELISA实验检测芍药苷对HS成纤维细胞中MMP1,MMP13表达及ColⅠ、Col Ⅲ含量。结果表明芍药苷能显著的下调MMP1及MMP13蛋白表达,减少ColⅠ及Col Ⅲ的合成,最终抑制胶原的沉积。最后本研究探讨芍药苷对TGF-β/Smad信号通路相关蛋白表达的影响,结果表明芍药苷能显著的下调TGF-β1、p-Smad2及p-Smad3表达。
综上所述,200、400、800 μmol/L的芍药苷能显著的降低HS成纤维细胞活力,诱导细胞凋亡,使细胞周期阻滞于G1期,同时下调MMP1及MMP13蛋表达,减少ColⅠ及Col Ⅲ的合成,此过程与芍药苷抑制TGF-β/Smad信号通路有关。
[1] Berman B, Maderal A, Raphael B. Keloids and hypertrophic scars: pathophysiology, classification, and treatment [J]. Dermatol Surg, 2017, 43 Suppl 1: S3-S18.
[2] Zhu Z, Ding J, Tredget EE. The molecular basis of hypertrophic scars [J]. Burns Trauma, 2016, 4: 2.
[3] 柯俐安, 杨军. 增生性瘢痕无创性评估策略及方法 [J]. 组织工程与重建外科杂志, 2016, 12(4): 262-265.
[4] 刘泾科, 薛晓东. 转化生长因子-β1与难愈性创面及病理性瘢痕形成关系研究进展 [J]. 中华实用诊断与治疗杂志, 2015, 29(9): 833-834.
[5] 胡宗涛, 高世乐, 秦峰, 等. 芍药苷对大鼠放射性肝纤维化的保护作用和机制研究 [J]. 解放军药学学报, 2012, 28(4): 283-288.
[6] Zeng J, Dou Y, Guo J, et al. Paeoniflorin ofPaeonialactifloraprevents renal interstitial fibrosis induced by unilateral ureteral obstruction in mice [J]. Phytomedicine, 2013, 20(8-9): 753-759.
[7] Ji Y, Dou YN, Zhao QW, et al. Paeoniflorin suppresses TGF-β mediated epithelial-mesenchymal transition in pulmonary fibrosis through a Smad-dependent pathway [J]. Acta Pharmacol Sin, 2016, 37(6): 794-804.
[8] 张雪, 兰东, 宁淑华, 等. A型肉毒毒素对增生性瘢痕成纤维细胞的抑制作用及机制 [J]. 重庆医学, 2017, 47(5): 580-582.
[9] 孙桂芳, 张晓芬, 陈亚峰, 等. 生肌玉红膏通过下调TGF-β1/Smads抑制人增生性瘢痕成纤维细胞增殖和胶原分泌 [J]. 时珍国医国药, 2016, 27(7): 1590-1593.
[10] 孙桂芳, 张晓芬, 陈亚峰, 等. 转化生长因子-β1/Smads信号在增生性瘢痕形成中的作用研究进展 [J]. 创伤外科杂志, 2015, 17(5): 473-477.
[11] 贾会玉, 李中南, 陈光亮. 糖尿病肾病中转化生长因子β1/Sma和Mad相关蛋白信号通路的作用及其相关药物研究进展 [J]. 中国药理学与毒理学杂志, 2016, 30(3): 266-271.
[12] Wang X, Gao Z, Wu X, et al. Inhibitory effect of TGF-β peptide antagonist on the fibrotic phenotype of human hypertrophic scar fibroblasts [J]. Pharm Biol, 2016, 54(7): 1189-1197.
[13] 金英善, 陈曼丽, 陶俊. 芍药化学成分和药理作用研究进展 [J]. 中国药理学与毒理学杂志, 2013, 27(4): 745-750.
[14] 葛永斌, 程孝中, 燕傲蕾, 等. 芍药苷抗肿瘤作用机制研究进展 [J]. 中药材, 2015, 38(3): 636-639.
[15] Seeland U, Schaffer A, Selejan S, et al. Effects of AT1- and β-adrenergic receptor antagonists on TGF-β1-induced fibrosis in transgenic mice [J]. Eur J Clin Invest, 2009, 39(10): 851-859.
Inhibitoryeffectandmechanismofpaeoniflorinonproliferationofhypertrophicscarfibroblasts
WANG Lei, Ma Yuan-yuan, Li Ya-ling, Zhou Yue-min
(Department of Orthopedic Surgery, Huaihe Hospital Affiliated to Henan University, Kaifeng 475001, China)
ObjectiveTo explore the inhibitory effect and related mechanism of paeoniflorin on proliferation of hypertrophic scar (HS) fibroblasts.MethodsHS fibroblasts were cultured with 0 (control), 200, 400, 800 μmol/L of paeoniflorin for 24, 48, and 72 h. Cell viability was detected by MTT assay. Cell apoptosis was detected using Hoechst staining. Cell cycle was measured by flow cytometry. The levels of type I collagen (COL I) and type III collagen (COL III) were detected by enzyme linked immunosorbent assay (ELISA). The expressions of transforming growth factor-β (TGF-β)/Smad signaling pathway related proteins, as well as matrix metalloproteinase 1 (MMP1) and MMP13 were detected by Western blot.Results200, 400, 800 μmol/L of paeoniflorin reduced the cell viability of HS fibroblasts significantly (P< 0.01), with the nuclei turning pale and shrunken, and caused cell cycle arrest at G1 phase (P< 0.01). Moreover, the levels of COL I and COL III in the cells were decreased significantly (P< 0.01), and the expressions of MMP1, MMP13, TGF-β1, p-Smad2 and p-Smad3 were down-regulated significantly (P< 0.01).ConclusionsPaeoniflorin can obviously inhibit the proliferation and collagen synthesis of hypertrophic scar fibroblasts, probably through inhibition of the TGF-β1/Smad signaling pathway.
Paeoniflorin; Hypertrophic scar, HS; Fibroblasts; Proliferation; Collagen synthesis
河南省省部共建课题项目:自体细胞培养复合型人工真皮的构建及临床应用研究(编号:201401014)。
王雷(1982 -),男,本科,研究方向:瘢痕的预防及治疗。E-mail: 54206653@qq.com
R-33
A
1671-7856(2017) 11-0038-06
10.3969.j.issn.1671-7856. 2017.11.008
2017-05-26

