果胶酶预处理辅助提取沉香精油研究
李明月,沈华杰,何海珊,邱坚
(西南林业大学材料工程学院,昆明 650224)
果胶酶预处理辅助提取沉香精油研究
李明月,沈华杰,何海珊,邱坚*
(西南林业大学材料工程学院,昆明 650224)
为提高沉香精油的提取得率并缩短提取时间,利用单因素法研究不同果胶酶预处理条件对沉香精油提取的影响。结果表明,当果胶酶预处理温度为60℃、质量分数为2%、预处理时间为5 h 时,沉香精油的提取得率达21.33%,与未进行预处理的提取工艺相比,提取得率增加了11.05%,果胶酶预处理可提高沉香精油提取得率。利用气质联用色谱检测预处理后沉香精油的主要化学成分,结果表明果胶酶预处理辅助提取沉香精油提高了精油得率,同时保留了精油纯度,具有良好的应用前景。沉香精油提取后残渣的主要化学成分测定结果表明,综纤维素质量分数为73.26%、木质素质量分数为20.98%、灰分质量分数为0.23%。研究结果可为精油提取后残渣利用提供基础数据。
果胶酶;沉香精油;提取;得率
沉香具有行气止痛、温中止呕、纳气平喘等功效[1],主要源于沉香中含有倍半萜类化合物和色酮类化合物[2-3],这两种成分主要存在于沉香挥发油中。目前除部分沉香的木质工艺品外,大部分沉香产品需将沉香精油从沉香木质部中提取出来再进行加工[4-5],所以沉香精油的提取工艺较为重要。常规的沉香精油提取方法有水蒸气蒸馏法、95%乙醇回流抽提法、苯醇抽提法、石油醚浸渍法等[6]。酶辅助提取法是近几年出现的沉香精油提取方法,其原理为通过酶水解细胞骨架,打通溶出的通道,从而快速高效地溶出细胞中活性成分[7-8]。随着沉香产业的发展,沉香精油大批量产出后,精油提取后残渣处理问题受到广泛关注。
果胶广泛存在于植物的初生壁和胞间层中,纹孔是在细胞壁形成过程中初生壁上未被加厚的部分,主要化学成分为果胶[9-10]。果胶酶是指各种可以分解果胶质的酶的总称,分为原果胶酶、碱性果胶酶和普通果胶酶[11-12]。近年来果胶酶被应用于果汁加工、纺织业、木材防腐、环境保护、木材纤维分离等各个领域。研究者利用果胶酶酶解胞间层的果胶,从而加快纤维分离时间[13],也有研究表明果胶酶预处理可通过打通木质部的通道而提高木材的渗透性[14]。笔者利用果胶酶酶水解果胶作用打通沉香精油溶出通道辅助提取沉香精油,以提高精油得率为目标,制定和完善果胶酶预处理提取沉香精油的提取工艺。
1 材料与方法
1.1 材料与仪器
沉香样品市购;果胶酶购自上海蓝季生物有限公司,酶活性为20 000 U/g,可用pH范围3.5~6.0;索氏抽提器(自组,使用回流管、烧瓶等组装);扫描电镜(日本,SU3500);THERMO TRACE1310/ISQ气相色谱质谱联用仪(美国,ISQ系列)。
1.2 试验方法
1.2.1 果胶酶预处理最佳条件确定
沉香样品粉碎,过40~60目(0.38~0.25 mm)筛后,取2.000 0 g至不同质量分数的果胶酶溶液中,在水浴锅中于不同温度条件下分别处理不同时间。加入定量乙醇溶液使乙醇溶液体积分数达到95%,使用索氏抽提器进行抽提。计算抽提所得精油得率,确定精油得率最高的预处理条件。
根据单因素考察结果(表1),在预试验基础上选取果胶酶质量分数为1%,2%,3%,4%和5%,在50℃条件下处理沉香样品2 h;根据单因素考察结果,确定果胶酶浓度为c时精油得率较高,以c浓度的果胶酶,在预试验基础上选取处理时间2,3,4,5和6 h;根据单因素考察结果,确定果胶酶浓度为c,处理时间为t,在预试验基础上选取处理温度为45,50,55,60和65℃;根据单因素考察结果,确定果胶酶浓度为c,处理时间为t,处理温度为T时为果胶酶预处理最佳条件。

表1 果胶酶预处理辅助提取沉香精油方案Table 1 Processing scheme of pectinase on extractingessential oil from agilawood
1.2.2 有效抽提时间确定
样品处理后加入适量的乙醇溶液使抽提所用液体的乙醇体积分数为95%,使用索氏抽提器进行抽提,控制抽提温度确保每小时回流次数为6次,抽提6 h后,将液体浓缩至100 mL,取抽提液25 mL,置于已恒重的蒸发皿中。将蒸发皿置于水浴锅上蒸干,放至105℃烘箱中干燥3 h后,在干燥皿中冷却30 min,取出后迅速称质量。计算精油的得率,确定精油得率最高的果胶酶质量分数。
将沉香样品研磨(过40~60目筛)平均分为12份,其中6份选择最佳预处理方案处理样品沉香,6份为空白对照组不经预处理,将2组沉香进行抽提,抽提时间分别为1,2,3,4,5和6 h,从而确定较为有效的抽提时间。
1.2.3 果胶酶预处理后沉香木质部结构观察
将沉香木块切成0.5 cm×0.5 cm×0.5 cm的小木块2组,在莱卡切片机上将径切面表面处理光滑,选取其中1组小木块采用最佳果胶酶预处理方案进行处理,处理后将2组小木块在体积分数为50%,75%,95%和100%的乙醇溶液、100%正丁醇溶液、100%二甲苯溶液中逐级脱水,试样脱水后喷金处理,在扫描电镜下观察经过果胶酶预处理的沉香样品和未经果胶酶处理的沉香样品木质部结构的变化。
1.2.4 果胶酶预处理后精油化学成分检测
果胶酶辅助提取所得沉香精油在水浴锅上将乙醇和水蒸干,使用色谱纯甲醇溶解,通过GC-MS进行样品分析,进样初始温度60℃,升温速度为5℃/min,升温达到280℃保留20 min。离子源温度260℃,溶剂延迟2 min,采集模式scan mode,信号阈值500。在气质联用色谱图库中检测有效化学成分。
1.2.5 精油提取残渣化学成分分析
对精油提取后的残渣进行主要化学成分分析,综纤维素质量分数参考GB/T 2677.10—1995《造纸原料综纤维素含量的测定》进行测定。木质素质量分数采用Klason法进行测定。灰分质量分数参考GB/T 742—2008《造纸原料、纸浆、纸和纸板灰分的测定》进行测定。
2 结果与分析
2.1 果胶酶预处理方案选择
果胶酶预处理试验方案及不同条件预处理后精油提取得率结果见表2。由表2可见,果胶酶预处理可提高沉香精油的抽提得率。当温度50℃、预处理时间2 h时,果胶酶质量分数为2%~3%时,精油得率最高达12.53%。当果胶酶质量分数为2%、预处理温度为50℃时,随着预处理时间增加,精油得率呈上升趋势。当预处理时间为5 h时精油得率18.20%;预处理时间为6 h时,精油得率18.32%,与预处理时间为5 h的得率相比增加不明显。因此,选取最佳预处理时间为5 h。当果胶酶质量分数为2%、预处理时间5 h时,不同温度预处理试验样品的精油得率随温度升高呈缓慢上升趋势,预处理温度为60℃时精油得率最高达21.33%。
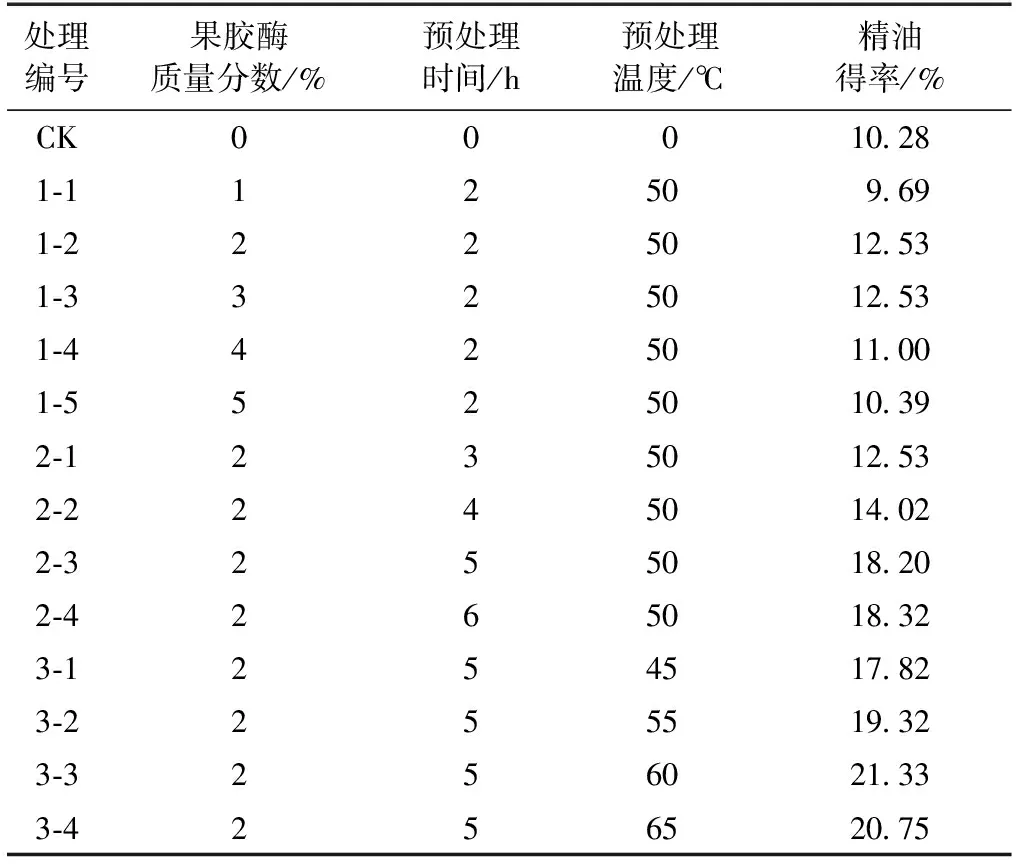
表2 果胶酶质量分数、预处理时间、预处理温度对沉香精油提取得率的影响Table 2 Effect of pectinase concentration, pretreatmenttime and temperature on extraction rate
由上述分析可知,果胶酶预处理辅助提取沉香精油的最佳预处理条件为:果胶酶质量分数2%,预处理时间5 h,预处理温度60℃。经此条件预处理后沉香精油得率达21.33%,与未进行预处理的提取工艺相比,沉香精油得率增加了11.05%。

图2 果胶酶预处理前后细胞壁纹孔变化Fig. 2 Changes of pit membrane after pectinase pretreatment
2.2 果胶酶预处理对沉香抽提时间的影响
沉香精油提取得率是沉香精油提取工艺的一个重要指标,同时提取时间、提取所需能耗也是精油提取工艺中的关键技术指标。在不同抽提时间(1,2,3,4,5和6 h)对经果胶酶预处理的样品和对照样品分别测定精油得率,精油得率随时间的变化情况如图1所示。由图1可知,随抽提时间延长,沉香精油得率呈增加趋势,精油得率在1~2 h增加明显,3 h后增加趋于平缓。经果胶酶预处理的沉香精油得率在2 h后达到16.78%,而未进行预处理的样品提取得率为11.82%。未经果胶酶预处理的样品在抽提4 h后提取得率基本稳定,而经果胶酶预处理的提取得率在4~6 h缓慢增加。总之,经果胶酶预处理的样品提取得率较未经处理的样品显著增加,虽然抽提时间较长,但抽提得率增加,这表明果胶酶预处理增加了沉香精油溶出通道,能够提高沉香精油提取得率。
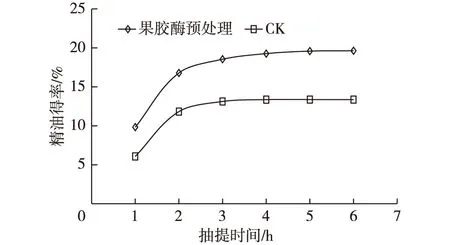
图1 抽提时间对沉香精油得率的影响Fig. 1 Effect of extraction time on extraction rate
2.3 果胶酶预处理对沉香木质部结构的影响
为分析果胶酶预处理对沉香木质部结构的影响,在扫描电镜下观察经果胶酶预处理样品与对照组样品的纹孔结构是否被破坏,结果如图2所示。由图2a可知,未经果胶酶预处理的样品结构表面粗糙,纹孔紧密完整,不利于沉香精油溶出;而由图2b可见,经过果胶预处理后,沉香结构表面光滑,纹孔结构被破坏而增大,有利于沉香精油溶出,提高精油得率。
2.4 果胶酶辅助提取沉香精油的GC-MS分析
对果胶酶预处理辅助提取的沉香精油进行GC-MS分析,结果如表3和图3所示。由表3和图3可知,经果胶酶预处理后,沉香精油中并未出现太多杂质,沉香纯度相对较高。沉香精油中的有效化学成分倍半萜类、色酮类化合物并未被破坏,如GC-MS检测出的沉香精油中的特征有效成分2-(2-苯乙基)色酮(图4)。由此可见,果胶酶预处理辅助提取沉香精油既能够提高精油得率,同时未破坏精油的有效化学成分,是一种有效的精油提取工艺。

表3 果胶酶预处理后提取精油的主要化学成分Table 3 Chemical composition of extraction afterpectinase pretreatment
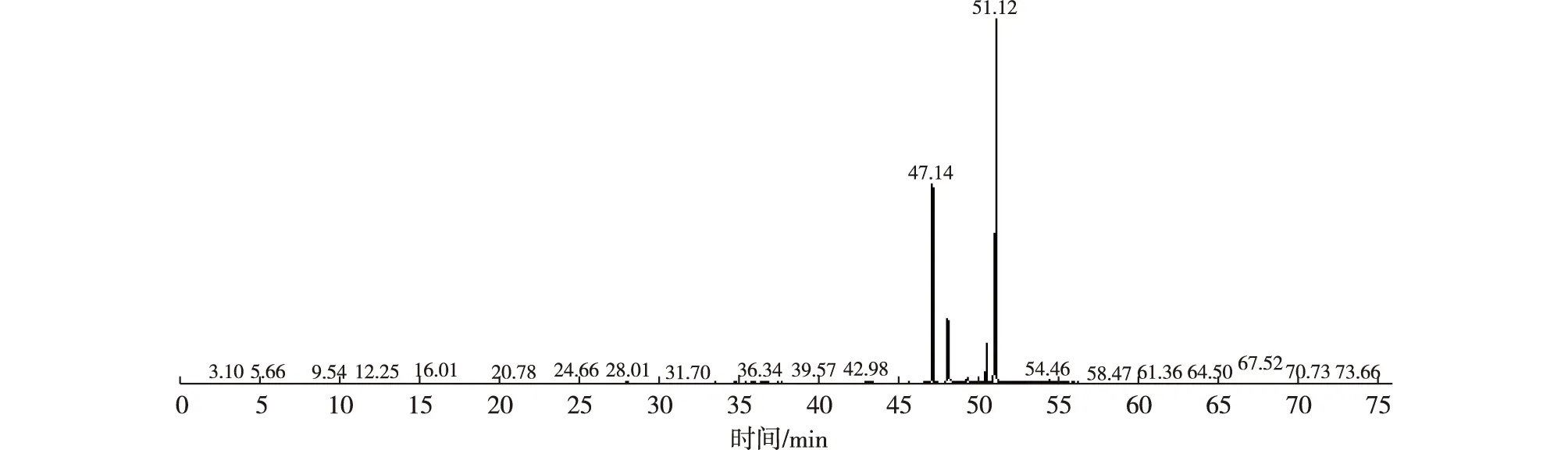
图3 果胶酶预处理后提取精油化学成分的GC-MS分析Fig. 3 The GC-MS analysis of extraction after pectinase pretreatment
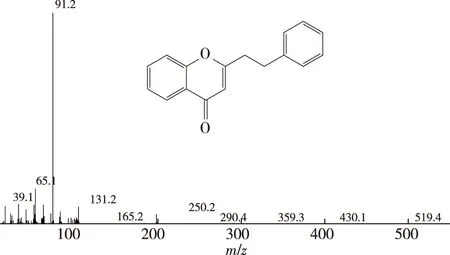
图4 果胶酶预处理后提取精油化学成分2-(2-苯乙基)色酮的GC-MS分析Fig. 4 The GC-MS analysis of 2-(2-Phenyleyhyl)chromone after pectinase pretreatment
2.5 精油提取残渣主要化学成分分析
沉香精油提取后残渣的主要化学成分是沉香残渣利用的重要指标,对沉香精油提取后的残渣进行主要化学成分分析,结果如表4所示。由表4可见,未经处理精油提取后残渣主要化学成分中综纤维素的质量分数达到77.56%,且灰分质量分数较少。经果胶酶处理后综纤维素质量分数稍有降低,可能是由于果胶酶中含有少量的纤维素水解酶,从而降低了纤维素质量分数。根据精油提取后沉香残渣的主要化学成分分析,主要化学成分为综纤维素,通过纤维素酶水解沉香残渣中的纤维素为糖类[15],这一方案应用于生物质转换中可减少工艺中的污染,增加附加值。
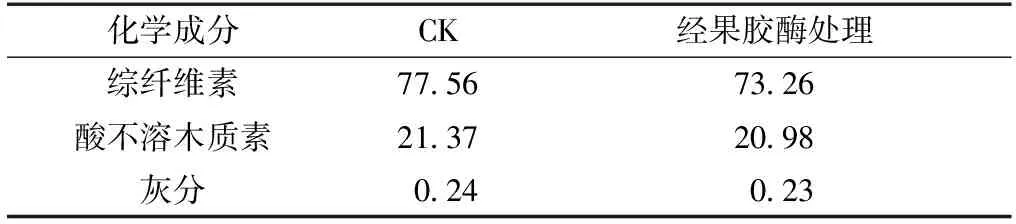
表4 精油提取后沉香残渣主要化学成分Table 4 Main chemical component of residue /%
3 结 论
利用果胶酶辅助提取沉香精油,以精油得率为指标确定果胶酶预处理的最佳条件。果胶酶预处理中果胶酶的酶水解作用水解了细胞壁上纹孔,从而增加了沉香精油溶出的通道,进而提高沉香精油的抽提得率。当预处理温度为60℃,处理时间为5 h,果胶酶质量分数为2%时,沉香精油的提取得率最高达21.33%,较对照组增加了11.05%。果胶酶预处理辅助提取沉香精油提高了精油抽提得率,且沉香精油的有效化学成分未改变,具有一定应用前景。
[1]戴好富, 梅文莉. 海南药用植物现代研究[M]. 北京:中国科学技术出版社, 2007:33.
DAI H F, MEI W L. Research on medicinal plants in Hainan[M]. Beijing:Science and Technology of China Press, 2007:33.
[2]杨峻山. 沉香化学成分的研究概况[J]. 天然产物研究与开发, 1998(1):99-103.
YANG J S. Study on agarwood chemical composition[J]. Natural Product Research and Development, 1998(1):99-103.
[3]苗成林, 孙宝腾, 罗丽萍, 等. 动态顶空进样-气质联用法分析国产沉香化学成分[J]. 食品科学, 2009, 30(8):215-217.
MIAO C L, SUN B T, LUO L P, et al. Analysis of chemical constituents of Chinese eaglewood wood by gas chromatography-mass spectrometry coupled with dynamic headspace sampling[J]. Food Science, 2009, 30(8):215-217.
[4]曾海亮, 蒋谦才, 张小花, 等. 沉香中药洗发水及其制法:CN103054777A[P]. 2013-04-24.
ZENG H L, JIANG Q C, ZHANG X H, et al. Chinese traditional medicine shampoo with agarwood and its manufacturing method:CN103054777A[P]. 2013-04-24.
[5]丁宗妙, 冯锦东, 弓宝, 等. 一种能够改善睡眠的沉香复方精油:CN 102210789B[P]. 2011-10-21.
DING Z M, FENG J D, GONG B, et al. A kind of compound essential oil from agarwood can improve sleep:CN 102210789B[P]. 2011-10-21.
[6]邓红梅, 周如金, 童汉清. 超临界二氧化碳萃取沉香精油工艺条件研究[J]. 时珍国医国药, 2009, 20(3):577-579.
DENG H M, ZHOU R J, TONG H Q. Study on extraction technique of the essential oil from Chinese eaglewood by supercritical CO2extraction[J]. Lishizhen Medicine and Materia Medica Research, 2009, 20(3):577-579.
[7]弓宝, 杨云, 黄立标, 等. 纤维素酶辅助提取沉香挥发油的工艺研究[J]. 中国新药杂志, 2013(15):1833-1835.
GONG B, YANG Y, HUANG L B, et al. Cellulase-assisted extraction of essential oil from eaglewood[J]. Chinese Journal of New Drugs, 2013(15):1833-1835.
[8]弓宝, 黄立标, 冯锦东, 等. 考察不同发酵时间对沉香精油提取率的影响[J]. 香料香精化妆品, 2011(6):17-18.
GONG B, HUANG L B, FENG J D, et al. The influence of different fermentation time on extracting yield of essential oil from eaglewood[J]. Flavour Fragrance Cosmetics, 2011(6):17-18.
[9]BASKIN T I. Anisotropic expansion of the plant cell wall[J]. Annual Review of Cell and Developmental Biology, 2005, 21(21):203-222.
[10]CAFFALL K H, MOHNEN D. The structure, function, and biosynthesis of plant cell wall pectic polysaccharides[J]. Carbohydrate Research, 2009, 344(14):1879-1900.
[11]李祖明, 张洪勋, 白志辉, 等. 微生物果胶酶研究进展[J]. 生物技术通报, 2010(3):42-49.
LI Z M, ZHANG H X, BAI Z H, et al. Advance in microbial pectinases research[J]. Biotechnology Bulletin, 2010(3):42-49.
[12]李伟, 吴槟. 产酸性果胶酶的研究应用及展望[J]. 生物技术世界, 2013(4):169.
[13]吴宁, 杜官本, 李晓平. 果胶酶预处理对木材纤维分离的影响初探[J]. 纤维素科学与技术, 2015, 23(1):21-28.
WU N, DU G B, LI X P. Effects of pectin enzyme pretreatment on wood fiber separation[J]. Journal of Cellulose Science and Technology, 2015, 23(1):21-28.
[14]黄镇亚, 于滨, 张力平. 酶法提高木材渗透性的研究[J]. 北京林业大学学报, 1991(2):1-7.
HUANG Z Y, YU B, ZHANG L P. Enzymatic improve permeability of wood[J].Journal of Beijing Forestry Uniwersity, 1991(2):1-7.
[15]吴创之, 周肇秋, 阴秀丽, 等. 我国生物质能源发展现状与思考[J]. 农业机械学报, 2009, 40(1):91-99.
WU C Z, ZHOU Z Q, YIN X L, et al. Current status of biomass energy development in China[J]. Transactions of the Chinese Society for Agricultural Machinery, 2009, 40(1):91-99.
Effectofpectinasetreatmentonextractionofessentialoilfromagarwood
LI Mingyue, SHEN Huajie, HE Haishan, QIU Jian*
(College of Materials Engineering, Southwest Forestry University, Kunming 650224, China)
The pectinase pretreatment of agarwood was optimized including temperature, time, and pectinase dosage by using single factor test. The compositions of extracted essential oil from the agarwood before and after the pretreatment were determined by gas chromatography-msaa spectrometer to investigate the effect of the pretreatment. The xylem structure of the agarwood after pretreatment was observed by scanning electron microscope. The chemical composition of extraction residue was also analyzed. The optimum conditions were determined as enzymolysis temperature of 60℃, time of 5 h, and pectinase dosage of 2%, at which the yield of essential oil from the agarwood reached 21.33% and increased 11.05% compared with that without the pretreatment. The effective chemical components of essential oil remained the same after the pretreatment. The results from scanning electron microscope showed that the pectinase pretreatment destroyed the pits on agarwood cell wall, which could improve the extraction of essential oil. The results of chemical analysis showed that extraction residue had holocellulose content of 73.26%, lignin content of 20.98% and ash content of 0.23%.
pectinase; essential oil; extraction; yield
2017-05-05
2017-08-13
国家自然科学基金(31570555)。
李明月,女,研究方向为木材学及木材功能性改良。
邱坚,男,教授。E-mail:qiujianswfu@foxmail.com
TQ351.3
A
2096-1359(2017)06-0055-05

