参芍口服液对糖尿病肾病大鼠肾脏内质网应激因子GRP78、PERK及CHOP表达的影响
远迪 ,董云朋 ,曾招军 ,黄安静 ,张春来 ,周洪霞
(1.华北理工大学,河北 唐山 063000;2.河北省唐山工人医院 心内四科,河北 唐山 063000)
参芍口服液对糖尿病肾病大鼠肾脏内质网应激因子GRP78、PERK及CHOP表达的影响
远迪1,董云朋1,曾招军1,黄安静1,张春来2,周洪霞2
(1.华北理工大学,河北 唐山 063000;2.河北省唐山工人医院 心内四科,河北 唐山 063000)
目的观察参芍口服液对糖尿病肾病大鼠肾脏内质网应激标志性因子GRP78、PERK及CHOP表达的影响。方法将30只健康雄性Wistar大鼠随机分为正常对照组(Sham组)、模型组(DN组)和参芍口服液组(SS组)。DN组和SS组予以高脂饲料加链脲佐菌素腹腔注射复制糖尿病肾病模型。SS组每日1次给予参芍口服液(250 mg/kg)灌胃,Sham组和DN组每日1次给予等剂量的蒸馏水灌胃。12周后检测各组血糖、尿素氮(BUN)、肌酐(Scr)及24 h尿蛋白定量(PRO);HE染色光镜下观察大鼠肾组织病理形态学改变;Western blot检测大鼠肾组织GRP78、PERK及CHOP蛋白表达情况;TUNEL染色检测大鼠肾组织细胞凋亡情况。结果DN组血糖、BUN、Scr及PRO与Sham组相比均增高,SS组血糖、BUN、Scr及PRO与DN组相比均降低(P<0.05)。HE发现Sham组大鼠肾组织形态结构清楚,未见异常;DN组可见肾小球体积增大,可见大量炎症细胞浸润,肾小球系膜基质区增生,肾小管基底膜增厚,部分肾小球、肾小管出现纤维化;SS组肾组织病理形态变化轻于DN组。Western blot发现DN组肾脏组织GRP78、PERK及CHOP蛋白表达高于Sham组,SS组肾组织GRP78、PERK及CHOP蛋白表达均低于DN组(P<0.05)。TUNEL发现DN组较Sham组肾脏组织存在更多细胞凋亡;SS组凋亡细胞少于DN组。结论参芍口服液可减轻糖尿病肾病大鼠肾脏病理损害,延缓肾功能减退,具有肾保护作用,其机制可能与降低内质网应激相关因子GRP78、PERK及CHOP的表达及减少肾组织细胞凋亡有关。
参芍口服液;糖尿病肾病;内质网应激;细胞凋亡;PERK;大鼠
糖尿病肾病(diabetic nephropathy,DN)是糖尿病患者重要的并发症之一,DN进展为慢性肾衰竭的比例逐年升高,是导致终末期肾衰竭的主要原因[1-2]。其发病机制复杂目前还未明确。近年来发现,内质网应激(endoplasmic reticulum stress,ERS)与糖尿病肾病的发生有密切关系[3]。研究表明[4],高血糖可诱发ERS,内质网应激及其介导的细胞凋亡在DN发生、发展中起重要作用,内质网应激是DN的重要发病机制。中医认为“脾肾气虚,痰瘀阻络”是糖尿病肾病发病的重要原因,研究发现中药在DN的早期防治有独特优势,可使糖尿病肾病的进展得到有效延缓[5-6]。参芍口服液是复方制剂,具备活血化瘀、益气通络之功效,以丹参、黄芪、赤芍及水蛭等主要成分精制而成[7]。研究已明确,参芍口服液可通过抑制DN病变过程中炎症因子的表达,改善糖尿病大鼠早期肾脏损害的作用。但参芍口服液是否能通过对糖尿病肾病内质网应激的影响发挥对肾功能的保护作用及作用机制目前尚不明确。本文从内质网应激的角度,研究观察参芍口服液对糖尿病肾损害大鼠肾脏内质网应激标志性因子GRP78、PERK及CHOP表达的影响。
1 材料与方法
1.1 实验动物
8周龄30只健康Wistar雄性大鼠,无特定病原体(SPF)级,体重120~160 g;由华北理工大学动物中心提供(环境设施合格证号:028)。
1.2 药物与试剂
参芍口服液(唐山市工人医院制剂室,批号:Z20050957)药物成份:丹参 250 g,黄芪 250 g,赤芍150 g,当归 150 g,川芎 75 g,桃仁 125 g,红花 75 g,水蛭187.5 g,地龙250 g,清半夏125 g。链脲佐菌素(streptozotocin,STZ)(美国 Sigma公司),血糖仪及血糖试纸(美国强生公司),免疫印迹试剂盒(上海碧云天生物公司),兔抗鼠GRP78抗体(美国Abcam公司),兔抗鼠PERK抗体及CHOP抗体(美国Abcam公司),TUNEL凋亡检测试剂盒(美国ROCHE公司)。
1.3 动物分组及模型复制
将30大鼠随机分为正常对照组(Sham组)、模型组(DN组)、参芍口服液组(SS组),各10只,Sham组以普通饲料喂养,DN组和SS组采用高脂饲料喂养。DN组和SS组禁食12 h后,予以一次性STZ(25 mg/kg)腹腔注射制备糖尿病肾病模型,分别于第2、3及14天,连续3次监测血糖≥16.7 mmol/L,并伴有多饮、多尿、多食,收集尿液测尿糖为+++、++++(强阳性),24 h尿蛋白定量 >30 mg/24 h,为造模成功。造模过程中,DN组和SS组各有1只大鼠血糖不符合模型标准和各有1只大鼠死亡,均被剔除。最终共26只大鼠(Sham组10只、DN组8只、SS组8只)纳入实验。
1.4 药物干预
造模后各组大鼠灌胃给药,SS组大鼠每天1次250 mg/kg参芍口服液灌胃,Sham组和DN组每天1次等剂量的蒸馏水灌胃,共12周。
1.5 标本采集与检测
1.5.1 血糖及肾功能指标检测 于给药12周用代谢笼采集大鼠24 h尿液,腹主动脉取血3 ml,监测各组大鼠血糖、血尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,Scr)水平、24 h 尿蛋白定量(proteinuria,24 h PRO)。
1.5.2 肾脏组织病理学检查 在采集血、尿标本后处死各组大鼠,取出肾组织,一部分制作成石蜡块,另一部分标本置于-80℃冰箱保存备用。将石蜡块包埋的肾组织切成4μm厚度切片,进行HE染色,按常规脱蜡,经苏木素染色、返蓝、伊红染色、再经乙醇、二甲苯冲洗及封片等步骤。显微镜下观察肾组织病理学改变。
1.5.3 肾组织GRP78、PERK及CHOP蛋白水平表达的检测 应用Western blot法,将肾组织取出,提取蛋白,取样品蛋白加入上样缓冲液,放到电泳槽上进行凝胶电泳,电泳结束后,将分离的蛋白条带转印至PVDF膜上,封闭,再分别加入一抗GRP78、PERK及CHOP抗体及辣根过氧化物酶标记的二抗对其进行孵育,洗膜,最后用生物凝胶图像分析系统软件进行蛋白定量分析,以目的条带与GAPDH条带的比值作为蛋白相对表达量。
1.5.4 大鼠肾脏细胞凋亡情况的检测 将肾组织石蜡块包埋后切片,进行TUNEL染色,按试剂盒说明书进行操作过程,经过烤片、脱蜡、孵育、冲洗、显色、细胞核复染及封片等步骤,显微镜下观察肾组织细胞凋亡情况。
1.6 统计学方法
数据处理采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,比较采用方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 参芍口服液对血糖及肾功能的影响
DN 组的血糖、BUN、Scr、24 h PRO 水平与 Sham组相比均增高(P<0.05),SS组上述指标的水平均低于DN组(P<0.05),见附表。
附表 各组大鼠血糖、及肾功能指标比较 (±s)
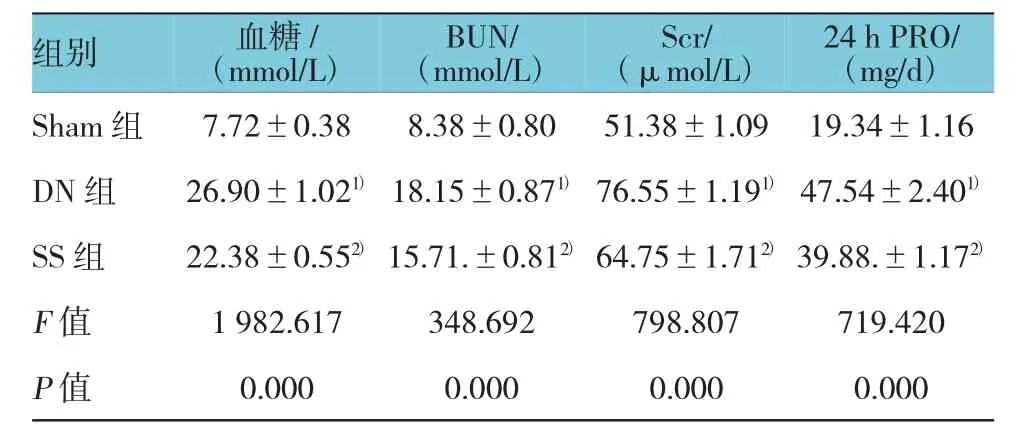
附表 各组大鼠血糖、及肾功能指标比较 (±s)
注:1)与 Sham 组比较,P <0.05;2)与 SS组比较,P <0.05
组别 血糖/(mmol/L)BUN/(mmol/L)Scr/(μmol/L)24 h PRO/(mg/d)Sham 组 7.72±0.38 8.38±0.80 51.38±1.09 19.34±1.16 DN 组 26.90±1.021) 18.15±0.871) 76.55±1.191) 47.54±2.401)SS 组 22.38±0.552) 15.71.±0.812) 64.75±1.712) 39.88.±1.172)F值 1 982.617 348.692 798.807 719.420 P值 0.000 0.000 0.000 0.000
2.2 参芍口服液对肾组织病理形态学改变的影响
HE染色示,Sham组可见大鼠肾组织结构清楚未见明显异常;DN组可见大鼠肾小球体积明显增大及大量炎细胞浸润,肾小球系膜基质及细胞外基区质增生,肾小管基底膜变厚,肾小管上皮细胞出现空泡变性及管腔炎细胞浸润,部分肾小球、肾小管纤维化;SS组与DN组相比肾小球及肾小管病理变化明显减轻。见图1。
2.3 参芍口服液对大鼠肾组织GRP78、PERK及CHOP蛋白水平表达的影响
Western blot结果示,DN组肾组织 GRP78、PERK和CHOP蛋白表达水平比Sham组增加(P<0.05);与 DN 组比较,SS组肾组织 GRP78、PERK 和CHOP蛋白表达水平降低(P<0.05)。见图2。
2.4 参芍口服液对大鼠肾组织细胞凋亡变化的影响
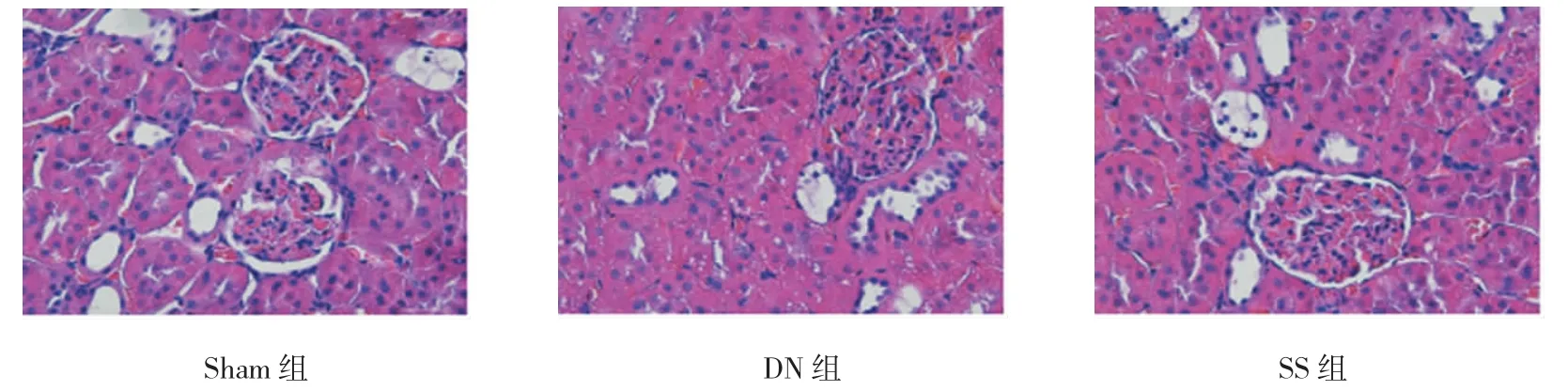
图1 各组大鼠肾组织病理学改变 (HE×400)
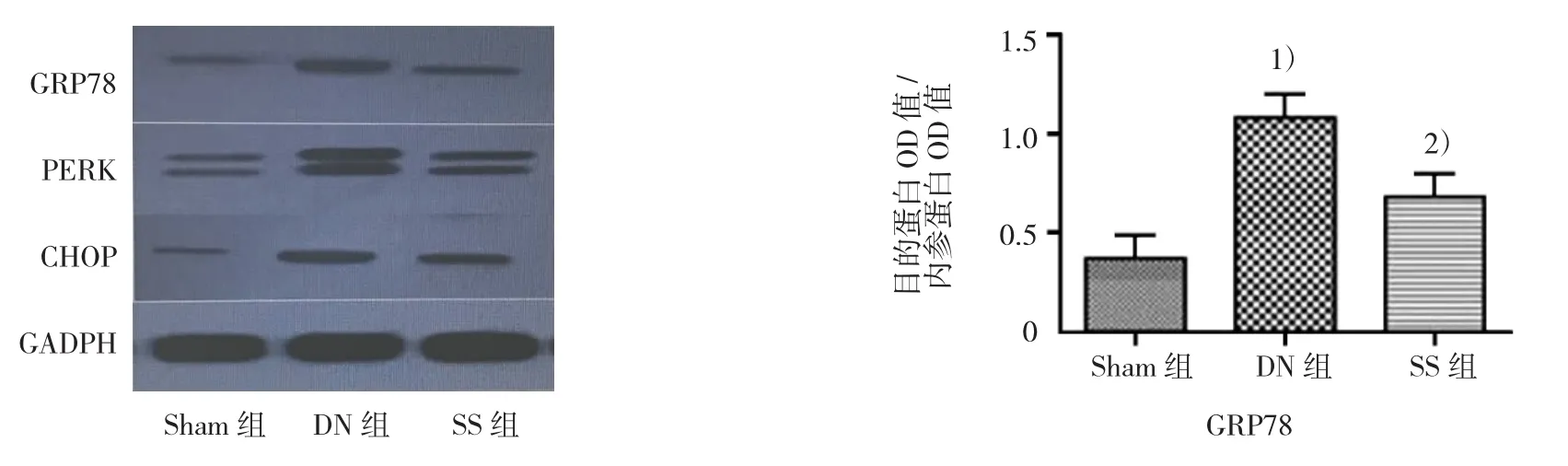
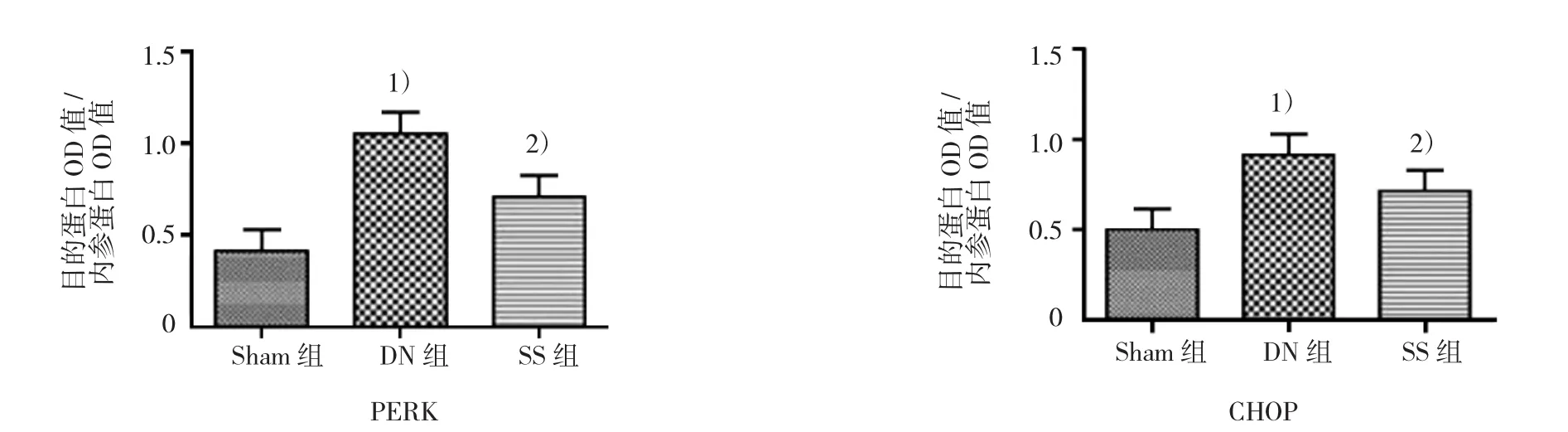
图2 各组大鼠肾组织GRP78、PERK、CHOP的表达 (Western blot法检测)
TUNEL染色检测各组大鼠肾组织细胞凋亡情况,显微镜下观察显示,TUNEL染色定位于细胞核内,细胞核呈棕黄色为阳性细胞,正常细胞核显色为蓝色。Sham组大鼠肾组织细胞可见少量凋亡细胞;与Sham组比较,DN组大鼠肾组织可见肾小球和肾小管均有大量凋亡细胞;SS组较DN组凋亡细胞减少。见图3。
3 讨论
糖尿病肾病是以蛋白尿和肾功能逐渐下降为主要临床表现,成为导致糖尿病患者死亡的重要原因,临床尚未有明确有效的治疗方法,近年来对其发病机制及防治方法的研究成为人们研究的焦点[8]。大量的临床实践研究发现,以益气活血化瘀为理念,中药在改善DN的临床症状、延缓肾功能下降等方面具有明显优势[9-10]。参芍口服液是以活血化瘀为治疗原则,兼以补气通络为法以丹参、黄芪、川芎、地龙及水蛭等为主要成分研究而成的中药复方制剂,具备活血化瘀、抗氧化应激和抑制纤维化等作用[7,11],参芍口服液符合中医治疗本虚标实慢性肾病病变以补气活血为主的理论。参芍口服液已被证明具有抑制炎症因子表达,减轻肾脏纤维化,改善肾功能作用。因此推测参芍口服液可通过抑制内质网应激,减少肾脏细胞的凋亡,改善DN肾功能从而起肾保护作用。
目前,愈来愈多的研究证明[3,12],内质网应激介导的凋亡可能是导致糖尿病肾病的重要机制。内质网是蛋白质合成转运的重要场所,在受到外界因素的影响下,蛋白质的正确折叠受到干扰,内质网稳态被打破失衡,即内质网应激(endoplasmic reticulum stress,ERS)。适度的ERS可以恢复内质网稳态;过度的ERS就会启动内质网膜上3种跨膜蛋白:跨膜蛋白激酶1(IRE1)、双链RNA依赖的蛋白激酶样激酶(PERK)和活化转录因子6(ATF6)介导的3条信号通路诱导细胞凋亡。肾脏细胞具有丰富而复杂的内质网结构,高血糖和蛋白尿是诱发内质网应激的重要因素,因此,糖尿病时肾脏细胞极易发生内质网应激,长期高血糖和蛋白尿引发内质网应激,内质网膜上的3种膜蛋白介导的凋亡途径被上调激活诱导细胞凋亡,造成肾脏细胞大量凋亡[12]。魏静[4]等发现,糖尿病肾病小鼠肾功能的恶化与内质网应激导致的肾脏细胞的凋亡可能有密切关系,证实持续存在的ERS参与DN的发生且细胞凋亡可能是DN肾功能减退的重要因素。
GRP78是内质网应激中是一个重要的分子伴侣蛋白,属于热休克蛋白家族成员,大量研究显示他在内质网应激相关疾病中大量表达,GRP78被认为是内质网应激发生和存在的标志蛋白[8]。FUKAMI等[13]发现,AGEs引起大鼠足细胞GRP78表达上调,诱发ERS,通过一系列反应激活凋亡基因导致足细胞凋亡。PERK通路是内质网应激最重要的通路,也是ERS时最先启动的通路[14]。内质网应激状态时,GRP78从PERK上解离大量表达,PERK通过自身磷酸化激活,进一步激活下游的一系列反应上调活化转录因子4(ATF4),进而激活生长停滞及损伤基因(CHOP)诱导细胞凋亡[12]。CHOP是介导ERS介导凋亡的关键蛋白也是ERS的一个重要中间信号分子,可被多个通路激活,PERK/ATF4是其表达的主要通路。陈玉凤等[3]发现糖尿病肾病小鼠肾组织GRP78、PERK表达水平提高,CHOP转录活性增强,并伴有肾小球硬化。敲除CHOP基因后小鼠上述指标表达降低,肾脏病变减轻。NIE等[5,10]研究发现,在诱导的大鼠糖尿病模型中存在细胞凋亡的现象,并且在肾小球和肾小管部位的GRP78表达量增加,和CHOP呈正相关。本研究结果观察发现,模型组大鼠出现大量蛋白尿,血糖、BUN及Scr水平升高及肾小球体积增大及大量炎细胞浸润,肾小球系膜基质及细胞外基质区增生,肾小管基底膜增厚及上皮细胞出现空泡和炎细胞浸润,部分肾小球和肾小管出现纤维化等糖尿病肾病表现;大鼠肾组织GRP78、PERK及CHOP蛋白水平表达升高,肾组织出现大量细胞凋亡。提示糖尿病大鼠肾脏处于内质网应激状态,GRP78表达上调,进而通过PERK/ATF4通路激活CHOP基因诱导细胞凋亡。参芍口服液组大鼠血糖、BUN及Scr水平降低,24 h PRO下降,大鼠肾脏病理损害及肾功能得到改善,肾组织GRP78、PERK及CHOP蛋白水平表达降低及肾组织细胞凋亡减少。提示参芍口服液可能通过下调内质网应激GRP78、PERK蛋白的表达,进而减少CHOP基因的激活,减轻糖尿病肾病大鼠肾组织的内质网应激,抑制肾脏细胞凋亡,延缓肾功能减退发挥肾保护作用,从而起到延缓DN的发生、发展的作用。
综上所述,参芍口服液能够降低糖尿病大鼠血糖和蛋白尿,提高肾功能,延缓糖尿病肾病的进程,其机制可通过抑制大鼠肾脏内质网应激及减少肾组织细胞凋亡有关,为临床早期防治糖尿病肾病提供新思路和其临床用药提供实验基础。
[1]MICHELLE T,BARATI DAVID W,POWELL,et al.Differential expression of endoplasmic reticulum stress-response proteinsindifferent renal tubule subtypes of OVE26 diabetic mice[J].Cell Stress and Chaperones,2016,21(2):155-166.
[2]CAO Y P,LIU W,LI H.et al.Role of endoplasmic reticulum stress in apoptosis of differentiated mouse podocytes induced by high glucose[J].InteinationnaiJouralofMolecularMedicine,2014,33(4):809-816.
[3]陈玉凤,张会娟,沈育芬,等.替米沙坦对糖尿病大鼠肾脏组织中内质网应激介导相关细胞凋亡的保护作[J].中华内分泌代谢杂志,2011,27(9):849-852.
[4]魏静,张建荣,等.缬沙坦抑制内质网应激对糖尿病肾损害大鼠足细胞的保护作用[J].武警医学,2015,26(12):1224-1227.
[5]聂彦娜.黄芪和葛根素注射液对糖尿病肾病内质网应激GRP78、ATF4、CHOP表达的影响[D].北京:北京中医药大学,2014.
[6]王丽华,刘丽秋,杨鹏鹏,等.祛痰通络汤对糖尿病肾病大鼠肾组织内质网应激的影响[J].中国中医急症,2016,32(1):59-60.
[7]薛忠文,董天崴.参芍口服液对冠状动脉粥样硬化大鼠主动脉IL-8V、CAM和ICAM-1表达的影响[J].中成药,2012,34(11):2077-2081.
[8]张瑜珊,汪年松,王筱霞,等.内质网应激在糖尿病肾病中的研究进展[J].中国中西医结合肾病杂志,2014,15(9):840-842.
[9]胡娜平,李会会.黄芪多糖和羟基红花黄色素A单用及合用对慢性肾病大鼠肾细胞凋亡的影响[J].中南药学,2016,14(2):113-117.
[10]罗春,步世忠,王福艳.葛根素治疗2型糖尿病的药理机制和临床进展[J].基础医学与临床,2016,36(11):1852-1855.
[11]张琦,李映雪,尚小明,等.参芍口服液对冠状动脉介入治疗术后活性物质患者血清血管和细胞因子的影响[J].中国老年学杂志,2015,3(35):1487-1489.
[12]YANG D. Autophagy in diabetic nephropathy[J]. Endocrinol, 2015,224(1): 946-952.
[13]FUKAMI K, YAMAGISHI S, UEDA S, et al. Role of AGEs in diabeticnephropathy[J]. Curt Pharm Des, 2008, 14(10): 946-952.
[14]WANG Z S, XIONG F, XIE X H, et al. Astragaloside IV attenuates proteinuria in Streptozotocin induced diabetic nephropathy via the inhibition of endoplasmic reticulum stress [J]. BMC Nephrology, 2015, 6(7): 1-9.
(王荣兵 编辑)
Effect of Shenshao oral liquid on expression of GRP78,PERK and CHOP in rat models of diabetic nephropathy
Di Yuan1,Yun-peng Dong1,Zhao-jun Zeng1,An-jing Huang1,Chun-lai Zhang2,Hong-xia Zhou2
(1.North China University of Science and Technology,Tangshan,Hebei 063000,China;2.Tangshan Workers'Hospital,Tangshan,Hebei 063000,China)
ObjectiveTo investigate the effect of Shenshao oral liquid on expression of endoplasmic reticulum stress factors GRP78,PERK and CHOP in rat models of diabetic nephropathy.MethodsA total of 30 healthy male Wistar rats were randomly divided into Sham group,model group (DN group)and Shenshao oral liquid group (SS group).Animals in DN group and SS group were fed with high fat diet in addition to intraperitoneal injection of streptozotocin.Rats in SS group were administrated with Shenshao oral liquid(250 mg/kg)daily,and distilled water were administered daily into rats from Sham group and DN group.Blood glucose,blood urea nitrogen (BUN),creatinine (Scr)and 24-hour urinary protein (PRO)were measured 12 weeks post insults.Histopathological changes in renal tissue were graded through HE staining.Expression levels of GRP78,PERK and CHOP in kidney were measured by Western blot.Apoptosis rate were determined by TUNEL staining.ResultsBlood glucose,BUN,Scr and PRO in rats from DN group were significantly increased compared with Sham group(P<0.05),which were attenuated with treatment of Shenshao oral liquid(P<0.05).HE staining showed that morphological abnormality was observed in DN group including enlarged glomerular volume,inflammatory cell infiltration,glomerular mesangial stromal hyperplasia,tubular basement membrane thickening,and glomerular and tubular fibrosis.Above histopathological deterioration of renal tissue was significantly ameliorated by treatment of Shenshao oral liquid (P<0.05).Western blot showed that the expression levels of GRP78,PERK and CHOP in renal tissue of DN group were significantly increased when compared with Sham group,which was decreased in SS group.TUNEL staining manifested that increased apoptosis rate in DN group (P<0.05)in comparison with Sham group could be attenuated in SS group (P<0.05).ConclusionsShenshao oral liquid reduces development of diabetic nephropathy,restoring renal function in dependence of manipulation on endoplasmic reticulum stress related factors GRP78,PERK,CHOP and apoptosis.
shenshao oral liquid;diabetic nephropathy;endoplasmic reticulum stress;apoptosis
R587.2
A
10.3969/j.issn.1005-8982.2017.27.005
1005-8982(2017)27-0022-05
2017-04-11
张春来,E-mail:zcl1290@163.com;Tel:15930458965

