黑藻叶、茎腐解释放溶解性有机物的特性
姚 佳,杨 飞,张毅敏*,朱月明,高月香,尹 杰,杜 聪,巴翠翠,李定龙
黑藻叶、茎腐解释放溶解性有机物的特性
姚 佳1,2,杨 飞2,张毅敏2*,朱月明2,高月香2,尹 杰1,2,杜 聪1,2,巴翠翠1,2,李定龙1
(1.常州大学环境与安全工程学院,江苏常州 213164;2.环境保护部南京环境科学研究所,江苏南京210042)
通过三维荧光光谱(3DEEM)和紫外吸收光谱(UV-vis)技术结合平行因子分析法(PARAFAC),研究了沉水植物黑藻死亡过程中叶、茎腐解释放DOM的特性,进一步揭示草型湖泊中水生植物腐解对水体的影响机制.结果表明,黑藻叶比茎腐解地更快,释放出更多的TN、TP,烘干处理减缓了叶和茎中TN的释放(<0.05),对TP的释放无明显影响(>0.05).采用平行因子分析法鉴别出叶中含有1种类蛋白质组分C1和2种类腐殖酸组分C2、C3,茎中含有2种类蛋白质C1、C3及2种类腐殖酸组分C2、C4.腐解前期(0~40d)DOM中类蛋白物质占主导地位,且叶与茎中类蛋白质含量比值约为1:1.5,此时水中DO偏低,DOC和NH3-N含量升高,腐解中期(40~60d)类蛋白和类腐殖酸组分共同作用,腐解后期(60~90d)以类腐殖质为主,且叶与茎中类腐殖质含量比值约为1:1,此时电导率、TN和PO4-P含量明显升高,腐解释放DOM可能影响水体的DO和pH值.
三维荧光光谱;平行因子分析;沉水植物腐解;溶解性有机物
水生植物是湖泊生态系统的重要初级生产者,由于其根、茎、叶等组织可以直接从水体或底泥中吸收营养盐,因此常被用来修复受污染水体[1-2].但在一些湖泊中,由于食物链失衡,外源性营养盐不断输入累积,再加上缺乏有效的管理,水生植物过量生长,植物残体不断淤积于湖底,导致湖泊迅速沼泽化[3-4].植物残体腐解不仅释放出N、P等,加剧湖泊内源性污染,而且会导致水质发黄恶化,如东太湖茭草腐解引发的“茭黄水”现象[5].溶解性有机物(, DOM)是有机质中最为活跃的组分,其结构和化学组成非常复杂,能影响水体中污染物的迁移和转化,加深水体污染程度[6].研究表明,在草型湖泊中水生植物腐解是内源DOM的最主要来源[7-8].
水生植物腐解是一个复杂的过程,既受外界环境因素如温度、光照、营养物质含量等影响[9-11],又受自身质量、组织结构和纤维含量的影响[12-13].Gessner[14]研究发现植物组织成分不同其分解速率、养分动态也可能不同.目前,关于水生植物各组织腐解释放DOM的研究较少,因此,本文选取典型沉水植物黑藻的叶、茎为研究对象,利用紫外光谱技术和荧光光谱技术分析其腐解释放DOM的特性差异,从而深入了解水生植物不同组织腐解对湖泊的元素循环和营养平衡的影响,为湖泊沼泽化的进一步研究和治理提供依据.
1 材料与方法
1.1 样品的采集与处理
黑藻采集于安徽省淮南市焦岗湖,该湖泊为草型湖泊.于植物的生长季(2016年5月),从焦岗湖采集植物的单优群落,保证植物的完好,低温(£4℃)保存迅速送至实验室.植物样品用自来水冲洗,以去除附着在植物表面的杂质,再以蒸馏水漂洗干净,用纸巾吸去表面的水.

1.2 测试与分析方法
采用纳氏试剂光度法测定NH4+-N,碱性过硫酸钾消解紫外分光光度法测定TN、TP,紫外分光光度法测定NO3--N,钼酸铵分光光度法测定PO43--P,溶解性有机碳DOC的含量采用岛津TOC分析仪测定.
采用岛津UV2700紫外可见分光光度计对紫外吸收光谱进行测定,波长范围为200~800nm,扫描波长间隔1nm,并计算紫外参数SUVA254、2/3、253/203、226-400的值.SUVA254值以DOM样品在紫外254nm的吸光度值乘以100除以DOC的比值表示,2/3等于吸光度在250nm与365nm处的比值,253/203指吸光度在253nm与203nm处的比值,226-400等于波长226~400nm之间的积分区域面积.
使用荧光分光光度计(CaryEclipse,美国安捷伦)测定样品的荧光光谱,首先稀释样品使得其在波长254nm处吸光度小于0.1[15].激发光源为150w疝弧灯,PMT电压为700V,信噪比>110,响应时间为0.05s,带通x=5nm、m=2nm,扫描速度为2400nm/min,扫描光谱进行仪器自动校正.激发波长x的扫描范围为200~450nm,发射波长Em的扫描范围250~550nm.
1.3 数据分析
样品进行荧光光谱扫描时,以纯水作空白,将数据导出到Excel,扣除空白、拉曼散射和瑞利散射后,使用带有DOMFlour工具包的matlab 7.8软件进行平行因子分析.采用SPSS 20.0和Origin 8.1处理分析图形.
2 结果与分析
2.1 黑藻叶茎腐解释放DOM的紫外吸收光谱
SUVA254(Specific Ultraviolet Absorbance 254nm)可以反映DOM的腐殖化程度[16-18].由图1可以看出,各处理组随时间变化SUVA254的值均逐渐增大,这表明随着腐解的进行,容易分解的物质被逐步消耗而使富含芳香环结构的腐殖质所占比例逐步升高,导致DOM的腐殖化程度增强,各处理组的芳香化强弱顺序为叶>叶(烘干)>茎>茎(烘干),烘干处理使叶茎腐解变慢(<0.05).
2/3常用来区分不同来源的DOM特性[19].当2/3值小于3.5时,主要反映DOM中胡敏酸的吸收特性,当2/3值大于3.5时,主要反映DOM中富里酸的吸收特性.由图2可见,除空白处理组的2/3值小于3.5,DOM中以胡敏酸为主外,其余各处理组的2/3值均大于3.5,表明黑藻叶、茎腐解DOM中均以富里酸为主[20].

图1 不同处理组SUVA254值随腐解时间的变化趋势

图2 不同处理组E2/E3值随腐解时间的变化趋势
253/203是反映芳香环上取代基的种类及取代程度高低的指标[21],它与腐解时间存在着正相关性(<0.05),由图3可以看出,与空白组相比,其余各处理组的253/203值均随腐解时间增加而增大,表明DOM中芳香环上的取代基转变为较复杂的羧基、羟基、酯类等,烘干处理对253/203值无明显影响(>0.05).

图3 不同处理组A253/203值随腐解时间的变化趋势

图4 不同处理组A226-400值随腐解时间的变化趋势
226-400可以反映有机质的吸收光谱特性,由图4可见,叶、茎腐解时间越长,释放的DOM中226-400值越大,DOM分子中苯环结构所占比例越高,叶和茎相比,其DOM中具有更多的苯环结构化合物,表明叶中大分子物质已腐解殆尽,烘干处理对226-400值无明显影响(>0.05).
2.2 黑藻叶茎腐解释放DOM的荧光光谱

采用平行因子分析法对黑藻叶茎腐解的DOM样品进行测定,叶腐解分离出3种荧光组分(图5),分别是以类色氨酸为主的类蛋白质组分C1(225nm、280nm/340nm)及以类富里酸为主的类腐殖酸组分C2(245nm、310nm/420nm)、C3(260nm、355nm/470nm),茎腐解分离得到4种荧光组分(图5),分别是以类色氨酸为主的类蛋白质C1(225nm、275nm/340nm)、C3(200nm、270nm/300nm)及以类富里酸为主的类腐殖酸组分C2(245nm、320nm/410nm)、C4(260nm、355nm/475nm)(表1),黑藻叶和茎腐解分离得到的荧光物质主要为类蛋白质和类腐殖质.类蛋白质包括类色氨酸和类酪氨酸物质,本实验中得到的类蛋白荧光峰反映的是生物降解来源的类色氨酸物质,代表与微生物降解产生的芳香性蛋白类结构有关的荧光基团[22-23],而类腐殖酸、类富里酸代表较难降解的DOM,这与腐殖质中的羟基和羧基有关[24-25].

表1 DOM的主要荧光物质及其相应位置
利用平行因子分析法分析黑藻叶、茎腐解DOM荧光矩阵所得的得分值max进行制图,max表示各类荧光峰的荧光强度或各样品中各组分的含量.由图6可以看出,随着腐解的进行,4个处理组的max值整体均呈现先升高后下降的趋势,叶、叶(烘干)处理组在9之前的各样品中组分C1含量较大,9之后的样品中组分C2比重增大,茎、茎(烘干)处理组在10之前的各样品中组分C1含量普遍较大,10之后的样品中组分C2含量普遍增大.烘干处理对叶茎所含组分的含量无明显影响(>0.05).4个处理组在腐解前期(0~40d)均为类蛋白组分在DOM样品中占据主导地位,腐解后期(40~60d)类腐殖酸物质占主导地位[36].
通过各荧光组分与腐解时间的多项式拟合(图7),可以看出各处理组中各个荧光组分在腐解过程中的生成情况.叶和叶(烘干)腐解过程中,类蛋白组分(C1)和类腐殖酸组分(C2、C3)的生成情况相似,且叶中各组分腐解释放速率快于叶(烘干).叶中C1组分在腐解第16d含量最多,C2、C3组分含量从腐解开始时逐渐增大,分别在第53d和第60d达到最大值.叶(烘干)中C1组分含量从腐解进行后持续降低,C2、C3组分含量分别在腐解第67d和83d达到最大值.茎腐解过程中各组分的释放趋势与茎(烘干)相似,在腐解第0~31d内组分C1、C3含量逐渐升高,之后持续降低,组分C2和C4含量从腐解开始后持续升高,分别在第58d和63d达到最大值.茎(烘干)腐解时C1、C3组分含量逐渐降低,C2、C4组分含量逐渐升高.结果表明,在植物腐解前40d内,类蛋白质含量占主导地位,且叶与茎中类蛋白质含量比值约为1:1.5,腐解第40~60d内,类蛋白和类腐殖酸组分共同作用,腐解第60~90d内以类腐殖质含量为主,且叶与茎中类腐殖质含量比值约为1:1.

图6 不同处理组各荧光组分的Fmax值分布

图7 各荧光组分与腐解时间的多项式拟合
2.3 黑藻叶茎腐解释放DOM对水体的影响
研究表明,溶解性有机碳DOC的浓度近似等于DOM浓度[37],黑藻叶、茎腐解过程中DOC浓度变化如图8所示.结果表明,空白处理组的DOC浓度随着腐解时间增长而逐渐降低,其余处理组的DOC浓度先升高后逐渐降低,且茎中DOC释放量高于叶,叶(烘干)、茎(烘干)处理组DOC释放量较少,表明烘干处理影响了DOC的释放(<0.05).由于植物腐解先释放出溶解性物质和苯醇溶出物,导致水体的DOC含量升高,随后水体中的微生物分解有机碳,导致DOC浓度下降[38].

植物腐解过程中会释放出氮磷等营养盐,由图8可知,各处理组TN、TP随腐解时间变化的情况.空白处理组的TN浓度基本无变化,叶和茎的TN、TP浓度均先增大后减小,叶在第30d TN释放量最大,茎在第36d TN释放量达到最大值,叶在第15d TP释放量最大,茎在第24d TP释放量达到最大值,且叶释放的TN、TP量高于茎.从这些结果可以看出,黑藻叶中的TN释放速率比茎快,叶中的TN、TP释放高于茎,烘干处理减缓了叶和茎中TN的释放(<0.05),对TP的释放无明显影响(>0.05).
2.4 黑藻叶茎腐解各指标间相关性分析
通过对叶、茎腐解所得的荧光组分进行相关性研究(表2),发现叶中的类蛋白组分(C1)与茎中类蛋白组分(C1、C3)达极显著相关(<0.01),叶中的类腐殖酸组分(C2、C3)与茎中类腐殖酸组分(C2、C4)呈极显著相关(<0.01),表明黑藻的叶与茎中的类蛋白组分和类腐殖酸组分均具有相同的来源和组分特征.

表2 叶和茎的荧光组分之间的相关性分析
注:“**”代表<0.01,“*”代表<0.05.

类腐殖酸组分C2、C3与电导率、TN、PO43--P呈极显著相关(<0.01),表明腐解后期类腐殖质占主导地位,TN、PO43--P含量升高,植物体内矿物质和导电物质释放的越多.类蛋白组分C1与DO呈极显著负相关(<0.01),而与NH3-N、DOC呈显著相关(<0.05),表明腐解前期以类蛋白质为主时,水体的DO降低,而NH3-N、DOC含量升高.
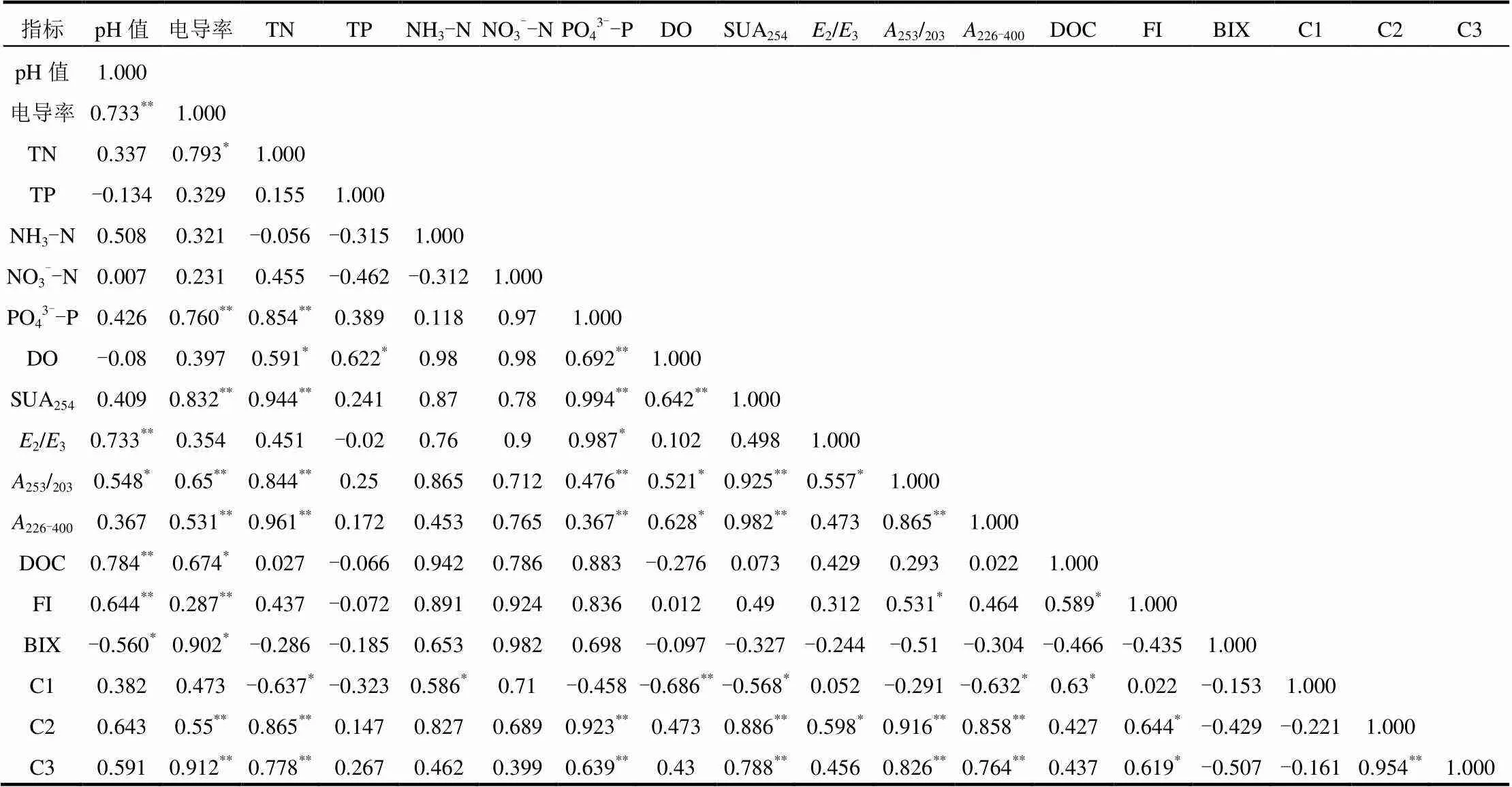
表3 不同指标之间的相关性分析
注:“**”代表<0.01,“*”代表<0.05.
3 结论
3.1 SUVA254、E2/E3、A253/203、A226-400等紫外参数表明,随着腐解的进行,DOM的芳香化程度和腐殖化程度越来越高,强弱顺序为叶 > 叶(烘干)> 茎 > 茎(烘干).
3.2 采用平行因子分析法得到黑藻叶中含有1种类蛋白质组分C1和2种类腐殖酸组分C2、C3,茎中含有2种类蛋白质C1、C3及2种类腐殖酸组分C2、C4.通过各组分的Fmax值结合线性拟合结果发现,腐解前期(0~40d)DOM中类蛋白物质占主导地位,且叶与茎中类蛋白质含量比值约为1:1.5,此时水中DO偏低,DOC和NH3-N含量升高,腐解中期(40~60d)类蛋白和类腐殖酸组分共同作用,腐解后期(60~90d)以类腐殖质为主,且叶与茎中类腐殖质含量比值约为1:1,此时电导率、TN和PO4-P含量明显升高.
3.3 黑藻茎中DOC释放量高于叶,烘干处理抑制了叶茎中DOC的释放,叶中的TN释放速率比茎快,叶中的TN、TP释放量高于茎,烘干处理减缓了叶和茎中TN的释放,对TP的释放无明显影响.
3.4 沉水植物腐解过程中释放的DOM主要包括类腐殖质和类蛋白质,这两种物质都可能影响水体的DO和pH值.
[1] 年跃刚,宋英伟,李英杰,等.富营养化浅水湖泊稳态转换理论与生态恢复讨论 [J]. 环境科学研究, 2006,19(1):67-70.
[2] 潘慧云,许小花,高士祥.沉水植物衰亡过程中营养盐的释放过程及规律 [J]. 环境科学研究, 2008,21(1):64-68.
[3] 秦伯强.太湖水环境演化过程与机理[M]. 北京:科学出版社, 2004:46-47.
[4] 尚士友,杜健民,李旭英,等.草型富营养化湖泊生态恢复工程技术的研究—内蒙古乌梁素海生态恢复工程试验研究 [J]. 生态学杂志, 2003,22(6):57-62.
[5] 李文朝.东太湖茭黄水发生原因与防治对策探讨 [J]. 湖泊科学, 1997,9(4):364-368.
[6] Aiken G R, McKnight D M, Wershaw R L, et al. Humic substances in soil, sediment and water [M]. New York: Wiley- Interscience, 1985.
[7] Tzortziou M, Neale P J, Osburn C L, et al. Tidal marshes as a source of optically and chemically distinctive colored dissolved organic matter in the Chesapeake Bay [J]. Limnology Oceanography, 2008,53:148-159.
[8] Zhang Y L, Liu X H, Wang M Z, et al. Compositional differences of chromophoric dissolved organic matter derived from phytoplankton and macrophytes [J]. Organic Geochemistry, 2013, 55:22-37.
[9] Brock T C M, Boon J J, Paffen B G P. The effects of the season and of water chemistry on the decomposition of Nymphaea alba L.: weight loss and pyrolysis mass spectrometry of the particular matter [J].Aquatic Botany, 1985,22(3):197-229.
[10] Carpenter J, Odum W E, Mills A. Leaf litter decomposition in a reservoir affected by acid mine drainage [J]. Nordic Society Oikos, 1983,41(2):165-172.
[11] Bruquetas D E, Zozaya I Y, Neiff J J. Decomposition and colonization by invertebrates of Typha Latifolia L: litter in Chaco cattail swamp (Argentina) [J]. Aquatic Botany, 1991,40(2):185- 193.
[12] 李 燕,王丽卿,张瑞雷.淀山湖沉水植物死亡分解过程中营养物质的释放 [J]. 环境污染与防治, 2008,30(2):45-48.
[13] Gaur S, Singhal P K, Hasija S K. Process of decomposition in Eichhornia crassipes (Mart.) Solms I: early decomposition in different plant parts and effect of site variation [J]. Environmental Biology, 1989,10(1):23-33.
[14] Gessner M O. Mass loss, fungal colonisation and nutrient dynamics of Phragmites australis leaves during senescence and early aerial decay [J]. Aquatic Botany, 2001,69(2/4):325-339.
[15] Cox L, Celis R, Hermonsin M C, et al. Effect of organic amendments on herbicide sorptionas as related to the nature of the dissolved organic matter [J]. Environmental Science & Technology, 2000,34(21):4600-4605.
[16] Shao Z H, He P J, Zhang D Q, et al. Characterization of water- extractable organic matter during the biostabilization of municiple solid waste [J]. Jounral of Hazardous Materials, 2009,164(2/3): 1191-1197.
[17] He X S, Xi B D, Wei Z M, et al. Spectroscopic characterization of water-extractable organic matter during composting of municiple solid waste [J]. Chemosphere, 2011,82(4):541-548.
[18] Nishijima W, Speitel G E Jr. Fate of biodegradable dissolved organic carbon produced by ozanation on biological activated carbon [J]. Chemosphere, 2004,56(2):113-119.
[19] Fialho L L, da Silva W T L, Milori D M B P, et al. Characterization of organic matter from compositing of different residues by physicochemical and spectroscopic methods [J]. Bioresource Technology, 2010,101(1):1927-1934.
[20] Artingera R, Buckaua G, Geyerb S, et al. Characterization of groundwater humic substances influence of sedimentary organic carbon [J]. Applied Geochemistry, 2000,15:97-116.
[21] Kumke M U, Specht C H, Brinkmann T, et al. Alkaline hydrolysis of humic substances-spectroscopic and chramatographic investigations [J]. Chemosphere, 2001,45(6/7):1023-1031.
[22] 柏林森,李向东,张 彦.微山湖(下级湖)中溶解性有机质(DOM)的降解实验研究 [J]. 科学技术与工程, 2015,15(5):162-169.
[23] 傅平青,刘丛强,吴丰昌.溶解有机质的三维荧光光谱特征研究 [J]. 光谱学与光谱分析, 2005,25(12):2024-2028.
[24] Wu F, Tanoue E. Isolation and partial characterization of dissolved copper-complexing ligands in streamwaters [J]. Environmental Science & Technology, 2001,35(38):3646-3652.
[25] 卢 松,江 韬,张进忠.两个水库型湖泊中溶解性有机质三位荧光特征差异 [J]. 中国环境科学, 2015,35(2):516-523.
[26] 虞敏达,何小松,檀文炳,等.城市纳污河流有色溶解有机物时空演变特征 [J]. 中国环境科学, 2016,36(1):133-142.
[27] Leenheer J A, Croue J. Peer reviewed: characterizing aquatic dissolved organic matter [J]. Environmental Science & Technology, 2003,37(1):18A-26A.
[28] Murphy K R, Ruiz G M, Dunsmuir W T, et al. Optimized parameters for fluorescence-based verfication of ballast water exchange by ships [J]. Environmental Science & Technology, 2006,40(7):2357-2362.
[29] 冯伟莹,朱元荣,吴丰昌,等.太湖水体溶解性有机质荧光特征及其来源解析 [J]. 环境科学学报, 2016,36(2):475-482.
[30] 黄昌春,李云梅,王 桥,等.基于三维荧光和平行因子分析法的太湖水体CDOM组分光学特征 [J]. 湖泊科学, 2010,22(3): 375-382.
[31] 郭卫东,黄建平,洪华生,等.河口区溶解有机物三维荧光光谱的平行因子分析及其示踪特性 [J]. 环境科学, 2010,31(6):1419- 1427.
[32] 汪玲玲.三维荧光光谱技术在溶解性有机物研究中的应用 [J]. 环境科学与管理, 2015,40(1):153-155.
[33] Bridgeman J, Bieroza M, Baker A. The application fluorescence spectroscopy to organic matter characterization in drinking water treatment [J]. Reviews in Environmental Science and Bio- Technology, 2011,10(3):277-290.
[34] Coble P G. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy [J]. Marine Chemistry, 1996,51(4):325-346.
[35] 宋晓娜,于 涛,张 远,等.利用三维荧光技术分析太湖水体溶解性有机质的分布特征及来源 [J]. 环境科学学报, 2010, 30(11):2321-2331.
[36] 洪志强,熊 瑛,李 艳,等.白洋淀沉水植物腐解释放溶解性有机物光谱特性 [J]. 生态学报, 2016,36(19):1-10.
[37] 祝 鹏,华祖林,张润宇,等.太湖溶解有机质光谱和氮磷污染的区域分布差异特征 [J]. 环境科学研究, 2010,23(2):129-136.
[38] 代静玉,秦淑萍,周江敏.水杉凋落物分解过程中溶解性有机质的分组组成变化 [J]. 生态环境, 2004,13(2):207-210.
[39] Yuan D H, He L S, Xi B D, et al. Characterization of Natural Organic Matter (DOM) in waters and sediment pore waters from Lake Baiyangdian, China [J]. Fresenius Environmental Bulletin, 2011,20(4A):1027-1035.
[40] Wang L Y, Wu F C, Zhang R Y, et al. Characterization of dissolved organic matter fractions from Lake Hongfeng, Southwestern China Plateau [J]. Journal of Environmental Science, 2009,21(5):581-588.
Research on the dissolved organic matter of’s leaf and stem decomposition.
YAO Jia1,2, YANG Fei2, ZHANG Yi-min2*, ZHU Yue-ming2, GAO Yue-xiang2, YIN Jie1,2, DU Cong1,2, BA Cui-cui1,2, LI Ding-long1
(1.School of Environmental and Safety Engineering, Changzhou University, Changzhou 213164, China;2.Nanjing Institute of Environmental Sciences, Ministry of Environmental Protection, Nanjing 210042, China)., 2017,37(11):4294~4303
The characteristics of DOM in the decomposed process of’s leaf and stem were studied by the combination of three-demensional fluorescence spectrum (3DEEM) and ultraviolet-visible (UV-vis) with parallel analysis (PARAFAC). And the effect mechanism of aquatic plants decomposition on the water was further revealed. The results showed that the leaf decomposed quicker than the stem and released more TN and TP. Drying treatment of stem and leaf slowed the release of their TN (<0.05) while it had no obvious influence on the TP (>0.05). One protein-like component C1and two components (C2 and C3) in the leaf, two protein-like components (C1 and C3) and two humic-like components (C2 and C4) in the stem were identified by PARAFAC. In the beginning of decomposition (0~40d), the protein-like substances were dominant and the ratio of it in leaf and stem was 1:1.5, and the content of DO in water was low, but the concentration of DOC and NH3-N rised. During 40~60d, both components were present. At the end of decomposition (60~90d), the humic-like acids had a high proportion, the ratio of content in leaf and stem was 1:1, and the value of CDC, TN and PO4-P increased, DOM in the decomposed process of submerged plants may affect the value of DO and pH in water.
three-demensional fluorescence spectrum;parallel analysis;submerged macrophyte decomposition;dissolved organic matter
X131.2
A
1000-6923(2017)11-4294-10
姚 佳(1994-),女,江苏扬中人,常州大学硕士研究生,主要研究方向为水体污染与生态修复.
2017-05-08
国家“十二五”水体污染控制与治理科技重大专项(2012ZX07101-007);江苏省环保科研课题(2016034);江苏省太湖水环境综合治理科研课题(TH2016402);武南区域河湖水系综合调控与生态恢复技术集成与示范(2017ZX07202006)
*责任作者, 研究员, zym7127@163.com

