盐生植物内生解烃细菌的分离及其特性
鲁红 吴+涛 姚志刚 谢文军 刘俊华 段代祥 张孝霖


摘 要:为获得盐生植物内生解烃细菌,该研究以黄河三角洲石油污染地区健康生长的盐生植物白茅、芦苇、蒙古鸦葱为材料,通过柴油平板培养实验分离得到22株内生解烃细菌。经16S rRNA同源序列分析,对菌株进行了鉴定。通过液体培养实验,研究了菌株对不同烃类物质利用能力。结果表明,22株内生细菌主要为原小单胞菌属、短小杆菌属、微杆菌属、假单胞菌属、芽孢杆菌属、沙雷氏菌属、考克氏菌属、不动杆菌属、红小梨形菌属和节细菌属,其中假单胞菌属和芽孢杆菌属菌株最多。分离出22株内生解烃细菌能降解直链烷烃的最多,能降解多环芳烃种类最少,其中部分内生解烃细菌既可以利用烷烃又可以利用芳香烃。
关键词:石油污染;盐渍化土壤;盐生植物;内生细菌;解烃
中图分类号 Q936 文献标识码 A 文章编号 1007-7731(2017)16-0018-04
Isolation and Characteristics of Hydrocarbon-degrading Endophytic Bacteria from Halophytic Vegetation
Lu Hong1,2 et al.
(1Shandong Provincial Engineering and Technology Research Center for Wild Plant Resources Development and Application of Yellow River Delta,School of Bioengineering,Binzhou University,Binzhou 256600,China;2Shandong Provincial Key Laboratory of Eco-Environmental Science for Yellow River Delta,Binzhou University,Binzhou 256600,China)
Abstract:To obtain efficient hydrocarbon-degrading endophytic bacteria from halophytic vegetation,22 endophytic bacteria strains which can grow in mineral liquid media amended with diesel oil as the sole carbon sources were isolated from Imperata cylindrica (L.) Beauv.,Phragmites australias Trin.,and Scorzonera mongolica Maxim.growing in a heavily saline and alkali,crude oil-contaminated environment in the Yellow River Delta,an important base of petroleum production in China.According to its 16S rRNA sequence analysis,these strains were identified.Moreover,liquid incubation experiment was conducted to clarify its characteristics of degrading efficiency for various hydrocarbons.Sequence analysis revealed that 22 strains were members of 10 genera (Promicromonospora,Curtobacterium,Microbacterium,Pseudomonas,Bacillus,Serratia,Kocuria,Acinetobacter,Rhodopirellula,Arthrobacter),and the dominant genera were Pseudomonas and Bacillus.Most of endophytic bacteria strains can degrade straight-chain alkanes,polycyclic aromatic hydrocarbons degradation species were the least.Some endophytic bacteria strains can utilize both alkanes and aromatic hydrocarbons.
Key words:Petroleum contamination;Saline soil;Halophytic vegetation;Endophytic bacteria;Hydrocarbon degradation
石油污染鹽渍化土壤治理是目前面临的一项重要任务[1]。植物修复具有不破坏土壤环境、修复成本低、无二次污染等优点,被视为最有前景的土壤修复方法。植物修复污染土壤的效率主要取决于植物所协同的功能微生物,特别是内生细菌的种类和数量[2]。利用具有降解石油烃功能内生细菌协同宿主植物修复污染土壤是最具发展潜力的新兴修复技术[3]。研究表明,部分盐生植物与非盐生植物相比,更能适应石油污染盐渍化土壤环境,种植盐生植物能显著提高石油污染盐渍化土壤中石油烃类污染物的降解率[4]。目前,关于盐生植物内生解烃细菌报道较少。本研究以黄河三角洲石油污染重盐碱地区健康生长的盐生植物白茅、芦苇、蒙古鸦葱为材料,分离盐生植物内生解烃细菌,初步研究菌株特性,以期为盐生植物修复石油污染盐渍化土壤提供优质内生细菌菌种资源。endprint
1 材料与方法
1.1 材料 盐生植物白茅(Imperata cylindrica(L.) Beauv.)、芦苇(Phragmites australias Trin.)、蒙古鸦葱(Scorzoneramongolica Maxim.),均采自黄河三角洲石油污染重盐碱地区。
1.2 培养基 无机盐液体培养基:Na2HPO4 1.79g,KH2PO4 0.68g,NH4NO3 1.0g,MgSO4 0.35g,微量元素混合液 1.0mL,蒸馏水1000mL,pH7.4。其中微量元素混合液:CoCl2·6H2O 4g、CuCl2·2H2O 1g、CaCl2 40g、ZnCl2 2g、H3BO3 0.5g、FeCl3·7H2O 40g、NaMoO4·2H2O 2g、MnCl2·4H2O 8g、AlCl3·6H2O 1g,蒸馏水1000mL。柴油平板培养基:在985mL无机盐液体培养基中加入15g琼脂,凝固后滴加柴油,使固体平板表面形成油膜。
1.3 内生解烃细菌的分离 取整株白茅、芦苇和蒙古鸦葱,自来水冲洗植物30min,然后蒸馏水冲洗3次,每次3min,用吸水纸将植物表面的水分吸干。用无菌剪刀将每种植物地上部和地下部分开,分别用70%的酒精浸泡2min,用磷酸缓冲液冲洗3次,再用3% NaClO浸泡2次,每次1min,用磷酸缓冲液冲洗3次,每次2min。将最后一次冲洗植物部位的磷酸缓冲液涂布于LB培养基,检验植物表面灭菌是否完全。取植株各部分约2g,分别放入无菌研钵中,加入10倍体积的磷酸缓冲液,研磨成匀浆,吸取1mL上清悬液,加入柴油平板培养基上,用玻璃棒涂布均匀,3个重复。于30℃生化培养箱培养4d。用接种环挑取单菌落,在LB平板上划线分离纯化单菌落3次,纯化后菌株保存于LB固体培养基。
1.4 菌株分子鉴定 菌株分子鉴定参照文献[5]所述方法。特异性条带扩增产物由上海生工测序,所测序列与Genbank数据库中序列进行同源性对比。
1.5 菌株对各种烃类物质的利用实验 分别选取代表直链烷烃的正辛烷、正十六烷,代表支链烷烃的异辛烷,代表简单芳香烃的二甲苯和代表多环芳烃的菲、萘为碳源,以无机盐液体培养基为基础,按照5%接种量接入供试菌株。以不加菌培养基为对照,设置3个重复。培养基初始pH值调整为7.4,在30℃摇床180r·min-1培养4d,在600nm处测定吸光度,以表示菌株利用各种烃类物质状况。
2 结果与分析
2.1 盐生植物内生解烃细菌的分离 从盐生植物白茅、芦苇、蒙古鸦葱地上部和地下部共分离得到能利用柴油的植物内生细菌22株,其中从白茅地下部分离出6株(编号为B01~B06),地上部分离出2株(编号为B07、B08)。从芦苇地下部分离出9株(编号为L09~L17),地上部分离出3株(编号为L18~L20)。从蒙古鸦葱地下部分离出2株(编号为M21,M22),地上部未分离出菌株。可以看出,从禾本科植物芦苇中分离出降解石油烃菌株最多,白茅次之,菊科植物蒙古鸦葱分离出降解石油烃内生细菌最少。已有研究表明,禾本科植物具有更大的根比表面积,能够附着大量的微生物,为微生物提供更多的生存空间,在修复石油污染土壤中更占有优势[6]。3种植物地下部分离出内生解烃细菌数量高于地上部,一般认为植物内生细菌主要来源于土壤,植物根部内生细菌数量高于茎和叶部位[7]。
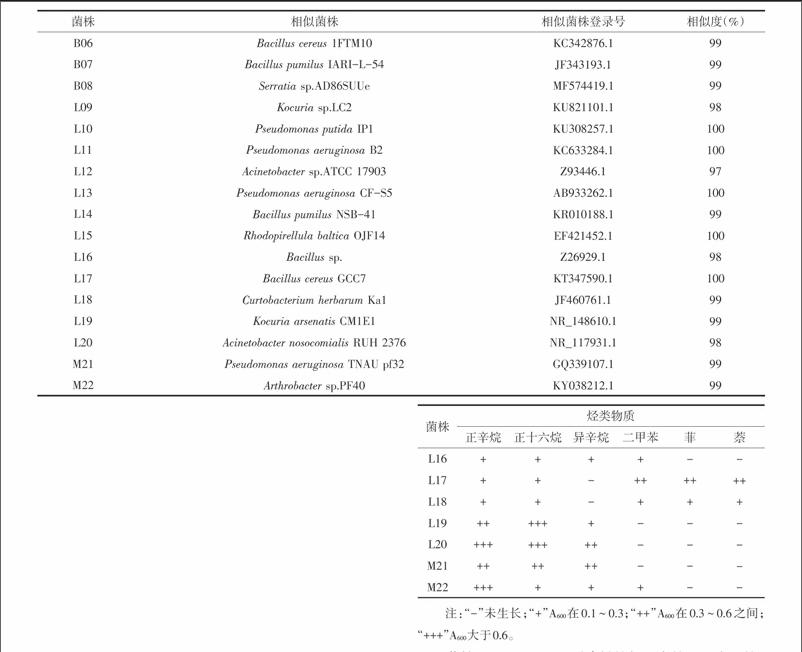
2.2 菌株鉴定及多样性分析 经过克隆测序获得22株内生解烃细菌的16S rRNA序列,通过GenBank的BLAST 软件对22株内生解烃细菌的16S rRNA 测序结果进行相似性比对,鉴定细菌的种类,结果见表2。由表2可以看出,22株内生解烃细菌与已知菌种的16S rRNA 序列相似性都大于97%。22株内生细菌归为10个属,分别为原小单胞菌属(Promicromonospora)、短小杆菌属(Curtobacterium)、微杆菌属(Microbacterium)、假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、沙雷氏菌属(Serratia)、考克氏菌属(Kocuria)、不动杆菌属(Acinetobacter)、红小梨形菌属(Rhodopirellula)、节细菌属(Arthrobacter)。其中假单胞菌属和芽孢杆菌属最多,分别有5株,各占总分离物的22.7%。短小杆菌属、原小单胞菌属、考克氏菌属和不动杆菌属各有2株。在白茅、芦苇和蒙古鸦葱中都分离出假单胞菌属内生解烃细菌,在白茅和芦苇中都分离出芽孢杆菌属内生解烃细菌,表明假单胞菌属和芽孢杆菌属内生解烃细菌在盐生植物中分布种类相对较多。通常认为假单胞菌属、芽孢杆菌属、肠杆菌属和土壤杆菌属是植物内生细菌中可培养细菌的优势种群[8]。本研究未分离出肠杆菌属和土壤杆菌属植物内生解烃细菌,可能是由于这2个属中细菌具有降解石油烃功能种类较少,也可能是由于植物种类、取样地点、分离及表面灭菌方法,培养基等不同所致[9]。
2.3 菌株利用烃类物质特性 22株菌对不同烃类物质的利用情况见表3。由表3可以看出,22株盐生植物内生解烃细菌中能利用正十六烷有20株,能利用正辛烷的有19株,能利用异辛烷的有16株,能利用二甲苯的有15株,能利用菲的8株,能利用萘的有9株。一般认为,石油烃类物质中饱和烷烃最易被微生物降解,其次是低分子量的芳香烃,高分子量的多环芳烃则较难降解[10]。在烷烃中,直鏈烷烃比支链烷烃容易降解,中等长度的链烷烃最易降解,短链烷烃对许多微生物有毒,而长链烷烃阻滞微生物酶活性,生物可降解性较低[11]。分离出22株内生解烃细菌降解直链烷烃最多,能降解多环芳烃最少,这与土壤中分布的降解石油烃功能微生物趋势一致[12]。
菌株B03、L11和L13对直链烷烃正辛烷和正十六烷、支链烷烃异辛烷、简单芳香烃二甲苯、多环芳烃菲和萘都能利用,菌株B02、B07、L14、L15、L19、L20、M21只能利用烷烃,菌株B06、B08只能利用芳香烃,菌株B01、B04、B05、L09、L10、L12、L16、L17、L18、M22能利用部分烷烃和部分芳香烃。Foght等[13]研究了从淡水、海水和河口水样中分离出的138株细菌降解烷烃和芳香烃能力,结果表明石油烃降解菌能降解烷烃或芳香烃,但不能同时降解2种烃类物质。本研究从盐生植物分离出部分内生解烃细菌既可以利用烷烃又可以利用芳香烃,表明自然界中石油烃降解菌能同时降解烷烃和芳香烃两种烃类物质。endprint
3 结论
从黄河三角洲石油污染重盐碱地生长的白茅、芦苇和蒙古鸦葱中分离出22株能利用柴油的石油烃降解菌,其中芦苇中分离出降解石油烃菌株最多,白茅次之,蒙古鴉葱分离出降解石油烃内生细菌最少。经16S rRNA同源序列分析,22株内生细菌分别为原小单胞菌属、短小杆菌属、微杆菌属、假单胞菌属、芽孢杆菌属、沙雷氏菌属、考克氏菌属、不动杆菌属、红小梨形菌属和节细菌属,其中假单胞菌属和芽孢杆菌属最多。22株内生解烃细菌中能利用正十六烷有20株,能利用正辛烷的有19株,能利用异辛烷的有16株,能利用二甲苯有15株,能利用菲的8株,能利用萘的有9株。分离出22株内生解烃细菌降解直链烷烃最多,支链烷烃次之,能降解多环芳烃最少,其中部分内生解烃细菌既可以利用烷烃又可以利用芳香烃。
参考文献
[1]吴涛,谢文军,依艳丽,等.耐盐石油烃降解菌的筛选鉴定及其特性研究[J].环境科学,2012,33(11):3949-3955.
[2]Hardoim P.R.,van Overbeek L.S.,Elsas J.D..Properties of bacterial endophytes and their proposed role in plant growth[J].Trends Microbiol.,2008,10 (16):463-471.
[3]Kukla M.,P?ociniczak T.,Piotrowska-Seget Z..Diversity of endophytic bacteria in Lolium perenne and their potential to degrade petroleum hydrocarbons and promote plant growth[J].Chemosphere,2014,17 (1):40-46.
[4]Wang Z.Y.,Xu Y.,Zhao J.,et al.Remediation of petroleum contaminated soils through composting and rhizosphere degradation[J].J.Hazard.Mater.,2011,190(1-3):677-685.
[5]Sambrook J.,Russell D.W..Molecular cloning:A laboratory manual(3rd Edition)[M].Beijing:Science Press,2002:597-627.
[6]Merkl N.,Schultze-kraft R.,Infante C..Phytoremediation in the tropics-influence of heavy crude oil on root morphological characteristics of graminoids[J].Environ.Pollut.,2005,138(1):86-91.
[7]Khan S.,Afzal M.,Iqbal S.,et al.Plant-bacteria partnerships for the remediation of hydrocarbon contaminated soils[J].Chemosphere,2013,90(4):1317-1332.
[8]胡萌.植物内生细菌研究进展[J].山东农业大学学报:自然科学版,2008,39(1):148-151.
[9]路国兵,冀宪领,张瑶,等.桑树内生细菌的分离及生防益菌的筛选[J].蚕业科学,2007,33(3):350-354.
[10]Bossert I.,Bartha R..The fate of petroleum in soil ecosystems.In:Atlas RM,eds.Petroleum Microbiology[M].NewYork:Macmillan Publishing Corporation,1984:89-98.
[11]Setti L.,Lanzarini G.,Pifferi P.G.,et al.Further research into aerobic degradation of n-alkanes in a heavy oil by a pure culture of a Pseudomonas spp[J].Chemosphere,1993,26(6):1151-1157.
[12]Siciliano S.,Germida J.J.,Banks K.,et al.Changes in microbial community composition and function during a polyaromatic hydrocarbon phytoremediation ?eld trial[J].Appl.Environ.Microbiol.,2003,69(1):483-489.
[13]Foght,J.M.,Fedorak,P.M.,Westlake,W.S..Mineralization of [14C]hexadecane and [14C]phenanthrene in crude oil:specificity among bacterial isolates[J].Canadian J.Microbiol.,1990,36(3):169-175. (责编:张宏民)endprint

