对比分析头颈部鳞状细胞癌PET/CT与PET/MR特征
白 乐,程 勇,唐勇进,凌雪英
(暨南大学附属第一医院医学影像中心,广东 广州 510630)

对比分析头颈部鳞状细胞癌PET/CT与PET/MR特征
白 乐,程 勇,唐勇进,凌雪英*
(暨南大学附属第一医院医学影像中心,广东 广州 510630)
目的探讨头颈部鳞状细胞癌(HNSCC)的PET/CT及PET/MR特征。方法纳入未经抗肿瘤治疗的头颈部鳞状细胞癌患者40例,所有患者均接受PET/CT及头颈部MR检查。由2名观察者独立观察PET阳性病灶,包括阳性原发灶及阳性淋巴结;并对PET/CT、PET/MR T1WI及PET/MR T2WI的图像质量、融合准确度、病灶清晰度、病灶特征等进行评分。分析2名观察者间的一致性。结果40例患者共90个PET阳性病灶,包括阳性原发灶40个、阳性淋巴结50个。PET/CT、PET/MR T1WI及PET/MR T2WI在图像质量及融合准确度方面差异均无统计学意义(P均>0.05);在显示阳性原发灶及阳性淋巴结的清晰度方面,PET/MR T1WI及PET/MR T2WI均优于PET/CT(P均<0.05)。40个阳性原发灶中,PET/MR T2WI对29个原发灶的特征显示多于PET/CT,4个原发灶与PET/CT相仿,7个原发灶较PET/CT少。结论PET/MR在HNSCC诊断中的应用是可行的,在显示头颈部局部病灶时较PET/CT更具优势。
正电子发射型体层摄影术;磁共振成像;癌,鳞状细胞;头颈部肿瘤
头颈部恶性肿瘤的发病率居全身恶性肿瘤的前10位[1],其中多数为起源于黏膜上皮的鳞状细胞癌[2]。由于头颈部解剖结构复杂,因此早期诊断头颈部肿瘤较困难。PET/MR作为先进的影像学设备,其结合了PET独特的代谢功能信息和MR高软组织分辨率的解剖信息,在临床应用中具有极大的潜力[3]。目前PET/MR在临床中的应用尚处于初步探索阶段,国内对头颈部恶性肿瘤的PET/MR研究报道较少。本研究采用PET/CT、PET/MR多模式显像系统对头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)的表现进行分析,旨在为PET/MR应用于头颈部疾病的诊断积累经验。
1 资料与方法
1.1 一般资料 收集2014年10月—2016年3月于我院未经抗肿瘤治疗并接受全身18F-FDG PET/CT及头颈部MR扫描的患者40例,其中男30例,女10例,年龄24~73岁,中位年龄51.5岁。所有患者均经病理确诊,其中鼻咽癌30例、颊癌2例、舌癌2例、下咽癌2例、牙龈癌2例、上颌窦癌1例、扁桃体癌1例。
1.2 仪器与方法 采用GE Discovery 750 3.0T MR扫描仪,8通道头颈联合线圈,行头颈部MR扫描,扫描序列包括轴位及矢状位FSE T1WI、轴位及冠状位FRFSE T2WI、轴位SS-EPI DWI,其中轴位各序列扫描参数:FSE T1WI,TR 466 ms,TE 14.1 ms,FOV 20 cm,矩阵 288×224;FRFSE T2WI,TR 3 877 ms,TE 81.3 ms,FOV 20 cm,矩阵 288×256;SS-EPI DWI,TR 3 000 ms,TE 80 ms,FOV 24 cm,矩阵128×128,b值分别为0、800 s/mm2;各序列轴位扫描层厚均为3.5 mm,层间隔均为0.5 mm。矢状位FSE T1WI扫描参数:TR 350 ms,TE 13.8 ms,FOV 26 cm,矩阵320×256,层厚4.0 mm,层间隔0.5 mm。冠状位FRFSE T2WI扫描参数:TR 3 023 ms,TE 108.2 ms,FOV 26 cm,矩阵 288×256,层厚4.0 mm,层间隔0.5 mm。头颈部MR扫描时长约15 min。
头颈部MR扫描完成后,采用GE Discovery Elite 690全身PET/CT机行全身PET/CT检查,扫描范围自颅顶至股骨上段。PET显像剂为18F-FDG(广州原子高科同位素医药有限公司),放化纯度>95%。所有患者检查前禁食4~6 h,血糖控制在4.0~11.1 mmol/L。18F-FDG注射剂量为3.70~5.55 MBq/kg体质量,注射后45~90 min进行扫描,平均扫描7个床位,110秒/床位。CT采集条件:管电压140 kV,电流115~180 mA,扫描层厚3.75 mm。经衰减校正后,采用自适应统计迭代重建算法得到PET图像。
1.3 图像分析 通过GE AW 4.6后处理工作站对PET、CT、MR图像进行融合。首先由2名观察者基于PET/CT及PET/MR观察18F-FDG PET阳性病灶的个数及位置,有分歧时经协商达成一致意见。PET阳性病灶包括阳性原发灶及阳性淋巴结。阳性原发灶定义为病灶18F-FDG浓聚区的最大标准摄取值(maximum standardized uptake value, SUVmax)高于周围本底组织[4],生理性摄取不计入内。阳性淋巴结为可疑转移性淋巴结,并满足以下参考标准:①PET SUVmax>2.5[5];②CT或MR上短径大于1.0 cm,或形态为圆形、不规则形,或淋巴结内有囊变坏死[6]。
而后2名医师分别对PET/CT、PET/MR T1WI、PET/MR T2WI的图像质量、融合准确度、病灶清晰度进行记录并评分。根据图像有无伪影及伪影是否影响病灶观察,对图像质量进行评分:2分,无图像伪影;1分,轻度图像伪影但对病灶观察并无影响;0分,图像伪影严重且影响病灶的观察[7]。根据PET图像与CT图像或MR图像中病灶及解剖结构是否匹配,对融合准确度进行评分:2分,图像匹配程度高;1分,图像匹配程度一般;0分,图像匹配差[8]。根据CT或MR轴位图像中病灶边界勾画程度,对病灶清晰度进行评分:3分,>75%的病灶边界可以勾画;2分,50%~75%的病灶边界可以勾画;1分,25%~49%的病灶边界可以勾画;0分,<25%的病灶边界可以勾画[9]。根据PET/CT、PET/MR T1WI及PET/MR T2WI能否对阳性病灶提供更多的诊断信息,包括解剖定位、边界显示、骨质破坏范围、病灶相邻组织浸润情况及淋巴结是否伴有坏死等,对病灶特征进行观察并记录[10]。
1.4 统计学分析 采用SPSS 19.0统计分析软件,以Kappa一致性分析评价2名观察者的一致性,Kappa值<0.40表示一致性差,0.40~0.75表示一致性较好,>0.75表示一致性好。PET/CT、PET/MR T1WI、PET/MR T2WI图像质量、融合准确度及病灶清晰度评分的比较采用多个样本比较的FriedmanM检验,进一步两两比较采用q检验。P<0.05为差异有统计学意义。
2 结果
通过PET/CT及PET/MR共同评价18F-FDG PET阳性病灶90个,其中原发灶40个、淋巴结50个。HNSCC原发灶SUVmax为4.79~25.87,平均 (12.74±5.33),最大长径1.61~6.23 cm,平均(2.90±1.05)cm。阳性淋巴结SUVmax为3.61~20.54,平均(8.20±4.03),短径1.01~4.97 cm,平均(1.55±0.65)cm。50个阳性淋巴结中,14个位于咽后间隙(14/50,28.00%)、36个位于颈部其他部位(36/50,72.00%)。
2.1 一致性分析 2名观察者评估PET/CT、PET/MR T1WI和PET/MR T2WI图像质量、融合准确度、病灶清晰度的一致性见表1。
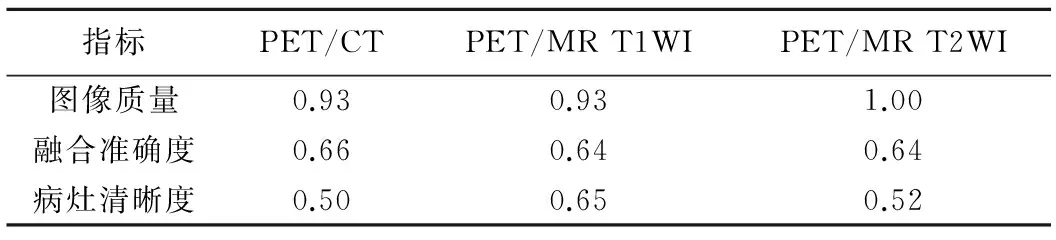
表1 2名观察者评估3种成像模式图像质量、融合准确度、病灶清晰度的一致性(Kappa值)
2.2 图像质量 3种成像模式的图像质量情况见表2。PET/CT、PET/MR T1WI及PET/MR T2WI图像质量为0分者,主要是口腔金属植入物产生伪影而影响病灶观察。3种成像模式间图像质量评分差异无统计学意义(P>0.05),见表3。
2.3 融合准确度 3种成像模式的融合准确度情况见表2。2名观察者对PET/CT及PET/MR T2WI的融合准确度均无评为0分者,即无融合较差的病例。3种成像模式间融合准确度差异无统计学意义(P>0.05),见表3。
2.4 病灶清晰度 3种成像模式的病灶清晰度情况见表2。PET/CT、PET/MR T1WI、PET/MR T2WI对阳性原发灶及阳性淋巴结的评分差异均有统计学意义(P均<0.01),见表3。两两比较显示,PET/MR T1WI、PET/MR T2WI对阳性原发灶清晰度的显示优于PET/CT(P均<0.01),见图1、2;PET/MR T1WI、PET/MR T2WI对阳性淋巴结清晰度的显示优于PET/CT(P均<0.05),见图1。
2.5 病灶特征 共40个阳性原发灶中,PET/MR T1WI对7个原发灶的特征显示多于PET/CT,26个原发灶与PET/CT相仿,7个原发灶较PET/CT少;PET/MR T2WI对29个原发灶的特征显示多于PET/CT(图2),4个原发灶与PET/CT相仿,7个原发灶较PET/CT少。50个阳性淋巴结中,PET/MR T1WI对12个淋巴结的特征显示多于PET/CT,37个淋巴结与PET/CT相仿,1个淋巴结较PET/CT少;PET/MR T2WI对17个淋巴结的特征显示多于PET/CT(图1),32个淋巴结与PET/CT相仿,1个淋巴结较PET/CT少。

表2 3种成像模式的图像质量、融合准确度、病灶清晰度情况

表3 3种成像模式间图像质量、融合准确度、病灶清晰度评分比较[分,中位数(上、下四分位数)]

图1 患者男,60岁,舌癌 A.PET/CT示原发灶位于舌右侧并见右侧颈部转移性淋巴结(箭); B.PET示原发灶(SUVmax=14.53,箭)及右侧颈部转移性淋巴结(SUVmax=10.16,箭头)代谢增高; C.MR T1WI显示原发灶小部分病灶边界; D.PET/MR示原发灶位于舌右侧并见右侧颈部转移性淋巴结(箭); E.CT无法显示原发灶边界; F.MR T2WI可清晰显示原发灶(箭)及右侧颈部转移性淋巴结(箭头)的边界,且可见淋巴结内坏死
3 讨论
PET根据示踪剂来反映组织的代谢信息,对病灶的解剖结构显示不清;而CT在病灶的定位、大小、边界及病灶与周围组织关系的显示方面更具优势。PET/CT则将PET的功能代谢信息与CT的解剖结构信息相结合,有利于病灶的准确诊断[11]。研究[12-13]表明,相对于单纯PET或CT,PET/CT对多种肿瘤的分期更加准确。随着PET/CT在临床的应用,其也逐渐暴露出辐射剂量大、软组织分辨率差等局限性。与CT相比,MR具有更高的软组织对比度,能多序列及功能成像且无电离辐射[14-15]。因此,在解剖结构复杂的头颈部的应用中,PET/MR具有极大潜力。
本研究结果表明,PET/CT、PET/MR T1WI、PET/MR T2WI的图像质量相似,这与国外研究报道基本一致[8, 16-17],但不同研究显示引起PET/CT与PET/MR图像伪影的原因不同。Varoquaux等[16]研究发现PET/CT及PET/MR的图像伪影均主要由口腔内的金属植入物引起,本研究与之相符;Kuhn等[17]及Queiroaz等[8]研究认为PET/CT的图像伪影主要在舌骨上区域,由口腔的金属植入物引起,而PET/MR的图像伪影主要由患者的自主运动、呼吸及吞咽活动引起。这种差异的原因可能是Kuhn等[17]及Queiroaz等[8]采用增强PET/CT与增强PET/MR,整个扫描时间相对较长,在扫描过程中患者更易产生自主或不自主运动。此外,本研究纳入的病例中75.00%(30/40)为鼻咽癌,鼻咽部位置较深且固定,而Queiroaz等[8,17]的研究以口咽癌、下咽癌及喉癌为主,位置相对较低且易受呼吸、吞咽运动的影响,这也可能是观察到的图像伪影不同的原因之一。

图2 患者男,39岁,鼻咽癌 A.PET/CT示原发灶位于鼻咽右侧(箭); B.MR T1WI可清晰显示原发灶边界(箭)并可见病灶包绕颈内血管; C.CT无法明确原发灶边界; D.PET/MR示原发灶位于鼻咽右侧(箭); E.PET示原发灶(SUVmax=25.87)代谢增高(箭); F.MR T2WI可清晰显示原发灶边界(箭)并可见病灶包绕颈内血管
PET与MR能准确融合也是PET/MR在头颈部恶性肿瘤中应用的前提。本研究对多模式成像所获得的融合图像进行分析,结果表明PET/CT及PET/MR的图像融合准确度均较高,与国外的研究结果一致[8]。在病灶清晰度方面,本研究结果表明无论是阳性原发灶还是阳性淋巴结,PET/MR T1WI及PET/MR T2WI均优于PET/CT。Huang等[18]对口腔颊面部鳞状细胞癌的图像特征进行观察,结果同样表明PET/MR较PET/CT对原发灶显示更清晰。Kuhn等[17]对比分析增强PET/MR及增强PET/CT对头颈部恶性肿瘤及淋巴结的清晰度,结果表明增强PET/MR T1WI在头颈部恶性肿瘤的清晰度优于PET/MR T2WI,二者均优于增强PET/CT;增强PET/CT、增强PET/MR T1WI、PET/MR T2WI对头颈部淋巴结的清晰度相似。对于淋巴结,本研究结果与其他研究不同的原因可能是本研究中28.00%(14/50)的淋巴结为咽后淋巴结,咽后间隙解剖位置较深,除了脂肪组织,还有颈内动、静脉经过,CT平扫难以区分淋巴结与周围组织,MRI具有较高的软组织分辨率,且有血管流空效应,对咽后淋巴结的显示要优于CT[19]。此外,本研究未行增强扫描,这也可能是与其他研究结果有所不同的原因。
对于HNSCC原发灶的病灶特征,本研究发现在40个阳性原发灶中,PET/MR T2WI对29个原发灶的特征显示多于PET/CT,主要是由于MR具有较高的软组织分别率,对病灶邻近组织器官的受累及范围及病灶内部特征能较CT提供更多的信息,而这对于头颈部的肿瘤的诊断及分期非常重要。对于淋巴结的病灶特征,本研究中PET/MR T2WI对32个淋巴结的特征显示与PET/CT相仿。另有研究[17]表明,增强PET/MR T1WI、PET/MR T2WI及增强PET/CT在转移性淋巴结病灶特征的显示方面并无差异。
综上所述,本研究通过多模式成像比较PET/CT、PET/MR T1WI及PET/MR T2WI的图像质量、融合准确度、病灶清晰度、病灶特征等,结果表明PET/MR在HNSCC诊断中的应用是可行的,且较PET/CT更具优势。
[1] Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008 . Int J Cancer, 2010,127(12):2893-2917.
[2] Curado MP, Hashibe M. Recent changes in the epidemiology of head and neck cancer. Cur Opin Oncol, 2009,21(3):194-200.
[3] 程勇, 白乐, 尚靖杰, 等. 肝脏局灶性病变18F-FDG PET/CT与PET/MR比较分析. 中国医学影像技术,2017,33(1):61-65.
[4] Tatsumi M, Isohashi K, Onishi H, et al.18F-FDG PET/MRI fusion in characterizing pancreatic tumors: Comparison to PET/CT. Int J Clin Oncol, 2011,16(4):408-415.
[5] Antoch G, Vogt FM, Freudenberg LS, et al. Whole-body dual-modality PET/CT and whole-body MRI for tumor staging in oncology. JAMA, 2003,290(24):3199-3206.
[6] van den Brekel MW. Lymph node metastases: CT and MRI. Eur J Radiol, 2000,33(3):230-238.
[7] Minamimoto R, Levin C, Jamali M, et al. Improvements in PET Image Quality in Time of Flight (TOF) Simultaneous PET/MRI. Mol Imaging Bio, 2016,18(5):776-781.
[8] Queiroz MA, Hullner M, Kuhn F, et al. PET/MRI and PET/CT in follow-up of head and neck cancer patients. Eur J Nucl Med Mol Imaging, 2014,41(6):1066-1075.
[9] Appenzeller P, Mader C, Huellner MW, et al. PET/CT versus body coil PET/MRI: How low can you go? Insights Imaging, 2013,4(4):481-490.
[10] Kuhn FP, Crook DW, Mader CE, et al. Discrimination and anatomical mapping of PET-positive lesions: Comparison of CT attenuation-corrected PET images with coregistered MR and CT images in the abdomen. Eur J Nucl Med Mol Imaging, 2013,40(1):44-51.
[11] 孙涛,韩善清,汪家旺.PET/CT成像原理、优势及临床应用.中国医学物理学杂志,2010,27(1):1581-1582,1587.
[12] Czernin J, Allen-Auerbach M, Schelbert HR. Improvements in cancer staging with PET/CT: Literature-based evidence as of September 2006. J Nucl Med, 2007,48(Suppl 1):78S-88S.
[13] Branstetter BFt, Blodgett TM, Zimmer LA, et al. Head and neck malignancy: Is PET/CT more accurate than PET or CT alone? Radiology, 2005,235(2):580-586.
[14] Catalano OA, Rosen BR, Sahani DV, et al. Clinical impact of PET/MR imaging in patients with cancer undergoing same-day PET/CT: Initial experience in 134 patients—a hypothesis-generating exploratory study. Radiology, 2013,269(3):857-869.
[15] Hu Z, Yang W, Liu H, et al. From PET/CT to PET/MRI: Advances in instrumentation and clinical applications. Mol Pharm, 2014,11(11):3798-809.
[16] Varoquaux A, Rager O, Poncet A, et al. Detection and quantification of focal uptake in head and neck tumours: (18)F-FDG PET/MR versus PET/CT. Eur J Nucl Med Mol Imaging, 2014,41(3):462-475.
[17] Kuhn FP, Hullner M, Mader CE, et al. Contrast-enhanced PET/MR imaging versus contrast-enhanced PET/CT in head and neck cancer: How much MR information is needed? J Nucl Med, 2014,55(4):551-558.
[18] Huang SH, Chien CY, Lin WC, et al. A comparative study of fused FDG PET/MRI, PET/CT, MRI, and CT imaging for assessing surrounding tissue invasion of advanced buccal squamous cell carcinoma. Clin Nucl Med, 2011,36(7):518-525.
[19] 苏勇,赵充,谢传淼,等.鼻咽癌咽后淋巴结转移的CT、MRI和PET-CT诊断的对比研究.癌症,2006,25(5):521-525.
ComparativeanalysisofPET/CTandPET/MRimagecharacteristicsofheadandnecksquamouscellcarcinoma
BAILe,CHENGYong,TANGYongjin,LINGXueying*
(MedicalImagingCenter,theFirstAffiliatedHospitalofJinanUniversity,Guangzhou510630,China)
ObjectiveTo investigate PET/CT and PET/MR characteristics of head and neck squamous cell carcinoma (HNSCC).MethodsTotally 40 patients with HNSCC underwent whole body18F-FDG PET/CT and MR scans of head and neck before anti-tumor treatment. PET positive lesions of HNSCC, including primary lesions and lymph nodes were evaluated by 2 radiologists independently. Then the imaging quality, fusion quality, lesion conspicuity and lesion characteristics were assessed based on PET/CT, PET/MR T1WI and PET/MR T2WI.ResultsNinety PET positive lesions in all 40 patients were evaluated,including 40 primary lesions and 50 lymph nodes. Similar imaging quality and fusion quality of PET/CT, PET/MR T1WI and PET/MR T2WI were obtained without statistical difference (bothP>0.05). For the lesion conspicuity, PET/MR T1WI and PET/MR T2WI demonstrated significantly better than PET/CT in positive primary lesions and lymph nodes (allP<0.05). For the characteristics of positive primary lesions, PET/MR T2WI provided more information than PET/CT in 29 lesions, equal to PET/CT in 4 lesions, and less than PET/CT in 7 lesions.ConclusionThe application of PET/MR in HNSCC is feasible, being superior to PET/CT in indication of lesions in head and neck area.
Positron emission tomography; Magnetic resonance imaging; Carcinoma, squamous cell; Head and neck neoplasms
白乐(1990—),女,湖北黄冈人,硕士,医师。研究方向:医学影像诊断。E-mail: 1071046798@qq.com
凌雪英,暨南大学附属第一医院医学影像中心,510630。E-mail: lingxuey@163.com
2017-02-10
2017-09-21
R739.6; R817.4
A
1003-3289(2017)11-1641-06
10.13929/j.1003-3289.201702038

