骨折修复过程中骨形态发生蛋白 2 对趋化因子 12表达的调控及其意义
康凯 白东昱 薛建利 栾彦军 刘延雄
骨折修复过程中骨形态发生蛋白 2 对趋化因子 12表达的调控及其意义
康凯 白东昱 薛建利 栾彦军 刘延雄
目的 探讨骨形态发生蛋白 2 ( bone morphogenetic protein,BMP2 ) 对趋化因子 12 ( chemokine C-X-C motif-ligand-12,CXCL12 ) 表达调节及其在骨折修复过程中的意义。方法 构建 BMP2 敲除鼠 BMP2cKO/+和 BMP2cKO/cKO。免疫组化分析正常小鼠、BMP2cKO/+小鼠及 BMP2cKO/cKO小鼠胫骨骨折模型中骨内膜细胞 CXCL12的表达及其随时间的变化。实时定量 PCR ( RT-qPCR ) 比较对照组与 BMP2cKO/+小鼠骨内膜细胞及其分化细胞CXCL12、骨钙蛋白、α-SMA 表达差异。结果 BMP2cKO/+和 BMP2cKO/cKO小鼠 BMP2 显著低于对照组。小鼠骨折修复过程中骨内膜细胞和成骨细胞 CXCL12 表达明显升高,且表达 CXCL12 细胞先增多再减少;BMP2cKO/+小鼠骨折修复过程中表达 CXCL12 的骨内膜细胞和成骨细胞逐渐增加。BMP2cKO/+小鼠分离的骨内膜细胞CXCL12 表达显著高于正常小鼠。在诱导分化的小鼠骨内膜细胞中添加 rhBMP2,CXCL12 的表达减少,骨钙蛋白和 α-SMA 表达显著增加。诱导分化的 BMP2cKO/cKO骨内膜细胞 CXCL12 表达显著高于正常小鼠,而骨钙蛋白的表达则显著降低。CXCL12 受体拮抗剂 AMD3100 处理诱导分化的 BMP2cKO/cKO骨内膜细胞,骨钙蛋白和α-SMA 表达显著增加。结论 骨折修复过程中,BMP2 下调 CXCL12 的表达有助于成骨细胞的分化从而促进骨折的修复。
骨形态发生蛋白 2;趋化因子 12;骨折修复;骨内膜细胞
骨折修复是由大量细胞因子调控的复杂的骨再生过程[1]。骨形态发生蛋白 ( bone morphogenetic protein,BMP ) 在骨折修复过程中发挥重要作用。骨形态发生蛋白 2 ( BMP2 ) 是目前公认的成骨细胞转化因子,能诱导特定的骨膜祖细胞不可逆地分化为软骨和骨细胞[2],有利于骨折修复。趋化因子 12( chemokine C-X-C motif-ligand-12,CXCL12 ),又称基质细胞衍生因子-1 ( stroma cell derived factor,SDF-1 ),它与其细胞表面受体 CXCR4 / CXCR7 结合,激活多种细胞信号通路发挥多种生理功能,尤其是能诱导造血干细胞和间充质干细胞的修复、再生[3]。研究表明,BMP9 依赖的成骨分化受 CXCL12调节[4]。CXCL12 与 BMP2 在小鼠成肌细胞系 C2C12成骨分化过程中共同发挥作用[5]。但是 CXCL12 与BMP2 在体内相互作用机制尚未阐明。由此,本研究比较 BMP2 基因敲除小鼠和对照组的骨折修复过程中,BMP2 和 CXCL12 表达细胞及其变化,探讨两者在骨折修复中的相互作用机制。
材料与方法
一、试剂与仪器
CXCL12 抗体、骨钙蛋白抗体、α-SMA 抗体、IgG 兔单克隆抗体、Fab 鼠单克隆抗体均购自于上海优宁维公司;重组小鼠 BMP2 购于 Santa cruz 公司;AMD3100 购于 Sigma 公司;RNA 抽提试剂盒、逆转录试剂盒和 SYBR GreenI 购于 TaKaRa 公司;StemXVivo 成骨细胞培养液购自于 R amp; D 公司;蛋白裂解液购自碧云天公司。
荧光定量 PCR 仪 ( Biorad CFX96 );IQ5 TM PCR仪;高速冷冻离心机 ( eppendorf 5427R );生物安全柜 ( ESCO );移液器 ( eppendorf );Biophotometer 分光光度计 ( eppendorf );Leica EG1160 全自动石蜡包埋机;Leisa RM2135 切片机,德国西门子显微 CT机,Olympus 显微镜,Biorad 凝胶成像系统。
二、方法
1. BMP2 敲除鼠模型的构建:带有 flox 标签的BMP2 ( BMP2flox) 小鼠由第四军医大学提供。C57B /L6 遗传标记 BMP2flox混合型小鼠杂交四代后产生纯种 C57B / L6 BMP2flox/flox小鼠。BMP2 敲除鼠模型的构建:BMP2flox/flox雌性小鼠与带有 Prx1 增强 Cre的 C57B / L6 转基因小鼠 ( Prx1-Cre 小鼠 ) 杂交产生 BMP2cKO/+敲除鼠。与小鼠相比,BMP2cKO/+敲除鼠没有明显的表型差异,其尺寸大小,健康状况,生育能力以及年龄基本相似。BMP2cKO/+敲除鼠与BMP2flox/flox鼠杂交产生 BMP2cKO/cKO敲除鼠。对照组小鼠为 Cre 阴性小鼠。本研究动物实验经我院动物伦理委员会批准实施。
2. 胫骨骨折模型:参照文献,对 9~12 周C57B / L6 小鼠进行胫骨骨折,方法如下:1% 戊巴比妥 1 ml / kg 腹腔注射,待小鼠完全麻醉后,备皮、消毒小鼠下肢,在膝关节下切开约 0.5 cm 纵行切口,由膑腱处插入 22 G / 0.41 mm 髓内固定针,分离胫骨中上 1 / 3 处肌肉及筋膜,使用锯片锯断胫骨骨干后立即使用 0.9% 生理盐水冲洗胫骨表面,再将髓内固定针完全插入并对合。逐层缝合切口,制成小鼠胫骨干性骨折模型。骨折处理后 14 天显微 CT检查胫骨骨折情况[6]。
3. 免疫组化:分别在 3、7、10、14 和 21 天解剖小鼠获取胫骨,取胫骨在 4% 多聚甲醛中浸泡18 h,10% 的 EDTA 溶液中脱钙 2 周,石蜡包埋,切片 ( 3 μm )。切片脱蜡,水化,经 0.1% 胰酶 37 ℃处理 30 min。血清封闭 60 min 后加入 CXCL12 一抗,4 ℃ 过夜,二抗在室温下孵育 60 min,镜检。
4. 骨内膜细胞分离:从胫骨和股骨的骨髓中分离骨内膜细胞。方法如下:快速解剖胫骨和股骨,剔除所有小鼠织后,胫骨和股骨在 0.1% 胶原蛋白酶和 0.125% 的胰蛋白酶中浸泡 30 min,浸泡 5 次。MSC 培养液快速冲洗骨髓。余下骨分裂成碎片,在 37 ℃,0.1% 胶原蛋白酶中处理 40 min,2 次。每个骨碎片用含抗生素和 10% 血清的 DMEM 培养液冲洗,接种到培养瓶中 37 ℃ 和 5% CO2培养。细胞传 3 代后继续后续实验。由含 0.5×Stem Xvivo 的StemXVivo 成骨细胞培养液培养骨内膜细胞,诱导其向成骨细胞分化。
5. RNA 提取与 RT-qPCR:细胞总 RNA 提取和 RNA 逆转录 cDNA 按 TaKaRa RNA 提取试剂盒和逆转录试剂盒说明书进行。逆转录反应体系如下:1 μg RNA,5 μl 10´ 逆转录缓冲液,0.25 μl dNTP( 100 mM ),4 μl 逆转录引物 ( 1 mM ),0.5 μl 逆转录酶 ( 50 U / μl ),0.25 μl Rnase 抑制剂 ( 20 U / μl ),RNAase-free 去离子水补足总体积 25 μl;反应条件为:25 ℃,10 min;37 ℃,60 min;95 ℃,5 min。实时定量 PCR 引物包括:小鼠 β-actin ( F:5’-acc cacactgtgcccatctacg-3’;R:5’-gccacgctcggtcagga tcttc-3’ ),小鼠 BMP2 ( F:5’-aagtctcctccttcatcag tatacgctcg-3’;R:5’-ccacacagagtcaaggtttaaaaggat gc-3’ ),小鼠 CXCL12 ( F:5’-agagtccgaggaacgctgc-3’;R:5’-ccctggcactgaactgga-3’ ),小鼠骨钙蛋白( F:5’-caagtcccacacagcagctt-3’;R:5’-aaagccgag ctgccagagtt-3’ ) ,小鼠 α-SMA ( F:5’-tactgccgagcg tgagat-3’;R:5’-gcttcgtcgtattcctgttt-3’ ) 反应体系如下:1.5 μl 逆转录产物,7.5 μl SYBR Green Mixture,上下游引物各 0.3 μl,5.4 ml RNAase-free 去离子水,总体积 15 μl;反应条件为 95 ℃,10 min;95 ℃,15 s,55 ℃,15 s,40 个循环。基因表达变化倍数采用 2-ΔΔCt法进行比较,内参为鼠源 β 肌动蛋白。
6. Western Bloting:蛋白裂解液裂解组织或细胞,10 000 g 4 ℃离心 5 min,收集上清,BCA 蛋白定量后进行 WB。WB 方法如下:20 μg 总蛋白上样,12% SDS-PAGE 分离蛋白质,湿转恒流 250 mA,70 min 将蛋白转至 PVDF 膜上,5% 脱脂奶粉封闭后2 h,加入一抗 4 ℃ 孵育过夜,充分洗涤后加入二抗室温孵育 2 h,充分洗涤后显影。
三、统计学处理
所有数据均采用 SPSS 18.0 软件统计学分析及Graphpad Prim 5.0 绘图。数据采用表示。两小鼠比较采用 t 检验,多小鼠间比较用单因素方差分析( oneway ANOVA )。P<0.05 为差异有统计学意义。
结 果
一、确定 BMP2cKO/+ 和 BMP2cKO/CKO 小鼠基因型
检测 BMP2cKO/+和 BMP2cKO/cKO小鼠 BMP2 表达,并比较各小鼠胫骨变化,见图 1。BMP2cKO/+和BMP2cKO/cKO小鼠 BMP2 显著低于小鼠 ( F=45.16,P=0.002 )。
二、骨折模型中表达 CXCL12 细胞及其变化
在对照组小鼠和 BMP2cKO/+小鼠未骨折时,表达CXCL12 细胞较少,见图 2a,d,g,j。对照组小鼠骨折后第 7 天和第 14 天,在骨折线的骨内膜细胞和骨内膜下的一些成骨细胞发现 CXCL12 表达,见图2b,c,e,f,且骨折第 14 天表达 CXCL12 细胞比第7 天增多。BMP2cKO/+小鼠骨折第 7 天和第 14 天,表达 CXCL12 的骨内膜细胞和成骨细胞比对照组小鼠明显增加,且呈无序的簇状分布,见图 2h,i,k,l。从骨折 14 天起,对照组小鼠骨折后骨内膜细胞表达 CXCL12 逐渐减少;而在 BMP2cKO/+鼠骨折后第14 天和 21 天,骨内膜细胞和成骨细胞表达 CXCL12仍较高,且无序分布,见图 3。
三、对照组小鼠和 BMP2cKO/+ 小鼠骨内膜细胞CXCL12 表达比较
BMP2cKO/+小鼠骨折后 14 天分离的骨内膜细胞CXCL12 表达显著高于对照小鼠 ( 图 4,t=3.513,P=0.025 )。
四、BMP2 对骨内膜细胞 CXCL12 表达及分化的调控
分离对照组小鼠骨内膜细胞,添加 rhBMP2 显著减少 CXCL12 的表达 ( P<0.05 ),同时致使成骨分化标志物骨钙蛋白和周细胞标志物 α-SMA mRNA 显著增加 ( P<0.05 ),( 图 5 )。
五、BMP2 依赖 CXCL12 调控骨内膜细胞分化成成骨细胞
分离对照组小鼠和 BMP2cKO/cKO小鼠骨内膜细胞,分化第 14 天,对照组小鼠骨钙蛋白显著高于BMP2cKO/cKO小鼠 ( 图 6 )。分化第 0、7、14 天,BMP2cKO/cKO小鼠细胞 CXCL12 表达显著高于对照组小鼠 ( P<0.05,图 6 )。使用 CXCL12 受体拮抗剂AMD3100 处理 BMP2cKO/cKO骨内膜细胞,BMP2cKO/cKO骨内膜细胞骨钙蛋白和 α-SMA 表达增加 ( P<0.05 ),( 图 7 )。
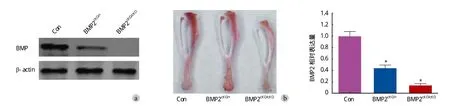
图 1 BMP2cKO/+ 和 BMP2cKO/cKO 小鼠 BMP2 表达及胫骨变化 a:WB 和 RT-qPCR 检测小鼠、BMP2cKO/+ 和 BMP2cKO/cKO 小鼠骨内膜细胞BMP2 表达;b:小鼠、BMP2cKO/+ 和 BMP2cKO/cKO 小鼠胫骨Fig.1 BMP2 expression and tibia changes in BMP2cKO/+ and BMP2cKO/cKO mice a: BMP2 expression in endosteal cells of the controlled, BMP2cKO/+and BMP2cKO/cKO mice by western bloting and RT-qPCR; b: The tibia of the controlled, BMP2cKO/+ and BMP2cKO/cKO mice
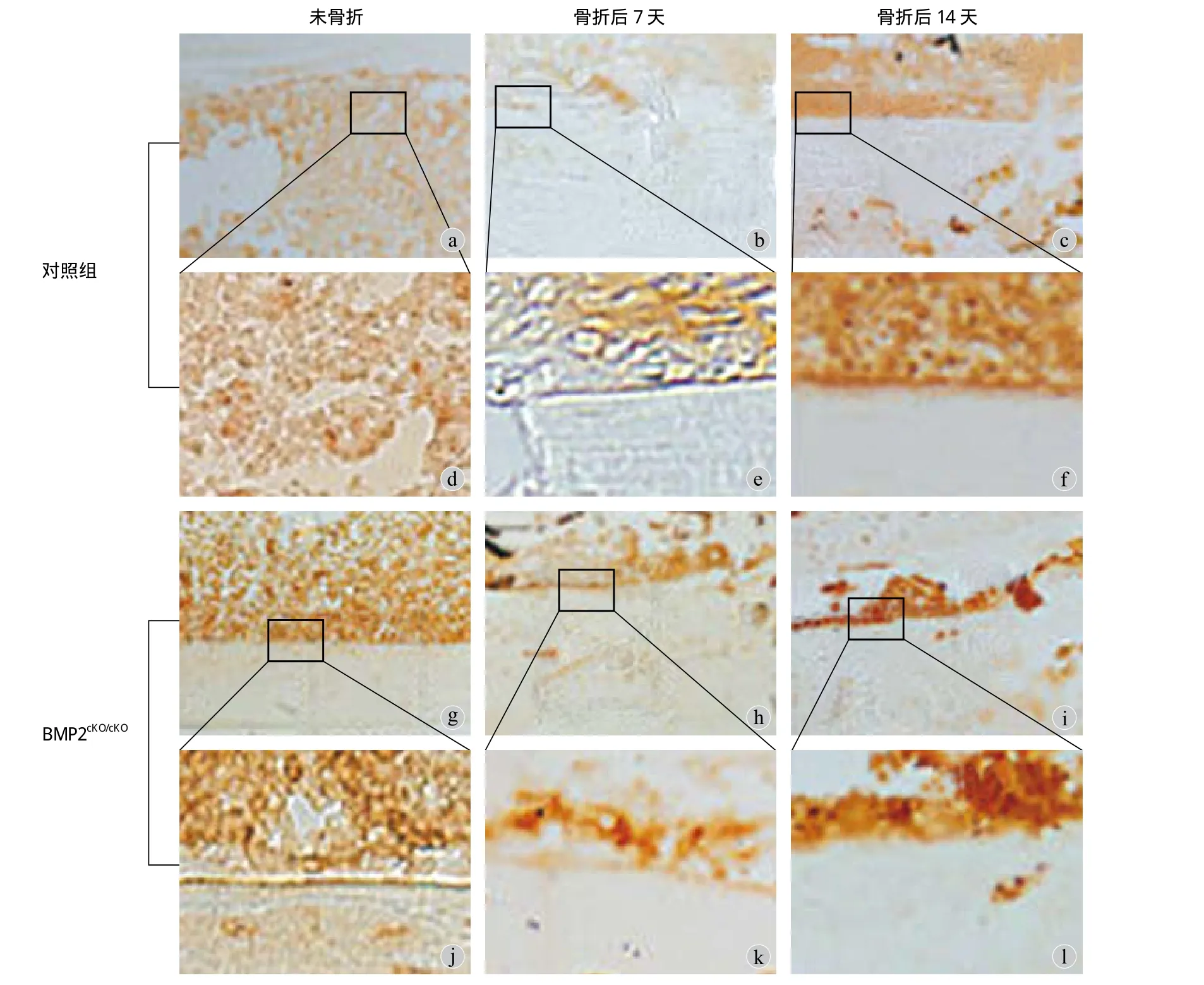
图 2 对照组小鼠和 BMP2cKO/+ 小鼠骨折模型中 CXCL12 表达细胞及其变化 ( 免疫组化 × 100 ) a,d:对照组小鼠未骨折;b,e:对照组小鼠骨折 7 天;c,f:对照组小鼠骨折 14 天;g,j:BMP2cKO/cKO 小鼠未骨折;h,k:BMP2cKO/cKO 小鼠骨折 7 天;i,l:BMP2cKO/cKO 小鼠骨折后 14 天表达 CXCL12 细胞 ( 棕色 ) 及其变化Fig.2 Cells with CXCL12 expression changes in fracture healing model of the controlled mice and BMP2cKO/+ mice, CXCL12 expression cells( brown ) and changes in the controlled mice without fracture ( a, d ), control mice with fracture for 7 days ( b, e ); the controlled mice with fracture for 14 days ( c, f ), BMP2cKO/cKO mice without fracture ( g, j ), BMP2cKO/cKO mice with fracture for 7 days ( h, k ); BMP2cKO/cKO mice with fracture for 14 days ( i, k ) by immunohistological staining
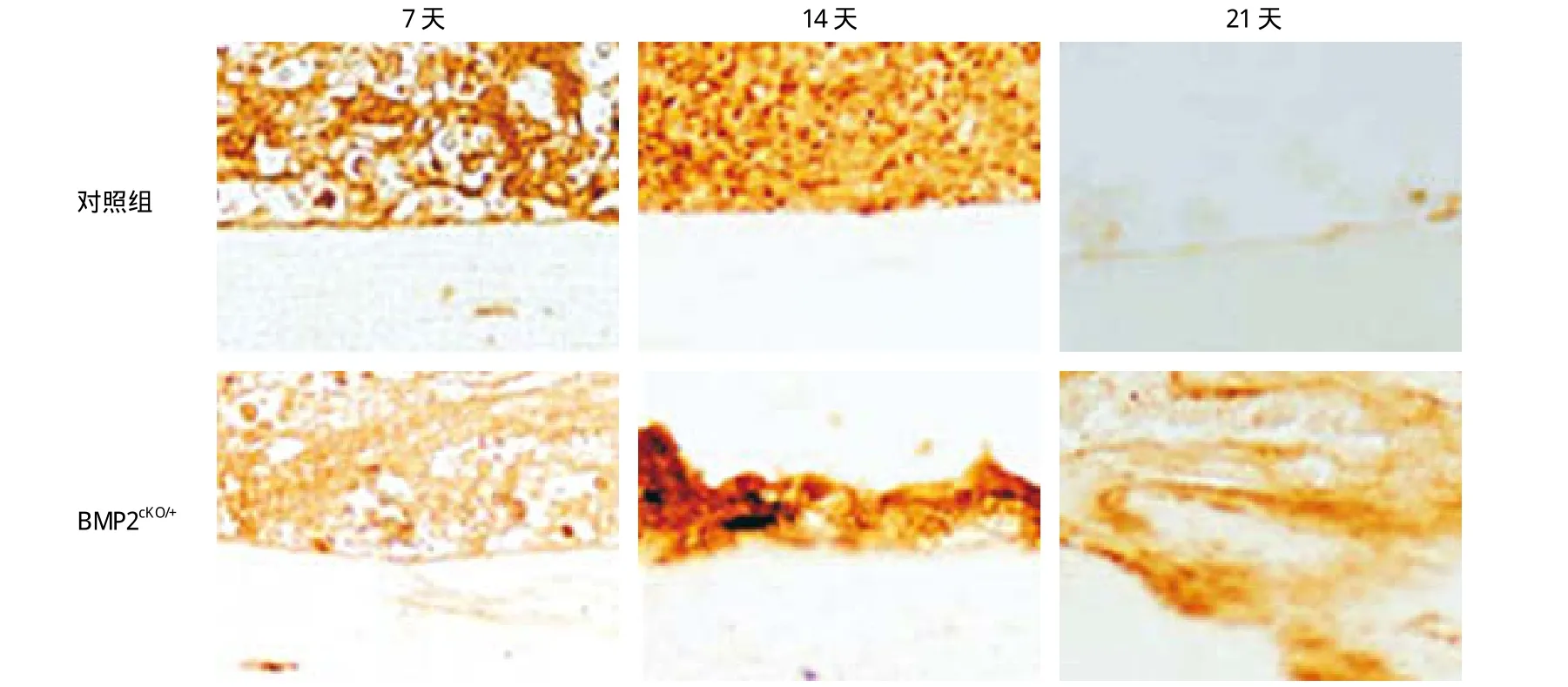
图 3 对照组小鼠和 BMP2cKO/+ 小鼠 CXCL12 表达随时间变化 ( 免疫组化 × 400 ) 对照组小鼠和 BMP2cKO/+ 小鼠骨折后 7、14、21 天CXCL12 表达细胞 ( 棕色 ) 变化Fig.3 CXCL12 expression changes in the controlled and BMP2cKO/+ mice after the fracture ( CXCL12 expression changes in the controlled and BMP2cKO/+ mice after the fracture for 7, 14, 21 days by immunohistological staining )
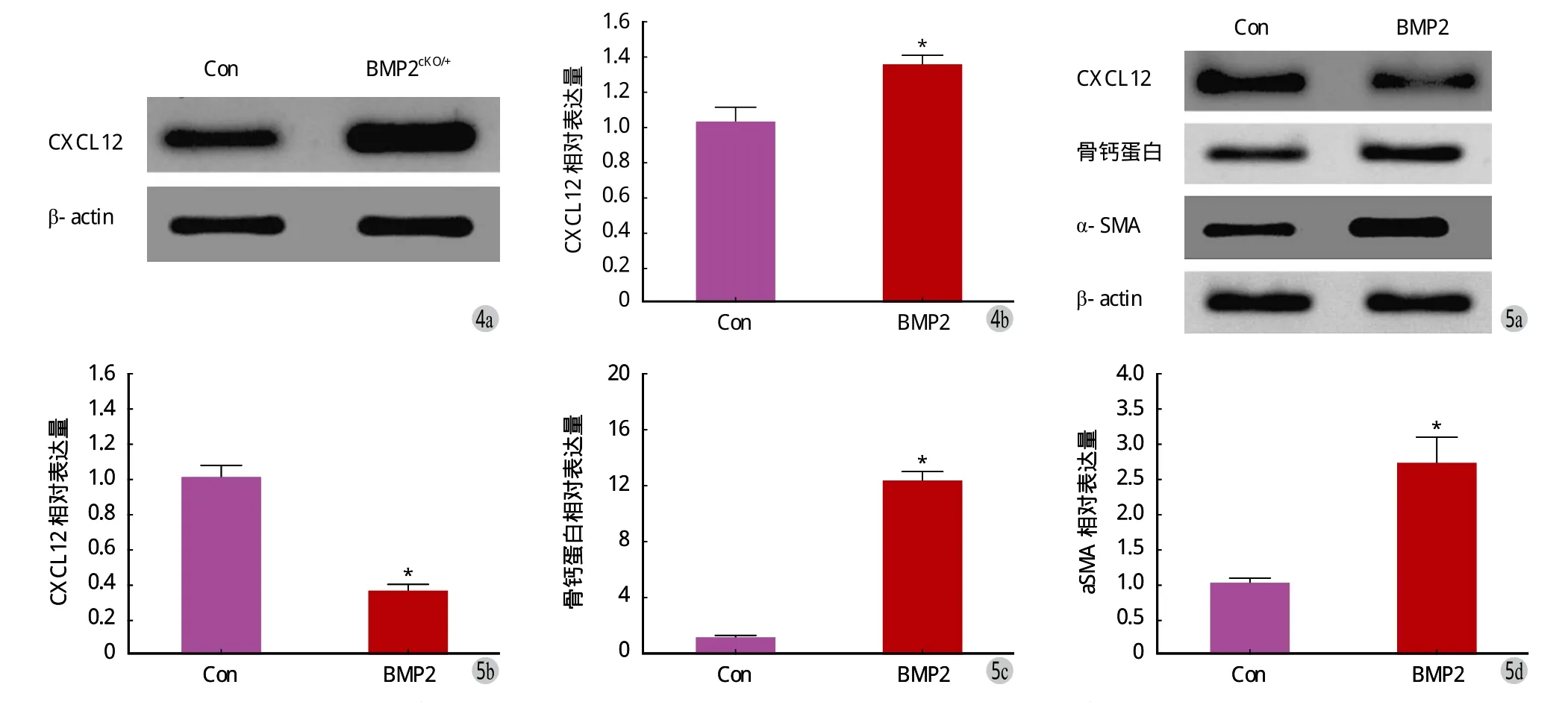
图 4 比较对照组小鼠和 BMP2cKO/+ 小鼠骨内膜细胞 CXCL12 表达 [ 分离对照组小鼠和 BMP2cKO/+ 小鼠骨内膜细胞,WB ( a ) 和 RT-qPCR( b ) 检测两小鼠骨内膜细胞 CXCL12 表达 ]图 5 BMP2 对骨内膜细胞 CXCL12 表达及分化的调节 [ 比较添加 100 ng / ml rhBMP2 入分化培养的对照组小鼠骨内膜细胞后 14 天,WB和 RT-qPCR 检测 CXCL12 表达 ( a、b )、骨钙蛋白表达 ( a、c )、α-SMA 表达 ( a、d ) ]Fig.4 Comparing CXCL12 expression in isolated endosteal cells of the controlled and BMP2cKO/+ mice. [ Endosteal cells in the controlled and BMP2cKO/+ mice were isolated, CXCL12 expression was detected by WB ( a ) and RT-qPCR ( b ) ]Fig.5 BMP2 regulated CXCL12 expression in endosteal cells [ comparison of protein expression in isolated endosteal cells of the controlled mice without and with rhBMP2 ( 100 ng / ml ) for 14 days, CXCL12 expression ( a, b ), osteocalcin expression ( a, c ) and α-SMA expression ( a, d ) ]
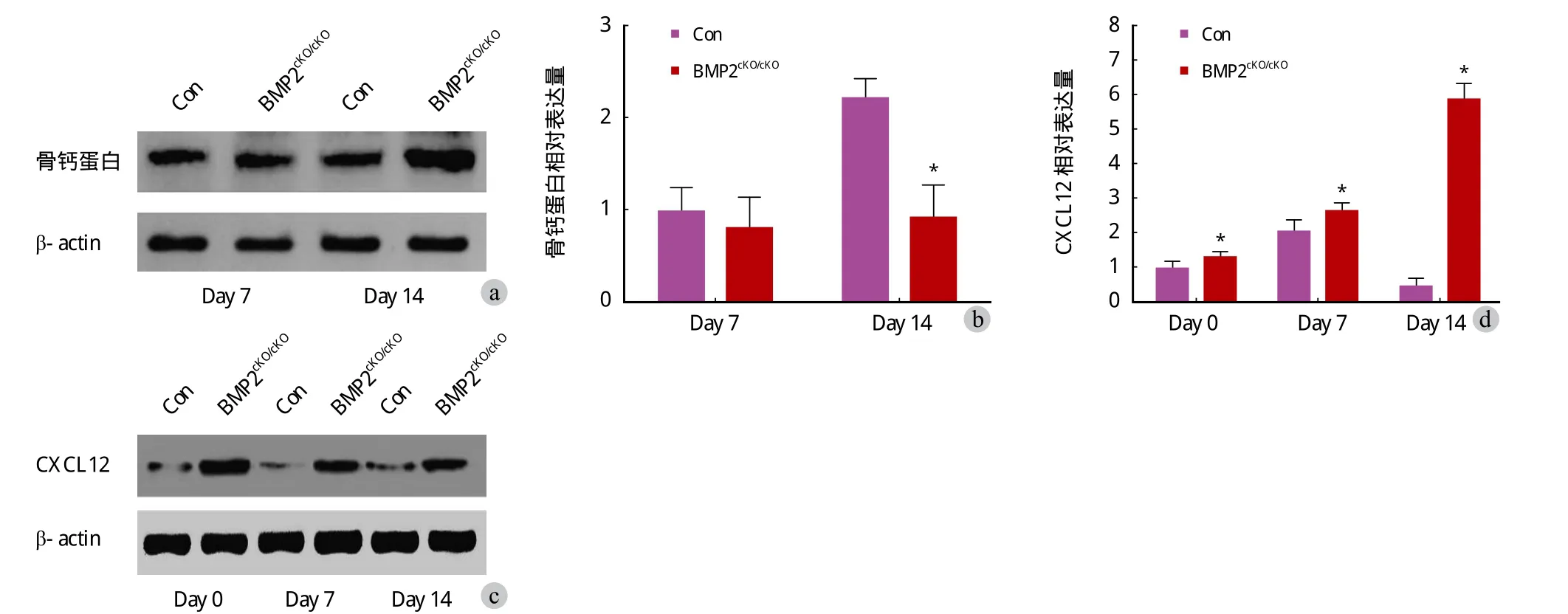
图 6 BMP2cKO/cKO 小鼠骨内膜细胞骨钙蛋白表达下降及 CXCL12 表达升高 [ 分离对照组小鼠和 BMP2cKO/cKO 小鼠骨内膜细胞,分化后 7、14 天,WB 和 RT-qPCR 检测骨钙蛋白 ( a~b );CXCL12 表达 ( c~d ) ]Fig.6 Osteocalcin expression decreased and CXCL12 expression increased in isolated endosteal cells of BMP2cKO/cKO mice [ Endosteal cells were isolated from the controlled and BMP2cKO/cKO mice, osteocalcin ( a - b ) and CXCL12 expression ( c - d ) were detected by WB and RT-qPCR after 7, 14 days’ isolation ]
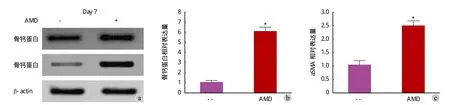
图 7 AMD3100 增加 BMP2cKO/cKO 骨内膜细胞骨钙蛋白和 α-SMA 表达 [ 分离 BMP2cKO/cKO 骨内膜细胞,分化后 7 天添加 400 μM AMD3100 /2 天,分化后 14 天 WB 和 RT-qPCR 检测骨钙蛋白 ( a~b ) 及 α-SMA 表达 ( c ) ]Fig.7 AMD3100 increased osteocalcin and α-SMA expressions in isolated endosteal cells of BMP2cKO/cKO mice [ Endosteal cells were isolated from BMP2cKO/cKO mice. After 7days, 400 μM AMD3100 was added into isolated endosteal cells per 2 days, osteocalcin ( a - b ) and α-SMA expressions ( c ) were detected by WB and RT-qPCR after 14 days’ addition ]
讨 论
骨折修复过程包括细胞募集、骨诱导、骨调控和骨传导。发生骨折后,临近及全身的成骨性干细胞募集于骨折处,骨折局部 BMP 等骨生长因子分泌增多,诱导干细胞向成骨细胞分化,骨再生[7]。BMP2 是一种分子量为 32KDa 的糖蛋白,属于转化生长因子 β 超家族成员。BMP2 是目前公认的成骨细胞转化因子,具有较强的成骨能力[8]。研究发现,将 rhBMP2 注射至去势大鼠体内,可提高骨质疏松的数量和质量[9];而缺少 BMP2 表达的小鼠骨折后无法启动骨愈合反应[10]。BMP2 可作为一种信号肽影响未分化的、有活性的间充质细胞的增殖、分化和细胞外基质合成,多向调节骨量、骨器官发生和骨组织重建[11]。但目前其诱导间充质细胞机制仍不明确。
CXCL12 / CXCR4 信号轴在多种组织细胞中表达,在骨髓间充质细胞的修复、再生和归巢过程中发挥重要作用。研究发现:在小鼠成肌细胞系C2C12 成骨分化过程中,CXCL12 与 BMP2 共同发挥成骨作用[5];阻断 CXCL12 / CXCR4 信号轴可抑制由 BMP2 介导的小鼠骨髓基质细胞的成骨分化[12]。这表明 CXCL12 与 BMP2 共同参与了在骨修复过程,但两者的关系尚未完全阐明。本研究比较小鼠和 BMP2 基因敲除小鼠的骨折修复过程中,BMP2 和CXCL12 表达细胞及其变化。结果发现小鼠骨折修复过程中骨内膜细胞和成骨细胞表达 CXCL12;敲除小鼠 BMP2 导致动物组织细胞 CXCL12 表达和分布发生改变。这提示骨折后 CXCL12+-BMP2+骨内膜细胞被招募到骨损伤处,参与骨折修复过程。
CXCL12 / CXCR4 信号轴可介导骨髓间充质干细胞趋化迁移至骨损伤区域,再使骨髓间充质干细胞分化,调控新生血管生成,促进骨修复[13]。CXCL12是增强骨矿化的关键成骨标记因子,它可调节 BMP2信号转导及氧化应激状态下骨髓间充质干细胞通过自噬增强的生存能力[14]。说明 CXCL12 与 BMP2 密切相关。另有研究发现:CXCL12 / CXCR4 信号通路参与 BMP2 在诱导骨髓间充质干细胞迁移。骨髓间充质干细胞的迁移数量与 CXCL12 和 BMP2 的浓度成正比;阻断剂 AMD3100 明显抑制 BMP2 诱导骨髓间充质干细胞迁移,但当增加 BMP2 浓度达到一定量时,骨髓间充质干细胞迁移数随着 BMP2 浓度的增加而增多。这提示 SDF-1 / CXCR4 信号通路参与BMP2 诱导骨髓间充质干细胞的迁移[15]。本研究发现 BMP2 调控 CXCL12 的表达和分布,且该调控具有时间效应。骨折后 BMP2 下调骨内膜细胞 CXCL12的表达有利于骨内膜细胞分化成成骨细胞。这提示骨内膜细胞分化成成骨细胞依赖 BMP2 下调 CXCL12信号轴从而影响骨修复。这些结果表明骨髓间充质干细胞迁移和分化过程中均依赖 BMP2 与 CXCL12相互调控。
综上所述,骨折修复过程中,骨内膜细胞通过BMP2 下调 CXCL12 有助于其分化为成骨细胞。本研究深入探讨了 BMP2 与 CXCL12 的关系,有序地调控 BMP2 与 CXCL12 对骨修复具有重要意义。
[1] Thomas AE, Louis CG. Fracture healing: mechanisms and interventions[J]. Nat Rev Rheumatol, 2015, 11(1):45-54.
[2] Wu MR, Chen GQ, Li YP. TGF-b and BMP signialing in osteoblast, skeletal development, and bone fromation,bomeostasis and disease[J]. Bone Res, 2016, 4:16009.
[3] Lukas P, Christina K, Christian W, et al. Diversity and interconnections in the CXCR4 chemokine receptor / ligand family:molecular perspectives[J]. Front Immunol, 2015, 6:429.
[4] Liu C, Weng Y, Yuan T, et al. CXCL12 / CXCR4 signal axis plays an important role in mediating bone morphogenetic protein 9-induced osteogenic differentiation of mesenchymal stem cells[J]. Int J Med Sci, 2013, 10(9):1181-1192.
[5] Wise JK, Sumner DR, Virdi AS. Modulation of stromal cellderived factor-1 / CXC chemokine receptor 4 axis enhances rhBMP-2-induced ectopic bone formation[J]. Tissue Eng Part A,2012, 18(7-8):860-869.
[6] 温轩, 谢杨丽, 苏楠, 等. 小鼠胫骨稳定性骨折模型制作及评价[J]. 第三军医大学学报, 2013, 35(15):404-408.
[7] Yue R, Shen B, Morrison SJ. Clec11a / osteolectin is an osteogenic growth factor that promotes the maintenance of the adult skeleton[J]. Elife, 2016, 13:e18782.
[8] Lee CH, Jin MU, Jung HM, et al. Effect of dual treatment with SDF-1 and BMP-2 on ectopic and orthotopic bone formation[J].PLoS One, 2015, 10(3):e0120051.
[9] Qian C, Zhu C, Yu W, et al. Bone morphogenetic protein 2 promotes osteogenesis of bone marrow stromal cells in type 2 diabetic rats via the Wnt signaling pathway[J]. Int J Biochem Cell Biol, 2016, 80:143-153.
[10] McBride-Gagyi SH, Mckenzie JA, Buettmann EG, et al. BMP2 conditional knockout in osteoblasts and endothelial cells does not impair bone formation after injury or mechanical loading in adult mice[J]. Bone, 2015, 81:533-543.
[11] Wu Y, Zhao RC. The role of chemokines in mesenchymal stem cell homing to myocardium[J]. Stem Cell Rev, 2012, 8(1)243-250.
[12] Rogers MB, Shah TA, Shaikh NN. Turning bone morphogenetic protein 2 (BMP2) on and off in mesenchymal cells[J]. J Cell Biochem, 2015, 116(10):2127-2138.
[13] 义勇, 魏垒. 基质细胞衍生因子-1 与骨再生修复[J]. 国际骨科学杂志, 2016, 37(3):190-194.
[14] Herberg S, Kondrikova G, Hussein KA, et al. Mesenchymal stem cell expression of stromal cell-derived factor-1β augments bone formation in a model of local regenerative therapy[J].J Orthop Res, 2015, 33(2):174-184.
[15] 杨毅, 易蕾, 叶尔扎提·哈加合曼, 等. SDF-1 / CXCR4 信号通路参与骨形态蛋白 2 在诱导骨髓间充质干细胞迁移的作用[J]. 中国组织工程研究, 2016, 20(41):6098-6104.
关于论文的作者署名与志谢
我国著作权法公布以来,已得到社会各界的广泛重视,作为医学科技期刊,必须不折不扣地执行著作权法。为此将本刊对作者署名和志谢的有关要求重申如下。
一、作者署名的意义和应具备的条件
1. 署名的意义:( 1 ) 标明论文的责任人,文责自负;( 2 ) 医学论文是医学科技成果的总结和记录,是作者辛勤劳动的成果和创造智慧的结晶,也是作者对医学事业做出的贡献,并以此获得社会的尊重和承认的客观指标,是应得的荣誉,也是论文版权归作者的一个声明;( 3 ) 作者署名便于编辑、读者与作者联系,沟通信息,互相探讨,共同提高;( 4 ) 作者姓名在文题下按序排列,其署名必须与授权书一致;( 5 ) 作者单位名称及邮政编码脚注于同页左下方。
2. 作者应具备下列条件:( 1 ) 参与选题和设计或参与资料的分析和解释者;( 2 ) 起草或修改论文中关键性理论或其它主要内容者;( 3 ) 能对编辑部的修改意见进行核修,在学术界进行答辩,并最终同意该文发表者。以上3 条均须具备。仅参与获得资金或收集资料者不能列为作者,仅对科研小组进行一般管理者也不宜列为作者。其他对该研究有贡献者应列入志谢部分。对文章中的各主要结论,均必须至少有 1 位作者负责。
3. 几项具体规定:( 1 ) 通讯作者应在投稿时确定。通讯作者只列 1 位,由投稿者决定;( 2 ) 第一作者与通讯作者为同一人时,不必标注为通讯作者;( 3 ) 在论文首页以脚注的形式标注通讯作者姓名与 Email;( 4 ) 外籍作者,应附本人亲笔签名同意在本刊发表的函件;( 5 ) 集体署名的论文于文题下列署名单位,于文末列整理者姓名;( 6 ) 集体署名的文章须将对该文负责的关键人物列为通讯作者;( 7 ) 多中心研究的论文,其各单位的第一作者,均为该文的并列第一作者。
二、志谢
在文后志谢是表示感谢并记录在案的意思。对给予过实质性帮助而又不能列为作者的单位或个人应在文后给予志谢。但必须征得被志谢人的书面同意。志谢应避免以下倾向:
被志谢者包括:( 1 ) 对研究提供资助的单位、个人和合作单位;( 2 ) 协助完成研究工作和提供便利条件的组织和个人;( 3 ) 出于某种考虑,将应被志谢人放在作者的位置上,混淆了作者和被志谢者的权利和义务;( 4 ) 名人、知名专家包装自己的论文,抬高论文的身份,将未曾参与工作的,也未阅读过该论文的知名专家写在志谢中;( 5 )协助诊断和提出重要建议的人;( 6 ) 予转载和引用权的资料、图片、文献、研究思想和设想的所有者;( 7 ) 作出贡献又不能成为作者的人,如提供技术帮助和给予财力、物力支持的人,阐明其支援的性质;( 8 ) 其他需志谢者。
Regulation mechanism of BMP2 on CXCL12 expression in fracture repair and its clinical significance
KANG Kai, BAI Dong-yu, XUE Jian-li, LUAN Yan-jun, LIU Yan-xiong. Department of Orthopedics, Hospital of Yanan University, Yanan, Shaanxi, 716000, China
Objective To investigate regulation mechanism of bone morphogenic protein 2 ( BMP2 ) on chemokine C-X-C motif-ligand-12 ( CXCL12 ) expression in the fracture repair and its clinical significance. Methods Knockout mice of BMP2 ( BMP2cKO/+and BMP2cKO/cKO) were constructed. Immunohistochemistry methods were used to analyze the cells with CXCL12 expression and the timely changes in the controlled, BMP2cKO/+and BMP2cKO/cKOmice bone fracture repair models. Real time-qPCR was used to compare the expression changes of CXCL12,osteocalcin and α-SMA gene in endosteal cells and differential endosteal cells isolated from the controlled, BMP2cKO/+and BMP2cKO/cKOmice. Results The expression of BMP2 was significantly lower in BMP2cKO/+and BMP2cKO/cKOmice than the controlled mice. CXCL12 was expressed in the endosteal cells and some osteocytes during mice fracture repair, and the cells with CXCL12 expression increased at the beginning and then decreased. The endosteal cells and osteocytes which expressed CXCL12 increased gradually in BMP2cKO/+mice. CXCL12 expression in endosteal cells isolated from BMP2cKO/+mice was higher than that cells from the controlled mice. In isolated endosteal cells, rhBMP2,while inducing osteoblastic differentiation, stimulated expression of osteocalcin and α-SMA that was coupled with a decrease of CXCL12 expression significantly. In isolated BMP2cKO/cKOendosteal cells, high CXCL12 expression and low osteocalcin expression were observed. In isolated BMP2cKO/cKOendosteal cells with AMD3100 ( an antagonist of CXCL12 receptor ) treatment, osteocalcin and α-SMA expression increased. Conclusions In fracture repair process,BMP2 leads to the downregulation of CXCL12 expression that would facilitate endosteal cells differentiating into osteoblasts and promote fracture healing.
Bone morphogenic protein 2; Chemokine C-X-C motif-ligand-12; Fraction repair; Endosteal cells
10.3969/j.issn.2095-252X.2017.11.009
R683
716000 陕西,延安大学附属医院骨科
2017-03-10 )
( 本文编辑:李慧文 )

