甜菜碱对单针藻Monoraphidium sp.QLY-1油脂积累的影响
,, ,, ,
(昆明理工大学生命科学与技术学院,云南昆明 650500)
甜菜碱对单针藻Monoraphidiumsp.QLY-1油脂积累的影响
李大菲,赵永腾,赵鹏,徐军伟,李涛,余旭亚*
(昆明理工大学生命科学与技术学院,云南昆明 650500)
为提高单针藻Monoraphidiumsp.QLY-1的生物量和油脂产量,本文结合两阶段策略,即异养-光诱导培养方法,研究甜菜碱(GB)对单针藻QLY-1生长和油脂积累的影响。结果表明,异养、自养的微藻生物量分别为(5.54±0.22)、(0.878±0.12)g/L,且异养比自养提高了5.3倍。此外,在光胁迫下,添加5 mmol/L甜菜碱时可有效提高微藻的油脂含量,其油脂含量(47.37%±2.93%)相比对照(36.68%±1.34%)提高了0.29倍(p<0.05)。进一步的研究表明,与对照相比,添加5 mmol/L甜菜碱时,藻细胞中性脂增加了12.83%±0.75%,对藻细胞内脂肪酸组成无显著性影响。研究表明,甜菜碱作为一种外源诱导子可有效促进微藻细胞中油脂积累,甜菜碱结合两阶段法可作为促进微藻细胞油脂积累的另一策略。
Monoraphidiumsp.QLY-1,油脂产率,油脂含量,甜菜碱,两阶段培养
化石能源不可再生,绿色能源的开发和利用受到越来越多的关注,生物柴油具有可再生等特点,可作为理想的化石能源替代品[1]。微藻具有产油量高、生物产量高、生长速率快、占耕地面积小、光合作用效率高、生物燃料污染小、温室气体排放少等特点,微藻的优势使其成为生产生物柴油的良好原料[2-7]。
一直以来,增加微藻的油脂产率、降低其油脂培养成本是微藻生物柴油制备领域的研究热点。改变其培养方式、选择合适的诱导条件是增加油脂产率的有效途径。传统的微藻培养方法多数为单一的外界胁迫条件,例如营养缺陷、高盐或强光照下促进微藻细胞中油脂积累[8]。一些新的策略如添加植物激素或化学诱导子并结合胁迫条件来解决传统培养方式导致的生物量和油脂产量低、生产成本高、单一的营养限制等问题,从而尽可能的提高微藻细胞中油脂含量,成为近年来研究的热点[9-10]。两阶段培养法是一种有效提高微藻生长和油脂积累的方法[11]。第一阶段异养提高生物量,第二阶段自养提高脂含量;从而使微藻的生物量和油脂产量最大化。研究表明,利用两阶段培养微藻可提高生物量与脂含量[9,12]。
甜菜碱是一类成分复杂的水溶性天然有机溶质,是一种植物生长调节剂,是重要的渗透调节物质,具有维持细胞渗透压平衡的作用,对蛋白质和细胞膜有保护作用[13],可促进植物的生长发育,是优良的生物诱导剂[14-15]。油脂是微藻在胁迫条件下产生并积累的次生代谢产物,与黄腐酸类似,甜菜碱作为外源诱导子可能对微藻油脂的积累有一定的促进作用[16];且甜菜碱对单针藻中油脂的积累影响和机理方面的研究还鲜有报道。
本实验以单针藻Monoraphidiumsp. QLY-1为研究对象,在两阶段培养的基础上研究添加不同浓度甜菜碱对单针藻生长和油脂合成的影响,并探究其对脂肪酸组成和油脂分级的影响。
1 材料与方法
1.1材料与仪器
单针藻Monoraphidiumsp.QLY-1 为本实验室筛选并保存;甜菜碱 纯度≥99%,昆明硕阳有限公司;甲醇、丙酮、氯仿 分析纯,昆明鼎国试剂公司。
TS-2011GZ恒温光照振荡摇床 上海天呈;XS-212-202显微镜 JNOEC;VS-840-1超净工作台 上海博讯;FD5-12冷冻干燥机SIM International Group;Ultrospec 2100pro紫外可见分光光度计 Amersham Biosciences;LDZX-50KBS灭菌锅 上海申安;FA2004N分析天平 上海箐海;HHW-D6水浴锅 金坛双捷;5804R离心机 Eppendorf;1730R高速冷冻离心机 Labogene Scanspeed。
1.2实验方法
1.2.1 单针藻Monoraphidiumsp. QLY-1的培养 接种至250 mL BG-11培养基中,25 ℃恒温摇床培养,摇床转速150 r/min,培养至对数生长期。
1.2.2 微藻的培养条件 第一阶段为异养培养:BG-11培养基中添加10 g/L的葡萄糖,无光照、摇床转速150 r/min,培养温度25 ℃[17]。第二阶段为自养培养:将生长至对数期的种子液接种至自养培养基中;添加甜菜碱诱导,将不同浓度梯度的甜菜碱添加至BG-11培养基中,使其形成浓度梯度,甜菜碱的浓度分别为5、10、20 mmol/L,对数期的种子液接种到不含甜菜碱的BG-11自养培养基作为对照,每组设3个平行样;置于25 ℃恒温摇床培养,摇床转速150 r/min,光照强度为3500 lux。在诱导第1、3、5 d分别收藻,并进行微藻的离心富集和油脂提取。
1.3微藻的富集及油脂提取
采用隔天取样的方式,将新鲜藻液转移至离心管内进行离心富集(4500 r/min,5 min),将收集的藻体进行冷冻干燥,制得的藻粉(w1)加入3 mL体积比为2∶1的氯仿甲醇溶液提取油脂(150 r/min,20 min),离心取上清(2000 r/min,10 min),重复提取至藻体发白(2~3次),将上清液并入预先称重的50 mL离心管(w2)中,39 ℃恒温干燥,称重(w3),油脂提取采用Bligh & Dyer法[18],油脂含量(%)计算公式如下:
油脂含量(%)=(w3-w2)/w1×100
1.4脂肪酸成分分析
将上述提取油脂加入2 mL 3%硫酸-甲醇进行甲酯化,70 ℃水浴冷凝回流4 h,取2 mL正己烷萃取4 h,取正己烷相进行GC-MS分析脂肪酸组成。Agilent7890执行GC-MS分析;色谱条件:HP-5MS色谱柱,高纯氦气载气,1.0 mL/min流速。二阶升温程序:170 ℃保持0 min,然后10 ℃/min到190 ℃,持续1 min;进样量为1 μL分流进样,分流比40∶1,进样口温度250 ℃。质谱条件:EI离子源温度为230 ℃,四级杆温度为150 ℃,溶剂延迟2 min;质量扫描范围为50~550 amu。选用NIST08.L数据库,计算各组分的相对百分含量采用峰面积归一化法。
1.5油脂分级
将藻粉添加硅胶、氯仿,充分搅拌至干粉状,均匀地加入层析柱中,再加适当的溶剂冲洗,连续不断地缓慢倒入柱内,任其自由流下,保持适当流速。依次以氯仿、丙酮、甲醇梯度洗脱(体积比为6∶4∶4),分别提取中性脂、糖脂、磷脂[19],分析各组分。
1.6数据处理
全部实验均设置3组平行,利用ANOVA(SPSS 19.0)一步法分析实验数据。最小显著性差异进行多重比较,检验调查不同实验的组间差异,且当p<0.05具有显著性意义。
2 结果与分析
2.1单针藻QLY-1的自养和异养
由表1可知,单针藻QLY-1与同属的藻类相比油脂含量较高,可作为生产生物柴油的原料[9,17,19]。然而在自养条件下,其生物量和油脂产率较低,采用两阶段的培养方式可能有助于提高微藻的生物量和油脂产率。
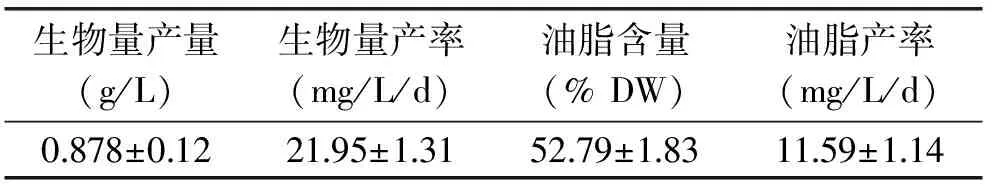
表1 单针藻QLY-1在自养条件下的 生物量产量、生物量产率、油脂含量及油脂产率Table 1 Biomass production,biomass productivity, lipid content and lipid productivity of Monoraphidium sp. QLY-1 under photoautotrophic condition
由图1可以看出,单针藻QLY-1在异养条件下,前4 d生物量增长缓慢;培养第4~8 d进入对数生长期,快速积累生物量;培养8~10 d生长率呈下降趋势,藻体已经进入稳定期,逐渐停止增长;微藻生物量持续增加,表明微藻通过异养可以显著提高生物量。
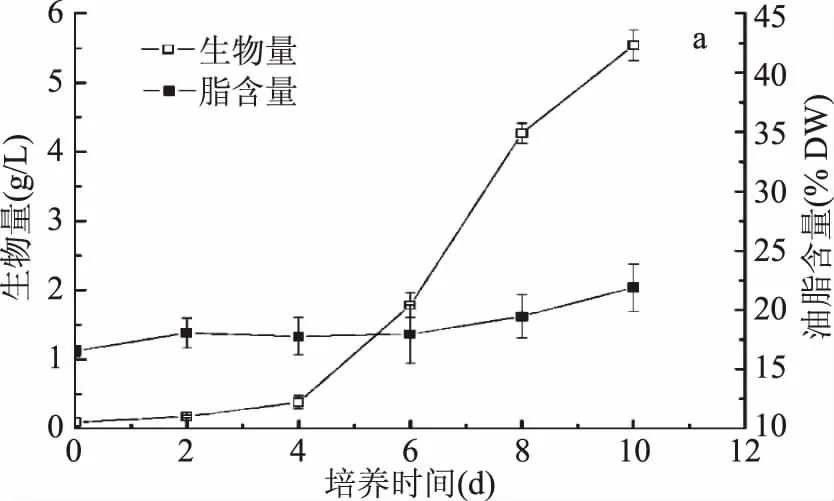
图1 单针藻在异养条件下的生物量及油脂含量Fig.1 The biomass and lipid content of Monoraphidium sp. QLY-1 during heterotrophic process
在自养条件下,单针藻QLY-1脂含量为52.79%±1.83%,但其生物量以及油脂产率很低;因此,QLY-1的生物量以及油脂产率需进一步提高。由图1可以看出,异养阶段结束,生物量达到了(5.54±0.22) g/L,生物量产率达到了(554±22) mg/L/d,比自养条件下提高了24.24倍(p<0.01);该产率也高于Yu等相关研究报告结果的396 mg/L/d[17]。异养油脂产率(124.48±4.4) mg/L/d是自养的10.74倍(p<0.01);但是,异养阶段油脂含量低;这与Fan 等人的研究结果相似[20]。
2.2不同浓度甜菜碱对单针藻QLY-1生物量以及脂含量的影响分析
由图2可以看出,在不同浓度甜菜碱的诱导条件下,生物量和油脂含量均高于对照。当甜菜碱浓度为5 mmol/L时,生物量和油脂含量均达到了最高值。研究甜菜碱对微藻油脂积累的影响可知,诱导第1 d油脂快速积累;甜菜碱诱导第3 d与对照相比较5、10、20 mmol/L甜菜碱处理组,油脂含量分别增加了29.06%(p<0.01),19.55%(p<0.05)以及8.7%,由此说明甜菜碱可以有效地提高单针藻QLY-1的油脂含量。Yang等研究了通过自养两阶段加盐诱导的方法提高单针藻MonoraphidiumdybowskiiLB50的油脂产率,其油脂产率为46.21 mg/L/d[9];Fan等利用异养稀释光诱导的方法提高小球藻C.vulgaris的油脂含量,其油脂产率可达85.43 mg/L/d[20]。结果表明,两阶段策略可以有效地提高微藻在不同胁迫条件下的生物量及油脂含量[9,16]。

图2 不同浓度甜菜碱对单针藻 QLY-1生物量以及油脂含量的影响Fig.2 Effects of different concentrations of glycine betaine on the biomass and lipid content of Monoraphidium sp. QLY-1
2.35mmol/L甜菜碱对单针藻QLY-1脂肪酸组成的影响
由表2可以看出,添加5 mmol/L甜菜碱诱导的藻细胞,脂肪酸C16∶0、C18∶1以及C18∶2的含量超过65%,诱导后C16∶0的脂肪酸含量增加,单不饱和脂肪酸(主要是C18∶1)含量减少。此外,藻细胞脂肪酸组成和不饱和度均无显著性变化,这与Li等利用褪黑素处理微藻后的结果一致[21]。因此,在光胁迫下,甜菜碱可能作为微藻的保护剂。
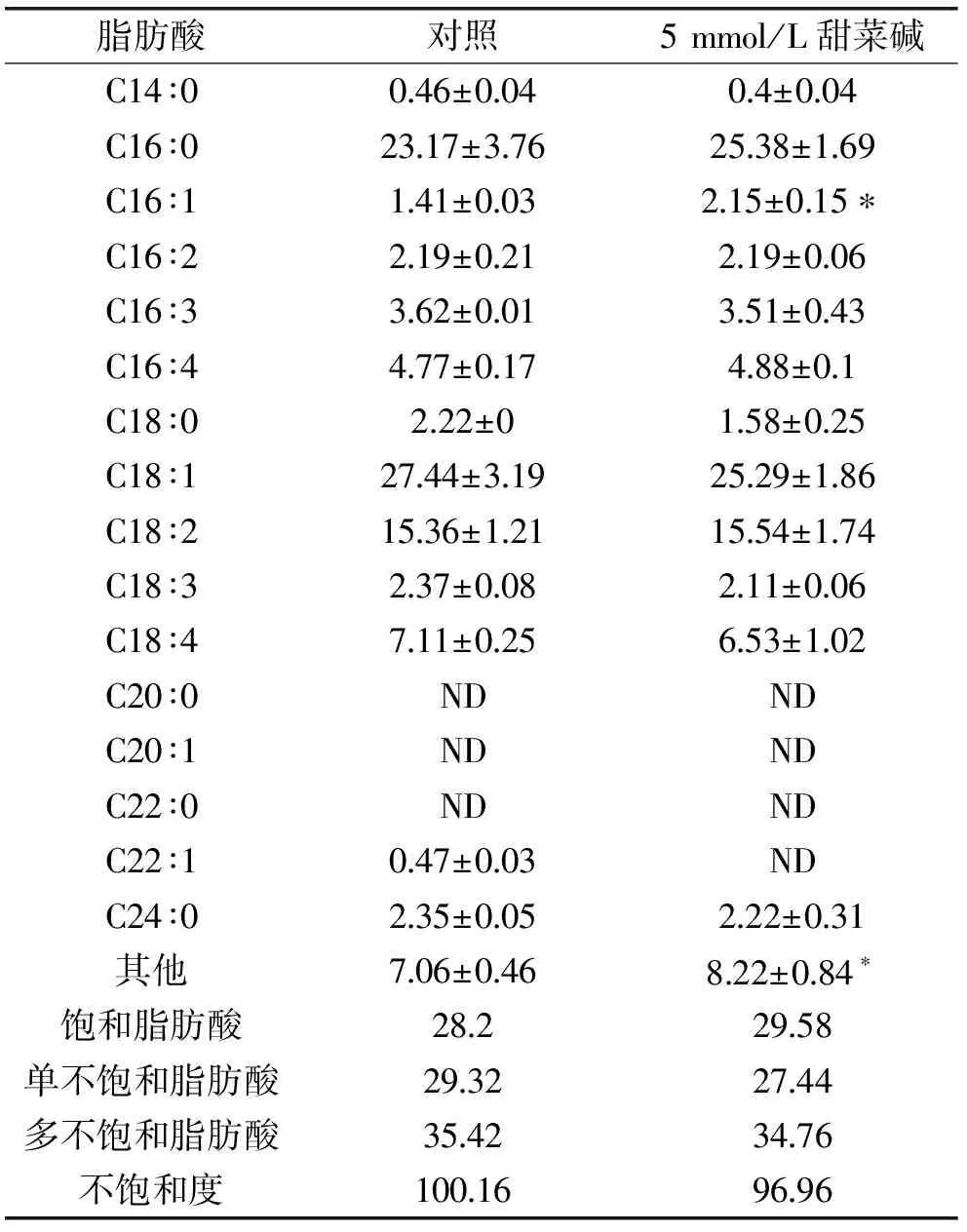
表2 单针藻QLY-1脂肪酸组成(%)Table 2 Fatty acids composition of the Monoraphidium sp.QLY-1(%)
注:ND:未检测到;其他:C4∶0~C10∶0;*:同行差异显著;不饱和度=单不饱和脂肪酸+2×多不饱和脂肪酸。
2.45mmol/L甜菜碱对单针藻QLY-1油脂分级的影响
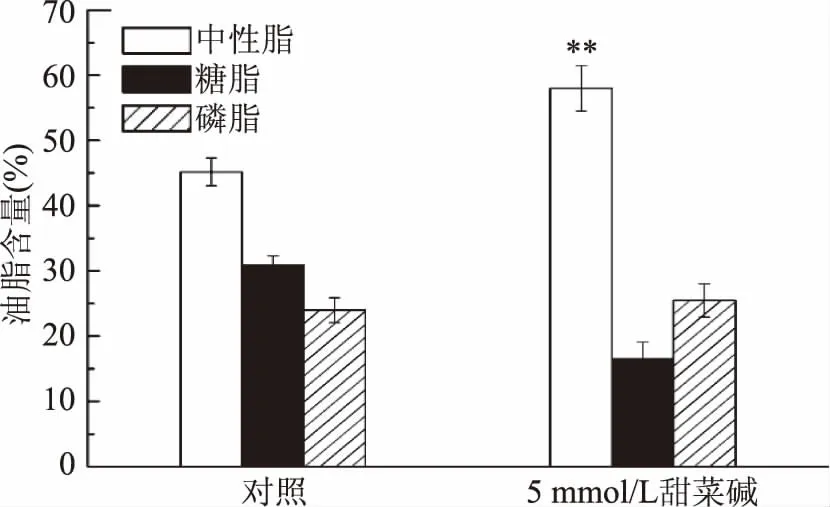
图3 单针藻QLY-1的油脂分级Fig.3 Lipid classes of Monoraphidium sp.QLY-1
结果表明,5 mmol/L的甜菜碱油脂分级中性脂、糖脂含量均高于对照;磷脂增加了1.49%,中性脂增加了12.83%(p<0.01),与糖脂降低的14.32%一致(图3);推测在5 mmol/L甜菜碱处理下糖脂可能转化为了中性脂[19]。添加外源甜菜碱微藻内油脂含量显著提升;但是,甜菜碱在微藻中详细的诱导机制尚不清楚[22-23];甜菜碱作为一个植物生长调节剂,促进了微藻中油脂的积累这可能与细胞内ROS有关[24-26];也可能与碳固定以及油脂生物合成相关基因表达有关[27],以上结论需要进一步探究。
3 结论
自养、异养是工业上常用的微藻培养方法,本研究采用异养-光诱导的两阶段培养方式。结果表明,异养可在短期内大幅提高微藻生物量;光胁迫下,添加外源甜菜碱有助于提高单针藻细胞中油脂积累,且在5 mmol/L甜菜碱诱导后,油脂含量可达47.37%。此外,添加外源甜菜碱提高了油脂中中性脂的含量,但对脂肪酸组成无显著性影响。本文就甜菜碱对油脂积累的影响进行了初步的研究,建立了植物生长调节剂甜菜碱与油脂合成启动之间的联系,相关的调控机制有待进一步深入研究。
[1]汪桂林,桂小华,邓伟,等. “异养-胁迫”分段培养对原始小球藻生物量和油脂含量影响研究[J]. 中国生物工程杂志,2013,33(3):99-104.
[2]李爱芬,刘然,刘晓娟,等. 碳源对粉核油球藻生长和脂肪酸组成特性的影响[J]. 水生生物学报,2009,33(3):461-467.
[3]Frondel M,Peters J. Biodiesel:a new oildorado?[J]. Energy Policy,2007,35(3):1675-1684.
[4]Zhao G,Yu J,Jiang F,et al. The effect of different trophic modes on lipid accumulation of Scenedesmus quadricauda[J]. Bioresource Technology,2012,114(114):466-471.
[5]夏金兰,万民熙,王润民,等. 微藻生物柴油的现状与进展[J]. 中国生物工程杂志,2009,29(7):118-126.
[6]Chisti Y. Biodiesel from microalgae[J]. Biotechnology Advances,2007,25(3):294-306.
[7]Hu Q,Sommerfeld M,Jarvis E,et al. Microalgal triacylglycerols as feedstocks for biofuel production:perspectives and advances[J]. The Plant Journal,2008,54(4):621-639.
[8]翟映雪,梁成伟,张伟,等. 微藻油脂的研究进展[J]. 食品工业科技,2014,35(17):370-375.
[9]Yang H,He Q,Hu C. Lipid accumulation by NaCl induction at different growth stages and concentrations in photoautotrophic two-step cultivation ofMonoraphidiumdybowskiiLB50.[J]. Bioresource Technology,2015,187:221-227.
[10]Singh P,Kumari S,Guldhe A,et al. Trends and novel strategies for enhancing lipid accumulation and quality in microalgae[J]. Renewable and Sustainable Energy Reviews,2016,55:1-16.
[11]Ling X,Ge H,Zhou X,et al. Photoautotrophic outdoor two-stage cultivation for oleaginous microalgaeScenedesmusobtusus,XJ-15[J]. Bioresource Technology,2013,144(3):261-267.
[12]Xian S,Yu C,Hui X,et al. Effect of nitrogen-starvation,light intensity and iron on triacylglyceride/carbohydrate production and fatty acid profile ofNeochlorisoleoabundans,HK-129 by a two-stage process[J]. Bioresource Technology,2014,155(2):204-212.
[13]Kurepin L V,Ivanov A G,Zaman M,et al. Stress-related hormones and glycinebetaine interplay in protection of photosynthesis under abiotic stress conditions[J]. Photosynthesis Research,2015,126(2-3):221-235.
[14]Chen T H H,Murata N. Glycinebetaine:an effective protectant against abiotic stress in plants[J]. Trends in Plant Science,2008,13(9):499-505.
[15]Ashraf M,Foolad M R. Roles of glycine betaine and proline in improving plant abiotic stress resistance[J]. Environmental and Experimental Botany,2007,59(2):206-216.
[16]车绕琼,赵鹏,徐军伟,等. 黄腐酸对单针藻生长和油脂含量的影响[J]. 水生生物学报,2017,41(2):437-442.
[17]Yu X,Zhao P,He C,et al. Isolation of a novel strain of Monoraphidium sp. and characterization of its potential application as biodiesel feedstock[J]. Bioresource Technology,2012,121(7):256-262.
[18]Bligh E G,Dyer W J. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry & Physiology,1959,37(8):911-917.
[19]Yang H,He Q,Rong J,et al. Rapid neutral lipid accumulation of the alkali-resistant oleaginousMonoraphidiumdybowskiiLB50 by NaCl induction[J]. Bioresource Technology,2014,172(22):131-137.
[20]Fan J,Huang J,Li Y,et al. Sequential heterotrophy-dilution-photoinduction cultivation for efficient microalgal biomass and lipid production[J]. Bioresource Technology,2012,112(5):206.
[21]Li D,Zhao Y,Ding W,et al. A strategy for promoting lipid production in green microalgaeMonoraphidiumsp. QLY-1 by combined melatonin and photoinduction[J]. Bioresource Technology,2017,235:104-112.
[22]Kurepin L V,Ivanov A G,Zaman M,et al. Stress-related hormones and glycinebetaine interplay in protection of photosynthesis under abiotic stress conditions[J]. Photosynthesis Research,2015,126(2-3):221-235.
[23]Swapnil P,Singh M,Singh S,et al. Recombinant glycinebetaine improves metabolic activities,ionic balance and salt tolerance in diazotrophic freshwater cyanobacteria[J]. Algal Research,2015,11:194-203.
[24]Hong M E,Hwang S K,Chang W S,et al. Enhanced autotrophic astaxanthin production from Haematococcus pluvialis under high temperature via heat stress-driven Haber-Weiss reaction[J]. Applied Microbiology and Biotechnology,2015,99(12):5203-5215.
[25]Babu A G,Wu X,Kabra A N,et al. Cultivation of an indigenous Chlorella sorokiniana,with phytohormones for biomass and lipid production under N-limitation[J]. Algal Research,2017:178-185.
[26]Che R,Huang L,Xu J W,et al. Effect of fulvic acid induction on the physiology,metabolism,and lipid biosynthesis-related gene transcription ofMonoraphidiumsp. FXY-10[J]. Bioresource Technology,2017,227:324-334.
[27]Wang Y,He B,Sun Z,et al. Chemically enhanced lipid production from microalgae under low sub-optimal temperature[J]. Algal Research,2016,16:20-27.
EffectsofglycinebetaineonlipidaccumulationofMonoraphidiumsp.QLY-1
LIDa-fei,ZHAOYong-teng,ZHAOPeng,XUJun-wei,LITao,YUXu-ya*
(Faculty of Science and Technology,Kunming University of Science and Technology,Kunming 650500,China)
For promoting biomass and lipid production inMonoraphidiumsp. QLY-1,this study investigated that the effects of glycine betaine(GB)on the growth and lipid accumulation in QLY-1 in combination with a two-step strategy,which was called heterotrophic and photoinduction cultivation. Results showed that the biomass concentration of heterotrophic and autotrophic algal cells were(5.54±0.22)and(0.878±0.12)g/L,respectively,and the heterotrophic cells was 5.3 folds higher than that of the autotrophic. Moreover,under high light stress,the lipid content(47.37%±2.93%)was enhanced by 0.29 folds(p<0.05)treated with 5 mmol/L glycine betaine than that of control(36.68%±1.34%). Further studies showed that the neutral lipid content was increased to 12.83%±0.75% than that of the control,and was no significant influences on the fatty acids composition under 5 mmol/L glycine betaine induction. The results indicated that glycine betaine could significantly increase the production of lipid in microalgae,combination of glycine betaine and two-step cultivation could act as another strategy for promoting the lipid accumulation in microalgae.
Monoraphidiumsp. QLY-1;lipid productivity;lipid content;glycine betaine;two-step strategy
2017-03-24
李大菲(1991-),男,硕士研究生,研究方向:微藻资源开发,E-mail:dafei_likmust@163.com。
*
余旭亚(1969-),男,博士,教授,主要从事生物炼制方面的研究,E-mail:xuya_yu@163.com。
国家自然科学基金资助项目(21266013)。
TS201.3
A
1002-0306(2017)21-0110-04
10.13386/j.issn1002-0306.2017.21.023

