四种消毒剂对摇蚊幼虫杀菌效果研究
黄博闻,李亚楠,史云雅,刘 珊,雷园园,郭永军,刘金兰
(天津农学院水产学院,天津市水产生态及养殖重点实验室,天津 300384)
四种消毒剂对摇蚊幼虫杀菌效果研究
黄博闻,李亚楠,史云雅,刘 珊,雷园园,郭永军,刘金兰
(天津农学院水产学院,天津市水产生态及养殖重点实验室,天津 300384)
为筛选四种鱼用消毒剂对摇蚊幼虫(Chironomidlarvae)最适消毒条件,在单因素试验基础上,以消毒剂对摇蚊幼虫携带细菌相对灭菌率为考察指标进行正交试验;以消毒后摇蚊幼虫相对存活率、稀有鲫(Gobiocyprisrarus)对摇蚊幼虫平均摄食时间、消毒后未杀灭细菌种类为指标,综合评价消毒虫体质量。结果显示:浓度因子对聚维酮碘、新洁尔灭、高锰酸钾的相对灭菌率有极显著影响;时间因子对聚维酮碘的相对灭菌率影响极显著;温度因子对聚维酮碘的相对灭菌率影响极显著,对新洁尔灭影响显著;浓度、时间和温度因子均对戊二醛的相对灭菌率无显著影响;在实验室条件下,根据消毒剂对相对灭菌率的各影响因子主次顺序得到了四种消毒剂消毒摇蚊幼虫的最佳因子参数,其中高锰酸钾:消毒剂浓度60 mg/L,消毒温度28 ℃,消毒时间1.5 h;聚维酮碘:消毒温度24 ℃,消毒剂浓度150 mg/L,消毒时间1 h;新洁尔灭:消毒剂浓度3 200 mg/L,消毒温度24 ℃,消毒时间1 h;戊二醛:消毒温度28 ℃,消毒时间1.5 h,消毒剂浓度20 000 mg/L。四种消毒剂最佳消毒条件对摇蚊幼虫相对存活率及对稀有鲫摄食效果影响不大;消毒后从不同来源的四份虫体样品共分离出未杀灭的细菌16种,主要隶属于气单胞菌属和不动杆菌属。
摇蚊幼虫(Chironomidlarvae);稀有鲫(Gobiocyprisrarus);高锰酸钾;聚维酮碘;新洁尔灭;戊二醛;相对灭菌率
摇蚊幼虫(Chironomidlarvae)又名红虫,隶属于节肢动物门(Arthropoda)昆虫纲(Insecta)双翅目(Diptera)摇蚊科(Chironomidae),广泛分布于各类水体,生物量常占底栖生物总量的50%以上,其营养丰富,蛋白质含量占干物重的41%~62%,脂肪占2%~8%,是多种经济水生动物的优良天然饵料[1-4]。摇蚊幼虫营底栖生活并有筑巢习性,通常以细沙、淤泥、腐屑、藻类等筑巢,以有机碎屑、细菌、藻类等为食,不可避免地携带着细菌等病原体[5-7]。目前关于对鲜活饵料的消毒主要集中于水蚯蚓、丰年虫、轮虫、大泷六线鱼等种类上[8-10],对摇蚊幼虫的消毒方法研究还未见报道。本试验旨在通过四种渔用消毒剂对摇蚊幼虫消毒方法的研究,筛选摇蚊幼虫最佳消毒条件,以降低养殖水生动物因摄食摇蚊幼虫引发疾病的风险。
1 材料与方法
1.1 试剂与实验动物
聚维酮碘(北京百灵威科技有限公司,有效碘含量10.62%)、戊二醛、新洁尔灭、高锰酸钾、氯化钠均为国产分析纯(天津市风船化学试剂科技有限公司)。
4份4龄期摇蚊幼虫样品购自天津中环花鸟鱼虫市场,暂养温度为(25±1)℃,光照周期为16∶8(光∶暗)。稀有鲫(Gobiocyprisrarus)由中科院水生生物研究所提供。
1.2 实验方法
1.2.1 虫体吐脏
参考樊海平等[10]的方法适当修改。称取滤干摇蚊幼虫100 g,在28 ℃条件下,分别于不同浓度食盐水中浸泡不同时间后,清水冲洗干净,于60 ℃干燥箱烘48 h称重,计算吐脏量。
吐脏量计算公式:吐脏量(g/100g)=G对照-G试验
式中,G对照、G试验分别为对照组与试验组摇蚊幼虫干重。
1.2.2 虫体消毒
试验在(20±1)℃水溶液中进行,每组3个平行。试验时,在无菌离心管内加入1 g经吐脏处理后的摇蚊幼虫,再加入10 mL消毒剂,作用至设定时间,使用无菌PBS冲洗三次。从每组分别称取0.1 g虫体经捣碎机(4 500 r/min)捣碎2 min,取原浆0.2 mL,10倍管外梯度稀释,吸取0.1 mL稀释液涂布于牛肉膏蛋白胨琼脂培养基,37 ℃培养36 h后进行活菌计数,并计算相对灭菌率。
相对灭菌率=(对照组活菌数-试验组活菌数)/对照组活菌数×100%
1.2.3 消毒剂对摇蚊幼虫消毒效果的条件优化
为得到优化方法,根据单因素实验结果设计正交实验,以药物浓度(A)、药物作用时间(B)、作用温度(C)为3个因素,每个因素3个水平,采用L9(34)正交表进行正交试验,因素与水平见表1。相对灭菌率计算方法同1.2.2。
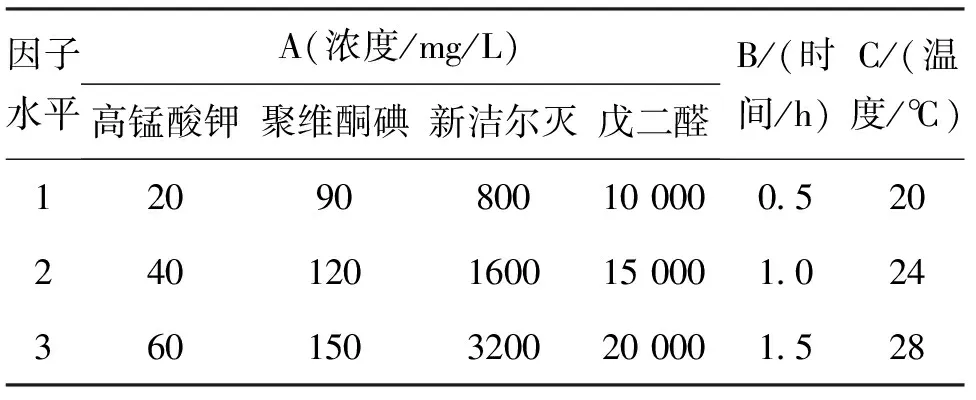
表1 正交试验因子与水平Tab.1 Orthogonal experimental factors and levels
1.2.4 验证试验
在正交试验得到的四种消毒剂对摇蚊幼虫的最佳消毒条件下进行验证试验,试验方法同1.2.2,每种消毒剂设3个平行组。
1.2.5 四种消毒剂消毒对摇蚊幼虫相对存活率的影响
采用正交实验最优结果对摇蚊幼虫进行消毒处理,置于1 000 mL烧杯中,每杯50虫,试验期间每24 h连续7 d计数各消毒组摇蚊幼虫存活情况,及时取出死亡个体。以玻璃棒轻压摇蚊幼虫尾部3次后不做“8”字形运动为死亡标准[13],计算虫体相对存活率。
试验在1 000 mL烧杯中进行。将75尾(平均体重0.84 g±0.1 g)健康稀有鲫随机分配到4个试验组和一个对照组,每组设3个平行,每平行5尾,每组共15尾。试验前将鱼饥饿1 d至排空粪便,每日按鱼体重5%的投喂量,试验组分别投喂在正交实验最优条件下由高锰酸钾、聚维酮碘、新洁尔灭、戊二醛消毒过的规格相对均一的摇蚊幼虫,对照组投喂未经消毒的摇蚊幼虫,每天2次(9∶00、17∶00),计时摄食时间,以5 min为摄食终点。如5 min后有饵料剩余,收集残饵吸干称重,计算摄食率;5 min内摄食完成,则记录摄食时间。试验时间为7 d,投喂期间自然光照,水温为(28±1)℃,pH(7.7±0.17),水深12 cm,24 h气泵增氧,每日换水量为1/3。
摄食率=(每次投喂量-每次残饵量)/每次投喂量×100%
1.2.7 消毒后存活细菌分离鉴定
对用四种消毒剂最佳消毒方案消毒过的4份不同水体来源摇蚊幼虫样品存活细菌分离并连续纯化3次。采用16S rDNA序列分析进行细菌鉴定:引物序列为27F:5′-AGA GTT TGA TCC TGG CTC AG-3′,1492R:5′-GGT TAC CTT GTT ACG ACTT-3′(北京生工生物工程有限公司合成),细菌DNA提取使用DNA提取试剂盒(天根生化科技有限公司),PCR产物进行琼脂糖凝胶电泳检测并送往生工生物工程(上海)股份有限公司进行序列测定,将序列与GenBank中序列进行比对分析。
1.3 数据处理
2 结果与分析
2.1 吐脏实验结果
不同盐度刺激摇蚊幼虫吐脏后的吐脏量结果见表2。表2显示,各盐度组随刺激时间增加吐脏量显著升高。当刺激时间为0.5 h时,各盐度组吐脏量均差异显著,随盐度的升高吐脏量增加;1.0 h时各盐度组吐脏量差异不显著。因此,选定在3‰盐度下刺激吐脏1.0 h为摇蚊幼虫吐脏条件。

表2 摇蚊幼虫吐脏量 Tab.2 Excretion amount from C.larvae (g/100g)
注:肩标不同小写字母表示同行数据差异显著(P<0.05),不同大写字母表示同列数据差异显著(P<0.05)。
2.2 四种消毒剂消毒摇蚊幼虫后细菌相对灭菌率
不同药物浓度与消毒时间下四种消毒剂对摇蚊幼虫携带菌杀灭效果见图1。由图1可见,四种消毒剂相同浓度组消毒虫体短时间(10 min和20 min)与长时间(60 min和90 min)间相对灭菌率差异显著;同一时间高浓度组相对灭菌率显著高于低浓度组,120 mg/L和150 mg/L聚维酮碘相对灭菌率显著高于30 mg/L和60 mg/L组;40 mg/L和60 mg/L高锰酸钾组相对灭菌率显著高于5 mg/L和10 mg/L组;15 000 mg/L和20 000 mg/L戊二醛组相对灭菌率显著高于1 000 mg/L和5 000 mg/L组;1 600 mg/L和3 200 mg/L新洁尔灭相对灭菌率显著高于200 mg/L和400 mg/L浓度组。由图2还可得到,随着药物浓度增加和消毒时间延长,四种消毒剂对虫体相对灭菌率显著上升,聚维酮碘、高锰酸钾、戊二醛、新洁尔灭最高相对灭菌率分别达到85.64%、91.59%、90.88%、88.47%。
2.3 消毒剂消毒摇蚊幼虫消毒条件的优化
通过正交实验并方差分析得到,聚维酮碘、新洁尔灭、高锰酸钾浓度对相对灭菌率有极显著影响,戊二醛浓度对相对灭菌率影响不显著;聚维酮碘消毒时间对相对灭菌率影响极显著,其余三种消毒剂消毒时间对相对灭菌率无显著影响;温度对聚维酮碘杀灭率影响极显著,对新洁尔灭影响显著,而对高锰酸钾、戊二醛相对灭菌率影响不显著。
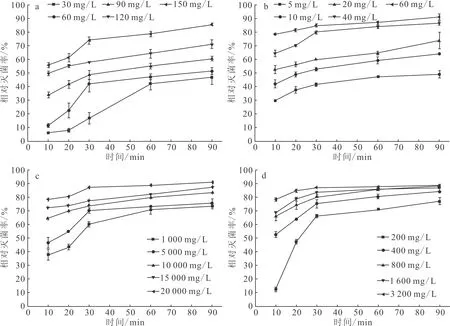
注:a.聚维酮碘 b.高锰酸钾 c.戊二醛 d.新洁尔灭
由表3可知,影响高锰酸钾对相对灭菌率的因素主次顺序为:消毒剂浓度>消毒温度>消毒时间,最优条件为:消毒剂浓度为60 mg/L,消毒温度为28 ℃,消毒时间为1.5 h;影响聚维酮碘的因素主次顺序为:消毒温度>消毒剂浓度>消毒时间,最优条件为:消毒温度为24 ℃,消毒剂浓度为150 mg/L,消毒时间为1 h;影响新洁尔灭的因素主次顺序为:消毒剂浓度>消毒温度>消毒时间,最优条件为:消毒剂浓度为3 200 mg/L,消毒温度为24 ℃,消毒时间为1.0 h;影响戊二醛的因素主次顺序为:消毒温度>消毒时间>消毒剂浓度,最优条件为:消毒温度为28 ℃,消毒时间为1.5 h,消毒剂浓度为20 000 mg/L。
2.4 验证试验结果
根据正交试验优化结果进行验证实验,每种药物设3平行,验证实验得到高锰酸钾、聚维酮碘、新洁尔灭、戊二醛平均相对灭菌率分别为92.23%、93.12%、95.21%、92.87%,其结果均略高于正交实验结果,表明正交实验的优化结果可信。
2.5 消毒剂消毒对摇蚊幼虫相对存活率的影响
由表4可知,四种消毒剂处理均对摇蚊幼虫相对存活率具有一定影响。高锰酸钾、戊二醛消毒处理后一周内摇蚊幼虫相对存活率与对照组相对存活率均无显著差异;而聚维酮碘、新洁尔灭对摇蚊幼虫消毒处理后的第3、6、7 d,其相对存活率显著低于对照组相对存活率。
由图2可知,四种消毒剂在最佳消毒方案下消毒的摇蚊幼虫对稀有鲫平均摄食时间有一定影响,但各消毒剂处理组均在1 min内完成摄食,故其5 min内摄食率为100%。试验第1~6天,各消毒剂处理组平均摄食时间与对照组差异显著;试验第7天,聚维酮碘、新洁尔灭处理组平均摄食时间与对照组无显著差异,试验组平均摄食时间随投喂天数的增加与对照组平均摄食时间差异逐渐减小。
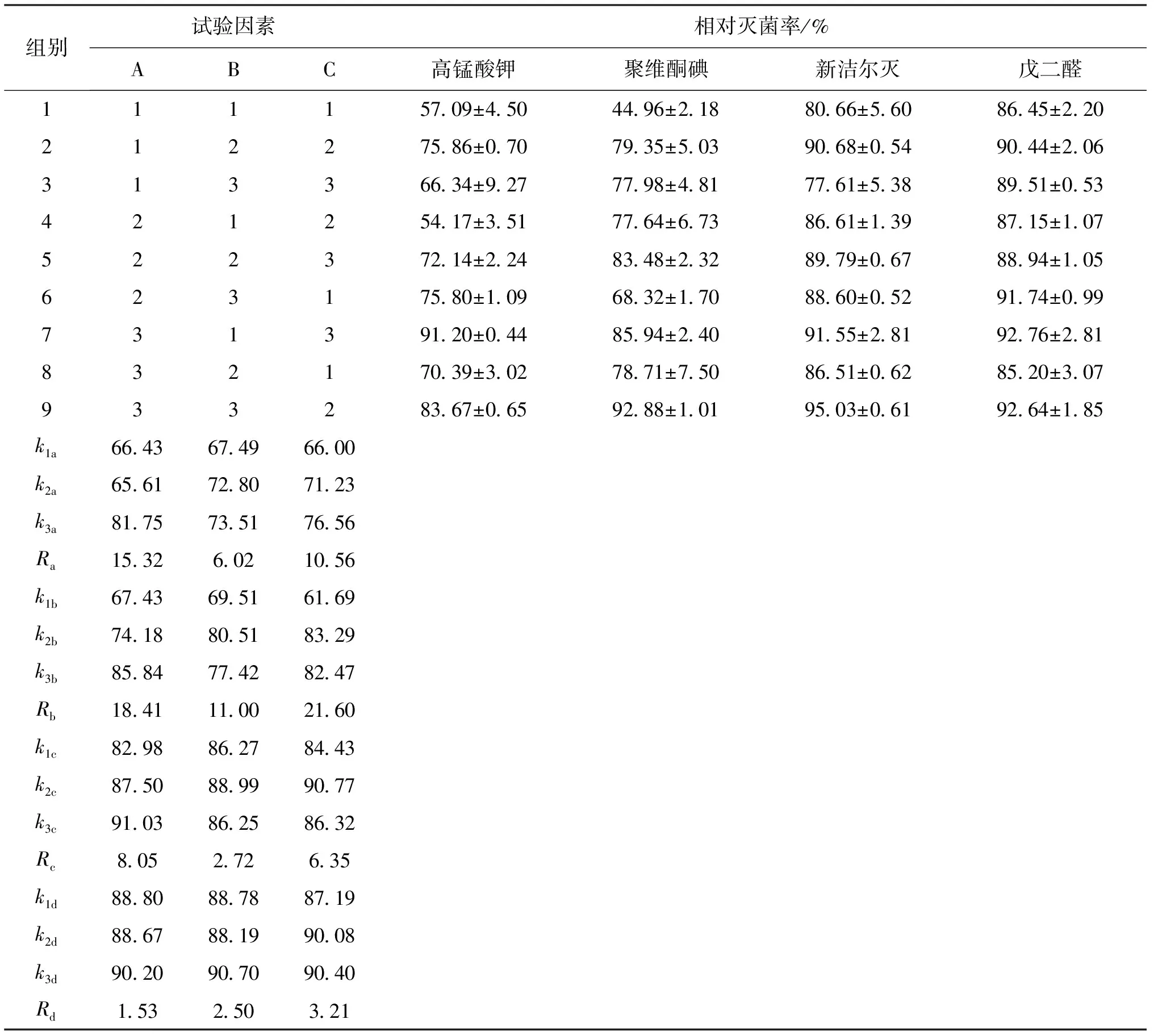
表3 正交试验设计及结果Tab.3 The orthogonal experiment design and result
注:a、b、c、d分别代表高锰酸钾、聚维酮碘、新洁尔灭、戊二醛杀灭率;A、B、C分别为消毒药物浓度、消毒时间、消毒温度。
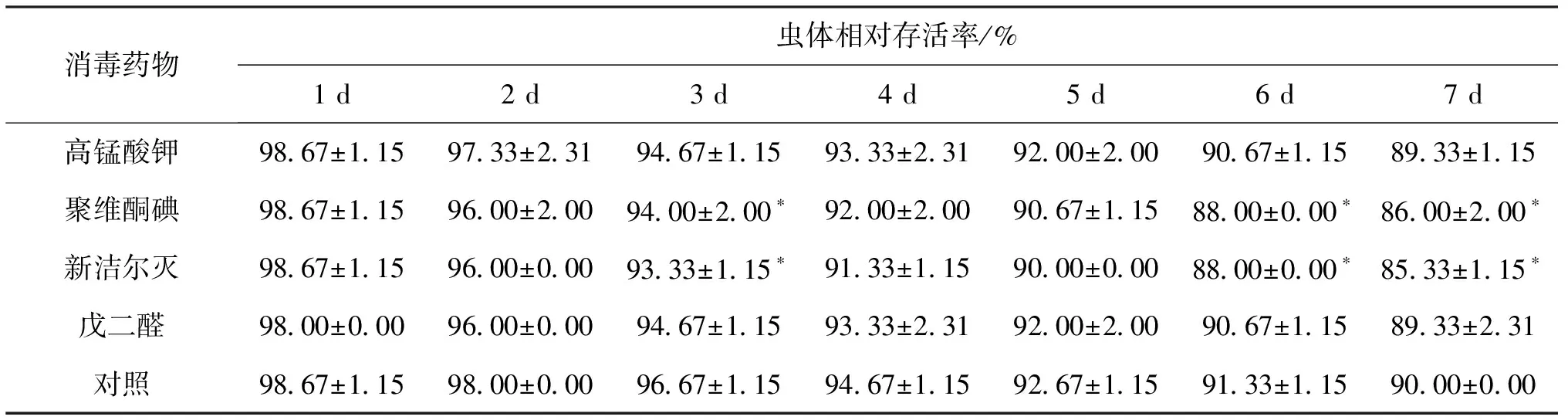
表4 四种消毒剂消毒后摇蚊幼虫相对存活率Tab.4 Relative survival percent of disinfected C.larvae
注:表中数值为平均数±标准差,*表示与对照组差异显著(P<0.05)。
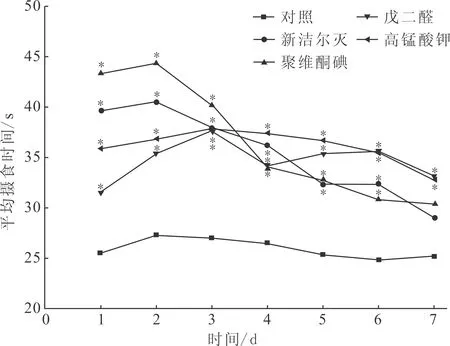
图2 四种消毒剂消毒的摇蚊幼虫对稀有鲫平均摄食时间的影响Fig.2 Effect of C.Larvae disinfected by four kinds of disinfectants on feeding time of Gobiocypris rarus
2.7 摇蚊幼虫消毒后未杀灭细菌鉴定结果
采用四种消毒剂最佳消毒方案对不同水体来源的四份摇蚊幼虫样品进行消毒处理后,通过细菌分离鉴定共得到16种未杀灭细菌,以气单胞菌属及不动杆菌属为主(见表5)。其中气单胞菌属中,嗜水气单胞菌、维氏气单胞菌、水生气单胞菌为水产养殖中常见致病菌。
3 讨论
摇蚊幼虫除极少种类外,普遍具有四龄[11],研究表明摇蚊幼虫随龄期增加对药物耐受能力增强[12,13]。本试验摇蚊幼虫为第4龄期,在实际生产中应根据生产条件、摇蚊幼虫龄期及待投喂鱼类品种,选择适当消毒剂及消毒剂浓度。
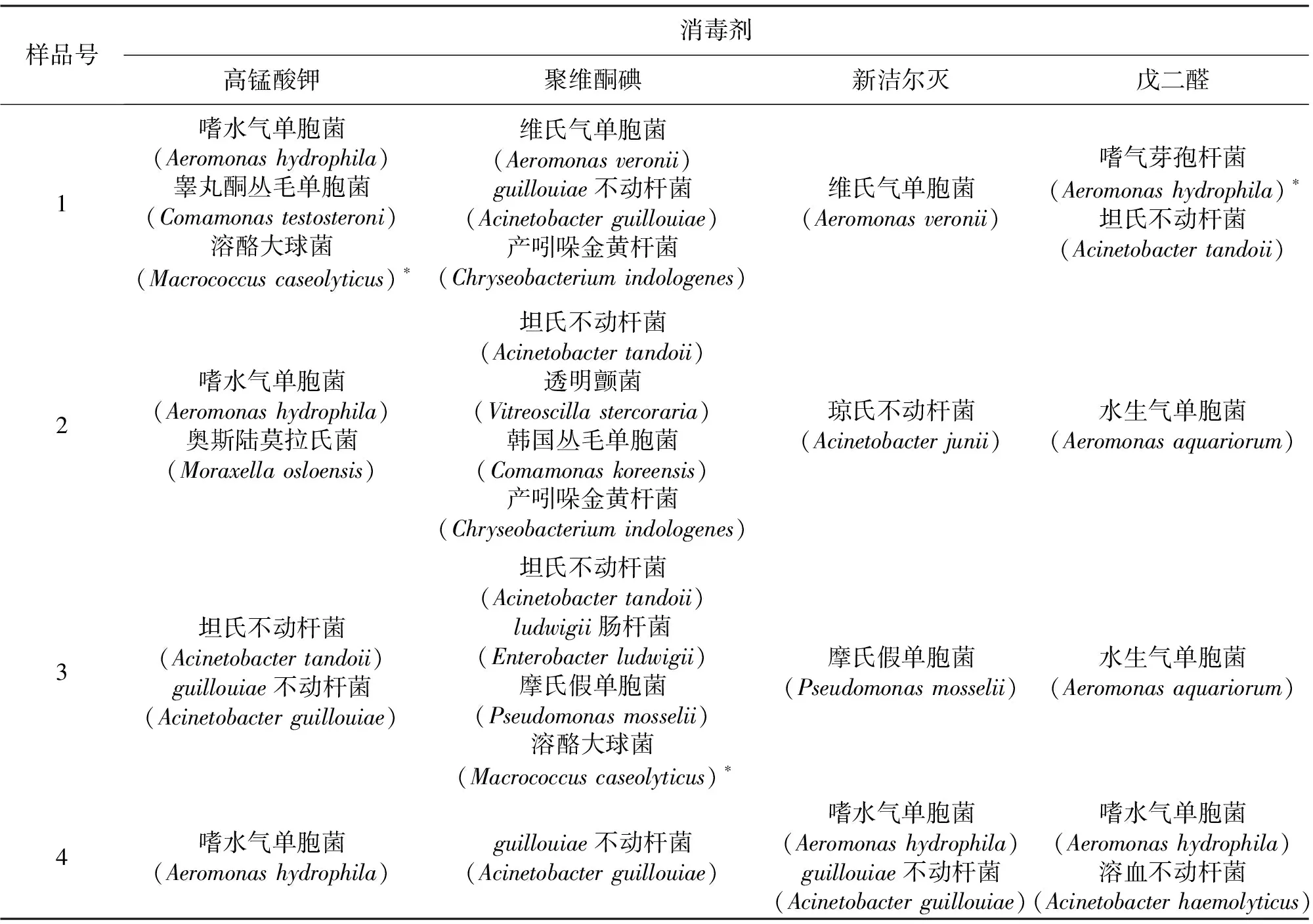
表5 消毒后未杀灭细菌分离鉴定结果Tab.5 Strains of survival bacterial from disinfected Chironomid Larvae by isolation and identification
注:*表示革兰氏阳性菌。
本实验中采用四种消毒剂最佳处理方案对4份摇蚊幼虫样品进行消毒处理后,分离细菌以不动杆菌属及气单胞菌属为主。气单胞菌普遍存在于淡水、淤泥和污水中[14],张涵等[15]报道不动杆菌属为三角帆蚌肠道优势菌,摇蚊幼虫与三角帆蚌生活环境、食性相似,故二者携带细菌组成相似。有研究表明,细菌可通过水产动物的摄食进入其体内[16,17],当气单胞菌等重要条件致病菌在鱼类消化道内达到一定的优势度时会体现其致病性[18]。
实验结果表明,实验室条件下四种消毒剂最佳消毒方法均对摇蚊幼虫携带的细菌具有较好的杀灭效果,但不能完全灭菌。有研究表明氟苯尼考、喹诺酮类药物对气单胞菌具有较好的抑制效果[19];吴雅丽等[20]研究发现,嗜水气单胞菌对喹诺酮类、第二、三代头孢类等敏感;维氏气单胞菌对氟苯尼考、阿洛西林、卡那霉素、链霉素等药物敏感[21]。根据实验结果,可筛选具有针对性的抗生素,采用消毒剂抗生素联合杀菌,以提高消毒效果。
[1]王 波.摇蚊幼虫在水产上的应用[J].科学养鱼,2002,(7):55.
[2]钟诗群.摇蚊幼虫的人工培育[J].科学养鱼,1997,(9):37.
[3]李 灿,殷梦光,徐小茜,等.放养密度和饵料种类对中国大鲵幼苗存活与生长的影响[J].水产学杂志,2013,26(1):23-26.
[4]普 炯,贾 砾,苏胜齐,等.中华沙鳅食性研究[J].西南大学学报:自然科学版,2014,36(1):41-46.
[5]孙兴滨,崔福义,张金松,等.水源水中摇蚊幼虫的孳生与生态控制[J].环境工程学报,2006,7(8):1-5.
[6]王丽珍,李 砥,刘永定,等.滇池摇蚊科幼虫和水丝蚓属的生物学特性分析[J].水生态学杂志,2004,24(2):48-50.
[7]吴 昊,韩庆文,汪 峰,等.摇蚊防治的研究进展[J].中华卫生杀虫药械,2012,18(5):444-446+448.
[8]陈超然,孟长明,陈昌福.用虾蟹康给鱼类鲜活饵料和饲料消毒的方法[J].渔业致富指南,2002,(7):50.
[9]张艳珍,张晓雁,王彦鹏.养殖中华鲟四种天然饵料的细菌分布及灭菌效果[J].淡水渔业,2014,44(3):90-94.
[10]樊海平,曾占壮,余培建,等.水蚯蚓的消毒试验[J].应用海洋学学报,2001,20(z1):80-84.
[11]McCauley VJ.Instar differentiation in larval chironomidae (diptera)[J].Can Ent,1974,106(02):179-200.
[12]孙兴滨,崔福义,张金松,等.几种常见氧化剂对水中摇蚊幼虫氧化杀灭效能的试验研究[J].环境科学学报,2005,25(7):930-935.
[13]Powlesland C,George J.Acute and chronic toxicity of nickel to larvae of Chironomus riparis (meigen)[J].Environ Pollut (Ser A),1986,42(1):47-64.
[14]汪开毓,范方玲,肖 丹,等.鱼源维氏气单胞菌的生物特性和基因分型[J].中国兽医科学,2011,41(4):367-374.
[15]张 涵,周 涛,王 岩.综合养殖池塘中三角帆蚌和鱼类肠道细菌的组成[J].水生生物学报,2013,37(5):824-835.
[16]Gatesoupe F J.The continuous feeding of turbot larvae,scophthalmus maximus,and control of the bacterial environment of rotifers[J].Aquaculture,1990,89(2):139-148.
[17]Ringø E,Birkbeck T.Intestinal microflora of fish larvae and fry[J].Aquac Res,1999,30(2):73-93.
[18]周金敏,吴志新,曾令兵,等.黄颡鱼肠道及养殖水体中菌群的分析[J].华中农业大学学报,2010,29(5):613-617.
[19]郭 闯,朱国强,王永坤,等.14株患病水生动物气单胞菌属细菌的分离鉴定与最佳治疗药物筛选试验[J].水产科学,2003,22(4):14-17.
[20]吴雅丽,邓玉婷,姜 兰,等.广东省水产动物源气单胞菌对抗菌药物的耐药分析[J].上海海洋大学学报,2013,22(2):219-224.
[21]夏 飞,梁利国,谢 骏.异育银鲫病原维氏气单胞菌的分离鉴定及药敏试验[J].淡水渔业,2012,42(5):22-26.
StudyonbactericidaleffectoffourkindsofdisinfectantsonChironomidlarvae
HUANG Bo-wen,LI Ya-nan,SHI Yun-ya,LIU Shan,LEI Yuan-yuan,GUO Yong-jun,LIU Jin-lan
(CollegeofFishery,TianjinAgricultureUniversity,TianjinKeyLaboratoryofAqua-EcologyandAquaculture,Tianjin300384,China)
The orthogonal experiment based on single factor experimental results was conducted to select optimal disinfection conditions of four kinds of disinfectant forChironomidLarvae with the relative percent of bactericide (RPB).Furthermore,the relative survival percent (RSP) of disinfectedChironomidLarvae,average feeding time ofGobiocyprisrarusforChironomidLarvae and identified survival bacterial species were used to evaluate comprehensively the quality of disinfectedChironomidLarvae.The result showed that all of povidone iodine,benzalkonium bromide and potassium permanganate in concentration factor and only povidone iodine in disinfection time factor as well as both povidone iodine and benzalkonium bromide in disinfection temperature factor affected significantly the RPB,glutaraldehyde in all of concentration,disinfection time and temperature factors had no significant effect on RPB.The optimum parameters of the four kinds of disinfectant were:60 mg/L of concentration,28 ℃ of disinfection temperature and 1.5 h of disinfection time for potassium permanganate;24 ℃ of disinfection temperature,150 mg/L of concentration and 1 h of disinfection time for povidone iodine;3 200 mg/L of concentration,24 ℃ of disinfection temperature and 1 h of disinfection time for benzalkonium bromide;28 ℃ of disinfection temperature,1.5 h of disinfection time and 20 000 mg/L of concentration for glutaraldehyde.Four kinds of disinfectant under optimal disinfection conditions had showed no effects on RSP ofChironomidLarvae and average feeding time ofGobiocyprisrarusforChironomidLarvae.16 strains of survival bacteria isolated from disinfectedChironomidLarvae belong mainly to Aeromonas and Acinetobacter according to phylogenetic analysis.
Chironomidlarvae;Gobiocyprisrarus;potassium permanganate;povidone iodine;benzalkonium bromide;glutaraldehyde;relative percent of bactericide(RPB)
2017-06-11;
2017-08-23
天津市科技帮扶工程项目“淡水新品种引进及养殖关键技术集成与应用”(15ZXBFNC00330)
黄博闻(1992- ),男,硕士研究生,专业方向为水生动物疾病与免疫。E-mail:huangbwn@163.com
刘金兰。E-mail:ljlan1115@163.com
S942.2+3
A
1000-6907-(2017)06-0074-07

