牛膝多糖对仔猪肠上皮细胞免疫应激的调控及其作用机制
王 雄 李孟伟 马 杰 陈清华*
(1.湖南农业大学动物科学技术学院,长沙 410128;2.中国农业科学院广西水牛研究所,南宁 530001)
牛膝多糖对仔猪肠上皮细胞免疫应激的调控及其作用机制
王 雄1李孟伟2马 杰1陈清华1*
(1.湖南农业大学动物科学技术学院,长沙 410128;2.中国农业科学院广西水牛研究所,南宁 530001)
本试验旨在考察牛膝多糖(ABPS)对脂多糖(LPS)免疫应激下仔猪空肠上皮细胞(IPEC-J2)促炎细胞因子分泌和表达的影响,并探讨ABPS调控IPEC-J2免疫应激可能的作用机制。选用4~5代的IPEC-J2,培养基中分别添加0(对照)、300、600、900、1 200 μg/mL ABPS和10 μg/mL LPS,每组12个重复,每孔为1个重复。培养72 h后,采用酶联免疫吸附测定(ELISA)方法检测ABPS对促炎细胞因子白细胞介素1(IL-1)、白细胞介素6(IL-6)、白细胞介素8(IL-8)和肿瘤坏死因子α(TNF-α)分泌量的影响,采用实时定量PCR测定Toll样受体4(TLR4)、核转录因子κB(NF-κB)的mRNA表达量,采用Western blot法测定TLR4、NF-κB、磷酸化核转录因子κB(p-NF-κB)蛋白表达量。结果显示:与对照组相比,300、600、900和1 200 μg/mL ABPS组能显著减少IL-1、IL-6、IL-8和TNF-α的分泌量(P<0.05);300 μg/mL ABPS组能显著减少p-NF-κB蛋白的表达量(P<0.05),900和1 200 μg/mL ABPS组能显著减少TLR4、NF-κB的mRNA和NF-κB蛋白的表达量(P<0.05)。由此可见,ABPS通过TLR4/NF-κB信号转导途径来调控促炎细胞因子的分泌,从而缓解免疫应激,低浓度ABPS通过直接抑制NF-κB磷酸化过程来降低免疫应激,高浓度ABPS则是通过抑制TLR4 mRNA、NF-κBmRNA和NF-κB蛋白的表达量来缓解免疫应激。
牛膝多糖;对脂多糖;促炎细胞因子;Toll样受体4;核转录因子κB
肠道是机体消化和营养吸收的主要器官,也是机体免疫系统的重要组成部分。肠道的功能直接影响到动物的健康[1]。肠上皮细胞在肠腔内起到重要的生理作用,其不仅负责吸收肠腔内的营养元素,同时感知外源异物的刺激,参与肠道免疫应答[2]。研究显示,脂多糖(LPS)这种革兰氏阴性菌的代谢产物是导致猪肠道功能紊乱的主要因素之一,其作用机制是通过激活肠上皮细胞中的Toll样受体4(TLR4)/核转录因子κB(NF-κB)信号,触发细胞内的炎性反应,促使促炎细胞因子的大量释放[3-4]。最近的研究表明,植物提取物是一种潜在的营养性添加剂,能起到改善肠道功能的作用。牛膝多糖(Achyranthesbidentatapolysaccharides,ABPS)是从苋科植物牛膝的根中提取、分离和纯化的水溶性小分子中性多糖,具有增强动物机体免疫、抵抗炎症等功能[5-6]。动物试验的结果表明,ABPS的添加能够改善仔猪的肠道功能,减少血液循环中促炎细胞因子的浓度[7-8]。袁媛等[9]试验表明,黄芪多糖能通过TLR4/NF-κB信号转导途径抑制NF-κB活化,降低促炎细胞因子的释放,保护肠道健康。但是ABPS改善肠道功能的分子机制还尚不明确。ABPS也属于多糖类,作者提出假设,ABPS通过TLR4/NF-κB信号转导途径来影响促炎细胞因子的释放,从而改善肠道健康。
本试验将以仔猪空肠上皮细胞(IPEC-J2)为模型,探讨ABPS对LPS应激的IPEC-J2的炎症细胞因子的影响,探讨IPEC-J2是否通过TLR4/NF-κB信号转导途径来缓解免疫应激,研究结果可帮助人们了解ABPS保护肠道受损的分子机制,也为ABPS在动物生产上的推广应用提供理论依据。
1 材料与方法
1.1细胞株
IPEC-J2由中国科学院亚热带农业生态研究所惠赠。
1.2主要药品与试剂
ABPS购自西安天瑞科技生物有限公司,纯度98%;LPS购自Sigma-Aldrich公司;DMEM/F12培养基、0.25%猪胰蛋白酶、双抗试剂购自Hyclone公司;胎牛血清(FBS)、细胞冻存液购自Gibco公司;中性磷酸盐缓冲液(PBS)购自Biotopped公司。
1.3细胞培养
选用4~5代的IPEC-J2,培养在含有DMEM/F12培养基(含10% FBS、1%双抗)的培养皿中,置于二氧化碳培养箱(37 ℃、5% CO2、95%湿度)内培养。取处在对数生长期的IPEC-J2细胞,在DMEM/F12培养基中分别混入0(对照)、300、600、900、1 200 μg/mL的ABPS和10 μg/mL 的LPS,每组12个重复(1个12孔板),每孔为1个重复,每孔接种相同密度的细胞。培养72 h后,首先采用预热至37 ℃后的PBS洗涤3次,然后采用预热至37 ℃后的0.25%胰蛋白酶消化细胞3 min,加入DMEM/F12培养基终止反应。
1.4IPEC-J2细胞因子分泌量的测定
采用酶联免疫吸附测定(ELISA)方法测定细胞因子白细胞介素1(IL-1)、白细胞介素6(IL-6)、白细胞介素8(IL-8)和肿瘤坏死因子α(TNF-α)的分泌量,按照试剂盒说明书的方法和步骤进行测定。裂解细胞后,将配制好的各种试剂移至18~25 ℃室温平衡至少30 min,备用;将标准品、待测样本加至包被的酶标板,37 ℃温育2 h;弃去液体,甩干,加入生物素标记工作液,37 ℃温育1 h;弃去液体,PBS洗板3次,甩干,加入辣根过氧化物酶(HRP)标记亲和素,37 ℃温育1 h;弃去液体,PBS洗板5次,甩干,加入底物溶液,37 ℃避光显色15~30 min,加入终止液,终止反应;终止反应5 min,用酶标仪在450 nm波长测定吸光度(OD)值。
1.5实时定量PCR(RT-qPCR)检测IPEC-J2中TLR4和NF-κB的mRNA表达量
细胞经胰酶消化后,离心,提取总RNA,总RNA提取试剂Trizol购自美国Invitrogen公司,最后得到的总RNA溶解于超纯水中。所提取的总RNA用1%琼脂糖凝胶电泳鉴定其完整性(图1),无DNA污染条带。总RNA分别用分光光度计在260与280 nm下检测,OD260 nm/OD280 nm在1.8~2.0方可采用。
图1 总RNA提取电泳图
采用相同浓度的总RNA样品按逆转录试剂盒(北京康为世纪)说明书要求配制逆转录反应液,总体系30 μL。用于实时定量PCR 的反转录产物(cDNA)于-20 ℃保存。目的基因序列在NCBI上搜索,基因引物设计采用Primer 5软件,引物序列参数见表1。采用SYBRGreenⅠ法,反应在荧光定量RCP仪PIKO REAL 96(Thermo)上进行。每个样本每个指标3个孔,每孔10 μL,共30 μL体系:反转录产物1 μL,上、下游引物(10 μmol/L)各0.5 μL,2×SYBRGreen PCR Master Mix 15 μL,加灭菌去离子水至30 μL。扩增反应条件为:50 ℃、3 min;95 ℃、10 min,95 ℃、5 s,60 ℃、30 s,40个循环。扩增反应结束后自60~95 ℃绘制熔解曲线。测定结果用2-ΔΔCt法计算mRNA的表达量,用内参基因β肌动蛋白(β-actin)对各基因表达水平进行均一化,计算公式如下:
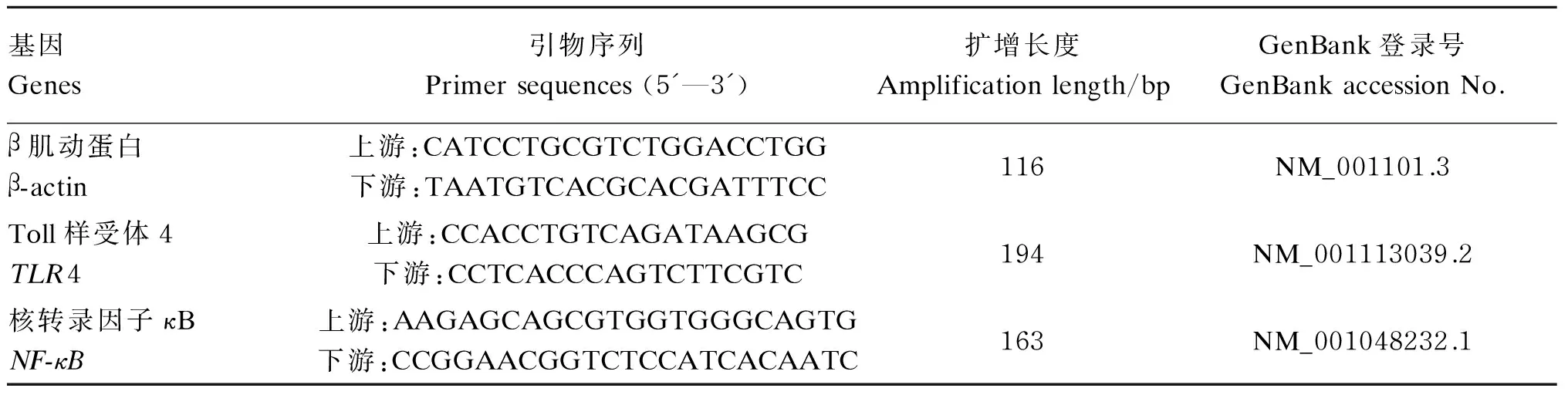
△Ct=目的基因Ct-内参基因Ct;-ΔΔCt=对照组ΔCt-试验组ΔCt;mRNA表达量=2-ΔΔCt。
1.6Westernblot法测定IPEC-J2中TLR4、NF-κB和磷酸化核转录因子κB(p-NF-κB)蛋白表达量
洗涤细胞后离心2 min,弃去上清液。加入裂解液,混匀;冰上裂解蛋白30 min;4 ℃,12 000 r/min离心15 min,待测。按照50∶1配制二辛可酸(BCA)溶液,混匀。溶解的蛋白质标准品浓度为2 mg/mL;分别按0、1、2、3、4、5和6 μL加到96孔板中,用蒸馏水补到20 μL。加待测样品到96孔板中,补到20 μL;各孔分别加200 μL BCA溶液,37 ℃静置30 min。根据标准品的测定结果绘制标准曲线,再根据标准曲线计算样品浓度。取50~100 μg蛋白与5×上样缓冲液混匀后,沸水煮5 min变性,放入冰盒速冻。已变性蛋白质进行十二烷基硫酸钠(SDS)-变性梯度凝胶电泳(PAGE)分离,分离胶12%,浓缩胶5%。浓缩胶电泳电压为80 V,分离胶电泳电压为120 V。待溴酚蓝电泳至胶底部时终止电泳。半干法将蛋白质转移至硝酸纤维素膜,封闭,洗膜。用1×TBST将一抗按照一定比例稀释,将膜与一抗一起孵育,4 ℃过夜。孵育结束,1×TBST洗3次,每次15 min。用1×TBST稀释HRP标记的二抗(Proteintech公司),稀释比例1∶3 000,将稀释后的二抗与膜共同孵育45~60 min。孵育结束,1×TBST洗3次,每次15 min。使用ECL化学发光液(Thermo公司)与膜孵育3 min,用吸水纸吸尽液体,在暗盒内于X胶片曝光数秒至数分钟;显影冲洗。
蛋白表达量=目的蛋白灰度值/内参蛋白灰度值。
1.7数据分析
数据采用SPSS 17.0统计软件进行统计分析,平均值的多重比较用Duncan氏法进行,结果用平均值±标准差表示。P<0.05为差异显著。
2 结 果
2.1ABPS对LPS免疫应激下IPEC-J2细胞因子分泌量的影响
表2显示,与对照组相比,300、600、900和1 200 μg/mL ABPS组细胞因子IL-1、IL-6、IL-8和TNF-α的分泌量显著降低(P<0.05),300、600、900和1 200 μg/mL ABPS组间细胞因子分泌量差异显著(P<0.05),且IL-1、IL-6、IL-8和TNF-α的分泌量与ABPS添加浓度呈一定的量效关系,随着ABPS添加浓度的增加而减少。

表2 ABPS对LPS免疫应激下IPEC-J2细胞因子分泌量的影响
同行数据肩标不同字母表示差异显著(P<0.05)。
Values in the same row with different letter superscripts differ significantly (P<0.05).
2.2ABPS对LPS免疫应激下IPEC-J2中TLR4和NF-κB的mRNA表达量的影响
图2显示,与对照组相比,900和1 200 μg/mL ABPS组TLR4和NF-κB的mRNA表达量显著降低(P<0.05),300 μg/mL ABPS组TLR4和NF-κB的mRNA表达量显著升高(P<0.05),600 μg/mL ABPS组TLR4和NF-κB的mRNA表达量与对照组差异不显著(P>0.05),但低于对照组。TLR4和NF-κB的mRNA表达量与ABPS添加浓度呈一定的量效关系,随着ABPS添加浓度的增加而减少。

数据柱形标注不同字母表示差异显著(P<0.05)。下图同。
Data columns with different small letters mean significant difference (P<0.05). The same as below.
图2ABPS对LPS免疫应激下IPEC-J2中TLR4(a)和NF-κB的mRNA表达量(b)的影响
Fig.2 Effects of ABPS on mRNA expression levels ofTLR4 (a) andNF-κB(b) in IPEC-J2 under LPS immunological stress
2.3ABPS对LPS免疫应激下IPEC-J2中TLR4、NF-κB和p-NF-κB蛋白表达量的影响
图3显示,与对照组相比,300 μg/mL ABPS组TLR4蛋白表达量显著高于对照组(P<0.05),600、900和1 200 μg/mL ABPS组TLR4蛋白表达量与对照组差异不显著(P>0.05);1 200 μg/mL ABPS组NF-κB蛋白表达量显著低于对照组(P<0.05),300、600和900 μg/mL ABPS组NF-κB蛋白表达量显著高于对照组(P<0.05);300 μg/mL ABPS组p-NF-κB蛋白表达量显著低于对照组(P<0.05),600、900和1 200 μg/mL ABPS组p-NF-κB蛋白表达量与对照组差异不显著(P<0.05)。
3 讨 论
肠上皮细胞是抵御病原菌通过肠道进入机体的第1道防线。IPEC-J2细胞来源于1日龄小猪的空肠组织,常作为肠道上皮细胞的模型来研究微生物对肠道的感染[10-11]。大量研究结果表明,肠上皮细胞在病原微生物入侵肠道或受到LPS刺激时,能分泌促炎细胞因子IL-1、IL-6、IL-8和TNF-α等[12-14]。本试验结果也证实了LPS可以导致IPEC-J2细胞分泌促炎细胞因子。促炎细胞因子的大量释放可诱导肠上皮细胞凋亡,增强细胞免疫和体液免疫介导的组织损伤过程,趋化中性粒细胞等炎性细胞进入肠道病变部位,引起一系列肠道炎症反应和组织破坏,进而导致仔猪腹泻和水肿等症状的出现[4],因此减少促炎细胞因子的过量分泌有利于仔猪肠道健康。ABPS能通过调控机体促炎细胞因子的释放来发挥其免疫调节、抗炎作用。陈清华等[15]和Chen等[16]研究表明,ABPS可提高仔猪血清中促炎细胞因子TNF-α、白细胞介素1β(IL-1β)、IL-6的分泌量;ABPS也能提高仔猪肝脏、空肠黏膜和肠系膜淋巴结的IL-1β基因表达水平。王红权等[17]研究发现,在草鱼饲粮中添加ABPS也能提高血清中TNF-α的分泌量。但当机体接受LPS免疫应激导致促炎细胞因子大量释放时,ABPS能抑制促炎细胞因子的分泌。朱惠玲等[18]研究发现,ABPS能够显著缓解LPS所致的仔猪血浆中的TNF-α升高。张文俊[7]研究结果也表明,ABPS能抑制LPS导致的仔猪血浆中促炎细胞细胞因子分泌量的升高。徐小娟[19]发现ABPS能降低TNF-α的活性,从而降低小鼠炎症反应。诸多动物试验的结果表明,ABPS的添加能够改善仔猪的肠道功能,然而ABPS是否能通过调控肠上皮细胞促炎细胞因子的释放来发挥其免疫调节、抗炎作用尚不明确。本试验结果发现适宜浓度的ABPS可抑制LPS所致IPEC-J2分泌IL-1、IL-6、IL-8和TNF-α,这为ABPS能缓解肠道免疫应激提供了理论依据,为进一步研究ABPS对IPEC-J2的免疫调控机制奠定基础。
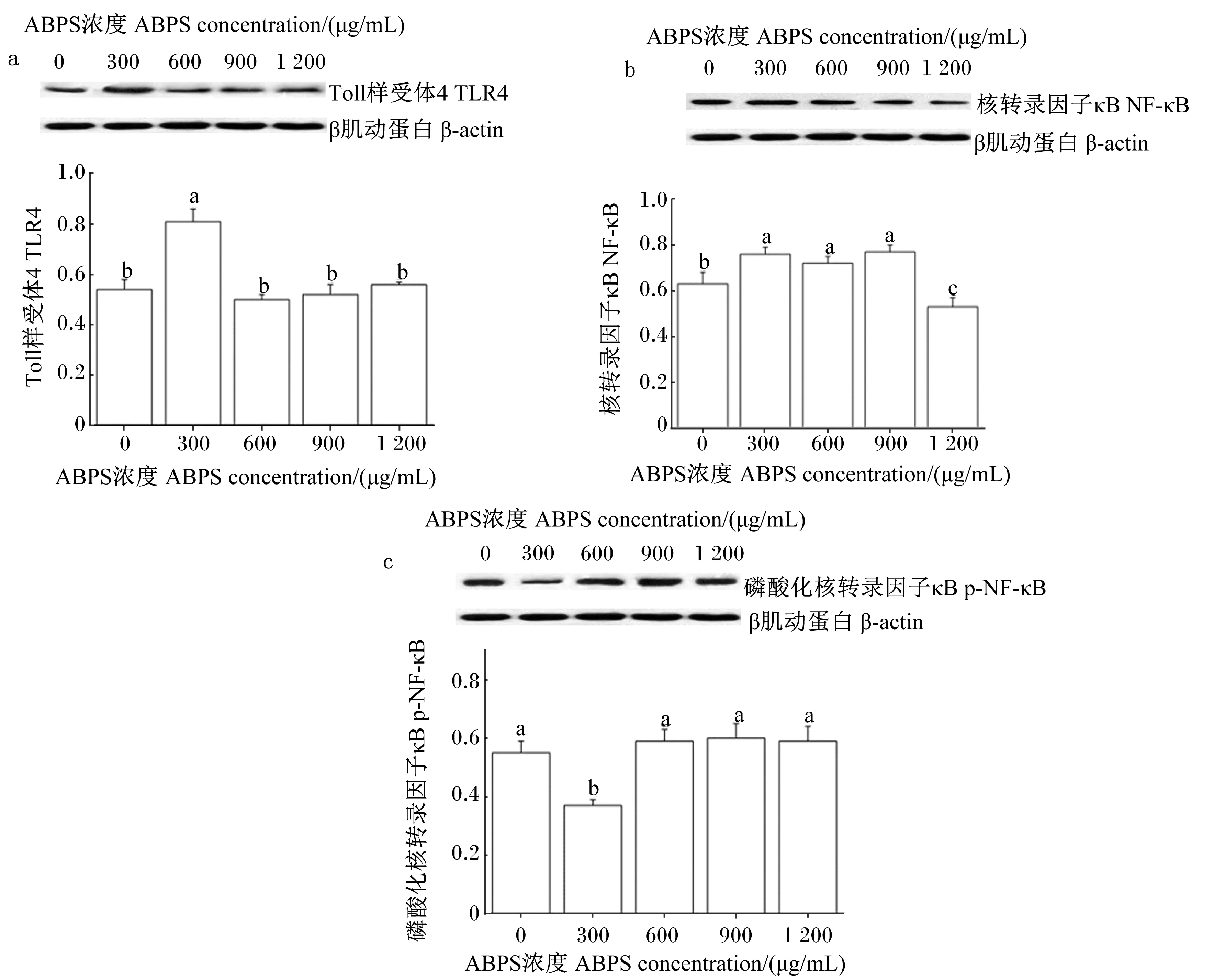
图3 ABPS对LPS免疫应激下IPEC-J2中TLR4 (a)、NF-κB (b)和p-NF-κB (c)蛋白表达量的影响
TLR4是天然免疫系统中的跨膜受体,也是LPS的主要识别受体[20]。TLR4接受LPS刺激后,将信号传到细胞内,通过髓样细胞分化基因88(MyD88)依赖和非依赖的信号通路激活NF-κB[21],导致促炎因子的大量释放,启动机体炎症反应。NF-κB是TLR4下游调控免疫反应的一组多效性核转录因子,其主要发挥调控细胞增殖与凋亡、免疫炎症反应的作用[22]。参与炎症反应的重要促炎细胞因子TNF-α、IL-1和IL-6等均已证实可受NF-κB调控[23]。研究发现,某些植物多糖能通过抑制NF-κB活化而发挥其抗炎免疫作用[24-26]。本试验结果显示,高浓度ABPS能显著降低LPS免疫应激下TLR4、NF-κB的mRNA和NF-κB蛋白的表达量,低浓度ABPS能显著降低p-NF-κB蛋白的表达量。这表明ABPS通过TLR4/NF-κB信号转导途径来抑制LPS免疫应激下IPEC-J2促炎细胞因子的释放,从而缓解免疫应激对肠道的损伤;但不同浓度的ABPS发挥作用的进程有区别,低浓度ABPS通过直接抑制NF-κB磷酸化过程来降低免疫应激,高浓度ABPS则是通过抑制TLR4的mRNA、NF-κB的mRNA和NF-κB蛋白表达量来缓解免疫应激。
4 结 论
ABPS通过TLR4/NF-κB信号转导途径来调控促炎细胞因子的分泌,从而缓解免疫应激,低浓度ABPS通过直接抑制NF-κB磷酸化过程来降低免疫应激,高浓度ABPS则是通过抑制TLR4的mRNA、NF-κB的mRNA和NF-κB蛋白的表达量来缓解免疫应激。
[1] ALIZADEH A,AKBARI P,DIFILIPPO E,et al.The piglet as a model for studying dietary components in infant diets:effects of galacto-oligosaccharides on intestinal functions[J].British Journal of Nutrition,2015,115(4):605-618.
[2] PETERSON L W,ARTIS D.Intestinal epithelial cells:regulators of barrier function and immune homeostasis[J].Nature Reviews Immunology,2014,14(3):141-153.
[3] 黄志清,陈小玲,陈代文,等.长链n-3多不饱和脂肪酸对肠上皮细胞促炎细胞因子基因mRNA表达的影响[J].动物营养学报,2012,24(7):1384-1388.
[4] 孙丽,夏日炜,殷学梅,等.LPS诱导条件下猪小肠上皮细胞TLR4及其信号通路基因表达变化分析[J].畜牧兽医学报,2015,46(7):1095-1101.
[5] 邹云,谢红兵,贺建华.中草药多糖的免疫调节作用及其受体的研究[J].中国饲料,2013(5):22-25.
[6] TAN F,DENG J.Analysis of the constituents and antisenile function ofAchyranthesbidentatapolysaccharides[J].Acta Botanica Sinica,2002,44(7):795-798.
[7] 张文俊.牛膝多糖对脂多糖应激断奶仔猪生长性能、免疫功能和肠道功能的影响[D].硕士学位论文.长沙:湖南农业大学,2011.
[8] 秦文雅.牛膝多糖对免疫应激仔猪肠道的影响及其作用机理[D].硕士学位论文.长沙:湖南农业大学,2012.
[9] 袁媛,孙梅.黄芪多糖对LPS损伤小肠上皮细胞的保护作用[J].世界华人消化杂志,2008,16(1):15-19.
[10] BROSNAHAN A J,BROWN D R.Porcine IPEC-J2 intestinal epithelial cells in microbiological investigations[J].Veterinary Microbiology,2012,156(3/4):229-237.
[11] 张永刚,DAVIN R.猪小肠上皮细胞作用的新发现[J].中国畜牧杂志,2015,51(8):57-60.
[12] LIU F N,LI G H,KE W,et al.Porcine small intestinal epithelial cell line (IPEC-J2) of rotavirus infection as a new model for the study of innate immune responses to rotaviruses and probiotics[J].Viral Immunology,2010,23(2):135-149.
[13] ARCE C,RAMREZ-BOO M,LUCENA C,et al.Innate immune activation of swine intestinal epithelial cell lines (IPEC-J2 and IPI-2I) in response to LPS fromSalmonellatyphimurium[J].Comparative Immunology,Microbiology and Infectious Diseases,2010,33(2):161-174.
[14] YANG F J,WANG A N,ZENG X F,et al.LactobacillusreuteriI5007 modulates tight junction protein expression in IPEC-J2 cells with LPS stimulation and in newborn piglets under normal conditions[J].BMC Microbiology,2015,15:32.
[15] 陈清华,刘祝英,贺建华.牛膝多糖对仔猪淋巴细胞增殖作用和细胞因子分泌量的影响[J].动物营养学报,2008,20(6):712-716.
[16] CHEN Q H,LIU Z Y,HE J H,et al.Achyranthesbidentatapolysaccharide enhances growth performance and health status in weaned piglets[J].Food and Agricultural Immunology,2011,22(1):17-29.
[17] 王红权,唐德约,赵玉蓉,等.牛膝多糖对草鱼免疫和抗氧化功能的影响[J].水生生物学报,2013,37(2):351-357.
[18] 朱惠玲,刘玉兰,郭广伦,等.牛膝多糖对免疫应激仔猪生长性能、炎性介质和内分泌激素的影响[J].中国畜牧杂志,2011,47(5):48-51.
[19] 徐小娟.山慈菇多糖、牛膝多糖对H22小鼠肝癌抑制作用及其抗肿瘤机制研究[D].硕士学位论文.长沙:湖南农业大学,2015.
[20] 蔡炳冈,朱进,汪茂荣.Toll样受体4信号通路研究进展[J].医学研究生学报,2015(11):1228-1232.
[21] PÅLSSON-MCDERMOTT E M,O’NEILL L A.Signal transduction by the lipopolysaccharide receptor,Toll-like receptor-4[J].Immunology,2004,113(2):153-162.
[22] LIU S F,MALIK A B.NF-kappa B activation as a pathological mechanism of septic shock and inflammation[J].American Journal of Physiology-Lung Cellular and Molecular Physiology,2006,290(4):L622-L645.
[23] 张彬,肖献忠,张文辉,等.核仁素对LPS诱导的白细胞介素1β释放的影响[J].中国病理生理杂志,2010,26(9):1796-1800.
[24] 陈金龙,张月巧,袁娅,等.植物多糖通过NF-κB信号通路对巨噬细胞的免疫调节作用研究进展[J].食品科学,2015,36(23):288-294.
[25] 武剑.柴胡多糖对巨噬细胞免疫功能的调节及对TLR4信号通路的影响[D].硕士学位论文.上海:复旦大学,2012.
[26] 刘瑞.黄芪多糖影响雏鸡免疫器官TLR4信号转导通路的研究[D].硕士学位论文.哈尔滨:东北农业大学,2015.
*Corresponding author, professor, E-mail: chqh314@163.com
AchyranthesbidentataPolysaccharides:RegulationonImmunologicalStressinPigletIntestinalEpithelialCellsandItsActionMechanism
WANG Xiong1LI Mengwei2MA Jie1CHEN Qinghua1*
(1.CollegeofAnimalScienceandTechnology,HunanAgriculturalUniversity,Changsha410128,China; 2.BuffaloResearchInstitute,ChineseAcademyofAgriculturalSciences,Nanning530001,China)
The purpose of this research was to investigate the effects ofAchyranthesbidentatapolysaccharides (ABPS) on secretions and expressions of proinflammatory cytokines in piglets jejunum epithelial cells (IPEC-J2) under the immunological stress of lipopolysaccharide (LPS), and to explore the possible mechanism of ABPS to regulate the immune stress of IPEC-J2. The 4th and 5th passages of IPEC-J2 were selected and cultured with 0 (control), 300, 600, 900 and 1 200 μg/mL ABPS, respectively, and both with 10 μg/mL LPS. Each group had 12 replicates with 1proe as 1 replicate. After cultured for 72 h, secretions of proinflammatory cytokines [interleukin (IL-1), interleukin 6 (IL-6), interleukin 8 (IL-8) and tumor necrosis factor α (TNF-α)] were detected by enzyme linked immunosorbent assay (ELISA) method, expression levels of Toll-like receptor 4 (TLR4) and nuclear factor κB (NF-κB) mRNAs were detected by real time quantitive PCR, and expression levels of TLR4, NF-κB and phosphorylated nuclear factor κB (p-NF-κB) proteins were detected by Western blot method. The results showed as follows: compared with control group, secretions of IL-1, IL-6, IL-8 and TNF-α were significantly decreased in 300, 600, 900 and 1 200 μg/mL ABPS groups (P<0.05); 300 μg/mL ABPS group significantly reduced p-NF-κB protein expression level (P<0.05); 900 and 1 200 μg/mL ABPS group significantly reduced the expression levels ofNF-κB andTLR4 mRNAs, and NF-κB protein (P<0.05). In conclusion, ABPS control the release of proinflammatory cytokines and relieve immune stress through TLR4/NF-κB signal transduction pathway, low concentration of ABPS reduce immune stress by inhibiting NF-κB phosphorylation process, high concentration of ABPS alleviate immune stress by inhibitingTLR4 mRNA,NF-κBmRNA and NF-κB protein expressions.[ChineseJournalofAnimalNutrition,2017,29(11):4116-4122]
Achyranthesbidentatapolysaccharides; lipopolysaccharide; proinflammatory cytokines; Toll-like receptor 4; nuclear factor κB
10.3969/j.issn.1006-267x.2017.11.034
S828
A
1006-267X(2017)11-4116-07
2017-05-11
湖南省教育厅重点项目“牛膝多糖通过TLR4信号通路调控仔猪肠道树突状细胞成熟的研究”(14A067)
王 雄(1991—),男,湖南长沙人,硕士研究生,研究方向为饲料资源开发与利用。E-mail: 188735129@qq.com
*通信作者:陈清华,教授,博士生导师,E-mail: chqh314@163.com
(责任编辑 王智航)

