草地早熟禾种间原生质体电融合条件的研究
牛奎举,张 然,赵春旭,马晖玲(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
草地早熟禾种间原生质体电融合条件的研究
牛奎举,张 然,赵春旭,马晖玲
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
为改良培育草地早熟禾(Poapratensis)新品种,拟建立草地早熟禾商用品种与具有优良性状的野生早地早熟禾种间原生质体融合体系。采用电融合法,研究了电融合仪的电场条件和原生质体密度对草地早熟禾种间原生质体融合的影响。结果表明:在交流电场强度和频率分别为20 V/cm和2000 kHz时,原生质体可在较短的时间内形成2~4个原生质体串;最适于草地早熟禾种间原生质体融合的直流脉冲强度为200 V/cm、DC幅宽为40 μs、直流脉冲次数为3次,原生质体密度为3×105个/mL,在此条件下,草地早熟禾种间原生质体总融合率和一对一融合率可分别达到25.39%和12.27%。
草地早熟禾;原生质体;电融合;种间体细胞杂交
早熟禾属(Poa)隶属于禾本科早熟禾亚科早熟禾族,是禾本科最大的属,广泛分布于寒带和北温带冷凉湿润地区[1-2]。目前全世界的早熟禾属植物有500多种,我国包括变种在内共有105种[3-4]。该属的草地早熟禾(Poapratensis)不仅是优良的牧草,同时由于具有质地纤细、再生能力和耐修剪性强、绿期长、坪质优美以及较强的抗寒能力等优良特性,被广泛应用于草坪建植,是宝贵的草坪植物种质资源。在草地早熟禾育种的研究中,人们以往采用常规育种方法和手段,如父母本杂交法[5-6]、筛选自然突变体和理化诱导突变体[7-9]等手段来选育草地早熟禾优良新品种。大量的研究表明,早熟禾属植物生殖方式复杂多样,草地早熟禾常以兼性无融合生殖方式进行繁殖,有些品种的无融合生殖率高达98%以上[10-11],而有性杂交率很低,很难获得杂种优势品种,利用传统育种方式改良品种特性存在着一定困难和局限性,自然杂交困难是制约早熟禾植物种质创新的瓶颈。
植物原生质体是脱去了细胞壁的裸露细胞,由于无细胞壁,在化学、物理或自发性作用下,原生质体之间可以进行细胞的融合而获得体细胞杂种[12]。植物原生质体融合技术给植物不同种、属乃至科的遗传物质的交流提供了可行的途径和方法,克服了杂交不亲和而导致的生殖屏障[13],通过此途径可以转移多基因控制的数量性状和细胞质基因控制的性状等[14]。1993年,Kisten等[15]成功建立了草地早熟禾‘Geronimo’的细胞悬浮系原生质体培养体系;国内马晖玲和赵小强等[16-17]以草地早熟禾Midnight Ⅱ和Nuglade的胚性愈伤组织为分离材料,获得的原生质体经液体培养后成功地再生出植株。但到目前为止,未见有关早熟禾种间原生质体融合的报道。与PEG法相比,电融合法可避免PEG高钙高pH强加于原生质体的生理条件,同时融合的条件更加数据化,便于控制和比较,且融合率相对较高[18]。
笔者所在课题组前期的初步研究表明,采集于甘肃安定区的野生草地早熟禾具有较强的抗旱性,可作为优良的育种材料[19-21],且已建立起了安定野生草地早熟禾的分离和培养体系[22]。因此,笔者以草地早熟禾商用品种Midnight Ⅱ和采集于甘肃省安定区的野生草地早熟禾的原生质体为材料,采用电融合法探索了草地早熟禾种间原生质体融合条件,以期确定适宜的电融合参数,为利用植物原生质体融合技术对草地早熟禾种质创新和品种改良奠定基础。
1 材料和方法
1.1试验材料
试验采用草地早熟禾Midnight Ⅱ(W-2)和采集于甘肃省安定区的野生草地早熟禾(AD)的原生质体,原生质体的获得分别参考马晖玲等[17]和牛奎举等[22]的研究;电融合仪选用CRY-3型细胞融合仪,融合电极小室为1.5 mm。
1.2融合参数的确定
原始融合参数的设定和基本操作参照CRY-3型细胞融合仪操作说明书和文献[23]的方法进行。
1.2.1 成串(交流,AC)电场参数 将获得的原生质体用电融合液纯化一次后再次悬浮,调整两亲本原生质体的密度,使其最终密度为1×105个/mL,并按1∶1的比例混合备用。融合液含有0.55 mol/L甘露醇和0.4 mmol/L的CaCl2·2H2O的双蒸水溶液,pH 5.8,过滤灭菌。
试验采用单因素设计,前次试验结果为后次试验的基本条件,每处理重复3次,倒置显微镜下观察原生质体接触情况、统计成串时间、成串率和串珠长度。成串脉冲电压和成串脉冲频率参数分别设置为:(1)电压:10、15、20、25、30、35 V/cm;(2)频率:1 000、1 500、2 000、2 500、3 000 kHz。
1.2.2 融合(直流,DC)脉冲参数 融合脉冲参数涉及融合脉冲电压、脉冲幅宽和脉冲次数3个因素,试验采用单因素设计,前次试验结果为后次试验的基本条件,每处理重复3次,倒置显微镜下观察原生质体融合情况、统计总融合率、一对一融合率。融合脉冲电压、脉冲幅宽和脉冲个数分别设置为:(1)直流脉冲电压:50、100、150、200、250、300 V/cm;(2)直流脉冲幅宽:5、10、20、40、80、100 μs;直流脉冲次数:1、2、3、4次。
1.2.3 原生质体密度对融合频率的影响 在最适的成串参数与融合参数的基础上,对不同的原生质体密度(1×105、2×105、3×105、4×105、和5×105个/mL)对融合率的影响进行统计分析。
1.3数据处理
数据的处理和统计分析采用Microsoft Excel 2013。采用SPSS 19.0进行数据单因素方差分析(ANOVA),使用 Duncan 法在0.05显著性水平进行差异显著性分析。
2 结果与分析
2.1交流电场强度对原生质体成串的影响
当融合亲本原生质体处于交流电场的作用时,彼此之间会相互靠近并逐渐相连排列成串。随着交流电场强度的增大,原生质体成串所需时间逐渐缩短,成串率逐渐增高,串珠长度也随之增大。然而,原生质体融合所期望的是双亲细胞融合,串珠长度过长则会引起多细胞的融合,所以串珠长度以2~3个细胞为最佳。因此,交流电场强度应小于25 V/cm。试验表明,交流电场强度以20 V/cm为最适,此条件下成串时间较短,串珠长度也较短,为2~4个,但成串率较高,为78.1%(表1)。
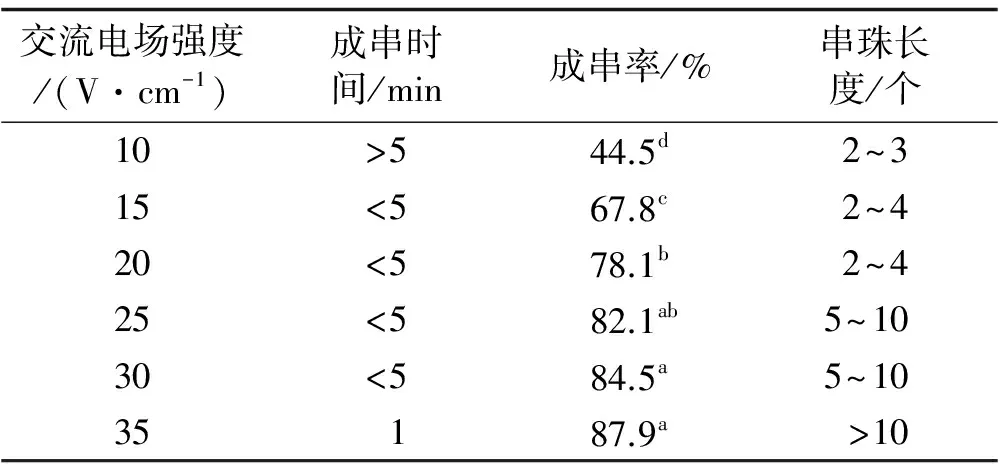
表1 交流电场强度处理下原生质体成串的指标
注:表中同列不同小写字母表示差异显著(P<0.05),下同
2.2交流电场频率处理下原生质体成串的指标
交流电场频率对原生质体的成串时间、成串率和串珠长度有着显著地影响(表2)。当交流频率为1 000 kHz时,显微镜下可观察到原生质体只是自身旋转,并未能成串,交流频率的逐渐增高,原生质体成串时间逐渐缩短,成串率也逐渐增高,但当交流频率达到2 500 kHz时,可观察到部分串珠长度超过5个。因此,适宜于草地早熟禾原生质体成串的交流电场频率为2 000 kHz。

表2 交流电场频率处理下原生质体成串的指标
2.3直流电场强度对原生质体融合的影响
在交流电场强度为20 V/cm,交流频率为2 000 kHz,持续时间为3 min的情况下,研究了不同直流脉冲强度,直流脉冲幅宽和脉冲个数对原生质体融合频率的影响(表3)。当直流脉冲电压强度为50 V/cm时,原生质体的总融合频率和一对一融合率均较低,分别为9.01% 和1.31%,随着直流电压的继续增高,总融合率和一对一融合率逐渐开始增高,当直流电压达到200 V/cm时,总融合率和一对一融合率达到最大值,分别为22.26% 和11.04%。当直流电压超过250 V/cm时,原生质体开始变形和破碎,总融合率和一对一融合率均开始下降,尤其是一对一融合率开始急剧下降。因此,草地早熟禾原生质体融合的最适直流电压为200 V/cm。
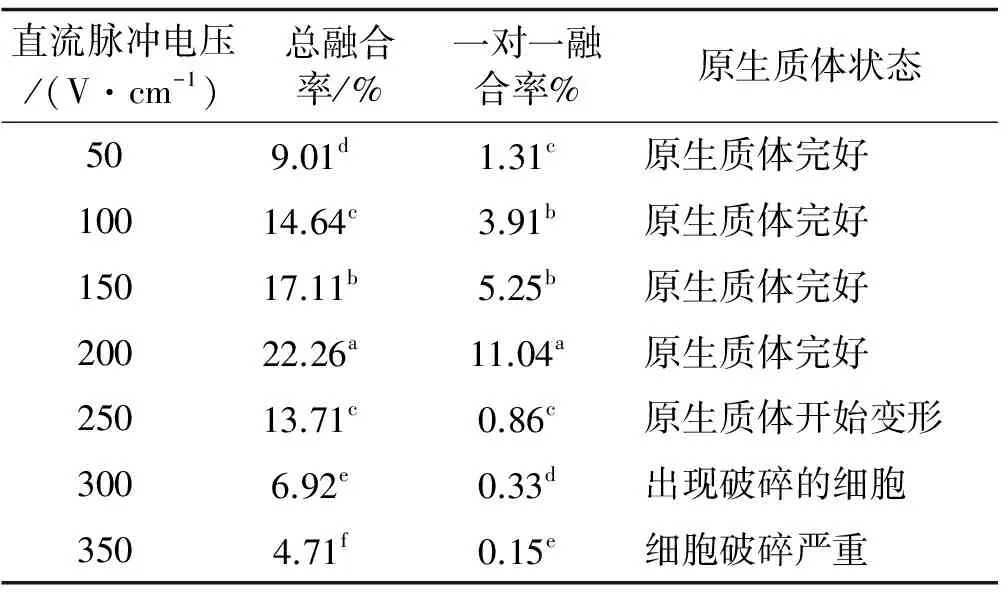
表3 直流电场强度处理下原生质体的融合
2.4直流脉冲幅宽对原生质体融合的影响
在直流脉冲强度为200 V/cm条件下,随着脉冲幅宽的延长,细胞的总融合率和一对一融合率均呈现出先增高后降低的趋势(表4)。在80 μs的脉冲幅宽下,总融合率达到最高,为22.81%,但是显微镜下可明显观察到有破碎的细胞出现,可能导致了其一对一融合率较40 μs显著地降低。当脉冲幅宽为40 μs时,虽然总融合率相对较低,但是其一对一融合率显著高于其他处理,因此,最适于草地早熟禾原生质体融合的脉冲幅宽为40 μs。
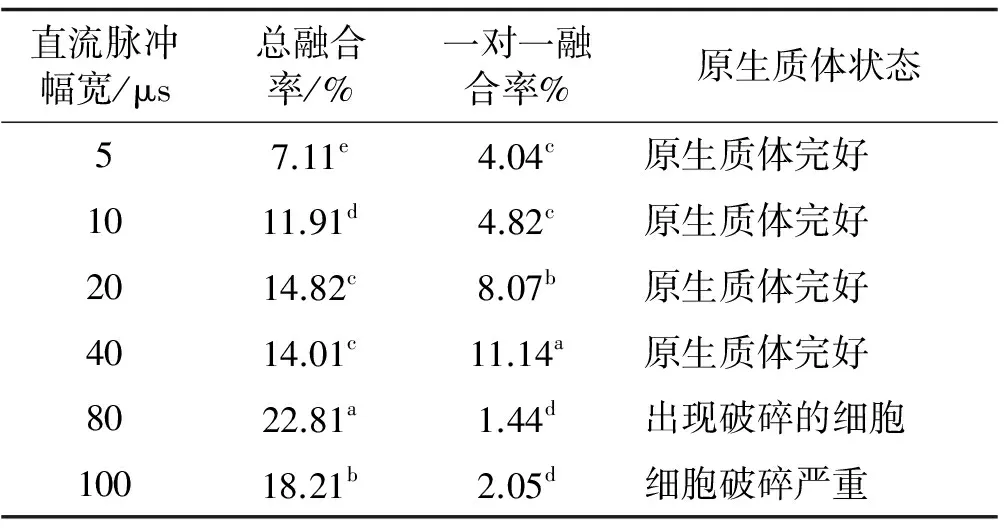
表4 直流脉冲幅宽处理下原生质体的融合
2.5直流脉冲次数对原生质体融合的影响
在直流脉冲强度为200 V/cm,幅宽为40 μs条件下,脉冲次数过少,则融合率较低;而脉冲次数超过4次时,导致细胞膜不能承受过强的脉冲刺激,从而降低融合率,尤其是一对一融合率开始显著降低(表5)。当脉冲次数为3时,其总融合率和一对一融合率显著高于其他处理,因此,最适于草地早熟禾原生质体融合的直流脉冲次数为3次。
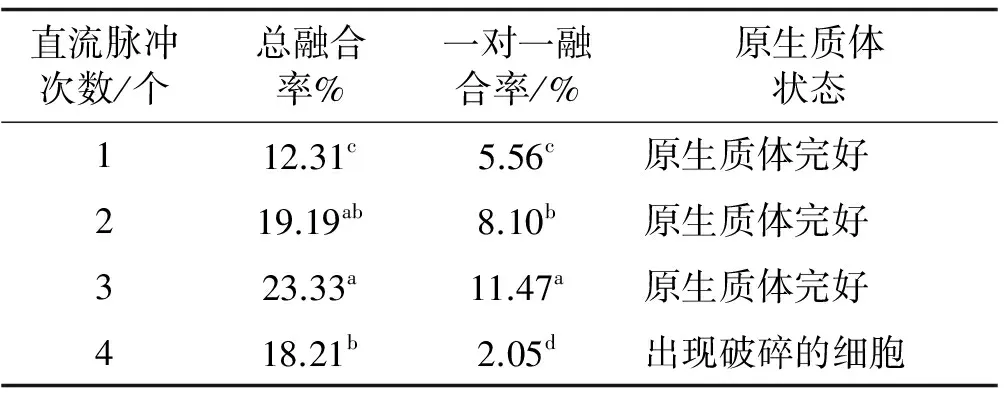
表5 直流脉冲次数处理下原生质体的融合
2.6原生质体密度对融合效率的影响
原生质体密度对融合频率同样具有显著的影响,随着原生质体密度的逐渐增大,融合频率呈现先升高后降低的趋势(表6)。当原生质体的密度为3×105个/mL时,草地早熟禾原生质体融合率和一对一融合率均达到最大值,分别为25.39% 和12.27%。
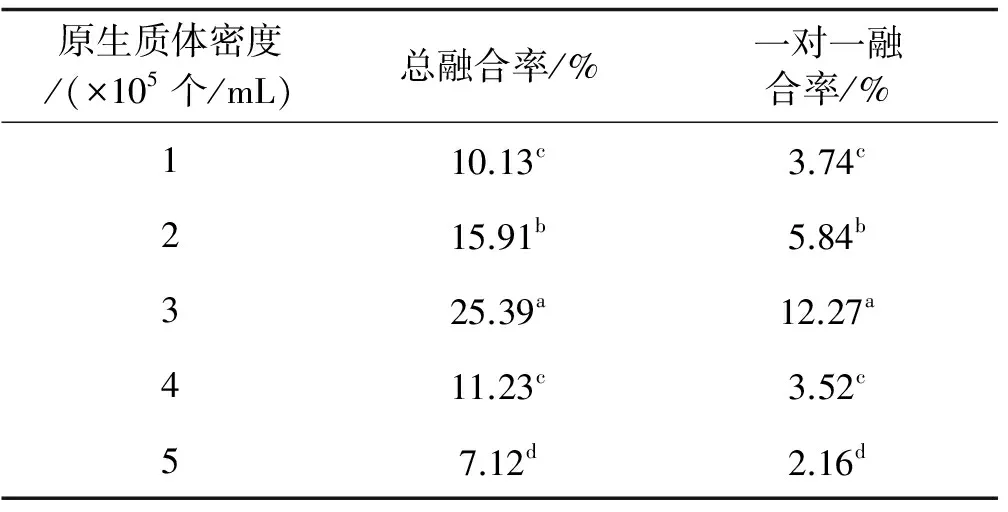
表6 原生质体密度处理下的融合效率
2.7草地早熟禾原生质体电融合过程
将W-2和AD的原生质体密度均调至3×105个/mL,1∶1混合。取0.4 mL加入1.5 mm平行电极,静置3~5 min,待原生质体沉淀后连接电极与融合仪输出接头,施加适当的交流电压(电压强度为20 V/cm,交流频率为2 000 kHz),2~3 min可观察到约80%的原生质体会形成2~4个原生质体串(图1-A),成串后,给予适当的直流脉冲(脉冲强度为200 V/cm,幅宽为40 μs,脉冲次数为3次),部分相互接触的原生质体则会发生融合(图1-B~1-D)。其总融合率和一对一融合率分别可达到25.39% 和12.27%。
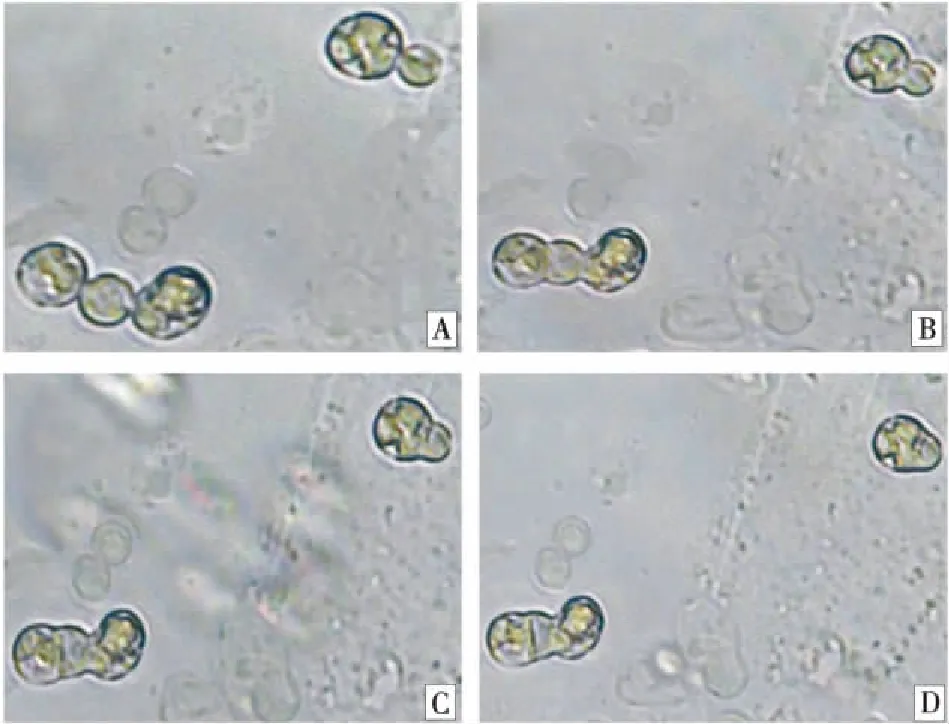
图1 原生质体电融合的过程Fig.1 The process of protoplast electrofusion
3 讨论
3.1电融合法在草地早熟禾体细胞杂交中的应用
1979年,Sencia等[24]建立了电融合法。与PEG融合法相比,电融合法避免了高Ca2+高pH强加于原生质体的生理条件对融合原生质体的伤害,同时,其便于融合过程中精准化的控制和比较,且可提高原生质体的融合率[25]。目前,国内外均已建立了草地早熟禾的原生质体培养体系[15-17],然而,有关草地早熟禾原生质体融合的研究报道却很少。因此,笔者首次对电融合法在草地早熟禾原生质体融合中的应用条件进行了一定的探索。
前人的研究表明,电融合法在高羊茅(Festucaarundinacea)与多花黑麦草(Loliummultiflorum)[26]、多花黑麦草与小麦(Triticumaestivum)[27]等禾本科植物中均取得了较好的结果。研究表明,在AC电压为20 V/cm、AC频率为2 000 kHz、DC脉冲强度为200 V/cm、DC幅宽为40 μs、DC脉冲次数为3次和原生质体密度为3×105个/mL的条件下,草地早熟禾种间原生质体融合率可达到25.39%,而赵小强等[28]采用PEG法在草地早熟禾种内原生质体融合的研究中所得到的融合率仅为9.8%,试验采用电融合法所得到的融合率是其采用PEG法的2.6倍。
3.2草地早熟禾原生质体电融合参数
电融合过程可分解为两步,首先是交流电场使得原生质体2~3个串在一起,最后是给予直流脉冲使得串在一起的原生质体发生融合,因此,影响电融合的参数就是交流电场和直流脉冲相关参数。
交流电场能促进原生质体的偶极化,进而使相邻的原生质体排列成串。交流电压过低时,原生质体无法成串或成串需要耗费比较长的时间,不利于后期直流脉冲诱发原生质体融合,而交流电场强度过高时,会使原生质体短时间内形成很长的串珠,则导致后期原生质体融合时形成多细胞融合体[29]。研究表明,在交流电场强度为20 V/cm和交流电场频率为2 000 kHz,草地早熟禾原生质体可在较短时间内形成2~3个原生质体的串珠,该结果与张凌云等[23]在苜蓿(Medicagosativa)原生质体电融合研究中所得到的结果相似。然而,魏彩霞等[29]研究表明,马铃薯(Solanumtuberosum)原生质体电融合的最佳交流电场强度为110 V/cm,这种差异可能是电融合仪的型号不同导致,不同的植物种之间原生质体电融合的条件也会存在一定的差异[23,30]。
直流脉冲通过脉冲电压,脉冲幅宽和脉冲次数3个参数影响着原生质体融合频率[23,30]。脉冲电压强度的大小预示着细胞膜能否被击穿及是否或导致细胞膜的不可逆性损伤,在原生质体融合时,找到适宜的直流脉冲电场强度、脉冲幅宽和脉冲次数的相应阈值,可避免直流脉冲强度过高引发的原生质体细胞膜的破碎,使得细胞质膜产生可逆性的击穿恢复,从而提高原生质体的融合频率[29]。研究表明,直流脉冲强度为200 V/cm、直流幅宽为40 μs和直流脉冲次数为3次时,草地早熟禾原生质体的融合率最高,且原生质体状态完好,而当直流脉冲强度为250 V/cm、直流幅宽为80 μs和直流脉冲次数为4次时,原生质体出现变形,破碎严重的情况,其融合率也随着降低。
4 结论
草地早熟禾种间原生质体电融合的最佳参数为: AC电压为20 V/cm、AC频率2 000 kHz、DC脉冲强度200 V/cm、DC幅宽40 μs、DC脉冲3次和原生质体密度为3×105个/mL。
[1] 黄丽,王璐,李存福,等.北京地区早熟禾属植物种质资源研究[J].草地学报,2011,19(5):760-765.
[2] 方强恩,孙英,白小明,等.甘肃早熟禾属野生植物资源分布研究[J].中国草地学报,2010,32(6):39-45.
[3] 陈雅君,祖元刚,刘慧民,等.早熟禾种质资源及其遗传改良研究进展[J].园艺学报,2008,35(11):1701-1708.
[4] Soreng R J,Davis J I,Doyle J J.A phylogenetic analysis of chloroplast DNA restriction site variation inPoaceaesubfamPooideae[J].Plant Systematics and Evolution,1990,172(1):83-97.
[5] Bonos S A,Hignight D,Hignight K,etal.Registration of 'Mallard' Kentucky Bluegrass[J].Journal of Plant Registrations,2012,6(1):6-10.
[6] Ad B,Cr F.Registration of Caliber Kentucky bluegrass[J].Crop Science,2002,42(2):667-668.
[7] Brede A D,Willard W E.Registration of ‘NuStar’ Kentucky Bluegrass[J].Crop Science,1993,46(6):1414-1415.
[8] 何亚丽,陈杰,郭金芳,等.草地早熟禾新品系“沪禾”的选育和在上海自然条件与人工逆境胁迫下的草坪特性鉴定[J].上海交通大学学报(农业科学版),2009,27(3):189-195.
[9] Hanson A A,Juska F V.A Progressive Mutation induced in (PoapratensisL.)by Ionizing Radiation[J].Nature,1959,184(4691):1000-1001.
[10] 田晨霞,马晖玲,张咏梅.草地早熟禾胚发育类型及无融合生殖特征[J].中国农业科学,2013,46(13):2633-2642.
[11] 田晨霞,马晖玲,张静,等.甘肃省野生草地早熟禾多胚苗发生研究[J].草原与草坪,2014(6):18-23.
[12] Davey M R,Anthony P,Patel D,etal.Plant protoplasts:isolation,culture and plant regeneration[M].New York:Wiley-Blackwell,2010:153-173.
[13] Johnson A A,Veilleux R E.Somatic hybridization and applications in plant breeding[J].Plant Breeding Reviews,2010,20:167-225.
[14] 赵宏波,陈发棣,房伟民.菊科植物原生质体融合研究进展[J].园艺学报,2006,33(4):908-914.
[15] Nielsen K A,Knudsen E.Regeneration of green plants from embryogenic suspension on cultures of kentucky blue grass(PoapratensisL.)[J].Journal of Plant Physiology,1993,141(5):589-595.
[16] 赵小强,马晖玲,林栋,等.草地早熟禾新格莱德胚性愈伤组织原生质体培养及植株再生的研究[J].草业学报,2010,19(2):55-60.
[17] 马晖玲,赵小强,白小明.草地早熟禾午夜Ⅱ号原生质体培养及植株再生[J].草地学报,2010,18(1):103-107.
[18] 戴雪梅,黄天带,孙爱花,等.植物原生质体融合研究进展及其在育种中的应用[J].热带作物学报,2012,33(8):1516-1521.
[19] 俞玲,马晖玲.干旱胁迫下甘肃野生草地早熟禾内源激素水平的动态变化[J].草原与草坪,2014,34(2):18-22.
[20] 白利国,俞玲,马晖玲.野生草地早熟禾对干旱胁迫的生理响应[J].草原与草坪,2014,34(2):86-91.
[21] 牛奎举,金小煜,李慧萍,等.甘肃野生草地早熟禾萌发期抗旱性鉴定与评价[J].草地学报,2016,24(5):1041-1049.
[22] 牛奎举,俞玲,李玉珠,等.甘肃野生草地早熟禾原生质体分离与培养研究[J].草业科学,2015,32(6):927-934.
[23] 张凌云,师尚礼.苜蓿原生质体电融合适宜条件的筛选[J].草地学报,2013,21(4):769-775.
[24] Sencia M,Takeda J,Abe S,etal.Induction of cell fusion of plant protoplasts by electrical stimulation[J].Plant and cell physiology,1979,20(7):1441-1443.
[25] 牛奎举,马晖玲.禾本科牧草及草坪草原生质体培养与融合技术研究进展[J].草地学报,2016,24(4):738-746.
[26] Spangenberg G,Valles M P,Wang Z Y,etal.Asymmetric somatic hybridization between tall fescue(FestucaarundinaceaSchreb.)and irradiated Italian ryegrass(LoliummultiflorumLam.)protoplasts[J].Theor Appl Genet,1994,88(5):509-519.
[27] Ge T M,Lin X H,Qin F L,etal.Protoplast electrofusion between common wheat(TriticumaestivumL.)and Italian ryegrass(LoliummultiflorumLam.)and regeneration of mature cybrids[J].In Vitro Cellular & Developmental Biology-Plant,2006,42(2):179-187.
[28] 赵小强,马晖玲,周万海,等.草地早熟禾原生质体培养与融合[J].核农学报,2010,24(4):737-743.
[29] 魏彩霞.马铃薯“GSAP-H”悬浮细胞原生质体培养与融合研究[D].兰州:甘肃农业大学,2015.
[30] 胡家金,萧浪涛,洪亚辉,等.水稻与空心莲子草原生质体电融合条件的研究[J].中国农学通报,2001,17(3):24-27.
StudyontheconditionsforelectrofusionofinterspecificprotoplastsinPoapratensis
NIU Kui-ju,ZHANG Ran,ZHAO Chun-xu,MA Hui-ling
(CollegeoPrataculturalScience,GansuAgriculturalUniversity,KeylaboratoryofGrasslandEcosystem,MinistryofEducation,Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China)
The conditions for electrofusion of interspecific protoplasts in genus ofPoapratensiswere studied.The results showed that the optimum AC (alternating current) electric field intensity and frequency were 20 V/cm and 2 000 kHz,and the bunch could be obtained in a relatively short time.The optimum DC (direct current) electric field intensity was 200 V/cm with 40 μs pulse width and 3 pulse frequency.The optimal protoplast density was 3×105number/mL.Under these conditions,the highest total fusion frequency and binary fusion frequency reached 25.39% and 12.27%,respectively.
Poapratensis;protoplast;electrofusion;interspecific somatic hybridization
S 543;Q 813.2
A
1009-5500(2017)05-0030-06
2017-02-28;
2017-03-22
国家自然科学基金“草地早熟禾种间体细胞杂交的研究”项目(31160482)资助
牛奎举(1991-),男,甘肃通渭人,在读博士。
E-mail:niukuiju@163.com
马晖玲为通讯作者。

