肺鳞癌组织miR- 146a表达变化及其对细胞迁移和侵袭的影响
王金兰,谭音玲,郭丽艳
(潍坊医学院附属益都中心医院,山东潍坊262500)
肺鳞癌组织miR- 146a表达变化及其对细胞迁移和侵袭的影响
王金兰,谭音玲,郭丽艳
(潍坊医学院附属益都中心医院,山东潍坊262500)
目的探讨miR- 146a在肺鳞癌发生、发展中的作用。方法采用qRT- PCR法检测70例份肺鳞癌组织及其配对的癌旁正常组织、20例份正常肺组织miR- 146a表达,并分析miR- 146a表达与肺鳞癌患者临床病理参数的关系。筛选人肺鳞癌细胞SK- MES- 1、NCI- H520、NCI- H2170、NCI- H226及正常肺组织上皮细胞(BEAS- 2B)中miR- 146a表达最低的NCI- H520细胞进行后续实验。采用脂质体介导法转染miR- 146a mimics或阴性对照mimics- NC,Transwell小室法检测转染miR- 146a mimics和阴性对照mimics- NC的NCI- H520细胞迁移和侵袭能力。结果肺鳞癌组织miR- 146a表达明显低于癌旁正常组织和正常肺组织(P均<0.01)。肺鳞癌组织miR- 146a表达与肿瘤组织分化程度、临床分期、淋巴结转移有关(P均<0.01)。转染miR- 146a mimics的NCI- H520细胞迁移和侵袭细胞数目较转染mimics- NC的NCI- H520细胞明显降低(P<0.05或<0.01)。结论肺鳞癌组织miR- 146a表达降低,其表达变化与肿瘤的恶性生物学行为有关;miR- 146a能够明显抑制肺鳞癌细胞的迁移和侵袭。
肺鳞状细胞癌;微小RNA- 146a;细胞侵袭;细胞迁移
在肺癌的常见病理类型中,肺鳞癌的发病率仅次于肺腺癌,近年来其发病率有明显上升趋势[1~3]。目前针对驱动基因的分子靶向治疗,如EGFR酪氨酸激酶抑制剂[4]、EML4- ALK融合基因抑制剂[5]等,主要用于治疗肺腺癌,关于肺鳞癌靶向治疗的研究较少且进展缓慢[6]。因此,寻找肺鳞癌敏感、特异的分子靶点及分子生物学标志物迫在眉睫。微小RNA(miRNA)是一类长度为17~25个核苷酸的非编码小分子RNA,可通过与靶基因mRNA的3′非编码区结合,降解mRNA,在转录后水平调节靶基因表达,进而参与机体炎症反应、免疫应答及细胞生长等病理生理过程[7,8]。据报道,miRNA虽然仅占所有基因的1%~5%,却参与人类约1/3蛋白编码基因的表达调控[9]。miRNA在恶性肿瘤的发生、发展过程中具有癌基因或抑癌基因作用。miR- 146a是首个被发现具有免疫调节作用的miRNA,在机体炎症反应及自身免疫性疾病的发生中具有重要作用[10,11]。近年研究发现,miR- 146a与恶性肿瘤的发生、发展亦具有一定关系。Kumaraswamy等[12]研究发现,乳腺癌组织miR- 146a低表达与肿瘤进展及患者预后不良有关;Hou等[13]研究发现,miR- 146a能抑制胃癌细胞的侵袭及迁移。但miR- 146a在肺鳞癌组织中的表达及其对肺鳞癌细胞侵袭和迁移的影响目前尚不清楚。本研究探讨miR- 146a在肺鳞癌组织中的表达及其对肺鳞癌细胞迁移和侵袭的影响。现分析结果并报告如下。
1 资料与方法
1.1 临床资料 选择2014年10月~2015年10月潍坊医学院附属益都中心医院手术切除的新鲜肺鳞癌组织及其配对的癌旁正常组织(距癌组织边缘≥5 cm)各70例份,均经组织病理检查明确诊断。标本来源患者男48例、女22例,年龄(58±7)岁;肿瘤最大直径:≤2 cm者24例,>2 cm者46例;组织分化程度:低分化20例,中高分化50例;临床分期(参照2009年第7版国际抗癌联盟肺癌TNM分期标准):Ⅰ、Ⅱ期31例,Ⅲ期39例;有淋巴结转移30例,无淋巴转移40例;有吸烟史者53例,无吸烟史者17例。所有患者术前未行任何抗肿瘤治疗,亦未合并其他器官或组织恶性肿瘤。同期收集因外伤、咯血等肺良性疾病行肺叶切除的正常肺组织标本20例份,标本来源患者性别、年龄等一般资料与肺鳞癌患者匹配。
1.2 组织miR- 146a表达检测 采用qRT- PCR法。取肺鳞癌组织及其配对的癌旁正常组织、正常肺组织标本,采用TRIzol法提取组织总RNA,分光光度计检测总RNA纯度,OD260/OD280为1.8~2.0。按RNA逆转录试剂盒说明将总RNA逆转录为cDNA,然后进行PCR扩增。引物设计:miR- 146a上游引物:5′- GGGTGAGAACTGAATTCCA- 3′,下游引物:5′- CAGTGCGTGTCGTGGAGT- 3′。按PCR试剂盒说明配置PCR反应体系。PCR反应条件:94 ℃预变性2 min,94 ℃变性20 s,60 ℃退火延伸30 s,共40个循环。以U6为内参,采用2-ΔΔCt法计算miR- 146a相对表达量。实验重复3次,取平均值。比较不同组织miR- 146a表达,并分析肺鳞癌组织miR- 146a表达与患者临床病理参数的关系。
1.3 细胞实验
1.3.1 细胞实验材料 人肺鳞癌细胞系(SK- MES- 1,NCI- H520,NCI- H2170,NCI- H226)、正常肺组织上皮细胞(BEAS- 2B),美国ATCC公司。高糖DMEM培养基,美国Hyclone公司;胰蛋白酶,美国Life公司;miR- 146a mimics及阴性对照mimics- NC,由上海吉玛制药技术有限公司设计合成;TRIzol试剂、LipofectamineTM2000,美国Invitrogen公司;RNA逆转录试剂盒及实时荧光定量PCR试剂盒,大连宝生物工程有限公司;miR- 146a及内参U6引物,广州市锐博生物科技有限公司设计合成;Transwell小室,美国Corning公司;基质胶,美国BD公司。
1.3.2 人肺鳞癌细胞筛选 采用qRT- PCR法。取人肺鳞癌细胞(SK- MES- 1、NCI- H520、NCI- H2170、NCI- H226)和正常肺组织上皮细胞(BEAS- 2B),采用TRIzol法提取细胞总RNA,余步骤同1.2,筛选miR- 146a相对表达量最低的细胞系进行后续实验。结果显示,SK- MES- 1、NCI- H520、NCI- H2170、NCI- H226及BEAS- 2B细胞miR- 146a相对表达量分别为0.57±0.08、0.21±0.06、0.44±0.09、0.37±0.10、1.03±0.02。与BEAS- 2B细胞比较,SK- MES- 1、NCI- H520、NCI- H2170、NCI- H226细胞中miR- 146a相对表达量明显降低(P均<0.01)。NCI- H520细胞miR- 146a相对表达量明显低于SK- MES- 1、NCI- H2170、NCI- H226细胞(P均<0.01)。故选择NCI- H520细胞进行后续实验。
1.3.3 上调miR- 146a表达细胞模型建立及验证 取NCI- H520细胞和BEAS- 2B细胞接种于含10% FBS的高糖DMEM培养基中,置于37 ℃、5% CO2细胞培养箱中培养,每2天更换1次培养液。当细胞铺至培养瓶底80%~90%时,0.25%胰酶消化、传代。取传5代对数生长期NCI- H520细胞,接种于6孔板中,随机分为miR- 146a mimics组、mimics- NC组和空白对照组,miR- 146a mimics组每孔加入100 pmol miR- 146a mimics及5 μL转染试剂,mimics- NC组每孔加入100 pmol mimics- NC及5 μL转染试剂,严格按LipofectamineTM2000试剂说明书进行转染。空白对照组不进行任何处理。各组继续培养24 h,采用qRT- PCR法检测miR- 146a相对表达量,步骤同1.2。结果显示,miR- 146a mimics组、mimics- NC组和空白对照组miR- 146a相对表达量分别为5.56±0.11、0.98±0.04、1.02±0.03,miR- 146a mimics组miR- 146a相对表达量明显高于mimics- NC组和空白对照组(P均<0.01)。说明上调miR- 146a表达细胞模型制作成功,可用于后续实验。
1.3.4 细胞迁移和侵袭能力检测 采用Transwell小室法。实验前用无血清的培养液饥饿处理转染miR- 146a mimics、mimics- NC的NCI- H520细胞。①细胞迁移实验:Transwell小室膜水化预处理,于Transwell小室上室每孔加入含2×105个细胞的细胞悬液,下室加入含10% FBS的培养基,37 ℃、5% CO2、饱和湿度条件下培养24 h,取出小室,棉签擦净上室内未迁移细胞,固定、染色,显微镜下观察。随机取5个200倍视野,计数穿膜细胞数,以此表示细胞迁移能力。实验重复3次,取平均值。②细胞侵袭实验:将Transwell小室进行包被基质膜处理,用基质胶包被Transwell小室基底膜,待基质胶凝固后进行后续实验,其余步骤同细胞迁移实验。实验重复3次,取平均值。

2 结果
2.1 肺鳞癌组织、癌旁正常组织、正常肺组织miR- 146a表达比较 肺鳞癌组织miR- 146a相对表达量为0.46±0.09,癌旁正常组织和正常肺组织分别为0.99±0.04、1.03±0.03。肺鳞癌组织miR- 146a相对表达量明显低于癌旁正常组织和正常肺组织(P均<0.01),而癌旁正常组织与正常肺组织比较差异无统计学意义(P>0.05)。
2.2 肺鳞癌组织miR- 146a表达与患者临床病理参数的关系 见表1。
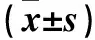
表1 肺鳞癌组织miR- 146a表达与患者 临床病理参数的关系
2.3 转染miR- 146a的肺鳞癌NCI- H520细胞迁移和侵袭能力变化 细胞迁移实验中,转染miR- 146a mimics、mimics- NC的NCI- H520细胞穿入Transwell小室下室的细胞数目分别为(30±8)、(81±10)个/HP,二者比较P<0.01。细胞侵袭实验中,转染miR- 146a mimics、mimics- NC的NCI- H520细胞穿入Transwell小室下室的细胞数目分别为(19±5)、(43±9)个/HP,二者比较P<0.05。
3 讨论
miRNA是一类长度为17~25个核苷酸的非编码小分子RNA,通过与靶基因mRNA的3′非编码区结合,降解mRNA,在转录后水平调节靶基因表达。目前已证实,在人类复杂的基因调控网络中miRNA具有极其重要的作用,在众多疾病的发生、发展过程中发挥重要作用。随着对miRNA研究的不断深入,很多miRNA已被证实在恶性肿瘤的发生、发展过程中起癌基因或抑癌基因作用[14]。但到目前为止,关于miRNA在恶性肿瘤中的具体分子机制仍未完全明确。
miR- 146a基因定位于染色体5q33,其在自身免疫性疾病、炎症反应、肿瘤等病理过程中发挥重要作用[15]。miR- 146a在不同肿瘤中作用不同,甚至相反。如miR- 146a在胃癌[16]、乳腺癌[17]、前列腺癌[18]及胰腺癌[19]等组织中表达下调,具有类似抑癌基因作用;在宫颈癌组织中表达上调,具有类似癌基因作用[20]。说明miR- 146a在不同肿瘤中存在组织或细胞特异性,miR- 146a在不同恶性肿瘤中可能通过调控不同的通路来参与肿瘤的发生、发展。但国内外有关肺鳞癌组织miR- 146a表达的研究相对较少。
本研究结果显示,肺鳞癌组织中miR- 146a表达明显低于癌旁正常组织及正常肺组织,说明miR- 146a在肺鳞癌中可能具有类似抑癌基因作用;肺鳞癌组织中miR- 146a表达变化与肿瘤组织分化程度、临床分期、淋巴结转移有关,说明miR- 146a表达变化与肺鳞癌的发生、发展有关,有可能作为判断肺鳞癌进展的分子生物学标志物。进一步研究发现,人肺鳞癌细胞(SK- MES- 1、NCI- H520、NCI- H2170、NCI- H226)miR- 146a表达明显低于正常肺组织上皮细胞(BEAS- 2B),进一步证实miR- 146a低表达与肺鳞癌的发生有关。
侵袭和转移是恶性肿瘤的基本生物学特征。临床研究发现,约90%的恶性肿瘤患者死于肿瘤的侵袭和转移[21]。说明肿瘤侵袭和转移是影响恶性肿瘤患者预后的重要因素。研究证实,miR- 146a能够影响恶性肿瘤细胞的侵袭和迁移[13,16,19]。本研究选择miR- 146a表达最低的肺鳞癌NCI- H520细胞,通过脂质体转染上调细胞中miR- 146a表达,并观察上调miR- 146a表达对肺鳞癌NCI- H520细胞迁移和侵袭能力的影响。结果发现,上调miR- 146a表达的肺鳞癌NCI- H520细胞迁移和侵袭能力明显降低,提示miR- 146a有可能成为肺鳞癌靶向治疗的潜在靶点。目前有关miR- 146a调控肺鳞癌细胞侵袭和迁移的具体分子生物学机制尚不明确,在胰腺癌中miR- 146a通过抑制EGFR和NF- κB信号通路抑制肿瘤细胞侵袭[19,22],在胃癌中miR- 146a通过靶向WASF2抑制胃癌细胞侵袭和迁移[16,23]。但miR- 146a在肺鳞癌中调控侵袭和转移的具体机制鲜见报道,尚需进一步研究。
综上所述,肺鳞癌组织miR- 146a表达下调,其表达变化与肿瘤的恶性生物学行为有关;miR- 146a能明显抑制肺鳞癌细胞的侵袭和迁移能力,这为探讨其发病机制及临床诊疗提供了新思路。
[1] Janne PA, Yang JC, Kim DW, et al. AZD9291 in EGFR inhibitor- resistant non- small- cell lung cancer[J]. N Engl J Med, 2015,372(18):1689- 1699.
[2] Leidinger P, Backes C, Blatt M, et al. The blood- borne miRNA signature of lung cancer patients is independent of histology but influenced by metastases[J]. Mol Cancer, 2014(13):202.
[3] Cheng H, Shcherba M, Kandavelou K, et al. Emerging drugs for squamous cell lung cancer[J]. Expert Opin Emerg Drugs, 2015,20(1):149- 160.
[4] Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first- line treatment for European patients with advanced EGFR mutation- positive non- small- cell lung cancer(EUR- TAC): a multicentre, open- label, randomised phase 3 trial[J]. Lancet Oncol, 2012,13(3):239- 246.
[5] Shaw AT, Kim DW, Nakagawa K, et al. Crizotinib versus chemotherapy in advanced ALK- positive lung cancer[J]. N Engl J Med, 2013,368(25):2385- 2394.
[6] 姜莹.肺鳞癌的分子靶向治疗研究现状及进展[J].山东医药,2015,55(44):104- 107.
[7] Gruber AR, Martin G, Muller P, et al. Global 3′ UTR shortening has a limited effect on protein abundance in proliferating T cells[J]. Nat Commun, 2014(5):5465.
[8] Zhou P, Xu W, Peng X, et al. Large- scale screens of miRNA- mRNA interactions unveiled that the 3′UTR of a gene is targeted by multiple miRNAs[J]. PLoS One, 2013,8(7):e68204.
[9] Sand M, Gambichler T, Sand D, et al. MicroRNAs and the skin: tiny players in the body′s largest organ[J]. J Dermatol Sci, 2009,53(3):169- 175.
[10] Hou Z, Zhang J, Han Q, et al. Hepatitis B virus inhibits intrinsic RIG- I and RIG- G immune signaling via inducing miR146a[J]. Sci Rep, 2016(6):26150.
[11] Prabowo AS, van Scheppingen J, Iyer AM, et al. Differential expression and clinical significance of three inflammation- related microRNAs in gangliogliomas[J]. J Neuroinflammation, 2015(12):97.
[12] Kumaraswamy E, Wendt KL, Augustine LA, et al. BRCA1 regulation of epidermal growth factor receptor (EGFR) expression in human breast cancer cells involves microRNA- 146a and is critical for its tumor suppressor function[J]. Oncogene, 2015,34(33):4333- 4346.
[13] Hou Z, Yin H, Chen C, et al. microRNA- 146a targets the L1 cell adhesion molecule and suppresses the metastatic potential of gastric cancer[J]. Mol Med Rep, 2012,6(3):501- 506.
[14] Zhao L, Chen X, Cao Y. New role of microRNA: carcinogenesis and clinical application in cancer[J]. Acta Biochim Biophys Sin, 2011,43(11):831- 839.
[15] Li L, Chen XP, Li YJ. MicroRNA- 146a and human disease[J]. Scand J Immunol, 2010,71(4):227- 231.
[16] Yao Q, Cao Z, Tu C, et al. MicroRNA- 146a acts as a metastasis suppressor in gastric cancer by targeting WASF2[J]. Cancer Lett, 2013,335(1):219- 224.
[17] Hurst DR, Edmonds MD, Scott GK, et al. Breast cancer metastasis suppressor 1 up- regulates miR- 146, which suppresses breast cancer metastasis[J]. Cancer Res, 2009,69(4):1279- 1283.
[18] Lin SL, Chiang A, Chang D, et al. Loss of mir- 146a function in hormone- refractory prostate cancer[J]. RNA, 2008,14(3):417- 424.
[19] Li Y, Vandenboom TG 2nd, Wang Z, et al. miR- 146a suppresses invasion of pancreatic cancer cells[J]. Cancer Res, 2010,70(4):1486- 1495.
[20] Wang X, Tang S, Le SY, et al. Aberrant expression of oncogenic and tumor- suppressive microRNAs in cervical cancer is required for cancer cell growth[J]. PLoS One, 2008,3(7):e2557.
[21] Gupta GP, Massagué J. Cancer metastasis: building a framework[J]. Cell, 2006,127(4):679- 695.
[22] 崔鹏,区金锐,简志祥,等.miR- 146a在胰腺癌组织中的表达及临床意义[J].岭南现代临床外科,2013,13(1):18- 22.
[23] 王海波,刘延军,陈树伟,等.miR- 146a在胃癌中的表达及其对胃癌细胞生物学特性的影响[J].中国生化药物杂志,2017,37(1):46- 50.
10.3969/j.issn.1002- 266X.2017.36.022
R734.2
B
1002- 266X(2017)36- 0068- 04
2016- 11- 12)

