喉鳞癌组织CHD5、E- cadherin、Smad4表达变化及其意义
王亚莉,葛建荣
(1青海省人民医院,西宁810000;2苏州大学附属第一医院)
·临床研究·
喉鳞癌组织CHD5、E- cadherin、Smad4表达变化及其意义
王亚莉1,葛建荣2
(1青海省人民医院,西宁810000;2苏州大学附属第一医院)
目的探讨染色质区解旋酶DNA结合蛋白5(CHD5)、E- 钙黏蛋白(E- cadherin)、Smad家族成员4(Smad4)在喉鳞癌组织中的表达变化及其意义。方法选择喉鳞癌组织及其配对的癌旁正常组织各35例份,采用免疫组化SP法检测两种组织CHD5、E- cadherin、Smad4表达。比较两种组织CHD5、E- cadherin、Smad4阳性表达,分析喉鳞癌组织CHD5、E- cadherin、Smad4阳性表达的关系及其与患者临床病理参数和预后的关系。结果喉鳞癌组织CHD5、E- cadherin、Smad4阳性表达率均低于癌旁正常组织(P均<0.05)。相关分析显示,喉鳞癌组织CHD5阳性表达与Smad4阳性表达呈正相关关系(r=0.810,P<0.05),与E- cadherin阳性表达无相关性(r=-0.263,P>0.05),E- cadherin阳性表达与Smad4阳性表达呈正相关关系(r=0.481,P<0.05)。喉鳞癌组织CHD5阳性表达与淋巴结转移、TNM分期有关,E- cadherin阳性表达与组织分化程度、淋巴结转移有关,Smad4阳性表达与淋巴结转移有关(P均<0.05)。CHD5、E- cadherin、Smad4阳性表达者术后生存时间>3年比例明显高于其阴性表达者(P均<0.05)。结论喉鳞癌组织CHD5、E- cadherin、Smad4低表达,其表达变化与喉鳞癌的恶性生物学行为和患者预后有关。
喉鳞状细胞癌;染色质区解旋酶DNA结合蛋白5;E- 钙黏蛋白;Smad家族成员4
喉癌是头颈部常见的恶性肿瘤之一,约占全身恶性肿瘤率的3%,其组织学类型以鳞癌最常见[1]。喉鳞癌具有易复发和转移等恶性生物学行为,是影响患者预后的重要因素[2]。目前认为,肿瘤的复发和转移是多因素共同作用的结果。有研究证实,染色质区解旋酶DNA结合蛋白5(CHD5)基因缺失与多种肿瘤的复发和转移密切相关,如乳腺癌、黑色素瘤、卵巢癌、肺癌等[3~7]。上皮间质转化(EMT)在胚胎发育、组织发生等生理过程中具有重要作用。E- 钙黏蛋白(E- cadherin)、Smad家族成员4(Smad4)等是EMT重要的分子生物学标记物。近年研究发现,在多种肿瘤组织中可见E- cadherin、Smad4表达改变,表明EMT可参与多种肿瘤的发生、发展[8]。2012年3月~2015年9月,本研究观察了喉鳞癌组织CHD5、E- cadherin、Smad4表达变化,并分析其与患者临床病理参数和预后的关系。
1 临床资料
1.1 基本资料 选择同期青海省人民医院和苏州大学附属第一医院收治的喉鳞癌患者35例。所有患者术前未行任何抗肿瘤治疗,术后经组织病理检查明确诊断。排除合并心、肝、肾等重要脏器疾病,免疫系统疾病,感染性疾病以及严重的心脑血管疾病。其中,男18例、女17例,年龄(58.21±12.37)岁;组织分化程度:高分化21例,中低分化14例;TNM分期:Ⅰ、Ⅱ期23例,Ⅲ、Ⅳ期12例;有淋巴结转移24例,无淋巴结转移11例。本研究经青海省人民医院和苏州大学附属第一医院医学伦理委员会批准,患者均知情同意。结果分析采用SPSS20.0统计软件。计数资料比较采用χ2检验。相关性分析采用Spearman等级相关分析。P<0.05为差异有统计学意义。
1.2 喉鳞癌组织及其配对的癌旁正常组织CHD5、E- cadherin、Smad4表达 取手术切除的喉鳞癌组织及其配对的癌旁正常组织(距肿瘤边缘≥1 cm),4%中性甲醛固定,石蜡包埋,5 μm厚切片。切片常规脱蜡至水,3% H2O2室温孵育,微波抗原修复;加入正常山羊血清室温封闭20 min,弃去血清,分别滴加CHD5、E- cadherin和Smad4一抗工作液(稀释倍数1∶150),37 ℃孵育2 h;PBS洗涤5 min×3次,加入生物素标记的二抗(稀释倍数1∶200),室温孵育30 min;PBS洗涤5 min×3次,DAB显色,苏木素复染,常规脱水,透明,干燥,封片。以PBS替代一抗作阴性对照。判定标准:CHD5阳性表达主要定位于细胞核,E- cadherin阳性表达主要定位于细胞膜,Smad4阳性表达主要定位于细胞质。随机选取10个含有阳性细胞的400倍视野进行观察。阳性细胞所占比例:无阳性细胞为0分,阳性细胞所占比例≤25%为1分,阳性细胞所占比例>25%~50%为2分,阳性细胞所占比例>50%为3分;染色程度:无阳性着色为0分,浅黄色为1分,深黄色为2分,棕黄色为3分。按阳性细胞所占比例和染色程度综合判定[9],二者之和>3分为阳性表达、≤3分为阴性表达。结果显示,喉鳞癌组织CHD5、E- cadherin、Smad4阳性表达率分别为42.86%(15/35)、45.71%(16/35)、40.00%(14/35),癌旁正常组织分别为97.14%(34/35)、91.42%(32/35)、94.29%(33/35)。喉鳞癌组织CHD5、E- cadherin、Smad4阳性表达率均低于癌旁正常组织(P均<0.05)。
1.3 喉鳞癌组织CHD5、E- cadherin、Smad4阳性表达的关系 15例CHD5阳性表达者中E- cadherin均为阴性表达,Smad4阳性表达1例、阴性表达14例;Spearman等级相关分析显示,喉鳞癌组织CHD5阳性表达与Smad4阳性表达呈正相关关系(r=0.810,P<0.05),与E- cadherin阳性表达无相关性(r=-0.263,P>0.05)。16例E- cadherin阳性表达者中,Smad4阳性表达3例、阴性表达13例;Spearman等级相关分析显示,喉鳞癌组织E- cadherin阳性表达与Smad4阳性表达呈正相关关系(r=0.481,P<0.05)。
1.4 喉鳞癌组织CHD5、E- cadherin、Smad4阳性表达与患者临床病理参数的关系 见表1。
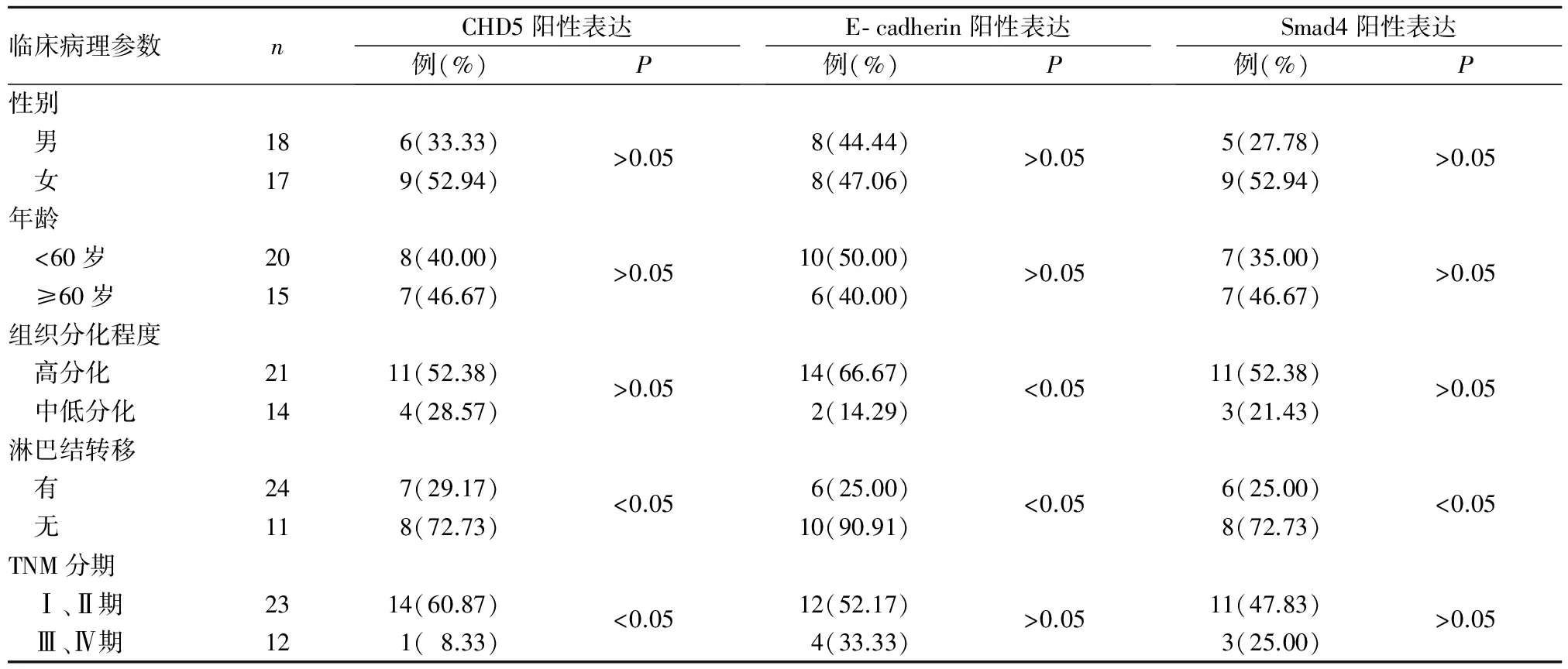
表1 喉鳞癌组织CHD5、E- cadherin、Smad4阳性表达与患者临床病理参数的关系
1.5 喉鳞癌组织CHD5、E- cadherin、Smad4阳性表达与患者预后的关系 所有患者术后随访1~36个月,记录术后生存时间。其中,术后生存时间>3年19例、≤3年16例。15例CHD5阳性表达者中,术后生存时间>3年11例(73.33%);20例CHD5阴性表达者中,术后生存时间>3年5例(25.00%)。16例E- cadherin阳性表达者中,术后生存时间>3年12例(75.00%);19例E- cadherin阴性表达者中,术后生存时间>3年4例(21.05%)。14例Smad4阳性表达者中,术后生存时间>3年11例(78.57%);21例Smad4阴性表达者中,术后生存时间>3年5例(23.81%)。CHD5、E- cadherin、Smad4阳性表达者术后生存时间>3年比例均明显高于其阴性表达者(P均<0.05)。
2 讨论
目前认为,侵袭和转移是导致喉鳞癌患者预后不良的主要原因,故早期发现其侵袭和转移的证据具有重要意义。但临床上缺少判定喉鳞癌早期发生侵袭和转移的分子生物学标记物[10]。
CHD5属于ATP依赖染色质重塑酶,能够通过水解ATP提供能量,改变染色质中核小体的位置,从而改变组蛋白与DNA链之间的空间构象,调控目的基因的转录活性[11]。研究发现,CHD5在霍奇金淋巴瘤、皮肌炎等多种疾病以及超过50%的肿瘤中异常表达[12]。本研究结果显示,喉鳞癌组织CHD5阳性表达率明显低于癌旁正常组织,其阳性表达与淋巴结转移、TNM分期有关,且其阳性表达者术后生存时间>3年比例明显高于阴性表达者,与Wang等[13]研究结果一致。说明CHD5在喉鳞癌的发生过程中可能具有抑癌基因作用。
EMT是肿瘤侵袭和转移的关键步骤,涉及到多种蛋白分子,如钙连接素。E- cadherin是钙连接素中影响肿瘤侵袭和转移的一种重要蛋白,在多种肿瘤组织中异常表达,并与肿瘤的去分化、淋巴结转移以及患者预后不良有关[14]。研究证实,E- cadherin在喉鳞癌细胞黏附紊乱中发挥重要作用,但其与喉鳞癌患者临床病理参数的关系仍存在争议。本研究结果发现,喉鳞癌组织E- cadherin阳性表达率明显低于癌旁正常组织,其阳性表达与肿瘤组织分化程度、淋巴结转移有关,且其阳性表达者术后生存时间>3年比例明显高于阴性表达者。提示E- cadherin参与了喉鳞癌细胞的EMT过程,其阳性表达升高可促进肿瘤的侵袭和转移。
转化生长因子β(TGF- β)是已知诱导肿瘤细胞发生EMT的重要因子,而Smad4是TGF- β信号转导通路中的一个关键性因子[15]。已有研究证实,Smad4缺失可促进原癌基因活化,使肿瘤发生侵袭和转移[16~18]。Papageorgis等[19]研究认为,Smad4具有抑癌基因功能,其表达缺失是多种肿瘤患者预后不良的独立影响因素。本研究结果显示,喉鳞癌组织Smad4阳性表达率明显低于癌旁正常组织,其阳性表达与淋巴转移有关,且其阳性表达者术后生存时间>3年比例明显高于阴性表达者。表明Smad4表达变化有助于判断喉鳞癌的疾病进程及评估患者预后。
CHD5参与组成CHD5/MTA3/NuRD复合物,该复合物能够与Snail(E- cadherin的上游负性调控基因)竞争性结合至E- cadherin启动子区,从而促进E- cadherin基因的转录[20]。本研究发现,CHD5与Smad4、E- cadherin与Smad4均呈正相关关系,三者均与淋巴结转移有关;在喉鳞癌淋巴结转移过程中CHD5与Smad4、E- cadherin与Smad4可能发挥协同作用。本研究并未发现CHD5与E- cadherin存在相关性,可能与研究病例数较少有关。
综上所述,喉鳞癌组织CHD5、E- cadherin、Smad4低表达,其表达变化与喉鳞癌的恶性生物学行为和患者预后有关。CHD5、E- cadherin、Smad4有可能作为评价喉鳞癌恶性生物学行为的潜在指标,并可为其治疗提供有价值的靶标。
[1] Marur S, Forastiere AA. Head and neck squamous cell carcinoma: update on epidemiology, diagnosis, and treatment[J]. Mayo Clin Proc, 2016,91(3):386- 396.
[2] Taguchi T, Nishimura G, Takahashi M, et al. Treatment results and prognostic factors for advanced squamous cell carcinoma of the head and neck treated with salvage surgery after concurrent chemoradiotherapy[J]. Int J Clin Oncol, 2016,21(5):869- 874.
[3] Xie CR, Li Z, Sun HG, et al. Mutual regulation between CHD5 and EZH2 in hepatocellular carcinoma[J]. Oncotarget, 2015,6(38):40940- 40952.
[4] Wu X, Zhu Z, Li W, et al. Chromodomain helicase DNA binding protein 5 plays a tumor suppressor role in human breast cancer[J]. Breast Cancer Res, 2012,14(3):R73.
[5] Lang J, Tobias ES, Mackie R. Preliminary evidence for involvement of the tumour suppressor gene CHD5 in a family with cutaneous melanoma[J]. Br J Dermatol, 2011,164(5):1010- 1016.
[6] Wong RR, Chan LK, Tsang TP, et al. CHD5 downregulation associated with poor prognosis in epithelial ovarian cancer[J]. Gynecol Obstet Invest, 2011,72(3):203- 207.
[7] Zhao R, Yan Q, Lv J, et al. CHD5, a tumor suppressor that is epigenetically silenced in lung cancer[J]. Lung Cancer, 2012,76(3):324- 331.
[8] Park JW, Park DM, Choi BK, et al. Establishment and characterization of metastatic gastric cancer cell lines from murine gastric adenocarcinoma lacking Smad4, p53, and E- cadherin[J]. Mol Carcinog, 2015,54(11):1521- 1527.
[9] Mathew J, Pathrose S, Kottoor J, et al. Evaluation of an indigenously prepared Herbal extract (EndoPam) as an antimicrobial endodontic irrigant: an ex vivo study[J]. J Int Oral Health, 2015,7(6):88- 91.
[10] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017,67(1):7- 30.
[11] Zhou CY, Narlikar GJ. Analysis of nucleosome sliding by ATP- dependent chromatin remodeling enzymes[J]. Methods Enzymol, 2016(573):119- 135.
[12] Kolla V, Zhuang T, Higashi M, et al. Role of CHD5 in human cancers: 10 years later[J]. Cancer Res, 2014,74(3):652- 658.
[13] Wang J, Chen H, Fu S, et al. The involvement of CHD5 hypermethylation in laryngeal squamous cell carcinoma[J]. Oral Oncol, 2011,47(7):601- 608.
[14] 鲁海珍,刘尚梅.E- cadherin和COX- 2蛋白在胃癌组织中的表达及临床意义[J].中国肿瘤临床,2013,40(8):458- 461.
[15] Massagué J. TGFβ signalling in context[J]. Nat Rev Mol Cell Biol, 2012,13(10):616- 630.
[16] Bornstein S, White R, Malkoski S, et al. Smad4 loss in mice causes spontaneous head and neck cancer with increased genomic instability and inflammation[J]. J Clin Invest, 2009,119(11):3408- 3419.
[17] Xia X, Wu W, Huang C, et al. SMAD4 and its role in pancreatic cancer[J]. Tumour Biol, 2015,36(1):111- 119.
[18] Yang J, Wang Y, Zeng Z, et al. Smad4 deletion in blood vessel endothelial cells promotes ovarian cancer metastasis[J]. Int J Oncol, 2017,50(5):1693- 1700.
[19] Papageorgis P, Cheng K, Ozturk S, et al. Smad4 inactivation promotes malignancy and drug resistance of colon cancer[J]. Cancer Res, 2011,71(3):998- 1008.
[20] Kolla V, Naraparaju K, Zhuang T, et al. The tumour suppressor CHD5 forms a NuRD- type chromatin remodelling complex[J]. Biochem J, 2015,468(2):345- 352.
青海省自然科学基金资助项目(2016- K- 9P4)。
10.3969/j.issn.1002- 266X.2017.36.015
R739.65
B
1002- 266X(2017)36- 0049- 03
2017- 05- 03)

