葡萄酒中总铁和Fe2+的改良菲洛嗪法快速测定
郭安鹊 张星星 张予林 董 鑫 陈力维
(西北农林科技大学葡萄酒学院,陕西杨凌 712100)
葡萄酒中总铁和Fe2+的改良菲洛嗪法快速测定
郭安鹊 张星星 张予林 董 鑫 陈力维
(西北农林科技大学葡萄酒学院,陕西杨凌 712100)
通过优化菲洛嗪法测定葡萄酒中总铁的检测条件,以及探讨Fe3+共存时菲洛嗪用量对Fe2+测定的影响,建立一种简易可靠、能够直接测定葡萄酒中总铁和Fe2+的方法。结果显示:改良菲洛嗪法测定葡萄酒中的总铁,在0.25~2.00 mg/L质量浓度范围内线性关系良好,检测限为0.011 5 mg/L,加标回收率为94.31%~104.34%,变异系数范围为0.95%~2.43%;然而,共存的Fe3+会影响对葡萄酒中Fe2+的测定,适合的显色剂用量是菲洛嗪与总铁摩尔比为7,在此条件下,Fe2+质量浓度的拟合准确度为101.98%~113.50%。利用该法测定葡萄酒样品的结果表明,葡萄酒中以Fe2+为主,其在红葡萄酒中的百分比相对较高。总之,改进的方法简单易行、准确可靠,能够满足葡萄酒中铁价态的快速定量测定,适于在葡萄酒生产中推广应用。
葡萄酒; 菲洛嗪法; 总铁; Fe2+; 快速测定
引言
葡萄酒氧化机制的研究表明,葡萄酒的氧化主要表现为酚类物质的氧化,铜、铁离子特别是后者在引发和延伸氧化反应中起着关键的催化作用[1-3]。随着不锈钢罐的广泛应用,葡萄酒中的铁含量大幅下降,成品酒中铁的质量浓度为0.5~5.0 mg/L[4]。然而,近年来的大量研究结果显示,葡萄酒中铁的离子形态及其分布是其催化氧化作用的关键所在,即使是微量的铁仍能引起葡萄酒的氧化褐变,严重影响酒的感官质量[5-8]。
众所周知,因所处的还原环境及酸度条件,葡萄酒中的铁以Fe2+为主[7,9]。目前,通过固相萃取技术进行样品前处理,然后利用原子吸收光谱法、电感耦合等离子体光谱法(ICP-OES)等检测葡萄酒中铁的离子存在形态[10-11],以及利用电化学方法测定葡萄酒中的铁价态[12],国内外均有文献报道。但上述方法操作复杂,检测成本高,不适于在葡萄酒生产中推广应用。尤其是,样品在前处理过程中,很容易因酒样与空气长时间接触、pH值调整等问题改变Fe2+/Fe3+氧化还原电子对的平衡,影响铁形态测定的准确度和精确度。相比之下,分光光度法操作简单、成本低,是测定葡萄酒中铁形态的常用方法。
基于不同显色剂与Fe2+或Fe3+作用形成特定有色络合物的原理,利用分光光度计能够很容易测定溶液中的Fe2+或Fe3+,由此出现了大量测定铁形态的显色剂。研究结果表明,由于测定Fe3+的显色剂受限于所测溶液中氯、焦磷酸等离子的浓度要求,有关Fe2+显色剂的研究越来越受到重视[13]。其中,菲洛嗪(Ferrozine)已经成为实践中定量测定Fe2+应用最广的物质[13-15]。目前,已有利用菲洛嗪法测定葡萄酒中铁形态的研究报道[10,13]。近年来,DANILEWICZ[7]在研究白葡萄酒中的Fe2+/Fe3+比和氧化还原状态时,以菲洛嗪分光光度法为基础,在不改变样品pH值的条件下,借助外推法确定葡萄酒中Fe2+的含量,很有借鉴意义。然而,与Fe3+共存时,菲洛嗪法测定Fe2+往往会受到干扰,干扰程度与Fe3+浓度及显色剂用量有关[15-17]。ANASTCIO等[17]认为,Fe3+可与菲洛嗪作用形成络合物,该络合物在光照下会被还原为Fe2+-菲洛嗪,直接导致Fe2+定量检测的结果偏高。IM等[15]在研究中则发现,即使在避光条件下,Fe3+也会干扰对Fe2+的测定,且干扰作用随时间呈线性递增趋势;Fe3+浓度越高,干扰作用越明显。在利用菲洛嗪法测定葡萄酒中铁含量的文献中,很少见到Fe3+对Fe2+测定影响的研究报道。
因此,本文通过在模拟葡萄酒中优化菲洛嗪法的检测条件和方法评价,建立一种简单易行、准确可靠、直接适于葡萄酒中总铁测定的方法;以总铁测定为基础,通过优化Fe3+共存时测定Fe2+所需的菲洛嗪用量,借助多项式曲线拟合,利用外推法获得葡萄酒中的Fe2+含量,最后通过差减法计算Fe3+的含量。
1 材料与方法
1.1 供试酒样
模拟酒、成品白葡萄酒和红葡萄酒。
1.2 主要供试试剂
Fe2+标准储备液(1.79 mmol/L):准确称取49.78 mg FeSO4·6H2O(纯度99.0%以上),置于烧杯中溶解,迅速转移至100 mL容量瓶,模拟酒定容至刻线。
抗坏血酸母液(1.79 mmol/L):准确称取31.54 mg抗坏血酸(纯度99.7%),置于烧杯中溶解,快速转移至100 mL棕色容量瓶,模拟酒定容至刻线。
菲洛嗪母液(10.74 mmol/L):准确称取52.92 mg菲洛嗪(纯度99.7%以上),置于烧杯中溶解,迅速转移至10 mL棕色容量瓶,模拟酒定容至刻线。
每次使用前,上述储备液和母液均为新鲜配制,避光保存。所有化学试剂均为分析纯,实验用水为去离子水,所有实验均在室温(20℃)下进行。
1.3 仪器与设备
主要设备:UV-2450型紫外-可见光分光光度计(日本岛津公司);PHS-3C型pH计(上海精密科学仪器有限公司);BT25S型十万分之一天平(德国Startorius公司);PinAAcle500型原子吸收光谱仪(美国PE公司);Mutiwave PRO型微波消解仪(奥地利安东帕公司)。
所有玻璃和塑料器材,均置于10%(体积分数)硝酸溶液中至少浸泡24 h,用去离子水清洗3次后,晾干,备用。
1.4 原理与方法
1.4.1总铁测定原理
在酸性条件下,菲洛嗪与Fe2+反应生成稳定的紫色络合物[Fe(Ferrozine)3]2+,在562 nm波长处有最大光吸收,其吸光度与Fe2+质量浓度成正比[14,18]。通过加入还原剂抗坏血酸(C6H8O6),可将葡萄酒中的Fe3+还原为Fe2+,据此测定葡萄酒中的总铁浓度。反应式为
1.4.2模拟酒的配制及通氮气处理
参照GUO等[8]的方法,将7 mmol/L酒石酸和11 mmol/L酒石酸氢钾溶解到体积分数12%的乙醇溶液中,利用1.0 mol/L氢氧化钠和1.0 mol/L盐酸调节溶液的pH值为3.20。使用前,对模拟酒进行通氮气处理,密封后于室温下避光放置。
1.4.3标准曲线的绘制
分别用移液枪吸取0、25、40、80、50、100、200 μL Fe2+标准储备液于10 mL棕色容量瓶,立即用模拟酒定容至刻线,配制0、0.25、0.40、0.50、0.80、1.00、2.00 mg/L 7个不同质量浓度梯度的Fe2+标准溶液。然后分别向各容量瓶中加入适量的抗坏血酸母液和菲洛嗪母液。最后,混匀静置30 min后,注入10 mm石英比色皿中,以空白做参比溶液,利用分光光度计于波长562 nm处测定吸光度,绘制标准曲线。每个质量浓度重复3次。
1.4.4葡萄酒中总铁的测定
室温下,葡萄酒开瓶后,快速吸取1 mL酒样并移至10 mL棕色容量瓶中;向容量瓶中添加模拟酒至刻线(即酒样被稀释10倍,简称“稀释样”);依次加入适量的抗坏血酸母液和菲洛嗪母液,混匀,避光放置30 min后,以稀释样代替样品做空白,并以此为参比样测定波长562 nm处的吸光度,根据标准曲线计算总铁含量。每个酒样重复3次。
1.4.5葡萄酒中Fe2+的测定
室温下,葡萄酒一开瓶,就立即吸取1 mL酒样加入事先通氮气处理的10 mL棕色容量瓶中,添加模拟酒至刻线。随后,直接加入适量的菲洛嗪,混匀后立即倒入比色皿中,以稀释样为参比,利用分光光度计于波长562 nm处每隔1 min测定一次吸光度。最后,对前10 min内的实验数据进行多项式曲线拟合,获得拟合曲线方程的常数项A0(截距),即反应时间为0时络合物所对应的吸光度。利用总铁标准曲线,通过反推法计算Fe2+的含量。每个酒样重复3次。
1.4.6葡萄酒中Fe3+的计算
总铁含量减去Fe2+的含量即为Fe3+的含量。
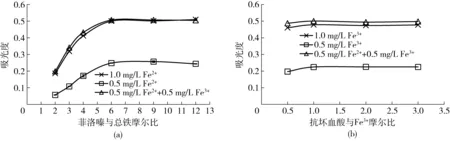
图2 菲洛嗪和抗坏血酸用量对总铁测定的影响Fig.2 Effects of ferrozine and ascorbic acid on total iron determination in model wine
1.4.7数据处理方法
实验数据的ANOVA(Duncan新复极差法)分析采用软件SPSS Statistics 21.0处理,每个处理重复3次,其结果以平均值±标准差表示。
2 结果与讨论
2.1 菲洛嗪法测定葡萄酒中总铁的条件优化
2.1.1检测波长的确定
配制不同质量浓度的Fe2+标准溶液,按照实验方法,利用分光光度计在400~700 nm(扫描间距为1.0 nm)波长范围内扫描Fe2+与菲洛嗪形成的络合物。由不同体系的吸收光谱(图1)可以看出,曲线在波长562 nm处均有最大吸收,且吸光度最大,与已有的文献报道一致[14,19],故检测波长选择562 nm。
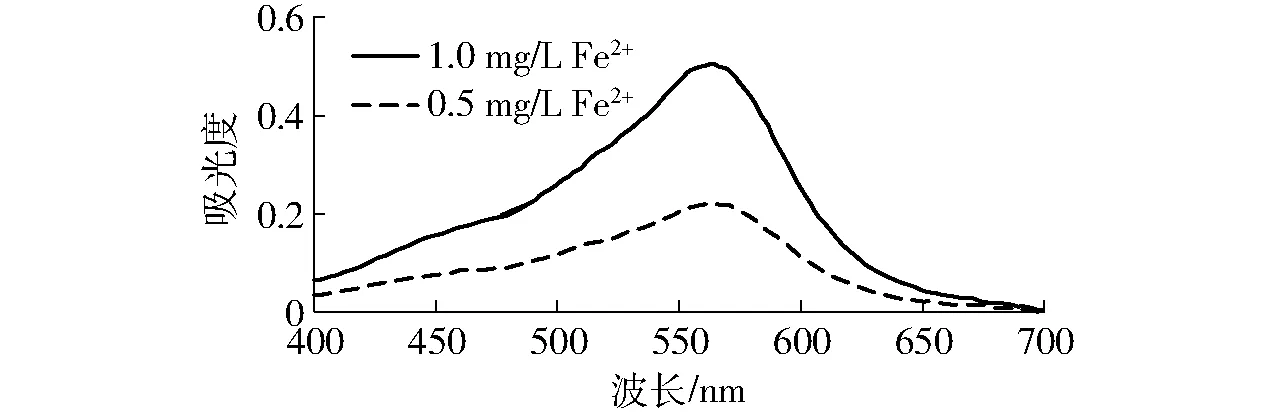
图1 菲洛嗪与Fe2+络合物的光吸收曲线Fig.1 Absorption spectra of Fe2+-ferrozine complex in model wine
摩尔吸光系数是衡量分光光度测定方法灵敏度的一个重要指标,在模拟酒中,菲洛嗪的摩尔吸光系数是1,10-邻菲啰啉摩尔吸光系数的2.4倍(表1),表明菲洛嗪是较1,10-邻菲啰啉更为灵敏的显色剂。

表1 显色剂菲洛嗪与1,10-邻菲啰啉的摩尔吸光系数Tab.1 Molar absorptivity of ferrozine and 1,10-phenanthroline in model wine
注:同行上角不同小写字母表示差异显著(P<0.05),下同。
2.1.2显色剂和还原剂用量的确定
在含不同铁形态的模拟酒中,首先加入过量的抗坏血酸,然后选择添加不同用量的显色剂菲洛嗪,混匀后反应30 min,测定562 nm处吸光度,结果如图2a所示。由结果分析可知,菲洛嗪与总铁摩尔比为2~4时,由于菲洛嗪用量不足,测定结果偏低;当摩尔比为6~12时,测定结果较为稳定,说明在模拟酒中适宜的显色剂用量是菲洛嗪与总铁摩尔比为6,而且显色剂过量对测定结果无显著影响(P>0.05)。
选择不同用量的还原剂抗坏血酸,然后加入显色剂(菲洛嗪与总铁摩尔比为6),混匀后反应30 min,测定吸光度。结果如图2b所示,当抗坏血酸与Fe3+摩尔比为0.5时(即两者反应的理论比值),Fe3+的还原并不完全,测定结果偏低;当摩尔比不低于1时,反应完全且测定结果非常稳定,说明适宜的还原剂用量为抗坏血酸与Fe3+摩尔比为1。
2.1.3反应时间的确定
按照实验方法,以及已经确定的还原剂、菲洛嗪用量,选择不同的反应时间0、5、10、15、20、25、30、35、40 min,测定吸光度。结果如图3所示,在反应前5 min,吸光度快速上升,5~10 min内仍缓慢增加,说明菲洛嗪和Fe2+的反应开始很快,但并未达到平衡;10~40 min内吸光度非常稳定,变化不显著,说明10 min时反应达到平衡,且在随后的30 min内非常稳定。
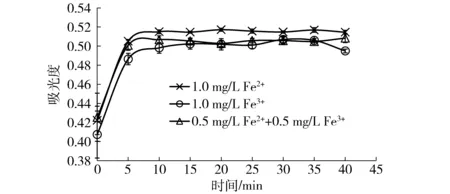
图3 反应时间对总铁测定的影响Fig.3 Effect of reaction time on total iron determination in model wine
关于菲洛嗪与Fe2+形成紫色稳定络合物进行比色之前的反应时间,在最初的文献报道中为1 min[20];在改良方法中,也有反应30 min的报道[15]。这主要取决于溶液的组成和内部环境条件。在葡萄酒中,由于酒石酸、酚类物质、蛋白质等大分子物质均能够与铁形成络合物[11,21],影响铁与菲洛嗪的络合,反应达到平衡所需要的时间就相对要长。因此,考虑到葡萄酒构成的复杂性,反应时间选择30 min。
2.1.4pH值和共存金属离子对总铁测定的影响
溶液的酸度直接影响金属离子的存在状态和络合物的稳定性[22-23],共存金属离子则通过电子交换影响葡萄酒中的铁形态[6, 24]。因此,在模拟酒中研究了共存金属离子和pH值对总铁测定的影响,共存金属离子及其质量浓度的选择参照GUO等[8]的文献,包括0.48 mg/L Al3+、0.98 mg/L Mn2+、1.17 mg/L Zn2+和1.14 mg/L Cu2+。实验结果表明,pH值和其他共存金属离子对总铁质量浓度测定均无显著影响(表2、3),因而优化后的菲洛嗪法可直接用于测定葡萄酒中总铁。
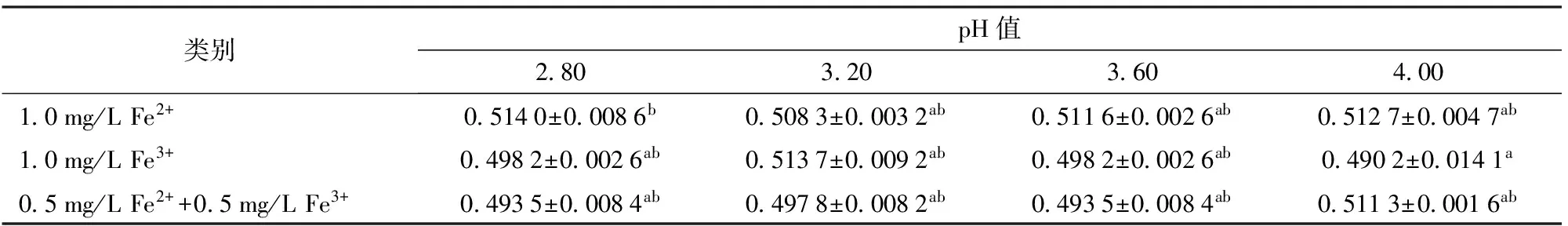
表2 pH值对总铁测定(吸光度)的影响Tab.2 Effect of pH values on total iron determination in model wine

表3 共存金属离子对总铁测定(吸光度)的影响Tab.3 Effect of coexisting metal ions on total iron determination in model wine
2.2 总铁测定方法的评价
2.2.1标准曲线和方法检测限
按照改良后的菲洛嗪法,以空白为参比,测定0.25~2.00 mg/L 6个质量浓度梯度的Fe2+标准溶液。以Fe2+质量浓度(mg/L)为横坐标、562 nm处吸光度为纵坐标,得到总铁测定的标准曲线为y=0.522 5x-0.022 3,决定系数R2为0.997 9,说明铁在0.25~2.00 mg/L质量浓度范围内线性关系良好。
按照美国环保总局计算检测限的估计方法[25]:配制8份以标准曲线估计的检测限质量浓度的3倍即0.128 mg/L Fe2+加入空白样品的Fe2+溶液,以改良菲洛嗪法测定,该方法检出限的计算公式为
MDL=St(n-1,1-α)
式中S——加标样品测试结果的标准偏差
t——自由度为n-1时的Student’s值,当n=8时,在99%置信区间(α=0.01)下,t=3.499
n——加标样品数量,n=8
经计算,检测限为0.011 5 mg/L。
2.2.2方法的准确度和精密度
以模拟酒、白葡萄酒和红葡萄酒为实验酒样,利用改良菲洛嗪法和原子吸收光谱法分别测定加标(加入Fe2+标准液)前后酒样中的总铁浓度,各重复3次,计算方法的回收率。结果如表4所示,改良菲洛嗪法与原子吸收光谱法的测定结果相差很小,并且方法回收率范围为94.31%~104.34%,说明方法的准确度很好。
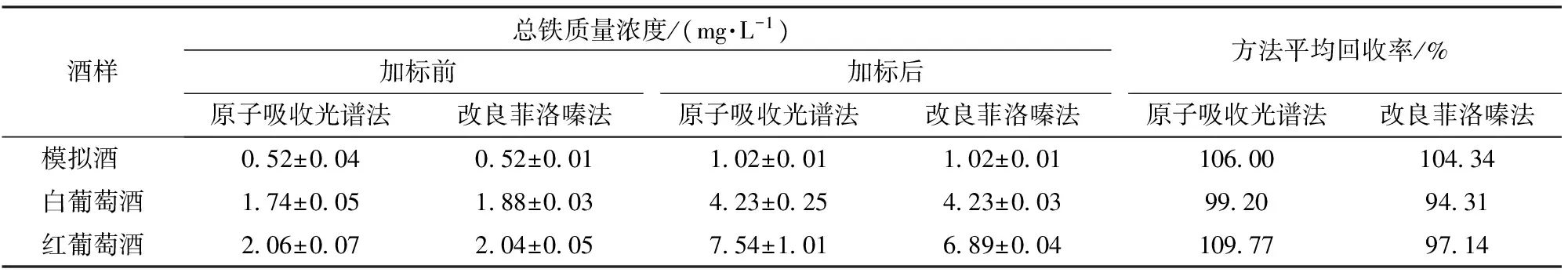
表4 葡萄酒样品中总铁测定的回收率和方法比较Tab.4 Recovery rates of total iron determination in wine samples and comparison of two methods
选择0.25、0.50、1.00 mg/L的Fe2+标准溶液和红、白葡萄酒各1款,利用菲洛嗪法重复测定6次,结果表明,总铁测定结果的变异系数范围为0.95%~2.43%,说明方法的精密度良好。
目前,邻菲啰啉比色法为国标中推荐测定葡萄酒中铁的方法。然而,该法必须进行酒样的消化前处理,过程非常繁琐、耗时。而且,有研究显示,当水质中总铁质量浓度低于1 mg/L时,其测定的精密度和准确度较低[26-27]。相比之下,改良菲洛嗪法在测定葡萄酒总铁含量方面优势明显:不仅避免了繁杂的样品前处理过程,而且准确度和精密度高。
2.3菲洛嗪用量对葡萄酒中Fe2+测定的影响
按照实验方法,在总铁为1.0 mg/L(Fe2+与Fe3+摩尔比为4)的模拟酒中,加入不同浓度的菲洛嗪,研究Fe3+共存时菲洛嗪用量对Fe2+测定的影响。
图4a显示了不同溶液的吸光度随反应时间(前10 min)的变化及其多项式拟合曲线(图中仅列出了摩尔比为7时的拟合曲线方程,A0为曲线截距)。结果表明,随着菲洛嗪添加量的增加,Fe2+质量浓度所对应的吸光度增大,而R2却在不断减小;特别是当摩尔比为8时,曲线的R2已经很差。图4b为利用外推法获得的Fe2+质量浓度与实际值(0.8 mg/L,图4b中的横向虚线部分)的平均拟合准确度,由结果分析可知,当摩尔比为7时,测定Fe2+浓度与实际值最为接近,拟合准确度为105.87%。而且,该比例下拟合曲线的R2很好(图4a),说明菲洛嗪的添加量最为适合。由此可见,在Fe3+共存条件下,存在一个最适合的菲洛嗪用量:过少或过多都会影响对葡萄酒中Fe2+的测定。

图4 不同菲洛嗪用量对Fe2+测定的影响Fig.4 Effect of ferrozine on Fe2+ determination in model wine
为了确保菲洛嗪用量的准确性和适用性,实验随后在含有不同Fe2+与Fe3+摩尔比的模拟酒中(总铁质量浓度为1.0 mg/L),加入菲洛嗪(菲洛嗪与总铁摩尔比为7),依据Fe2+的测定方法,计算Fe2+质量浓度。结果表明,4阶多项式拟合曲线的R2均在0.95以上,拟合的准确度在101.98%~113.50%之间(表5);这说明:在Fe3+共存条件下,选择菲洛嗪与总铁摩尔比为7时,对葡萄酒中Fe2+的测定效果最好。另外,不难发现,随着Fe2+与Fe3+摩尔比的降低,即Fe3+浓度的增加,拟合曲线的R2在下降,Fe2+的拟合准确度持续偏高(表5),说明共存Fe3+的浓度越大对Fe2+的测定影响越大,虽然葡萄酒中的铁主要以Fe2+存在。
因此,Fe3+的存在会影响对葡萄酒中Fe2+的定量测定,影响程度与菲洛嗪用量和Fe3+浓度有关,这与ANASTCIO等[17]的研究结果一致。然而,在葡萄酒条件下,相比于Fe3+浓度的影响,菲洛嗪用量的影响更大。尤其是加入的菲洛嗪过量时,会过高估计葡萄酒中Fe2+的实际浓度(图4b)。这可能是因为菲洛嗪加入后会优先与酒中的Fe2+络合,Fe3+/Fe2+氧化还原电势升高[28],Fe3+成为较强的氧化剂,在氧化多酚等物质的同时被还原为Fe2+;而过量的菲洛嗪与还原的Fe2+络合,吸光度增加[7,28]。
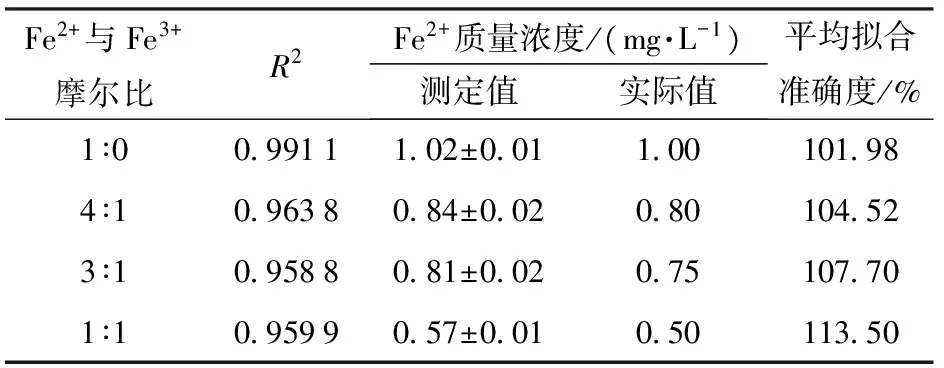
表5 Fe3+共存时菲洛嗪法测定的Fe2+质量浓度Tab.5 Concentration of Fe2+ determined by ferrozine assay in model wine containing Fe3+
2.4 样品测定
利用改良菲洛嗪法测定成品葡萄酒中的总铁和Fe2+含量。结果显示,红葡萄酒中的总铁质量浓度(平均值3.89 mg/L)明显高于白葡萄酒中的总铁质量浓度(平均值1.80 mg/L)(图5a),这可能与测试的葡萄酒样品有关,对此结果仍需扩大酒样数量进行深入研究;葡萄酒中的铁以Fe2+为主(图5b),红葡萄酒中的Fe2+百分比(平均值82.15%)高于白葡萄酒中的Fe2+百分比(平均值77.00%)(图5b),这与DANILEWICZ[7]的研究结果一致。这可能与红葡萄酒中含有较丰富的酚类物质有关。
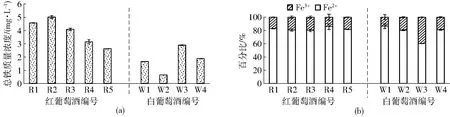
图5 改良菲洛嗪法测定的葡萄酒中总铁、Fe2+和Fe3+Fig.5 Determination of total iron, Fe2+ and Fe3+ in wines by the modified ferrozine assay
3 结论
(1)新建立的改良菲洛嗪法,能够直接、快速测定葡萄酒中的总铁和Fe2+含量,避免了繁杂的样品前处理过程及其对Fe2+测定结果准确性的干扰,方法简单易行、准确度和精密度高,适于在葡萄酒生产中推广应用。
(2)葡萄酒中共存的Fe3+能够影响对Fe2+的准确测定,其影响程度主要取决于显色剂菲洛嗪的用量和Fe3+的浓度,而过量添加菲洛嗪会导致Fe2+测定结果的偏高,适合的显色剂用量是菲洛嗪与总铁摩尔比为7。
(3)葡萄酒中的铁主要以Fe2+形态存在,而与白葡萄酒相比,红葡萄酒中含有的Fe2+百分比较高。
1 DANILEWICZ J C.Review of reaction mechanisms of oxygen and proposed intermediate reduction products in wine: central role of iron and copper[J].American Journal of Enology and Viticulture, 2003, 54(2): 73-85.
2 LI H, GUO A, WANG H.Mechanisms of oxidative browning of wine[J].Food Chemistry, 2008, 108(1): 1-13.
3 OLIVEIRA C M, FERREIRA A C S, DE FREITAS V, et al.Oxidation mechanisms occurring in wines[J].Food Research International, 2011, 44(5): 1115-1126.
5 KREITMAN G Y, CANTU A, WATERHOUSE A L, et al.Effect of metal chelators on the oxidative stability of model wine[J].Journal of Agricultural and Food Chemistry, 2013, 61(39): 9480-9487.
6 KREITMAN G Y, DANILEWICZ J C, JEFFERY D W, et al.Reaction mechanisms of metals with hydrogen sulfide and thiols in model wine.Part 2: iron-and copper-catalyzed oxidation[J].Journal of Agricultural and Food Chemistry, 2016, 64(20): 4105-4113.
7 DANILEWICZ J C.Fe(II):Fe(III) ratio and redox status of white wines[J].American Journal of Enology and Viticulture, 2016,67(2): 146-152.
8 GUO A, KONTOUDAKIS N, SCOLLARY G R, et al.Production and isomeric distribution of xanthylium cation pigments and their precursors in wine-like conditions: impact of Cu(II), Fe(II), Fe(III), Mn(II), Zn(II), and Al(III)[J].Journal of Agricultural and Food Chemistry, 2017,65(11): 2414-2425.
9 李湘利, 刘静.葡萄酒铁破败的发病机理及综合性防治技术[J].酿酒, 2007, 34(6): 73-74.
LI Xiangli, LIU Jing.Mechanism of casse and integrated prevention and control on wine ferric casse[J].Liquor Making, 2007, 34(6): 73-74.(in Chinese)
10 POHL P, PRUSISZ B.Application of tandem column solid phase extraction and flame atomic absorption spectrometry for the determination of inorganic and organically bound forms of iron in wine[J].Talanta, 2009, 77(5): 1732-1738.
11 ROUSSEVA M, KONTOUDAKIS N, SCHMIDTKE L M, et al.Impact of wine production on the fractionation of copper and iron in Chardonnay wine: implications for oxygen consumption[J].Food Chemistry, 2016, 203: 440-447.
14 刘球英, 骆艳娥.改进Ferrozine法测定溶液中的二价铁, 三价铁及总铁[J].科学技术与工程, 2016, 16(10): 85-88.
LIU Qiuying, LUO Yan’e.Determination of Fe2+, Fe3+and total iron ion with improved ferrozine UV-spectrophotometry[J].Science Technology and Engineering, 2016, 16(10): 85-88.(in Chinese)
15 IM J, LEE J, LÖFFLER F E.Interference of ferric ions with ferrous iron quantification using the ferrozine assay[J].Journal of Microbiological Methods, 2013, 95(3): 366-367.
16 孙静娴, 丁煜, 李清曼.与Fe(III)共存的Fe (II)分光光度法测定[J].土壤, 2011, 43(4): 662-668.
SUN Jingxian, DING Yu, LI Qingman.Accurate spectrometric determination of Fe(II) co-existing with Fe(III) in soils using 2,2′-Dipyridine or Ferrozine[J].Soils, 2011, 43(4): 662-668.(in Chinese)
18 VIOLLIER E, INGLETT P W, HUNTER K, et al.The ferrozine method revisited: Fe(II)/Fe(III) determination in natural waters[J].Applied Geochemistry, 2000, 15(6): 785-790.
19 CARPENTER C E, WARD R E.Iron determination by ferrozine method[M]∥Food Analysis Laboratory Manual.Springer International Publishing, 2017: 157-159.
20 STOOKEY L L.Ferrozine—a new spectrophotometric reagent for iron[J].Analytical Chemistry, 1970, 42(7): 779-781.
21 KONTOUDAKIS N, GUO A, SCOLLARY G R, et al.The impact of aging wine in high and low oxygen conditions on the fractionation of Cu and Fe in Chardonnay wine[J].Food Chemistry, 2017, 229: 319-328.
22 JANSEN B, NIEROP K G J, VERSTRATEN J M.Influence of pH and metal/carbon ratios on soluble organic complexation of Fe (II), Fe(III) and Al(III) in soil solutions determined by diffusive gradients in thin films[J].Analytica Chimica Acta, 2002, 454(2): 259-270.
23 KNOCKAERT D, RAES K, STRUIJS K, et al.Influence of microbial conversion and change in pH on iron-gallic acid complexation during lactobacillus fermentation[J].LWT—Food Science and Technology, 2014, 55(1): 335-340.
24 GRYGO-SZYMANKO E, TOBIASZ A, WALAS S.Speciation analysis and fractionation of manganese: a review[J].TrAC Trends in Analytical Chemistry, 2016, 80: 112-124.
25 王艳洁, 那广水, 王震, 等.检出限的涵义和计算方法[J].化学分析计量, 2012, 21(5): 85-88.
WANG Yanjie, NA Guangshui, WANG Zhen, et al.Connotation and calculation methods of detection limit[J].Chemical Analysis and Meterage, 2012, 21(5): 85-88.(in Chinese)
26 尚尔坤, 田然, 马丽媛, 等.4 种分光光度法测定铁含量的对比分析[J].食品工业, 2013,34(10): 223-225.
SHANG Erkun, TIAN Ran, MA Liyuan, et al.Comparative analysis of the four spectrophotometric determination of iron content[J].The Food Industry, 2013,34(10): 223-225.(in Chinese)
27 李媛, 陈奇洲.菲咯嗪分光光度法测定水中的总铁[J].解放军预防医学杂志, 2003, 21(1): 30-32.
LI Yuan, CHEN Qizhou.Determination of total iron content in water by the ferrozine spectrophotometric method[J].Journal of Preventive Medicine of Chinese People’s Liberation Army, 2003, 21(1): 30-32.(in Chinese)
28 DANILEWICZ J C.Reactions involving iron in mediating catechol oxidation in model wine[J].American Journal of Enology and Viticulture, 2013, 64(3): 316-324.
RapidDeterminationofTotalIronandFerrousIoninWinebyModifiedFerrozineAssay
GUO Anque ZHANG Xingxing ZHANG Yulin DONG Xin CHEN Liwei
(CollegeofEnology,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
More and more recent literatures have shown that iron and copper, especially iron plays critical roles in the initiation and propagation of wine oxidation, which seems to depend not only on the total concentration of iron, but also more on the speciation of iron in wine.A rapid method for directly accurate determination of total iron and ferrous ion (Fe2+) in wine was developed by optimizing the ferrozine-based assay for total iron detection, and the effects of ferric ion (Fe3+) and ferrozine levels on the quantification of Fe2+under wine conditions were also investigated.The results showed that the modified ferrozine assay was established for the direct determination of total iron in wine, the standard curve exhibited a good linear relationship between absorbance and iron concentration from 0.25 mg/L to 2.00 mg/L (R2=0.997 9) and the method detection limit was 0.011 5 mg/L, with the recovery rate of 94.31%~104.34%.Moreover, the total iron concentration determined by the modified ferrozine assay was in good accordance with that measured by the atomic absorption spectroscopy (AAS) in different wine samples.However, the presence of Fe3+seriously interfered with the accurate measurement of Fe2+in wine, and the optimized molar ratio of ferrozine to total iron was 7, with fitting accuracy ranging from 101.98% to 113.50% for Fe2+determination.The assay was applied to some commercial bottled wines, and it was confirmed that Fe2+was the dominant iron in wine, although the percentage of Fe2+in red wines was much higher than that in white ones.In brief, the modified ferrozine assay was simple, accurate and reliable to determine total iron and Fe2+in wine rapidly, and it can be widely used in the wine industry in future.
wine; ferrozine assay; total iron; ferrous ion; rapid determination
10.6041/j.issn.1000-1298.2017.10.043
TS262.6
A
1000-1298(2017)10-0338-07
2017-07-11
2017-08-05
中央高校基本科研业务费专项资金项目(Z109021702)和“十二五”国家科技支撑计划项目(2012BAD31B00)
郭安鹊(1976—),男,讲师,博士,主要从事葡萄酒氧化机制研究,E-mail:guoanque@nwsuaf.edu.cn

