Taqman探针荧光PCR法检测熊源性成分
邵建宏 罗宝正 薄清如 赵福振 帖丽莎 徐海聂 廖秀云 彭玉芬 陈 敬
(珠海出入境检验检疫局,国家外来病检测重点实验室,珠海,519015)稿件运行过程
Taqman探针荧光PCR法检测熊源性成分
邵建宏 罗宝正 薄清如*赵福振 帖丽莎 徐海聂 廖秀云 彭玉芬 陈 敬
(珠海出入境检验检疫局,国家外来病检测重点实验室,珠海,519015)稿件运行过程
熊;源性成分;荧光PCR;检测
为了对熊源性成分进行有效鉴定,本研究根据熊科动物线粒体DNA(mtDNA)序列,使用分子生物学软件Primer Express 3.0设计了一套特异性引物、探针,用以建立Taqman探针荧光PCR检测熊源性成分的方法。结果显示,所建立方法特异性强,15份熊属动物组织样品均出现特异性扩增曲线,20份阴性对照动物样品均未出现扩增曲线;方法灵敏度高,最低可以检测到10个拷贝数量级的重组质粒DNA,对熊胆粉稀释106倍后,仍可扩增出熊DNA;方法稳定性好,对相同的样品在不同时间进行2次重复检测,批内变异系数分别为0.88%、1.13%,批间变异系数为1.38%。结果表明,本研究建立的方法可应用于熊属动物组织及其加工品中的熊源性成分的检测。
熊,在物种分类中归于哺乳纲食肉目(Carnivora)熊科(Ursidae),根据BOLD Systems(http://www.boldsystems.org/)提供的资料,现存熊科动物分5属8种:熊猫属Ailuropoda(大熊猫Ailuropodamelanoleuca),眼镜熊属Tremarctos(眼镜熊Tremarctosornatus),马来熊属Helarctos(马来熊Helarctosmalayanus),懒熊属Melursus(懒熊Melursusursinus)以及熊属Ursus(棕熊Ursusarctos、美洲黑熊Ursusamericanus、亚洲黑熊Ursusthibetanus和北极熊Ursusmaritimus)[1]。
熊猫属的大熊猫作为国宝被全世界所熟悉[2],但熊属中的北极熊和亚洲黑熊在动物观赏、制药方面也具有重要意义,北极熊作为寒带动物被引进到亚热带甚至热带进行饲喂,代表着环境生物工程的长足进步,而亚洲黑熊的胆汁是亚洲传统医学的重要药材,具有极高的药用价值;熊的皮毛、肉、脂、掌等也是物资交易的重要物品,也具有很高的经济价值[3],使得熊属及其制品的非法交易普遍存在于各国间[4]。根据动物保护名录,除亚洲黑熊和棕熊外,其余熊属物种相继被纳入国际自然保护联盟组织[5]。
为加强对熊属动物的保护,限制和打击非法行为,对源自熊的可疑样品建立一种迅速、便捷、高效的检测方法将具有重要的实际意义。目前针对熊及其制品的DNA研究主要集中在熊的基因分析及保护[6]、性别、MHC基因及亲子鉴定[2,7-11]、熊胆成分检测[4]和熊的种属鉴定等方面[1,3-5],针对熊的物种鉴定和熊制品的DNA检测、鉴定技术的研究多用常规PCR技术[1-2,4-5,7-10],该技术在目前的研究成果中,能够对熊属的物种进行定性鉴定,但由于方法自身的缺陷,对DNA含量低的样品则难以进行检测鉴定[12]。
在当前分子生物学的研究领域中,较之常规PCR技术,荧光PCR技术得益于探针的加入,能够通过荧光信号实时监测PCR产物每个循环的积累总量,融合了常规PCR技术和光谱技术的特点,具有更强的特异性和更高的灵敏度,能够对微量样品(如毛发)进行准确鉴定,同时也免去了凝胶电泳可能产生的交叉污染。因此该技术被广泛应用于生命科学的各个领域。目前采用荧光PCR技术对动物源性成分的检测已十分成熟[13],但国内外尚无利用该技术检测熊属动物源性成分的相关报道。
鉴于荧光PCR技术在DNA检测方面的优点,本实验拟建立一种荧光PCR技术检测熊属动物源性成分的方法。
1 材料与方法
1.1 熊属动物样品
共15份,其中:美洲黑熊掌、亚洲黑熊掌各1份,棕熊毛发、北极熊毛发各2份,亚洲黑熊胆6份,为本实验室存留样品;棕熊肉罐头1份,亚洲黑熊熊胆粉2份,为市场采购样品。
1.2 阴性对照动物样品
共20份,其中:驴肉、水牛肉、牦牛肉、黄牛肉、猪肉、绵羊肉、山羊肉、马肉各2份,犀牛角、象牙各1份,为本实验室存留样品;人手指表皮2份,为本实验操作人员现场采集样品。
1.3 主要生物学试剂
DNA提取试剂盒E.Z.N.A.TMTissue DNA Kit为美国OMEGA公司产品,DNA Marker DL 2000与Premix ExTaqTM(Probe qPCR)试剂均为TaKaRa产品,均购自宝生物工程(大连)有限公司。
1.4 主要仪器
7500 Fast Real Time PCR System、ViiA 7 Real Time PCR System和QuantStudio 6 FlexReal Time PCR System为美国Applied Biosystems公司产品。Alpha Imager HP凝胶成像分析系统为美国Alpha Innotech公司产品。Sigma 3-18 K小型高速冰冻台式离心机为德国Sartorius公司产品。NanoDrop -1000 Spectrophotometer紫外分光光度计为美国NanoDrop Technologies 公司产品。
1.5 荧光PCR引物、探针的设计与合成
根据GenBank中公布的各熊科物种线粒体DNA(mtDNA)序列,使用生物学软件Clustal X进行比对,并通过生物学软件Primer Express 3.0在高度保守区域设计特异性荧光PCR引物、探针一套,由上海辉睿生物科技有限公司合成。引物、探针序列见表1。
表1 荧光PCR引物、探针序列
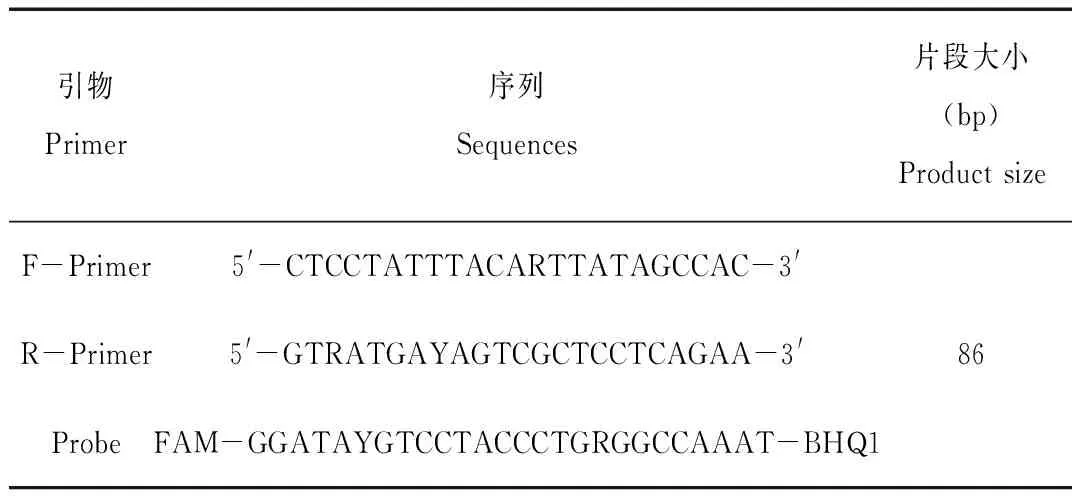
Tab.1 Sequences of fluorescent PCR primers and probe
1.6 样品的DNA提取
按照DNA提取试剂盒说明书提取样品DNA,并确保所提取的DNA模板260/280比值介于1.8至2.0。
1.7 熊属动物样品的种属鉴定
以上述1.1检测样品提取的DNA为模板,使用自行设计的引物(引物序列见表2)进行常规PCR扩增。PCR反应体系:2×TaqPCR Master mix 12.5 μL,10 μmol/L上下游引物各1.0 μL,DNA模版2.0 μL,补水至25 μL。PCR反应程序:94 ℃ 4 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 5 min。扩增结束后于2%琼脂糖凝胶电泳检测,回收目的片段,送宝生物公司进行TA克隆测序,将测序结果与靶基因进行比对,确定其种属来源。
表2 种属鉴定引物序列
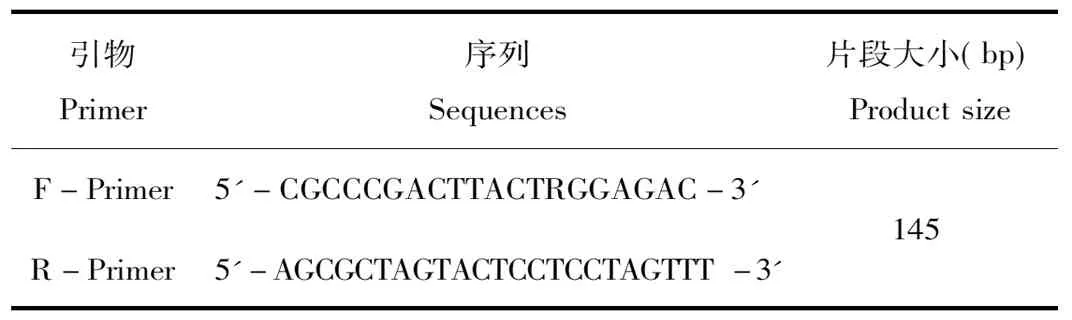
Tab.2 Sequences of PCR primers
1.8 荧光PCR方法的反应体系和程序
以上述1.1检测样品提取的DNA为模板进行荧光PCR扩增。反应体系:2×TaqPCR Master mix 12.5 μL,上下游引物各0.5 μL(引物浓度10 μmol/L),探针1.0 μL(探针浓度10 μmol/L),DNA模版2.0 μL,补水至25 μL。反应程序:94 ℃ 3 min;94 ℃ 15 s,58 ℃ 40 s(收集荧光信号),40个循环。
1.9 荧光PCR方法的特异性试验
以上述1.1和1.2的检测样品和对照样品提取的DNA为模板,分别使用上述1.8反应体系和反应程序进行荧光PCR扩增,验证所建立方法的特异性。
1.10 荧光PCR检测质粒的灵敏度试验
使用荧光PCR引物按上述1.7反应体系和反应程序进行常规PCR扩增,产物经克隆测序形成重组质粒后。将该质粒以10倍梯度进行10次稀释,将原质粒和稀释后的质粒分别作为质粒灵敏度试验的阳性标准品,对经梯度稀释的阳性标准品进行荧光PCR检测,验证所建立方法对质粒的灵敏度。
1.11 荧光PCR检测样品的灵敏度试验
取上述1.1检测样品中的1份熊胆粉(净重0.07 g)加200 μL蒸馏水充分溶解后以10倍梯度进行7次稀释,分别作为样品灵敏度试验的阳性标准品,对标准样品提取DNA并进行荧光PCR扩增,验证所建立方法对样品的灵敏度。
1.12 荧光PCR的稳定性试验
取上述1.10中稀释了105倍的阳性标准品为模板,使用上述1.7反应体系和反应程序进行2次试验,试验时间间隔为15 d,单次试验重复数为20个。使用统计学软件SPSS 22.0计算Ct值之间的差异,以验证所建立方法的稳定性。
2 结果与分析
2.1 熊属样品的种属鉴定
由图1可见,15份检测样品均被成功扩增,产物大小约145 bp,与预期相符。PCR产物经测序后在GenBank中比对,明确15份检测样品来自美洲黑熊、亚洲黑熊、棕熊和北极熊,均为熊属物种,与上述1.1相符。
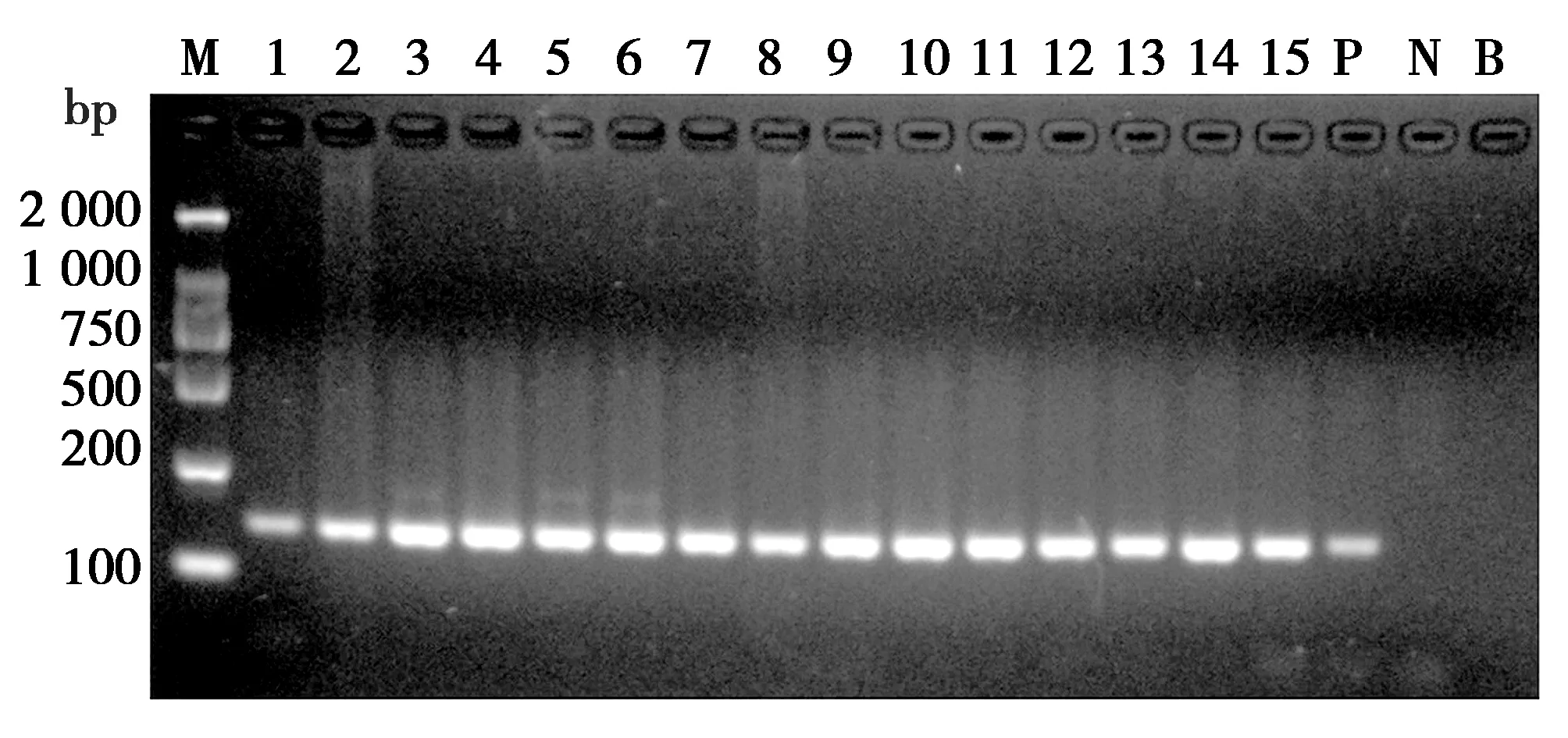
图1 检测样品种属鉴定常规PCR扩增结果Fig.1 Result of PCR for species identification of testing samples 注:M.DNA Marker DL2000;1.美洲黑熊掌;2.亚洲黑熊掌;3.北极熊毛发A;4.北极熊毛发B;5.棕熊毛发A;6.棕熊毛发B;7.亚洲黑熊熊胆粉A;8.棕熊肉罐头;9.亚洲黑熊熊胆粉B;10.亚洲黑熊胆A;11.亚洲黑熊胆B;12.亚洲黑熊胆C;13.亚洲黑熊胆D;14.亚洲黑熊胆E;15.亚洲黑熊胆F;P.阳性对照;N.阴性对照;B.空白对照 Note:M.DNA Marker DL2000;1.Ursus americanus paw;2.Ursus thibetanus paw;3.Ursus maritimus fur A;4. Ursus maritimus fur B;5.Ursus arctos fur A;6.Ursus arctos fur B;7.Ursus thibetanus bile powder A;8.Ursus arctos canned meat;9.Ursus thibetanus bile powder B;10.Ursus thibetanus gall A;11.Ursus thibetanus gall B;12.Ursus thibetanus gall C;13.Ursus thibetanus gall D;14.Ursus thibetanus gall E;15.Ursus thibetanus gall F;P.Positive;N.Negative;B.Blank
2.2 荧光PCR的特异性试验
由图2、图3可见,15份检测样品DNA均现扩增曲线,Ct值≤26;20份对照样品均未见扩增曲线。
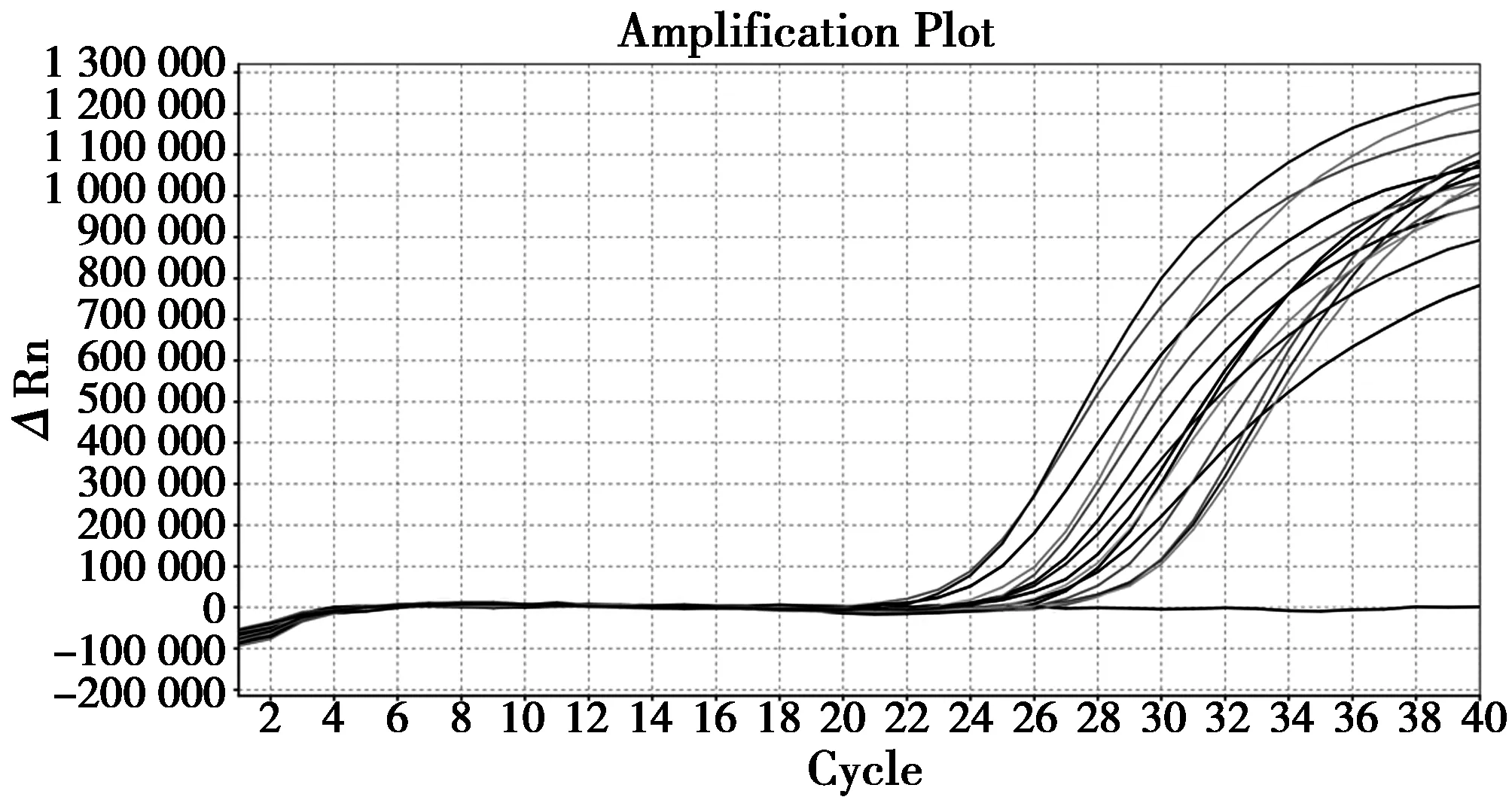
图2 检测样品荧光PCR检测结果Fig.2 Result of Real-time PCR for testing samples 注:扩增曲线:15份检测样品;未扩增线段:阴性对照 Note:Amplification curve: 15 testing samples;Non-amplification curve: Negative
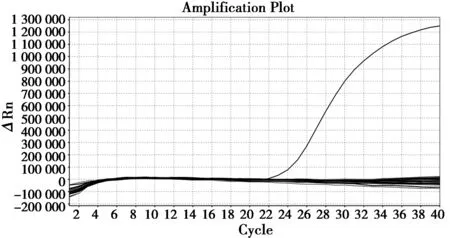
图3 对照样品荧光PCR检测结果Fig.3 Result of Real-time PCR for comparison samples 注:扩增曲线:20份对照样品;未扩增线段:阳性对照 Note:Non-amplification segment: 20 comparison samples;Amplification curve: Positive
2.3 荧光PCR检测质粒的灵敏度试验
根据质粒质量(2 μg)、DEPC水体积(100 μL)、质粒大小(约3 000 bp)及阿伏伽德罗常数(6.02×1023)换算为拷贝数,可得其初始拷贝数约为0.61×1010。由图4可见,10个梯度的阳性标准品中8个出现扩增曲线,Ct值≤33,可检测到的最低拷贝数约0.61×101,即为该方法针对质粒的检测灵敏度。
2.4 荧光PCR检测样品的灵敏度试验
经紫外分光光度计测量,阳性标准品初始DNA浓度为2.2 ng/μL。由图5可见,8个梯度的样品中7个梯度出现扩增曲线,Ct值≤36,可检测到的最低稀释倍数为106倍,即为该方法针对样品的检测灵敏度。
2.5 荧光PCR的稳定性试验
由图6、图7可见间隔15 d的2次试验结果图,批内变异系数分别为0.88%和1.13%,批间变异系数为1.38%。说明重复试验结果符合性较好,方法稳定。
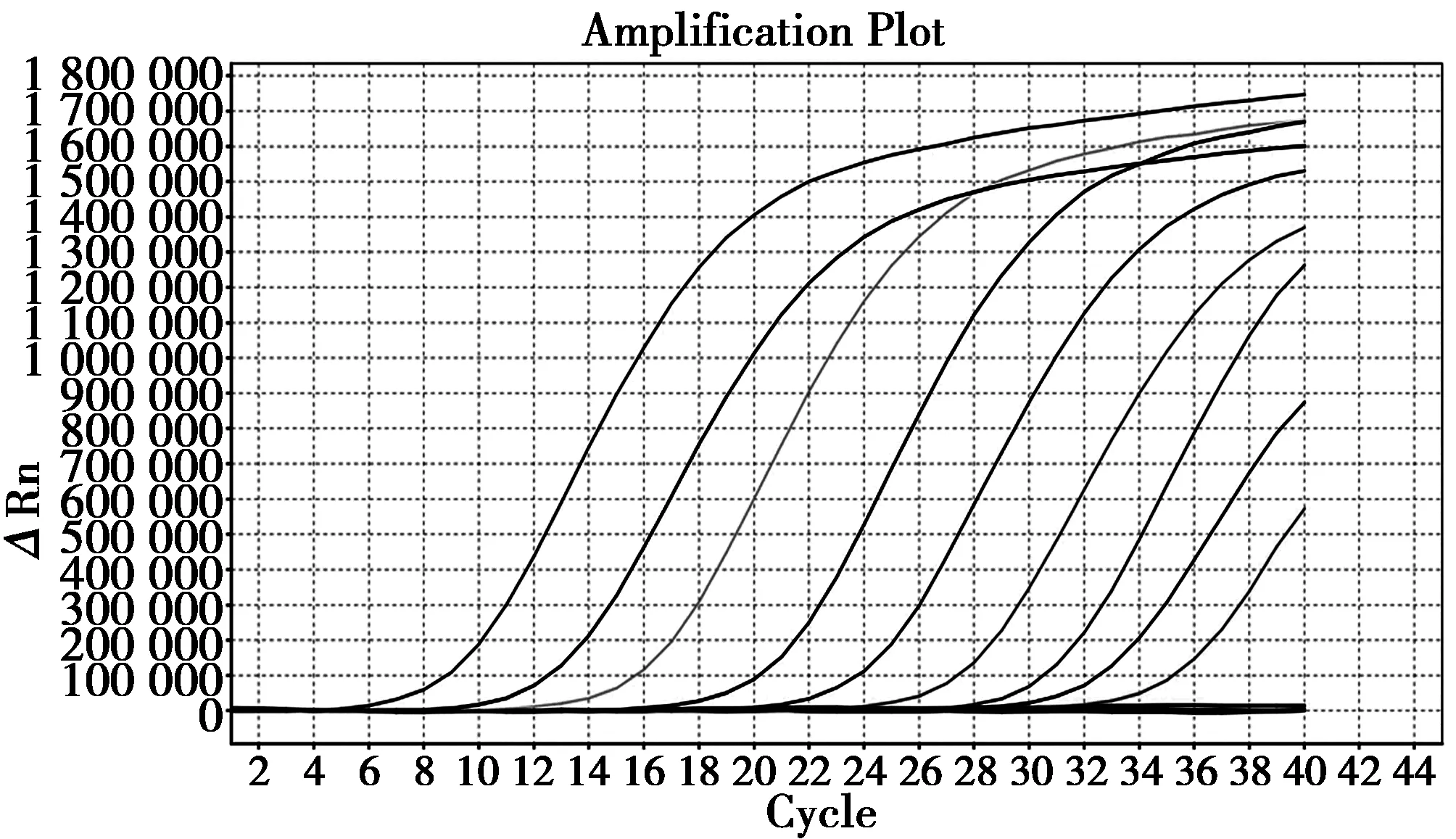
图4 质粒灵敏度试验结果Fig.4 Result of Real-time PCR for sensibility of plasmid 注:扩增曲线:从左至右分别为0.61×1010至0.61×102拷贝数质粒;未扩增线段:0.61×101、0.61×100及阴性对照 Note:Amplification curve: plasmid with 0.61×1010 to 0.61×102 copies from left to right;Non-amplification segment: plasmid with 0.61×101,0.61×100 and Negative
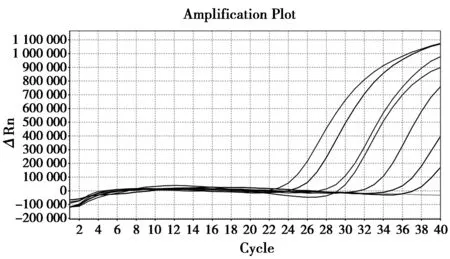
图5 样品灵敏度试验结果Fig.5 Result of Real-time PCR for sensibility of sample 注:扩增曲线:从左至右稀释倍数分别为100至107倍,未扩增线段:稀释倍数为108倍 Note:Amplification curve: samples that was diluted 100 times to 107 times from left to right;Non-amplification segment: sample that was diluted 108 times
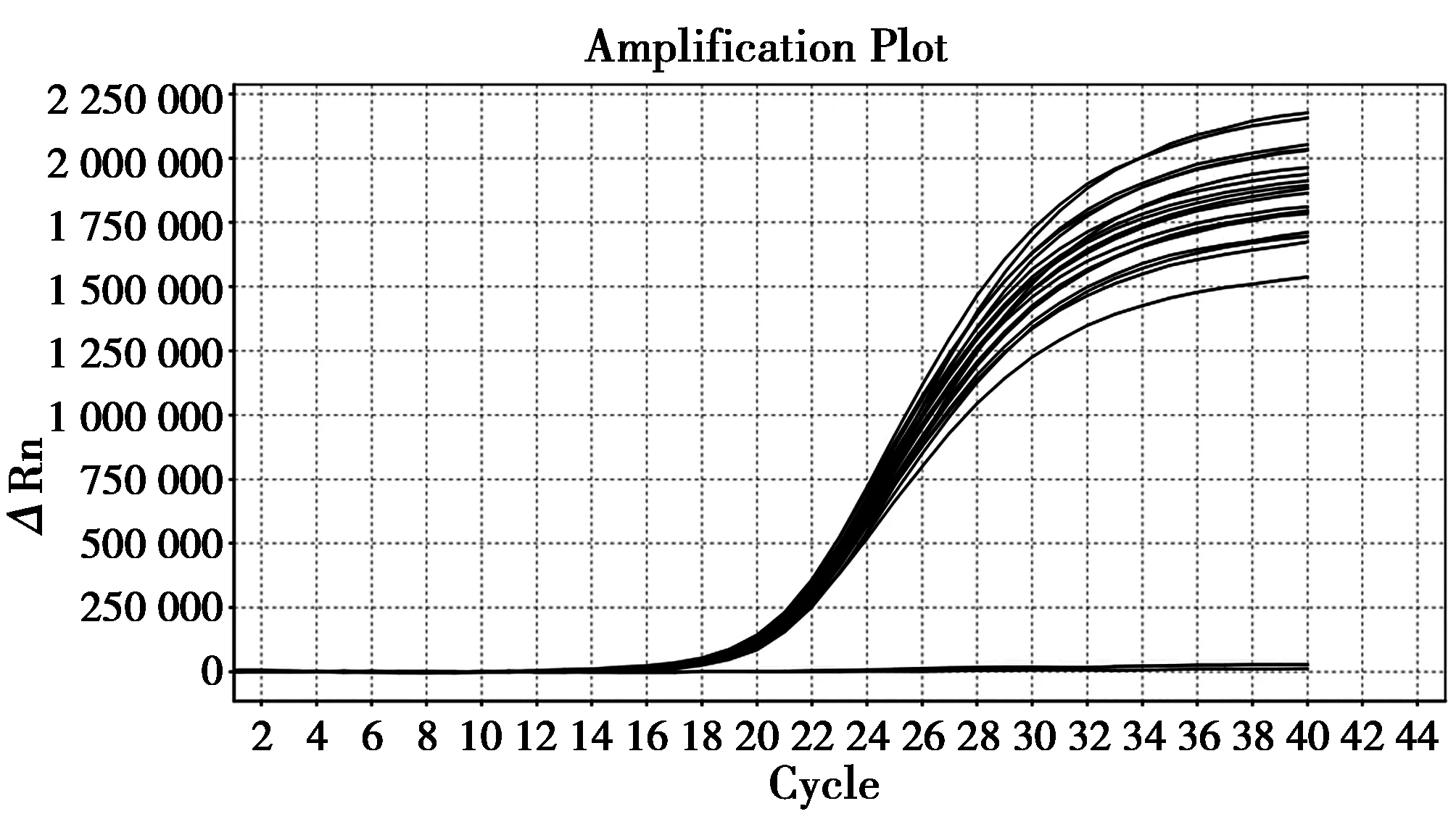
图6 第一次稳定性试验结果Fig.6 Result of first stability detection
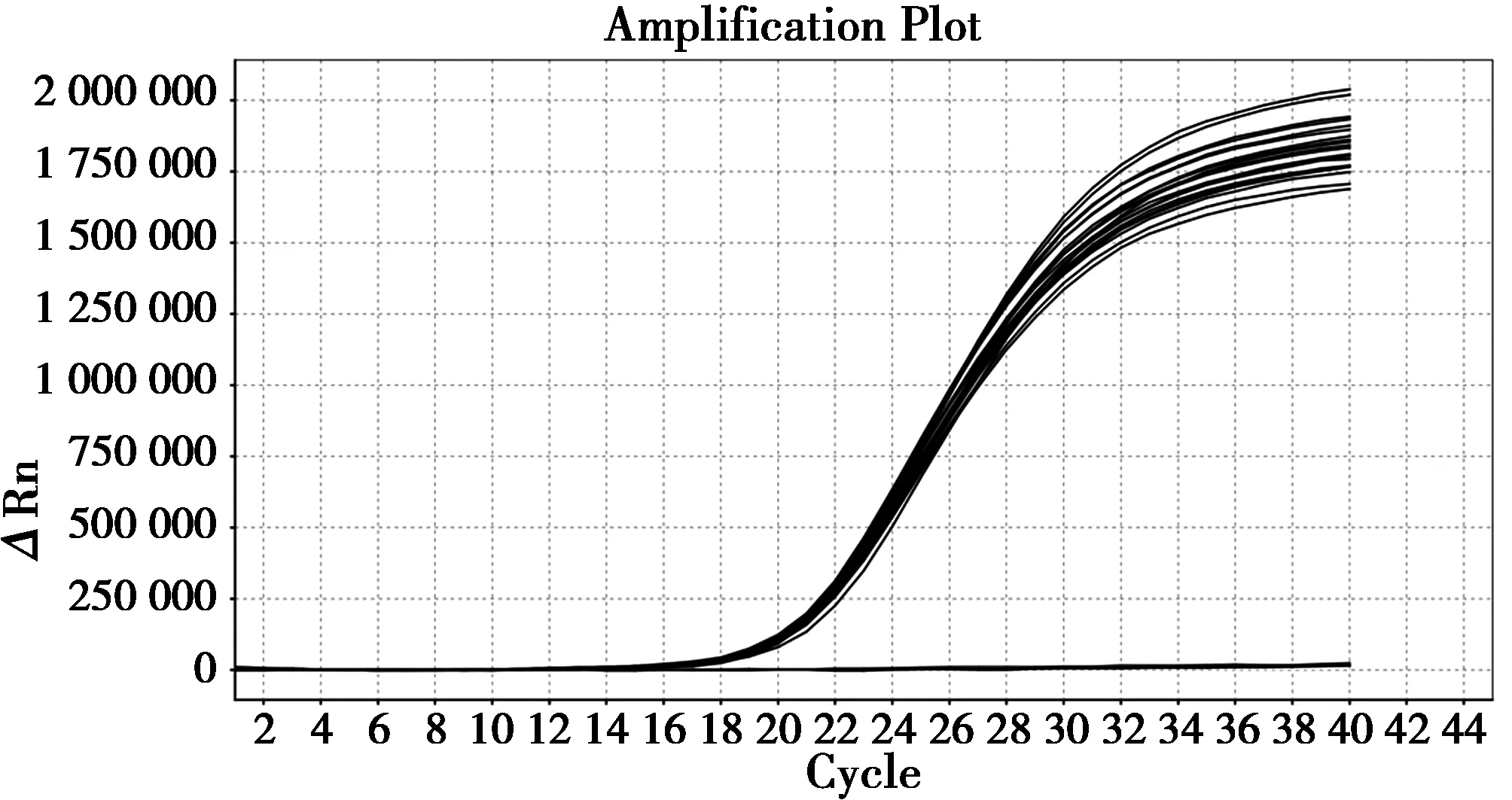
图7 第二次稳定性试验结果Fig.7 Result of second stability detection
3 讨论
本研究所建立的荧光PCR检测方法在试验中显示出较高的特异性和灵敏度。熊属4个物种共15份无关已知个体的样品均产生特异性扩增曲线,样品中包括毛发、粉末和肉罐头,且Ct值≤26,已具备检测痕量样品和加工产品的能力。包括多种常见哺乳动物和人类DNA在内的11种共20份对照样品均未产生特异性扩增曲线,可充分排除检测过程中的环境或样品污染对检测结果造成影响的可能性。荧光PCR方法检测重组质粒的最低检出值为10个拷贝数量级,已接近检测极限。荧光PCR方法检测已知痕量样品的最低稀释倍数为106,综合考虑样品的纯度、有效DNA片段等因素,该灵敏度已充分满足对痕量样品的检测需求。此外,2次稳定性试验的统计分析结果显示批内和批间变异系数均小于2%,具有高度的稳定性。
本研究的前期规划旨在设计一种能够对现有熊科物种进行鉴定的方法,故所建立的方法中引物和探针的设计源于现有熊科物种线粒体DNA(mtDNA)序列,但后续的落实中发现,熊科物种分布广泛,且多数为保护动物,样品的收集难度大,全科8个物种仅熊属的所有4个物种能够收集得到,其余4个物种尚无相应样品。
综上,本研究所建立的方法适用于熊科中熊属动物及其产品的熊源性成分鉴定,并充分具备检测痕量样品和加工产品的能力。本研究所建立的方法对熊科中其余各属的鉴定是否同样有效,有待后续广泛的样品收集和试验验证。
[1] BOLD Systems [EB/OL].[2017-05-03].http://www.boldsystems.org/index.php/TaxBrowser_Taxonpage?taxid=1408.
[2] Durnin M E,Palsboll P J,Ryder O A.A reliable genetic technique for sex determination of giant panda (Ailuropodamelanoleuca) from non-invasively collected hair samples[J].Conservation Genetics,2007,8(3): 715-720.
[3] 鲁再丰.熊科物种DNA编码与系统发育关系研究[D].哈尔滨:东北林业大学,2010.
[4] Peppin L,Mcewing R,Carvalho G R,et al.A DNA-Based approach for the forensic identification of asiatic black bear (Ursusthibetanus) in a traditional Asian medicine[J].Journal of Forensic Sciences,2008,53(6): 1358-1362.
[5] Shahzadi I,Janjua S,Fakhar-I-Abbas F,et al.A universal primer set to amplify the cytochrome c oxidase subunit I gene in bears[J].Ursus,2014,25(1): 74-78.
[6] Swenson J E,Taberlet P,Bellemain E.Genetics and conservation of European brown bearsUrsusarctos[J].Mammal Review,2011,41(2): 87-98.
[7] Yasukochi Y,Kurosaki T,Yoneda M A.Identification of the expressed MHC class II DQB gene of the Asiatic black bear,Ursusthibetanus,in Japan[J].Genes & Genetic Systems,2010,85(2): 147-155.
[8] Yamamoto K,Tsubota T,Komatsu T,et al.Sex identification of Japanese black bear,Ursusthibetanusjaponicus,by PCR based on amelogenin gene[J].Journal of Veterinary Medical Science,2002,64(6): 505-508.
[9] Bidon T,Frosch C,Eiken H G,et al.A sensitive and specific multiplex PCR approach for sex identification of ursine and tremarctine bears suitable for non-invasive samples[J].Molecular Ecology Resources,2013,13(3): 362-368.
[10] Pages M,Maudet C,Bellemain E,et al.A system for sex determination from degraded DNA: a useful tool for palaeogenetics and conservation genetics of ursids[J].Conservation Genetics,2009,10(4): 897-907.
[11] 高建伟.应用微卫星 DNA 标记对延边圈养黑熊进行亲子鉴定和遗传多样性研究[D].延吉:延边大学,2012.
[12] 李家鹏,乔晓玲,田寒友,等.食品和饲料中动物源性成分检测技术研究进展[J].食品科学,2011,32(9):340-347.
[13] 徐君怡,曹际娟,王秋艳,等.SYBR Green Ⅰ实时荧光PCR检测鉴定狮制品[J].野生动物,2010,31(4):171-174.
Ursus;Derived ingredients;Real-time PCR;Detecting
Detection of Ursus-Derived Ingredients by TaqMan Probe Fluorescent PCR
Shao Jianhong Luo Baozheng Bo Qingru*Zhao Fuzhen Tie Lisha Xu Hainie Liao Xiuyun Peng Yufen Chen Jing
(Zhuhai Entry-Exit Inspection & Quarantine Bureau,Zhuhai,519015,China)
To establish the TaqMan fluorescent PCR method for detectingUrsus-derived ingredients,specific primers and a Taqman probe were designed using software Primer Express 3.0.The sequence of the primers and probe were based on mitochondrial DNA sequence of Ursidae.Our results indicated high specificity,high sensitivity and high stability.The specific amplification curve only occurred in 15 ursine samples,while all of 20 negative samples showed no amplification curve.The minimum detectable amount of recombinant plasmid DNA was 10 copies,and the DNA in theUrsusthibetanusbile powder could be amplified even if it was diluted 106times.The intra-assay variation coefficients were 0.88% and 1.13%,and the inter-assay variation coefficient was 1.38% in a duplicate assay of the same samples at different times.The method established in this research can be applied in detectingUrsus-derived ingredients in tissues and related processed products ofUrsus.
2017-01-06
修回日期:2017-07-28
发表日期:2017-11-10
Q523+.8
A
2310-1490(2017)04-575-05
邵建宏,男,34岁,兽医师;主要从事动物物种分子生物学检测方向研究。
*通讯作者:薄清如, E-mail:boqr@tom.com

