满天星染色体制片技术优化及多倍体诱导
黄 磊 ,吴丽芳,何飞飞,杨春梅,余蓉培,单芹丽,阮继伟,汪国鲜,屈云慧
(1.云南大学农学院,云南 昆明 650091;2. 玉溪云星生物科技有限公司,云南 玉溪 653100;3. 云南省农业科学院花卉研究所/国家观赏园艺工程技术研究中心,云南 昆明 650205)
满天星染色体制片技术优化及多倍体诱导
黄 磊1,吴丽芳2*,何飞飞1,杨春梅2,3,余蓉培2,3,
单芹丽2,3,阮继伟2,3,汪国鲜2,3,屈云慧3*
(1.云南大学农学院,云南 昆明 650091;2. 玉溪云星生物科技有限公司,云南 玉溪 653100;3. 云南省农业科学院花卉研究所/国家观赏园艺工程技术研究中心,云南 昆明 650205)
【目的】研究满天星染色体鉴定方法,在对主栽品种进行染色体鉴定的基础上探讨满天星多倍体育种的可行性。【方法】以满天星品种‘云星75’组培苗的根尖和茎尖为试验材料,利用压片法比较不同材料、不同预处理方法对满天星染色体制片效果的影响,并对4个满天星主栽品种进行染色体倍性鉴定,还以二倍体品种‘千万星’为材料进行了多倍体诱导试验。【结果】采用对二氯苯对组培苗茎尖预处理4 h是满天星最适合的染色体制片方法,‘云星75’、‘繁星’、‘日出’为四倍体(4n=68),‘千万星’为二倍体(2n=34);用0.05 %的秋水仙碱浸泡处理‘千万星’茎段48 h,多倍体诱导率最高,可达16 %。【结论】采用染色体加倍技术培育满天星多倍性新品种是可行的。
满天星;染色体;倍性鉴定,多倍体诱导
【研究意义】满天星(GypsophilapaniculataL.)又名圆锥花丝石竹、锥花霞草,系石竹科丝石竹属的双子叶草本植物[1]。花色以白色、粉红色为主,花序为二歧聚伞花序[2],是世界上主要的切花配花种类。由于满天星重瓣栽培品种存在空花粉囊、花粉活力不足、花粉败育等问题,导致采用传统杂交育种技术进行新品种培育受到很大的限制[3],满天星累计通过欧盟申请保护的品种只有78个,与其它花卉每年保护上百个品种相比,相对较少,这与满天星杂交育种难有关。通过多倍体选育获得的品种多具有花器官变大、颜色艳丽、株型较矮、抗逆性好等特点,目前,多倍体育种已广泛应用于兰花、香石竹、马蹄莲、非洲凤仙等观赏植物的育种中[5-14],也有望成为满天星育种的一种重要手段。满天星倍性鉴定、评价和多倍体诱导技术的研究和应用,可为进一步开展满天星倍性育种,获得创新种质提供系统的技术支持。【前人研究进展】石竹科植物染色体普遍较小(2~3 μm),且数目较多,染色体计数和鉴定难度大,国外仅有Vittori[3]等进行过满天星倍性鉴定的报道,国内至今未见满天星染色体鉴定及倍性育种相关研究报道。中国在育种方面,仅见车代弟[10]和赵培飞[4]通过田间无性系芽变选择获得新品种,并报道了通过芽变选育从满天星品种‘百万星’获得新品种‘千万星’。 国内满天星市场流行品种很少,每年仅有4~6个。其中‘千万星’[4],‘日出’和‘云星75’均是通过芽变选育获得。【本研究的切入点】针对国内满天星倍性育种相关技术缺乏,育种技术单一,品种倍性不清等现状,研究建立满天星染色体倍性鉴定和多倍体诱导技术。【拟解决的关键问题】本研究对满天星染色体倍性鉴定材料选择、预处理条件、多倍体诱导剂及浓度进行试验分析,旨在建立满天星染色体倍性鉴定和多倍体育种技术体系,为培育大花型新品种提技术支持。
1 材料与方法
1.1 植物材料
以云南省农业科学院花卉研究所提供的4个满天星品种‘千万星’、‘云星75’、‘繁星’、‘日出’的组培苗为植物材料,组培苗培养条件:光照强度2000~2500 lx,温度(25±2)℃。其中,染色体制片技术研究中所用品种为‘云星75’,多倍体诱导研究品种为‘千万星’。
1.2 染色体制片方法研究
1.2.1 取材部位 分别切取‘云星75’组培苗生长旺盛的茎尖和根尖,长度约为0.5 cm,茎尖要剥离至露出叶原基,根尖取生根培养20 d的主根。
1.2.2 预处理和制片 预处理: 对茎尖和根尖分别预处理,并对预处理方法进行筛选,3种预处理方法分别为0.0005 mol/L 8-羟基喹琳8 h、0.1 %秋水仙素8 h、饱和对二氯苯溶液4 h。制片: 预处理后用清水浸泡30 min,再用卡诺氏固定液I固定24 h(4 ℃)。固定后用清水冲洗3次,加入1 mol/L盐酸溶液,在水浴锅中(60 ℃)酸解10 min,再用水浸泡10~15 min。切取根尖或者茎尖部分约0.2 cm,卡宝品红染色12 min,用45 %乙酸冲洗。
1.2.3 染色体装片观察 在显微镜DW2000下对制备好的染色体装片进行观察,选择分裂相较多的10个视野,统计细胞大小和有丝分裂指数。
1.3 4个满天星主要栽培品种的染色体倍性鉴定
采用本研究1.2中筛选出的满天星最适染色体倍性鉴定方法对‘千万星’、‘云星75’、‘繁星’、‘日出’等4个满天星主要栽培品种进行染色体制片,统计不同品种染色体数目。按照李懋学的鉴定标准[15]在显微镜下找到50个较为清晰的分裂中期细胞,其中85 %以上细胞染色体数目一致,则此结果为此材料染色体数。
1.4 满天星多倍体诱导
以倍性鉴定为二倍体的品种‘千万星’材料,切取无菌苗带节茎段,分别在0.2 %、0.1 %、0.05 %、0.025 %的秋水仙碱溶液(均添加0.05 %二甲基亚砜)中浸泡液24、48、72 h,每处理100个茎段,处理后转接到增殖培养基MS+BA 0.5+NAA 0.1 mg/L中,20 d后统计死亡率(死亡株/总株数),经倍性鉴定后统计变异率(变异株数/总株数)。
2 结果与分析
2.1 不同预处理液对染色体形态影响
通过对‘云星75’茎尖采用不同预处理液处理后染色体形态观察表明:满天星适宜的预处理方法为在饱和对二氯苯溶液中处理4 h。 0.0005 mol/L的8-羟基喹啉中预处理能够较好的显示出染色体缢痕,但是染色体收缩不明显,部分相与粘连(图1A);0.1 %秋水仙素能够明显收缩染色体,但主缢痕和次缢痕不清晰,分散度不好,不利于观察(图1B);用饱和的对二氯苯处理后染色体收缩明显,4 h可以收缩到2~5 μm,且形态清晰、分散良好(图1C)。

表1 茎尖与根尖分生细胞比较
注: *代表数据差异显著 (P<0.05)。
Notes:* represented significant difference between the data (P<0.05).

表2 不同满天星品种的倍性鉴定结果
2.2 茎尖和根尖染色体制片效果比较
从表1可看出,满天星 ‘云星75’茎尖为材料的有丝分裂指数和分生细胞大小均显著高于根尖。茎尖中期细胞分裂相多,有丝分裂指数1.9 %,最高可达到2.4 %,显著高于根尖,且分生细胞大小平均值为25 μm,最大达30 μm,显著大于根尖。茎尖可作为满天星染色体倍性鉴定材料的适宜材料。
2.3 不同品种的染色体倍性鉴定结果
将茎尖材料采用饱和对二氯苯溶液处理4 h,对4个满天星主要栽培品种染色体数目鉴定结果见表2:满天星品种‘云星75’、‘ 繁星’、‘ 日出’的染色体数均2n=4x=68,为四倍体(图2A、2C、2D),‘千万星’的染色体数为2n=2x=34,为二倍体(图2B)。通过鉴定可见,满天星栽培品种中以四倍体为主,只有小花型品种‘千万星’是二倍体。
2.4 多倍体诱导研究结果
2.4.1 不同处理对死亡率和诱导率的影响 从表3可见,秋水仙素浸泡处理的浓度和时间均与死亡率呈正相关,随处理时间和浓度的增加,死亡率明显增加;在处理72 h时,不同浓度(0.025 %~0.2 %)的死亡率达到89 %~100 %,在处理浓度0.2 %时,不同时间(24~72 h)的死亡率达到91 %~100 %。变异率在处理48 h时较好,每个处理均有变异发生,其中以在0.05 %浓度中浸泡48 h,变异率最高,达到16 %。浸泡24 h的只在浓度为0.2 %时,有2 %变异率;浸泡72 h,只有浓度0.025 %时发生变异,有1 %变异率。
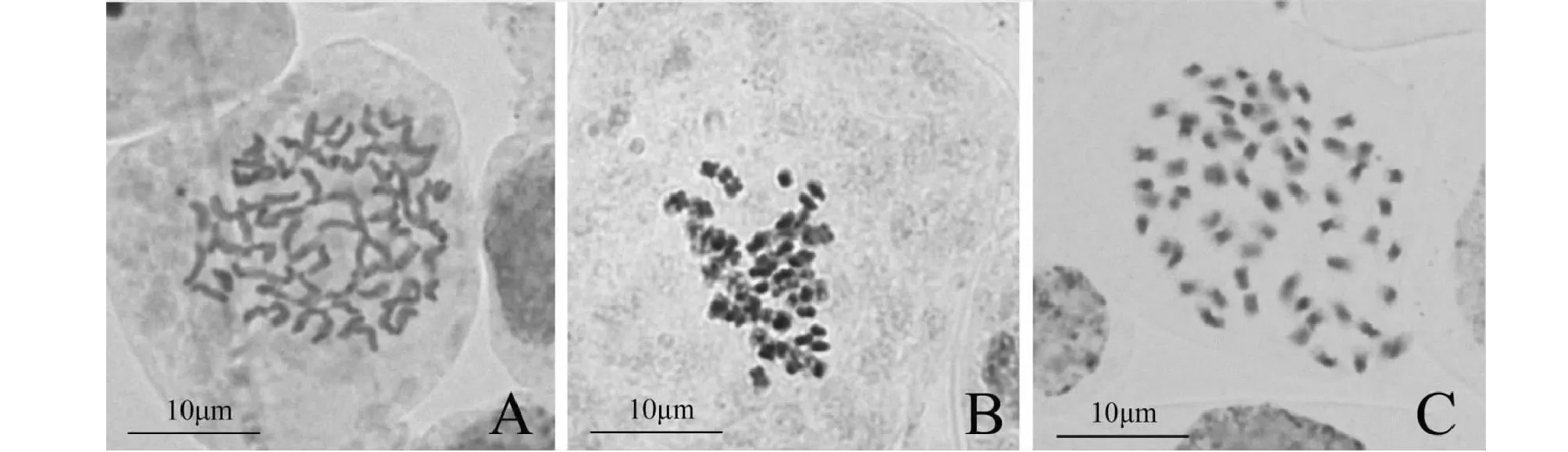
A:0.0005 mol/L 8-羟基喹啉预处理8 h;B:0.1 %秋水仙素处理8 h;C:饱和对二氯苯溶液处理4 hA:Pretreated for 8 h ourswith 0.0005 mol/L 8-hydroxyquinoline;B:Pretreated for 8 h with 0.1 % colchicin;C:Pretreated for 4 h with saturated p-dichlorobenezene图1 不同预处理剂预处理后‘云星75’茎尖中期染色体形态Fig.1 Chromosome morphology of metaphase in stem tips of ‘Yun Xing 75’pretreated by different pretreatment agents
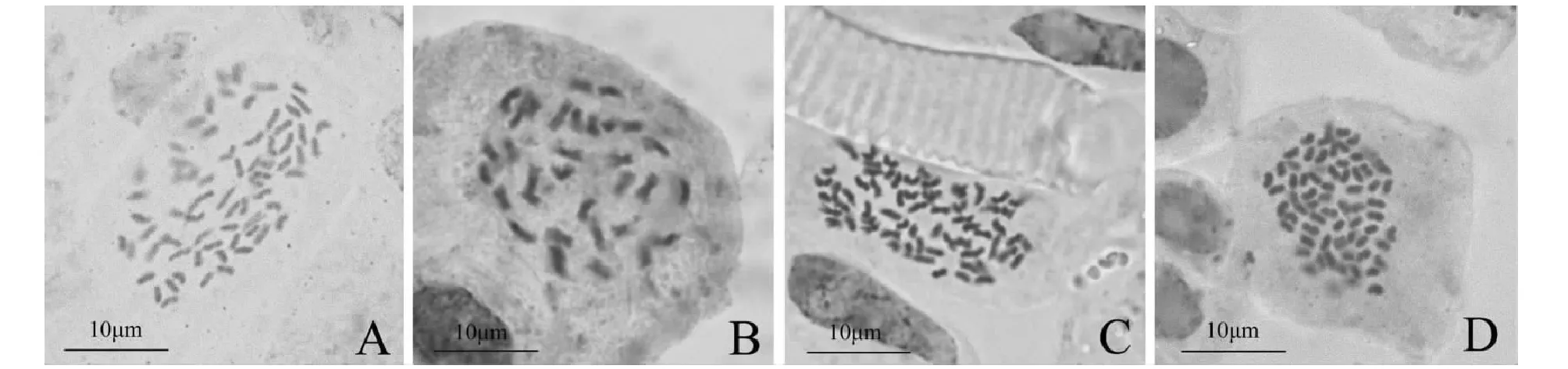
A.‘云星75’2n=68 ;B.‘千万星’2n=34;C.‘繁星’2n=68;D.‘日出’2n=68A.’YunXing 75’2n=68; B.’QianWanxing’2n=34; C.’Fanxing’2n=68; D.’Sunrise’2n=68图2 4个满天星品种的染色体数目Fig.2 The chromosome number of 4 commercial varieties of gypsophila paniculataby
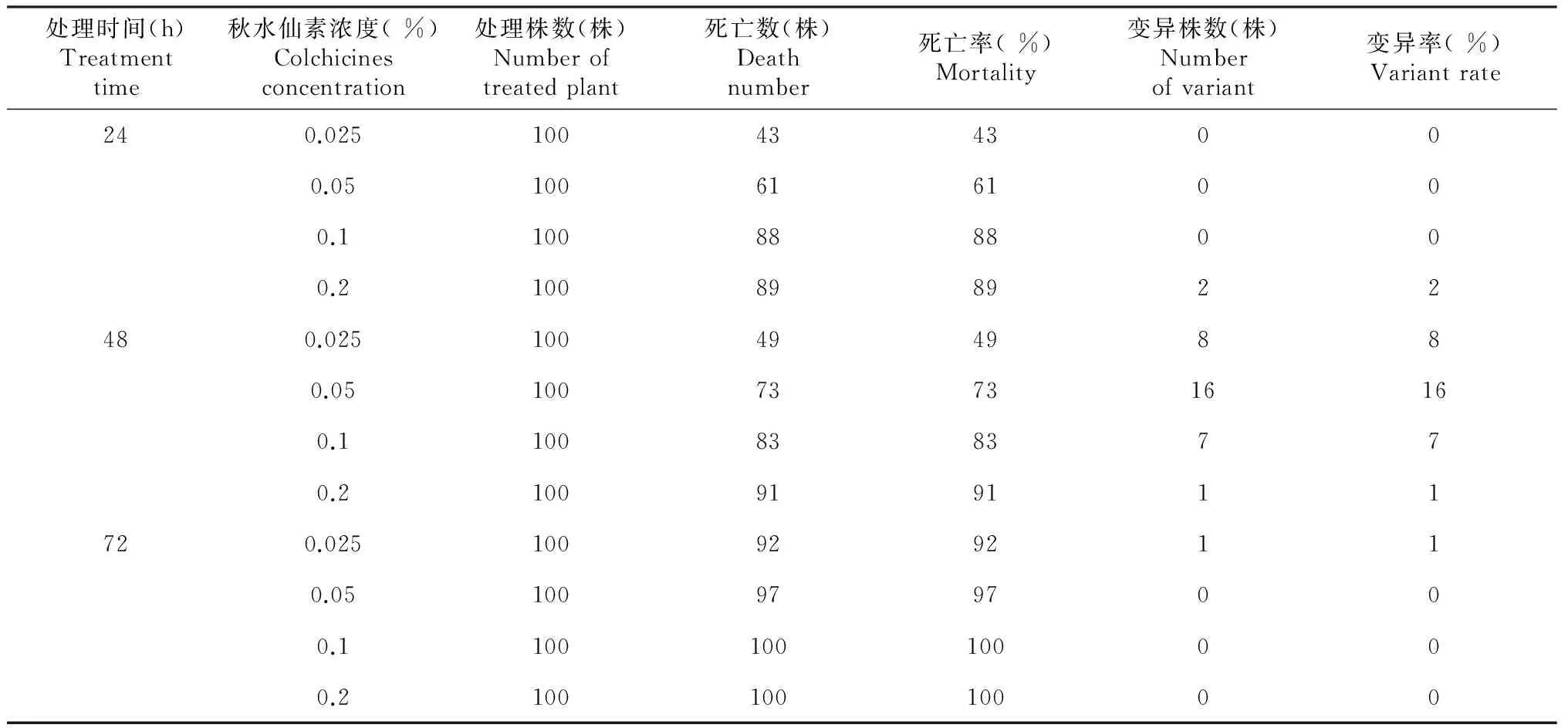
处理时间(h)Treatmenttime秋水仙素浓度(%)Colchicinesconcentration处理株数(株)Numberoftreatedplant死亡数(株)Deathnumber死亡率(%)Mortality变异株数(株)Numberofvariant变异率(%)Variantrate240.0251004343000.051006161000.11008888000.2100898922480.0251004949880.05100737316160.11008383770.2100919111720.0251009292110.051009797000.1100100100000.210010010000
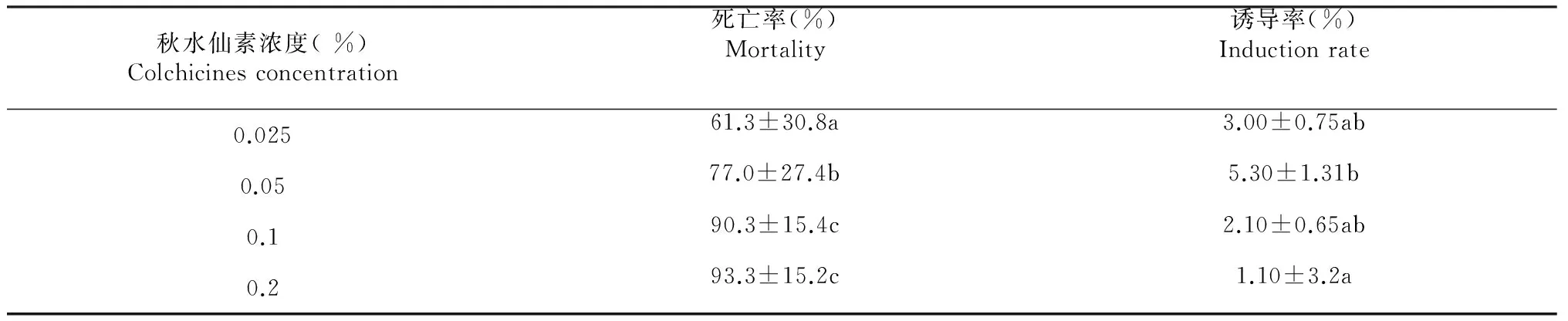
表4 不同处理浓度对死亡率和诱导率的影响
注:相同字母间数据差异不显著。
Notes: The same letter represented insignificant difference between the data.
对秋水仙素处理浓度与死亡率和变异率关系进行方差分析(表4)。材料死亡率在秋水仙素浓度为0.1 %和0.2 %时显著高于浓度为0.05 %,浓度为0.05 %时也显著高于浓度为0.025 %,0.025 %时的平均死亡率最低,为61.3 %。诱导率在浓度为0.05 %时最高,达到5.30 %,显著大于其他浓度处理的诱导率。
浸泡处理24和48 h时,材料死亡率显著低于浸泡72 h(表5)。诱导率则在浸泡48 h时显著高于浸泡24和72 h,为8.00 %。
综上所述,在采用秋水仙素进行满天星加倍诱导时,处理表5浓度为0.05 %,处理时间为48 h时,处理的组合死亡率适中,变异率最高。
2.4.2 变异材料形态评价 通过对形态变异植株叶片长、叶宽和节间长度进行测量,并进行T检验结果如表6。变异植株与对照植株相比形态变化如图3(A、B、C):叶片长和宽显著变大,节间长度显著变短,节较多且整体株型较矮,叶片颜色较深,叶片数更多。

表5 不同处理时间对死亡率、诱导率的影响
注:相同字母间数据差异不显著。
Notes:The same letter represented insignificant difference between the data.

表6 对照株与变异株形态对照
注:*表示数据差异显著。
Notes:* represented significant difference between the data.
表7 变异植株气孔、保卫细胞和叶绿体数目
注:*代表数据差异显著。
Notes:* represented significant difference between the data.
2.4.3 变异植株气孔特征比较 如表7所示,变异植株保卫细胞宽、保卫细胞长、气孔宽度、气孔长度、叶绿体数目都显著高于对照植株。变异植株气孔长度平均值为对照植株的1.86倍。经过秋水仙素处理后的形态变异植株与对照植株相比,保卫细胞更加厚实,气孔面积更大;叶绿体数量增加、且颜色更深、饱满(图4)。
2.4.4 ‘千万星’变异材料染色体鉴定 图5A为对照材料的染色体图片(2n=2x=34),图5B为诱导加倍后的染色体图片(2n=4x=68)。采用秋水仙素诱导处理,可以获得满天星多倍体材料。

A:变异株(左)、对照株(右);B:变异株(左)、对照株(右);C:变异株(左)、对照株(右)A:Variant(left);contrast(right);B:Variant(left),contrast(right);C:Variant(left),contrast(right)图3 对照植株与变异植株形态对比Fig.3 Comparison between contrast and variant traits of Gypsophila paniculata
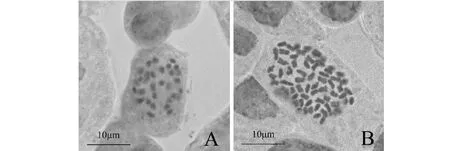
A‘千万星’二倍体;B‘千万星’四倍体A.’QianWanxing’ diploid;B’QianWanxing’ tetraploid图5 ‘千万星’二倍体和四体倍染色体Fig.5 Diploid and tetraploid chromosomes of’QianWanxing’
3 讨 论
通过对满天星不同预处理方法和不同取材部位制片的比较,发现采用对二氯苯处理4 h的满天星茎尖最适合进行染色体制片。杜鹃花科、石竹科等植物中,茎尖也常作为染色体倍性鉴定的材料[16,22]。满天星组培苗根系发达,主根不明显、须根系多,不易获得主根尖,而组培苗生长快速,茎尖分裂活跃,通过本研究结果也看出‘云星75’茎尖的有丝分裂指数和分生细胞大小均显著高于根尖,茎尖细胞中期分裂相多。可能是由于满天星根尖和茎尖由不同生发层分裂而来,其二者的生长活跃程度、营养物质含量等都存在差异[24-25]。
预处理剂既可使染色体缩紧,利于观察,又会抑制微管蛋白组装成纺锤丝,阻止分裂中期细胞进入后期,预处理剂选用对制片效果影响大[17-18]。目前在细胞学研究中,研究者常使用的预处理液主要包括秋水仙素、对二氯苯、8-羟基喹啉和冰水混合物等[19],目的是获得较多中期分裂相,使染色体尽可能分散均匀,有利于进行染色体计数与核型分析。本研究中,‘云星75’组培苗茎尖用饱和的对二氯苯处理4 h后,染色体形态清晰,且分散良好,可作为满天星染色体鉴定预处理液,且饱和对二氯苯溶液具有简单易制、价格低廉、不易使材料染色体加倍等优点[20],已经应用在多种植物的染色体计数中,并且取得了较好效果[21-24]。但是,饱和对二氯苯溶液处理后的染色体缢痕不如用8-羟基喹啉处理明显,不适合进行核型分析的研究[25]。
Vittori等[3]对‘百万星’倍性鉴定表明,其为二倍体(2n=34),品种‘千万星’是‘百万星(Million starts)’的芽变品种[4],虽然‘千万星’在花朵大小、花瓣数上均比 ‘百万星’有所增加,但两者在染色体数目和倍性上仍然保持一致。采用秋水仙素0.025 %~0.05 %处理48 h可诱导多倍体发生,本研究可为满天星的倍性育种提供技术支持。
4 结 论
满天星以茎尖为材料,采用对二氯苯预处理4 h可获得形态清晰、分散良好的染色体;主栽满天星品种‘云星75’、‘繁星’、‘日出’为四倍体(4n=68),‘千万星’为二倍体(2n=34);采用满天星茎段进行0.05 %秋水仙碱诱导处理48 h可获得多倍体材料。倍性育种是满天星新品种培育的另一有效途径。
[1]中国科学院中国植物志编辑委员会 .中国植物志(26卷)[M]. 北京:科学出版社, 1996.
[2]Darwent A L, Coupland R T. Life History of Gypsophila paniculata[J]. Weeds, 1966, 14(4):313-318.
[3]Vittori L, Schiff S, Tani C, et al. Morphological and cytological observations of wild species and hybrids of Gypsophila[J]. Plant Biosystems, 2015(2):322-328.
[4]赵培飞,单芹丽,王继华,等. 满天星新品种‘千万星’[J]. 园艺学报,2011,3807:1421-1422.
[5]蒋淑磊,李志斌,徐立军,等 观赏植物多倍体育种研究进展[J]. 河北林业科技,2015(6):82-85.
[6]吴丽民,陈建青,郑若男,等. 兰花多倍体人工育种研究进展[J]. 海峡药学,2016(8):52-54.
[7]高 静,吴景芝,郭彦兵,等. 多倍体彩色马蹄莲抗寒性初步研究[J]. 热带农业科学,2016(7):53-57+67.
[8]孔 红,王宝增,马建军,等. 秋水仙素诱导非洲凤仙多倍体的研究[J]. 贵州农业科学,2015(12):161-163.
[9]段九菊,张 超,贾民隆,等. 秋水仙素诱导矮牵牛四倍体的研究[J]. 山西农业科学,2016(7):951-953+976.
[10]车代弟,樊金萍.满天星新品系的选育[J].北方园艺,2002(5): 56-57.
[11]石 佳.南高丛越橘(Vacciniumaustrale)四倍体诱导及鉴定[D].西南大学,2012.
[12]何策熙. 无性繁殖植物的顶端分生组织及其诱发突变的显现[J]. 核农学通报, 1987(1):38-40.
[13]周玉丽,任士福,张成合.连翘多倍体诱导与鉴定[J].河北农业大学学报,2011(1):73-77.
[14]陶俊锋.腋花杜鹃再生体系建立和多倍体诱导及鉴定[D].云南农业大学,2014.
[15]李懋学,陈瑞阳. 关于植物核型分析的标准化问题[J]. 武汉植物学研究,1985(4):297-302.
[16]Kromer K, Gamian A. Analysis of Soluble Carbohydrates, Proteins and Lipids in Shoots of M 7 Apple Rootstock Cultured in vitro,during Regeneration of Adventitious Roots[J]. Journal of Plant Physiology, 2000, 156(6):775-782.
[17]林秀琴, 蔡 青, 陆 鑫,等. 甘蔗根尖染色体制片技术研究[J]. 中国农学通报, 2011, 27(27):104-108.
[18]江力榕, 陈 沁, 刘文轩. 预处理对辣椒根尖细胞染色体制片的影响[J]. 上海大学学报自然科学版, 2005, 11(4):427-430.
[19]尹丽莎,陈 杰,周 军,等.滇杨根尖细胞染色体制片技术优化[J].南方农业学报,2015,46(7):1253-1258.
[20]李懋学. 对二氯苯在植物染色体预处理中的应用[J]. 遗传, 1980, 2(6):30-32.
[21]Liu Y J, Li M Y, Zhang T, et al. Polyploidy induction and identification inLiliumformosanum×Liliumlongiflorumvar.scabrum.[J]. Journal of Yunnan Agricultural University, 2009,24(6):859-864.
[22]赛尔兰·热合买提, 萨娜瓦尔·艾比布拉, 陈全家,等. 不同预处理对鹰嘴豆根尖细胞染色体制片的影响[J]. 生物学通报,2014,49(4):47-49.
[23]周旭红, 桂 敏, 夏 晶,等. 利用子房壁鉴定香石竹染色体数目的研究[J]. 江西农业学报, 2010, 22(1):61-63.
[24]Wang X H, Xiong L, Qu Y H, et al. The ployploid induction and identification ofPlatycodongrandiflorus(Campanulaceae) in China[J]. Acta Botanica Yunnanica, 2006, 28:593-598.
[25]宋新红.紫薇多倍体的诱导、鉴定及内多倍性[D].山东农业大学,2012.
[26]侯 睿,岳福良,张小红, 等.EMS诱变对花生油酸、蛋白质含量的影响[J].西南农业学报,2016,49(6):1245-1249.
OptimizationofChromosomeSectioningTechniqueandPolyploidyInductioninGypsophilapaniculata
HUANG Lei1, WU Li-fang2*,HE Fei-fei1, YANG Chun-mei2,3, YU Rong-pei2,3, SHAN Qin-li2,3, RUAN Ji-wei2,3, WANG Guo-xian2,3, QU Yun-hui3*
(1.College of Agriculture, Yunnan University,Yunnan Kunming 650091, China; 2.Yuxi Yunxing Biotech Co.,Ltd, Yunnan Yuxi 653100, China;3.Flower Research Institute, Yunnan Academy of Agricultural Sciences, Yunnan Kunming 650205, China)
【Objective】The purpose of this research was to study the identification method of chromosome number forGypsophilapaniculata, and explore the possibility of polyploidy breeding based on the identification of chromosome number for currently cultivated cultivars. 【Method】The root tips and stem tips of in vitro plantlets ofgypsophilapaniculata‘Yun Xing 75’were used as materials to study the effects of different plant materials and pretreatment methods on the chromosomes sectioning by squashing technique, then identification of chromosome ploidy for 4 cultivars ofgypsophilapaniculatawas conducted. Moreover,gypsophilapaniculata‘Qian Wan Xing’, a diploid cultivar, was used as materials to conduct the polyploidy induction. 【Result】The results showed that the in vitro plantlet stem tips pretreated with p-dichlorobenzene for 4 hours was an optimal method for chromosome sectioning ofgypsophilapaniculata. ‘Yun Xing 75’,‘Fan Xing’and‘Ri Chu’ were tetraploid (4n=68) , and ‘Qian Wan Xing’ was diploid (2n=34). With the method that stem segments of ‘Qian Wan Xing’ were soaked with 0.05 % colchicine for 48 hours, polyploidy induction rate was highest, reaching to 16 %. 【Conclusion】Polyploidy breeding was reasonable forgypsophilapaniculataby chromosome doubling.
Gypsophilapaniculata; Chromosome; Ploidy identification; Polyploidy induction
1001-4829(2017)10-2327-07
10.16213/j.cnki.scjas.2017.10.028
2016-06-10
中央财政农业技术推广与服务补助资金项目(云财农[2016]158号);云南省科技计划项目(20161A001);云南省重大专项(农业)(2016ZA005)
黄 磊(1992-),男,研究生,从事花卉育种研究,E-mail:282950707@qq.com,*为通讯作者:吴丽芳,E-mail:568306407@qq.com;屈云慧,E-mail: quiyunhui404@163.com。
S682.3
A
(责任编辑 王家银)

