肝血管肉瘤和血管瘤的CT影像特点对比
河南省驻马店市中心医院放射科
(河南 驻马店 463000)
王 赢 代向党 乔继红
肝血管肉瘤和血管瘤的CT影像特点对比
河南省驻马店市中心医院放射科
(河南 驻马店 463000)
王 赢 代向党 乔继红
目的探讨肝血管肉瘤和血管瘤的CT影像特点。方法选取我院2015年2月-2017年5月收治的6例肝血管肉瘤患者和14例肝血管瘤患者为研究对象。所有患者行腹部螺旋 CT 平扫和动态增强扫描。结果26个肝血管肉瘤在增强早期表现为周边强化38.46%,非周边强化61.54%。38个肝脏血管瘤在增强早期表现为非周边强化23.68%,周边强化76.32%。肝血管肉瘤和肝血管瘤早期强化CT强化位置比较存在显著性差异(P<0.05)。26个肝血管肉瘤在增强早期表现为片状强化形态65.38%,结节状强化形态34.62%。38个肝脏血管瘤在增强早期表现为片状强化形态60.53%,结节状强化形态39.47%。肝血管肉瘤和肝血管瘤早期强化CT强化形态比较无显著性差异(P>0.05)。肝血管肉瘤和肝血管瘤伴瘤周动静脉短路者分别占53.85%和15.79%,比较存在显著性差异(P<0.05)。结论肝血管肉瘤主要表现为非周边强化、动静脉短路,而肝脏血管瘤主要表现为周边强化,动静脉短路较为少见。非周边性强化和动静脉短路的强化模式对于鉴别肝血管肉瘤和肝血管瘤具有重要意义。
肝血管肉瘤;肝血管瘤;CT
肝血管肉瘤(PHA)是一种较为罕见的间质性肝脏恶性肿瘤,其发生率仅为0.5%~1.5%[1]。肝血管瘤(HHE)是一种常见的肝脏良性肿瘤,属于血管的先天性畸形,其发生率约为0.4%~7.3%[2]。肝血管肉瘤和肝血管瘤两种肿瘤性质完全不同,有着不同的治疗方法和预后,但由于缺乏特异性的诊断指标,且二者影像表现类似,导致临床误诊率较高[3-4]。为了提高对肝血管肉瘤的认知水平,提高临床诊断率,本研究对我院2015年2月~2017年5月收治的肝血管肉瘤和肝血管瘤的CT临床资料进行回顾性分析,现报告如下。
1 资料与方法
1.1 临床资料选取我院2015年2月~2017年5月收治的6例肝血管肉瘤患者和14例肝血管瘤患者为研究对象。纳入标准:均经病理证实为肝血管肉瘤或肝血管瘤;行腹部螺旋CT平扫和动态增强扫描。排除标准:合并肝脏其他肿瘤者。肝血管肉瘤患者6例肝血管肉瘤患者中男4例,女2例;年龄36~72岁,平均(53.6±12.9)岁;4例上腹疼痛,2例饮酒后呕血现象,6例患者中均无肝硬化和肝炎病史,2例存在体重减轻的现象,1例肺部转移,1例胸椎转移。14例肝血管瘤患者中男9例,女5例;年龄32~78岁,平均(56.2±11.7)岁;7例无明显症状,4例肝区胀痛,6例上腹不适。
1.2 CT检查采用GE Lightspeed VCT 16层螺旋CT机行上腹部检查。检查前患者空腹4h以上,饮水600ml充盈上消化道。患者取仰卧位,足先进,双上肢上举抱头。均行CT平扫和增强扫描。对比剂采用碘海醇,规格:350mg I/mL(50ml:15g(I),通用电气药业(上海)有限公司),采用德国Ulrich高压注射器自肘正中静脉注射,剂量为1.2~1.5mL/Kg,注射流速为3.0~3.5mL/s。延迟20~30s行动脉期扫描,40~50 s行静脉期扫描,120~180s行延迟期扫描。扫描参数:120kV,240~350mA,层间距5mm,层厚5mm。
1.3 图像后处理及数据分析扫描完成后将扫描所得原始数据传入ADW4.6工作站,由两位有10年以上工作经验的影像诊断医师阅片分析,着重观察肿瘤密度、形状、大小、有无出血、有无钙化或坏死等情况。意见不一致时,经二者协商取得一致意见。
1.4 统计学分析统计分析所有资料采用SPSS 20.0进行分析处理。计数资料采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 强化位置26个肝血管肉瘤在增强早期表现为周边强化38.46%,非周边强化61.54%。38个肝脏血管瘤在增强早期表现为非周边强化23.68%,周边强化76.32%。肝血管肉瘤和肝血管瘤早期强化CT强化位置比较存在显著性差异(P<0.05)。见表1和图1-5。
2.2 强化形态26个肝血管肉瘤在增强早期表现为片状强化形态65.38%,结节状强化形态34.62%。38个肝脏血管瘤在增强早期表现为片状强化形态6 0.5 3%,结节状强化形态39.47%。肝血管肉瘤和肝血管瘤早期强化CT强化形态比较无显著性差异(P>0.05)。见表2。
2.3 动静脉短路肝血管肉瘤和肝血管瘤伴瘤周动静脉短路者分别占53.85%和15.79%,比较存在显著性差异(P<0.05)。见表3。
3 讨 论
血管肉瘤是血管内皮细胞肉瘤的简称,是一种由血管内皮细胞发生的恶性肿瘤。原发于肝脏血管肉瘤较为少见,肝血管肉瘤又称肝恶性血管内皮瘤、肝血管内皮肉瘤和Kupffer细胞肉瘤,目前其病因及发病机制尚不明确,可能与长期接触氯乙烯、二氧化钍、砷剂,既往放疗、合成激素等有关[5-6]。相对而言,肝血管瘤则更为常见,组织学上可分为海绵状血管瘤、毛细血管瘤、血管内皮细胞瘤和硬化性血管瘤四型,以海绵状血管瘤最常见。多数肝血管瘤无自觉症状和体征,通常在体检时发现[7-8]。虽然肝血管肉瘤和肝血管瘤治疗方案和预后存在很大的不同,但二者均是富血供的血管源性肝肿瘤,其影像学表现存在一定的交叉性,容易导致误诊。
肝血管肉瘤肿瘤细胞沿原有的血管腔隙生长,生长于肝窦内,破坏肝细胞和肝板,形成大小不等的管腔,腔内肿瘤细胞碎片或凝血[9]。因此,肝脏血管肉瘤往往伴有多个多种形态的肝内血管腔。本研究结果显示,26个肝血管肉瘤在增强早期表现为周边强化38.46%,非周边强化61.54%;38个肝脏血管瘤在增强早期表现为非周边强化23.68%,周边强化76.32%。肝血管肉瘤和肝血管瘤早期强化CT强化位置比较存在显著性差异(P<0.05)。可见,肝血管肉瘤主要表现为非周边强化,而肝脏血管瘤主要表现为周边强化。这主要是由于CT影像增强早期,对比剂快速进入肝血管肉瘤血管腔内,表现为非周边强化[10]。有研究显示,肝血管肉瘤增强扫描可见动脉期病灶中心和周边明显不均匀强化,周边强化常呈花边状,强化程度高于肝实质而低于腹主动脉[11]。而肝脏血管瘤的主要由血窦和血窦壁构成,血窦大小、形状、壁厚薄差异较大,厚壁内有较多的纤维细胞和胶原纤维,血管腔很小,薄壁型的壁内可见少量成纤维细胞和胶原纤维,血管腔隙很大,血液缓慢流动,因此肝脏血管瘤主要表现为周边强化[12]。

表1 肝血管肉瘤和肝血管瘤早期强化CT强化位置比较

表2 肝血管肉瘤和肝血管瘤早期强化CT强化形态比较

表3 肝血管肉瘤和肝血管瘤早期强化CT动静脉短路比较
本组数据显示,肝血管肉瘤和肝血管瘤伴瘤周动静脉短路者分别占53.85%和15.79%,肝血管肉瘤伴瘤周动静脉短路比例显著高于肝血管瘤(P<0.05),表明动静脉短路是肝血管肉瘤的特征性增强表现之一,可与肝血管瘤进行区分。而肝血管肉瘤和肝血管瘤早期强化CT强化形态比较无显著性差异(P<0.05),因此强化形态不能作为鉴别肝脏血管肉瘤和肝血管瘤的依据,与文献[4,13-15]报道一致。
综上所述,肝血管肉瘤主要表现为非周边强化、动静脉短路,而肝脏血管瘤主要表现为周边强化,动静脉短路较为少见。因此,非周边性强化和动静脉短路的强化模式对于鉴别肝血管肉瘤和肝血管瘤具有重要意义。
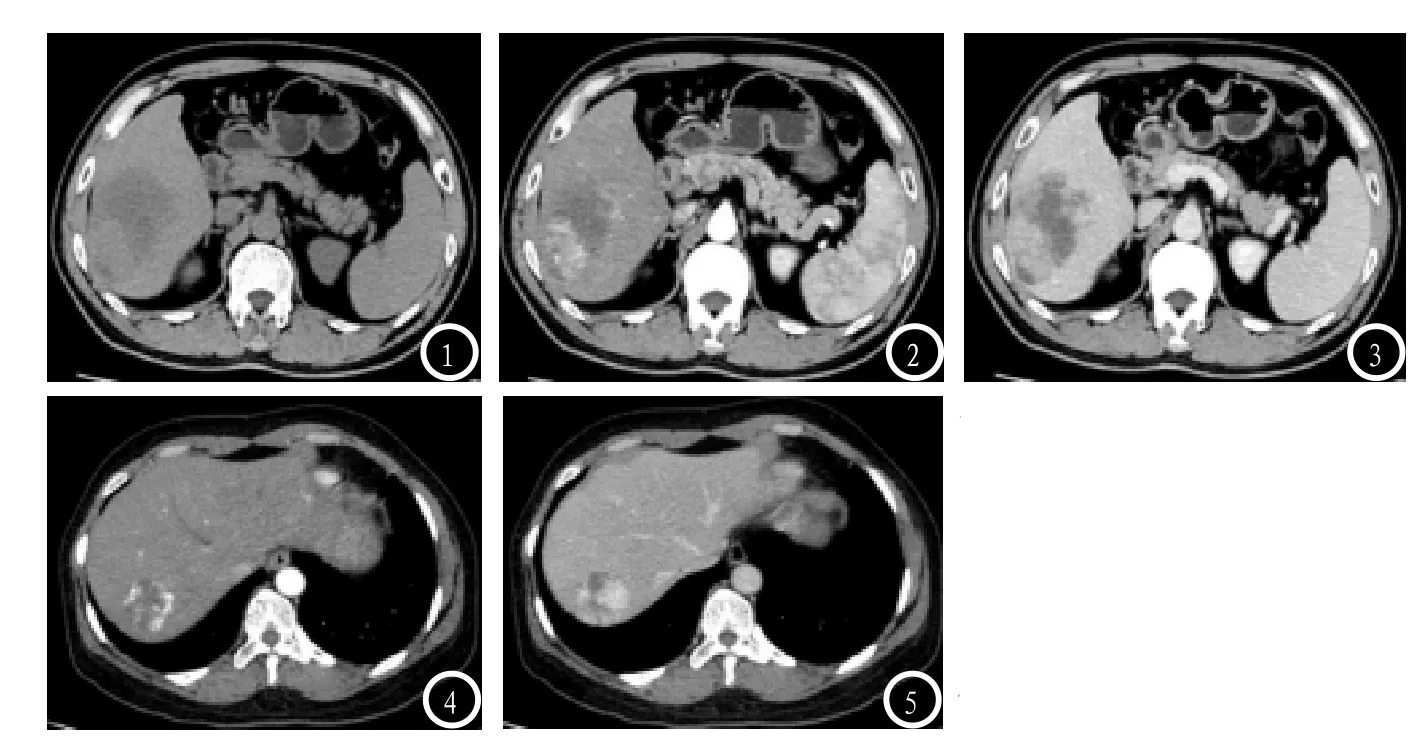
图1-5 肝血管肉瘤和肝血管瘤CT表现(图1:肝血管肉瘤平扫示肝右叶大片状低密度影;图2:肝血管肉瘤增强扫描见片状强化;图3:肝血管肉瘤延迟期强化部分密度减低;图4-5肝血管瘤动脉期边缘结节样强化)。
[1] Pickhardt P J,Kitchin D,Lubner M G,et al.Primary hepatic angiosarcoma:multiinstitutional comprehensive cancer centre review of multiphasic CT and MR imaging in 35 patients[J].European radiology,2015,25(2):315-322.
[2] Duran R,Ronot M,Di Renzo S,et al.Is magnetic resonance imaging of hepatic hemangioma any different in liver fibrosis and cirrhosis compared to normal liver[J].European journal of radiology,2015,84(5):816-822.
[3] 贾翠宇,赵大伟,王欣欣.肝脏海绵状血管瘤的不典型影像表现及病理对照[J].临床放射学杂志,2016,35(5):732-735.
[4] 赵德利,张金玲,姜慧杰,等.动态增强CT在鉴别诊断肝脏血管肉瘤和血管瘤中的价值[J].放射学实践,2016,31(8):764-767.
[5] Rothweiler S,Dill M T,Terracciano L,et al.Generation of a murine hepatic angiosarcoma cell line and reproducible mouse tumor model[J].Laboratory investigation,2015,95(3): 351.
[6] Wang Z B,Yuan J,Chen W,et al.Transcription factor ERG is a specific and sensitive diagnostic marker for hepatic angiosarcoma[J].World Journal of Gastroenterology:WJG,2014,20(13):3672.
[7] Shen W C,Liang P C,Wu J F,et al.Combined transarterial embolization and propranolol as effective treatment for hepatic hemangioma with Kasabach-Merritt syndrome and heart failure in a neonate[J].Pediatrics & Neonatology,2017,58(2):191-193.
[8] Bhardwaj H,Stephens M,Bhatt M,et al.Prostatespecific membrane antigen PET/CT findings for hepatic hemangioma[J].Clinical nuclear medicine,2016,41(12):968-969.
[9] 张伟,王兰荣,薛鹏,等.原发性肝血管肉瘤的CT和MRI表现[J].临床放射学杂志,2014,16(5):24.
[10]王剑杰,陈燕,蒲朝煜,等.原发性肝血管肉瘤4例PET/CT诊断分析[J].武警医学,2016,27(11):1133-1135.
[11]王亮,傅先水,吕珂,等.原发性肝血管肉瘤的临床及影像学特征[J].中国医学影像技术,2013,29(6):957-961.
[12]李小荣,欧陕兴,彭光明,等.肝细胞癌,肝血管瘤及FNH的双源CT灌注成像对比研究[J].中国CT和MRI杂志,2016,16(12):68-70,117.
[13]Lin J,Bigge J,Ulbright T M,et al.Anastomosing hemangioma of the liver and gastrointestinal tract:an unusual variant histologically mimicking angiosarcoma[J].The American journal of surgical pathology,2013,37(11):1761-1765.
[14]Zhu Y P,Chen Y M,Matro E, et al.Primary hepatic angiosarcoma:a report of two cases and literature review[J].World Journal of Gastroenterology:WJG,2015,21(19):6088.
[15]Wadhwa S,Kim T H,Lin L,et al.Hepatic angiosarcoma with clinical and histological features of Kasabach-Merritt syndrome[J].World journal of gastroenterology,2017,23(13):2443.
(本文编辑: 刘龙平)
Comparison of CT Features of Hepatic Angiosarcoma and Hemangioma
WANG Ying, DAI Xiang-dang, QIAO Ji-hong. Department of Radiology, Zhumadian Central Hospital, Zhumadian 463000, Henan Province, China
ObjectiveTo investigate the CT features of hepatic angiosarcoma and hemangioma.MethodsSix patients with hepatic angiosarcoma and 14 patients with hepatic hemangioma who were treated in our hospital from February 2015 to May 2017 were selected as the study subjects. All patients underwent abdominal spiral CT scan and dynamic enhanced scan. Results26 cases of hepatic angiosarcoma were 38.46% in the early enhancement and 61.54% in the peripheral enhancement. 38 cases of hepatic hemangioma in the early enhancement of non-peripheral enhancement of 23.68%,peripheral enhancement 76.32%, with a significant difference between the two groups (P<0.05). 26 cases of hepatic angiosarcoma in the early enhancement of the performance of lamellar enhanced form of 65.38%, nodular enhancement of 34.62%. 38 cases of hepatic hemangioma in the early enhancement of the performance of sheet-like enhanced form 60.53%, nodular enhancement of 39.47%. There was no significant difference in the enhancement of CT enhancement between hepatic angiosarcoma and hepatic hemangioma (P>0.05). Hepatocellular sarcoma and hepatic hemangioma with peritumoral venous short circuit were 53.85% and 15.79%, there was significant difference (P<0.05).ConclusionHepatic angiosarcoma is mainly composed of non - peripheral enhancement,arteriovenous short circuit, and hepatic hemangioma mainly for peripheral enhancement,arteriovenous short circuit is rare. Non-peripheral enhancement and arteriovenous short circuit of the enhanced model for the identification of hepatic hemangiaroma and hepatic hemangioma is of great significance.
Hepatic Sarcoma; Hepatic Hemangioma; CT
R735.7;R445.3
A
10.3969/j.issn.1672-5131.2017.11.022
王 赢
2017-09-25