运用无创容量指标评价儿童先天性心脏病术后液体反应性*
程玉薇, 许 峰, 李 静△
重庆医科大学附属儿童医院 1急诊科 2重症医学科,3儿童发育疾病研究教育部重点实验室,4儿科学重庆市重点实验室,5重庆市儿童发育重大疾病诊治与预防国际科技合作基地,重庆 400014
*重庆市卫生局项目(渝卫科教(2013)39号文)
运用无创容量指标评价儿童先天性心脏病术后液体反应性*
程玉薇1,3,4,5, 许 峰2,3,4,5, 李 静2,3,4,5△
重庆医科大学附属儿童医院1急诊科2重症医学科,3儿童发育疾病研究教育部重点实验室,4儿科学重庆市重点实验室,5重庆市儿童发育重大疾病诊治与预防国际科技合作基地,重庆 400014
目的运用连续多普勒超声心排量监测仪(ultrasonic cardiac output monitor,USCOM)对先天性心脏病(先心病)术后患儿液体治疗前后进行血流动力学监测,比较血流动力学指标如中心静脉压(central venous pressure,CVP)、每搏量变异度(stroke volume variation,SVV)、校正血流时间(corrected flow time,FTc)及肌力指数(smith madigan inotropy index,SMII)等预测先心病术后患儿液体反应性的准确性。方法应用USCOM对先心病术后患儿进行液体治疗前后血流动力学的监测。根据液体治疗前后的每搏输出量指数(stroke volume index,SVI)计算每搏输出量指数变化率(ΔSVI),根据正性肌力药物的使用情况计算出正性肌力药物评分(inotropic scores,IS)。定义液体治疗后ΔSVI≥15%为液体治疗有反应组,<15%为液体治疗无反应组;根据正性肌力药物的使用情况分亚组:IS≤10组及IS>10组。结果①全部患儿中仅SVV的ROC曲线下面积(area under the ROC curve,AUC)具有评估液体反应性的价值(AUC为0.776,P<0.01);②亚组中:IS≤10组及IS>10组中也表现为仅SVV的AUC具有评估液体反应性的价值(AUC分别为0.732,P<0.05及0.813,P<0.01)。结论①用USCOM监测的SVV可以预测先心病术后的液体反应性,而CVP、FTc及SMII均不能准确预测先心病术后的液体反应性;②亚组中,IS>10组SVV预测液体反应性的准确性要高于IS≤10组。
先天性心脏病; 超声心排血量监测仪; 每搏量变异度; 校正血流时间; 中心静脉压
液体复苏是先天性心脏病(先心病)术后血流动力学不稳定患儿的首选治疗方式,但患儿心功能往往会使液体复苏受到限制。有研究显示,重症监护室内血流动力学不稳定的患者中,只有接近一半的患者能通过液体复苏增加搏出量[1]。据统计,美国每年由于液体治疗不恰当导致外科手术术后患者死亡例数约27万,其中有50%以上是可以避免的[2]。因此寻找能够准确评估液体反应性的心脏前负荷指标在指导液体复苏治疗中显得尤为重要。
多年的研究显示,目前临床上传统的容量负荷指标——中心静脉压(central venous pressure,CVP)预测液体反应性的准确性并没有想象中理想[3]。新的动态前负荷指标如每搏量变异度(stroke volume variation,SVV)被大量研究证实适用于成人多种疾病的液体反应性评估[4-6]。但对于儿童,由于其与成人之间存在生理差异性,SVV能否准确预测儿童液体反应性尚不清楚。且目前临床上尚无应用无创设备监测CVP、SVV、校正血流时间(flow time corrected,FTc)及肌力指数(smith madigan inotropy index,SMII)等前负荷指标评估儿童先心病术后患儿的容量状态和液体反应性的研究。因此,本研究旨在探讨以无创设备监测CVP、SVV、FTc、SMII等来预测先心病术后患儿液体反应性的价值。
1 资料与方法
1.1 研究对象
本研究选择重庆医科大学附属儿童医院重症医学科收治的60例在体外循环+全身麻醉下完成先心病直视手术术后呼吸机辅助通气的患儿,所有患儿符合入选标准及排除标准的限制条件。本研究经重庆医科大学附属儿童医院伦理委员会审批通过。
1.1.1 入选标准 ①单纯室间隔缺损患儿,或合并房间隔缺损、动脉导管未闭、卵圆孔未闭的室间隔缺损患儿,且所有解剖异常均予以外科手术修补;②处于镇静状态,呼吸机辅助呼吸,呼吸机设置为定容模式,潮气量设定在10 mL/kg;PEEP≤5;呼吸频率<30次/min;③液体治疗前后未调整血管活性药物剂量;④无呼吸条件的改变。
1.1.2 排除标准 ①合并有复杂先心病的患儿;②血压进行性下降,伴有心率、血氧饱和度进行性下降不能维持,需立即行胸外按压及用血管活性药物进行抢救的患儿;③术后出现心律失常或带有临时起搏器的患儿;④术后出现腹腔内压过高的患儿;⑤术后压力控制通气或已脱离呼吸机辅助通气的患儿;⑥术后出现皮下气肿的患儿。
1.2 研究方法及分组
所有入选患儿均进行液体复苏治疗1次,时间30 min,所输液体为6%羟乙基淀粉,在临床医生判断患儿无液体复苏治疗禁忌后,予以10 mL/kg液体量输入。分别在液体复苏治疗前后应用无创超声心排出量监测仪(ultrasonic cardiac output monitor,USCOM)进行血流动力学监测。
USCOM操作:患儿在安静或镇静状态下,将探头(直径约1 cm大小)放置胸骨上窝,让波束方向从胸骨后发射角度轻轻朝向患者右臀部,可轻微调节探头方向直至获得最佳血流频谱。仪器中输入患儿身高体重,USCOM便可测得SVV、FTc、SMII值。均由同一位医生使用USCOM在床旁进行无创血流动力学监测。连续监测3次取平均值。所有患儿经锁骨下静脉置入中心静脉导管,测定CVP。
于液体治疗即刻和液体治疗结束后3 min内采集资料,并记录姓名、性别、年龄、体重、患儿液体治疗前后的心率(heart rate,HR)、正性肌力药物使用情况、CVP、每搏输出量指数(stroke volume index,SVI)、SVV、FTc及SMII。计算每搏输出量指数变化率(ΔSVI)及正性肌力药物评分(inotropic scores,IS)。
ΔSVI =(液体治疗结束后SVI-液体治疗前SVI)/液体治疗前SVI×100%
IS=多巴胺×1+多巴酚丁胺×1+氨力农×1+米力农×10+肾上腺素×100+异丙肾上腺素×100
将液体治疗后ΔSVI≥15%定义为液体治疗有反应组,<15%为液体治疗无反应组[3]。
由于本研究所纳入均为先心病术后患儿,无法避免正性肌力药物的使用,为了解正性肌力药物对本研究结果的影响,本研究根据正性肌力药物使用情况,根据IS评分对纳入研究的所有患儿进行分组:分为IS≤10组及IS>10组。
1.3 统计学方法
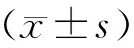
2 结果
2.1 一般临床资料
本研究共纳入患儿63例,资料采集过程中3例因术后并发皮下气肿、心律失常以及临时起搏器等因素予以剔除,剩余有效资料60例,其中男性31例,女性29例;有反应组32例,无反应组28例。两组患儿年龄、性别构成比、体重、IS、体外循环时间(cardiopulmonary bypass time,CPBT)、主动脉阻断时间(aortic cross clamping time,ACCT)的差异均无统计学意义(表1)。
2.2 全体患儿液体治疗前后的血流动力学变化
有反应组和无反应组的液体治疗前HR、SVI、CVP、FTc、SMII差异均无统计学意义。液体治疗前无反应组SVV显著低于有反应组(P<0.05)。有反应组SVI、CVP、FTc及SMII液体治疗后较治疗前增加,而SVV较治疗前降低,差异有统计学意义(均P<0.05)。无反应组SVI及SMII液体治疗后较治疗前增加,SVV较治疗前降低,差异有统计学意义(均P<0.05);而其中HR、CVP及FTc较治疗前的变化无统计学意义(表2)。
术后带正性肌力药物入重症监护室[多巴胺5~10 μg/(kg·min),米力农0.5~0.75 μg/(kg·min),肾上腺素0.01~0.1 μg/(kg·min)],同时给予咪达唑仑镇静、舒芬太尼镇痛,调节血管活性药物保证血流动力学相对稳定,所有患儿均顺利出院,无死亡病例。

表1 纳入患儿的一般临床资料Table 1 General clinical data of included children(±s)
IS:正性肌力药物评分;CPBT:体外循环时间;ACCT:主动脉阻断时间

表2 患儿液体治疗前后的血流动力学资料Table 2 Haemodynamic parameters of included children before and after fluid therapy(±s)
HR:心率;SVI:每搏量指数;CVP:中心静脉压;SVV:每搏量变异度;FTc:校正血流时间;SMII:肌力指数;与无反应组比较,aP<0.05;与液体治疗前比较,bP<0.05
2.3 全体患儿液体治疗前各指标与ΔSVI的相关性分析
利用Pearson相关分析或Spearman等级相关分析对液体治疗前各指标进行相关性分析,发现仅SVV与ΔSVI之间有相关性(P<0.01),相关系数r为0.42,而CVP、FTc、SMII与ΔSVI之间无相关性(均P>0.05),见表3。
2.4 全体患儿ROC曲线评估
CVP、SVV、FTc和SMII预测液体反应性的ROC曲线下面积(表4)分别为:0.508(95%CI:0.358~0.657,P=0.92)、0.776(95%CI:0.656~0.895,P<0.01)、0.446(95%CI:0.300~0.593,P=0.48)和0.350(95%CI:0.210~0.491,P=0.47),说明SVV预测液体反应性的准确性高于其它3个指标,其中SVV=17.04%时预测液体反应性的灵敏度为84.4%,特异度为60.7%。

表3 患儿液体治疗前血流动力学指标与ΔSVI的相关性Table 3 Correlation of the haemodynamic parameters before fuild therapy with ΔSVI in all patients
CVP:中心静脉压;SVV:每搏量变异度;FTc:校正血流时间;SMII:肌力指数;变量服从正态分布用Pearson相关分析;变量不服从正态分布用Spearman等级相关分析
2.5 分IS亚组比较液体治疗前后患儿的血流动力学变化
IS≤10组及IS>10组均表现为液体治疗前HR、FTc与液体治疗后无明显差异(均P>0.05)。而液体治疗前后SVI、CVP、SVV、SMII的差异均有统计学意义(均P<0.01),详见表5。
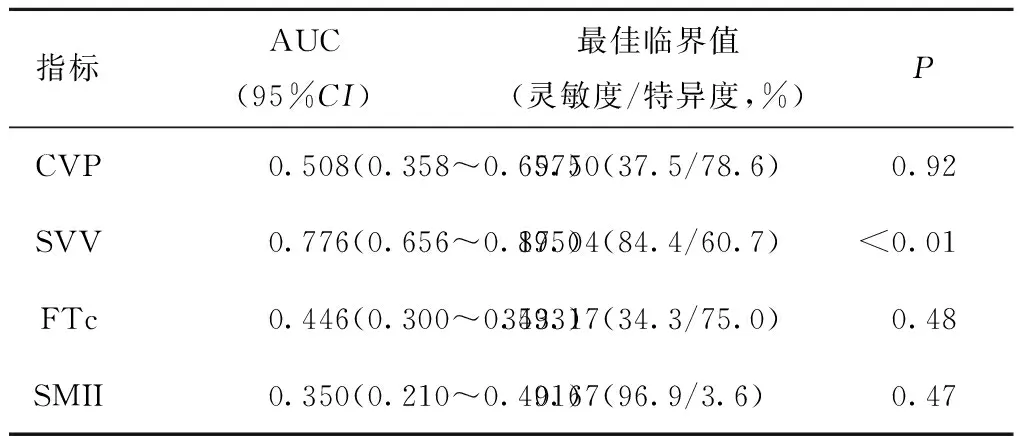
表4 受试者工作曲线(ROC)分析结果Table 4 Results of receiver operating characteristics curve analysis
AUC:曲线下面积;CI:可信区间;CVP:中心静脉压;SVV:每搏量变异度;FTc:校正血流时间;SMII:肌力指数

表5 IS亚组液体治疗前后血流动力学资料比较Table 5 Comparison of hemodynamic data before and after fluid therapy in IS groups(±s)
HR:心率;SVI每搏量指数;CVP:中心静脉压;SVV:每搏量变异度;FTc:校正血流时间;SMII:肌力指数;与液体治疗前比较,bP<0.05
2.6 IS亚组液体治疗前各参数与ΔSVI的相关性分析
IS≤10组,液体治疗前CVP、SVV、FTc、SMII与ΔSVI之间均无相关性(均P>0.05)。而IS>10组中,液体治疗前仅SVV与ΔSVI之间有相关性(r=0.52,P<0.01),而CVP、FTc、SMII与ΔSVI之间无相关性(均P>0.05),详见表6。
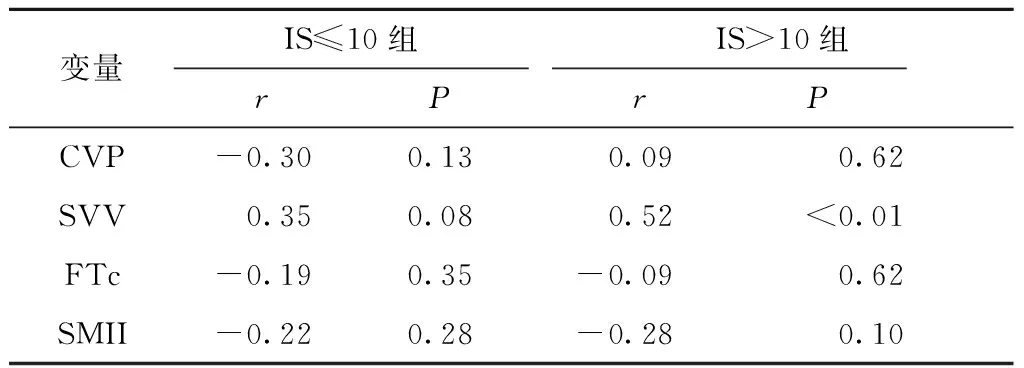
表6 IS亚组液体治疗前血流动力学参数与ΔSVI的相关性Table 6 Correlation of the hemodynamic data before fluid therapy withΔSVI between the IS groups
CVP:中心静脉压;SVV:每搏量变异度;FTc:校正血流时间;SMII:肌力指数;变量服从正态分布用Pearson相关分析,变量不服从正态分布用Spearman’s等级相关分析
2.7 分IS亚组进行ROC曲线评估
结果见 表7。ROC曲线评估IS≤10组患儿CVP、SVV、FTc和SMII曲线下面积分别是:0.524(95%CI:0.283~0.764,P=0.84)、0.732(95%CI:0.526~0.938,P<0.05)、0.554(95%CI:0.327~0.780,P=0.64)和0.345(95%CI:0.124~0.566,P=0.18)。其中SVV=15.62%时预测液体反应性的灵敏度为92.9%,特异度为50%。
ROC曲线评估IS>10组患儿CVP、SVV、FTc和SMII曲线下面积分别是:0.488(95%CI:0.287~0.688,P=0.90)、0.813(95%CI:0.669~0.956,P<0.01)、0.375(95%CI:0.185~0.565,P=0.21)和0.347(95%CI:0.158~0.531,P=0.13)。其中SVV=17.04%时预测液体反应性的灵敏度为88.9%,特异度为62.5%。
3 讨论
CVP是目前临床上最常用的前负荷监测指标。但是由于压力和容积并非线性关系,以压力指标反映前负荷可能受到心率、心肌顺应性及心室间相互作用、胸廓、胸腔内压及肺顺应性等多种因素的影响,因此近年来CVP被用来预测液体反应性的能力受到质疑[7]。而目前临床上更为准确的评估手段多为有创性操作,如脉搏指数连续心搏出量监测(PiCCO)、经食道超声等技术的应用为监测心脏前负荷指标提供更多的选择,但有创性操作也带来了感染、出血、血栓等风险,且有一定的操作难度及专业要求,在儿童患者中的应用受到极大的限制。因此,寻找更准确的利用无创监测设备的评估指标尤为重要。本研究以液体治疗前后ΔSVI≥15%为液体治疗有反应性[3]的标准,结果显示在全部纳入患儿及IS亚组中,CVP与ΔSVI之间无相关性(P>0.05),ROC曲线评估亦显示CVP不能准确地预测液体反应性。这与Renner等[3]的研究结果一致。
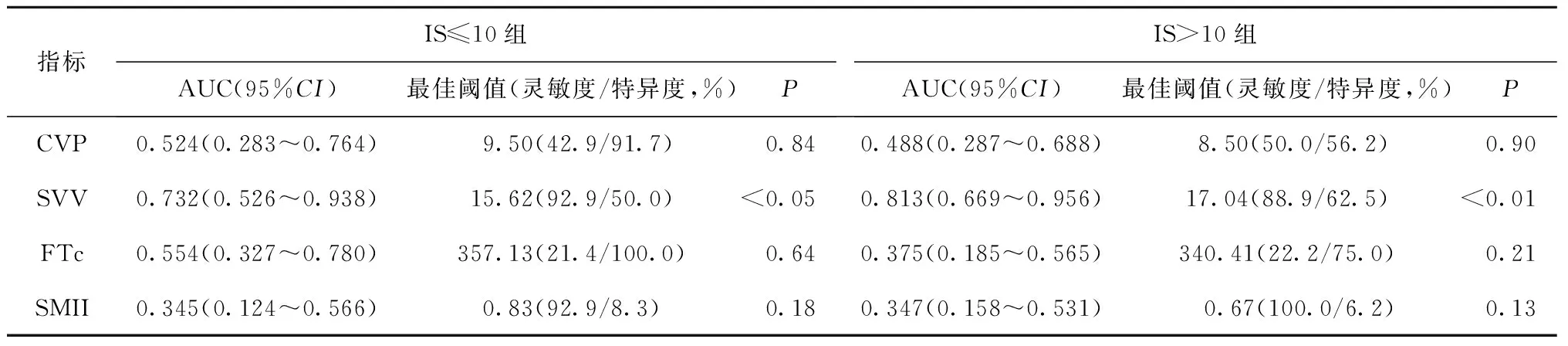
表7 IS亚组受试者工作曲线(ROC)分析结果Table 7 Results of receiver operating characteristics analysis in IS groups
AUC:曲线下面积;CI:可信区间;CVP:中心静脉压;SVV:每搏量变异度;FTc:校正血流时间;SMII:肌力指数
血流时间是心脏产生一个每搏输出量所需的时间,它反映了收缩期的实际时间,校正血流时间(FTc)是将测得的流动时间调整为心率60次/min的数值,以便在不同患者间进行比较。FTc在多年来的研究中仍存在争议,有研究发现,FTc可以作为比CVP等更好的前负荷指标,可以准确地预测液体反应性[8-9],而且有动物实验研究表明与SVV相比,FTc不但可以可靠地反映出血容量不足状态下的液体反应性,还可以反映出血容量过多状态下的液体反应性[10]。本研究结果显示:FTc与ΔSVI之间无显著相关性,而ROC曲线下面积对所有患儿及分IS亚组的评估,表明其均不能预测先心病术后患儿的液体反应性。本研究和既往研究出现矛盾的原因可能是可能是因为FTc作为反映收缩期的实际时间的指标,不仅受到前后负荷的影响,也与心肌收缩力密切相关,本研究纳入对象均为先心病术后患儿,术中直接损伤心肌或者由于体外循环阻断心脏循环所致心脏缺血缺氧及再灌注损伤等因素均可导致心肌收缩不全,从而使得FTc不能准确预测先心病术后患儿的液体反应性。另有研究表明FTc在心衰患者的液体治疗中,也不能准确预测液体反应性[11],和本研究结果相似。
肌力指数(SMII)是一种监测心肌收缩力、衡量心功能的指标,代表心脏动能和势能的总和,可以用于识别正常心功能和心脏收缩功能低下,以及区分低血容量和心肌抑制的原因。液体反应性对于具有较低的SVI的患者是至关重要的,而SMII可以决定低SVI患者对液体治疗是否有反应性。Smith等[12]针对非心源性休克的成人休克患者进行液体复苏治疗发现,当SMII<1.1 W/m2时有94%的患者液体反应性差,需早期使用强心剂,而SMII>1.1 W/m2时则可表现出较好的液体反应性。因此液体反应性的判定需结合SMII,对于SMII<1.1 W/m2的患者需将SMII提升至>1.1 W/m2才可判定其液体反应性。本研究中患儿的SMII均大于1.1 W/m2,但本研究中SMII与ΔSVI无明显相关性,ROC曲线下面积小于0.5,提示本研究中SMII不能准确预测液体反应性。
每搏量变异度(SVV)是利用心肺相互作用机制来评价容量状态、预测液体反应性的功能性指标。根据Frank-Starling定律,每搏输出量(stroke volume,SV)仅在Frank-Starling曲线陡峭上升部分随心室充盈末容积(前负荷)的增加而增加,而在曲线平坦部分,随着前负荷进一步增加,SV变化不大。因此,可以根据SVV来判断目前的容量状态是处于Frank-Starling曲线的陡峭上升部分还是平坦部分,预测液体治疗的反应性[13]。成人领域,在多种疾病的液体治疗中,SVV已被证实其预测液体反应性的准确性要明显高于CVP等静态前负荷指标[4-5]。而目前临床大力提倡的目标导向液体治疗,如果引入SVV小于10%为液体治疗目标,将会减少肺水肿等并发症的发生率[6]。由于儿童较成人存在更快的心率、更好的血管弹性和更好的胸壁顺应性,所以在儿科领域,SVV能否准确预测儿童液体反应性尚有待探讨。目前仅有少数动物实验[14]和2篇临床研究[3、15]探讨了SVV用于幼年动物和儿童液体反应性监测,指导儿童液体治疗。Renner等[3]利用有创的PiCCO联合经食道超声技术研究先心病手术前后液体反应性时发现:SVV在术前左向右分流存在的情况下不能预测液体反应性,而左向右分流修补术后SVV能够准确地预测液体反应性,ROC曲线下面积为0.78,预测液体反应性的最佳阈值为15%。随着医学的发展,由于感染、创伤、出血等并发症和儿科患者的特殊性,无创和持续性监测必将取代有创监测,而成为未来儿童血流动力学监测的必然趋势。本研究利用无创连续的心功能监测仪监测液体反应性参数SVV,结果发现本研究患儿液体治疗前有反应组SVV明显高于无反应组,SVV与ΔSVI有显著相关性,ROC曲线下面积为0.776,说明用无创心功能监测仪监测SVV可以预测先心病根治术后患儿的液体反应性,SVV诊断液体反应性的阈值为17.04%。Lee等[15]利用NICOM研究室间隔缺损术后患儿液体反应性时发现SVV预测液体反应性的最佳阈值为10%,比本研究所得SVV预测液体反应性的最佳阈值低,出现这种差异可能与监测所用仪器及方法有关。Lee等[15]在研究中发现用NICOM测得的心指数(cardiac index,CI)较心脏彩超测得的CI低约25%,这可能是其SVV预测液体反应性的最佳阈值低于本研究的原因。另外USCOM为经皮无创超声技术,其监测原理为利用超声多普勒技术测得经主动脉的速度时间积分(velocity-time integral,VTI)即每次心搏血液流动的距离,再直接根据所输入患者的身高体重,通过已经被Nidorf等[16]验证的身高或体重与主动脉直径相关性的公式计算出主动脉直径(D),再根据公式计算出SV= VTI×流出道面积(π/4×D2)。本研究所纳入均为先心病术后患儿,术后均选用血管活性药持续泵入,造成测得的VTI、SV偏高,所以可能造成本研究SVV预测液体反应性的最佳阈值偏高。
作为心肺相关性动态指标,SVV的预测价值受到呼吸模式、潮气量、呼吸频率、自主呼吸、心率失常、血管顺应性、腹腔压力等因素的影响[14,17-19]。因此本研究将所纳入患儿呼吸机设置为定容模式,潮气量为10 mL/kg,呼吸频率小于30次/min,患儿充分镇静,剔除术后出现心律失常及有腹腔内压增高的患儿,尽量减少相关因素对SVV的影响。本研究所纳入均为先心病术后患儿,无法避免正性肌力药物的使用,故而在本研究中,根据正性肌力药物使用情况,计算出IS值,再根据IS结果对纳入研究的所有患儿进行分组研究。本研究将患儿分成IS>10和IS≤10两个亚组,发现:IS>10组ROC曲线下面积明显高于IS≤10组(分别为0.813和0.732),说明SVV在IS>10组能更好地预测液体反应性。这可能是因为大剂量正性肌力药物使用可以使Frank-Starling曲线向左上移位,使得SVV在改善的心功能曲线上表现为能够更准确地预测液体反应性。有研究证实,以心脏彩超所得射血分数进行分组的患者的液体治疗中,射血分数较高组患者SVV的ROC曲线下面积要明显大于射血分数较低组,即心功能好的患者SVV预测液体反应性较心功能较差者准确[20]。本研究发现IS>10组中,SVV的预测液体反应性的最佳阈值为17.04%,而IS≤10组中,SVV的预测液体反应性的最佳阈值为15.62%。SVV出现不同的预测液体反应性的最佳阈值可能和正性肌力药物包括多巴胺、米力农及肾上腺素的应用有关。美国专家针对术后第1个4 h内应用正性肌力药物的心血管患者进行的研究发现,血管扩张剂治疗使SVV增高,而强心剂及血管收缩剂不改变SVV值[21]。由上可以看出正性肌力药物将会影响SVV的预测液体反应性的最佳阈值,所以在利用SVV作液体反应性判断时,要结合正性肌力药物评分来考虑阈值。
USCOM作为一种完全无创的监测设备,非常适合临床应用,本研究利用其无创、安全的特点,避免了因有创置管带来的感染、脉管炎、血栓、血肿、渗血等风险,本研究中没有因使用USCOM而致的并发症发生。既往有大量的研究证实USCOM监测的心输出量(cardiac output,CO)与有创监测手段有很好相关性[22-23],而且USCOM费用低廉,操作简便,易于掌握,研究显示普通医务工作人员经过20~30次的训练即可熟练掌握操作方法[24]。
USCOM利用连续多普勒原理经皮测得流出道面积(cross-sectional area,CSA),所以可能不适于应用在如法洛四联症及其他合并流出道畸形的先心病术后的血流动力学监测中。我们需要更深入地研究适于各种类型先心病患儿的血流动力学监测,以确保患儿的安全。
[1]Marik P E,Monnet X,Teboul J L,et al.Hemodynamic parameters to guide fluid therapy[J].Ann Intensive Care.2011,1(1):1.
[2]所剑,蔡秀军,李宗芳.腹部中等以上手术术后液体治疗方案推荐[J].中国实用外科杂志,2011,31(7):624-625.
[3]Renner J,Broch O,Duetschke P,et al.Prediction of fluid responsiveness in infants and neonates undergoing congenital heart surgery[J].Bri J Anae,2012,108(1):108-115.
[4]Khwannimit B,Bhurayanontachai R.Prediction of fluid responsiveness in septic shock patients:comparing stroke volume variation by FloTrac/Vigileo and automated pulse pressure variation[J].Eur J Anaesthesiol,2012,29(2):64-69.
[5]Willars C,Dada A,Huqhes T,et al.Functional haemodynamic monitoring:The value of SVV as measured by the LiDCORapidTMin predicting fluid responsiveness in high risk vascular surgical patients[J].Int J Sur,2012,10(3):148-152.
[6]Haas S,Eichhorn V,Hasbach T,et al.Goal-directed fluid therapy using stroke volume variation does not results in pulmonary fluid overload in thoracic surgery requiring one-lung ventilation[J].Crit Care Res Pract,2012,2012(6):687018.
[7]Magder S,Bafaqeeh F.The clinical role of central venous pressure measurements[J].J Intensive Care Med,2007,22(1):44-51.
[8]Madan A K,UyBarreta V V,Aliabadi-Wahle S,et al.Esophageal Doppler ultrasound monitor versus pulmonary artery catheter in the hemodynamic management of critically ill surgical patients[J].J Trauma,1999,46(4):607-611.
[9]Sturgess D J,Pascoe R L,Scalia G,et al.A comparison of transcutaneous Doppler corrected flow time,B-type natriuretic peptide and central venous pressure as predictors of fluid responsiveness in septic shock:a preliminary evaluation[J].Anaesth Intensive Care,2010,38(2):336-341.
[10] Fujita Y,Yamamoto T,Sano I,et al.A comparison of changes in cardiac preload variables during graded hypovolemia and hypervolemia in mechanically ventilated dogs[J].Anesth Analg,2004,99(6):1780-1786.
[11] Vallée F,Fourcade O,De Soyres O,et al.Stroke output variations calculated by esophageal Doppler is a reliable predictor of fluid response[J].Intensive Care Med,2005,31(10):1388-1393.
[12] Smith B E,Madigan V M.Inotropy index accurately predicts fluid responsiveness in volume resuscitation[J].Emerg Med Australas,2009,21(S1):A15.
[13] Cavallaw F,Sandreni C,Antonelli M.Functional hemodynamic monitoring and dynamic indices of fluid responsiveness[J].Minerva Anestesiol,2008,74(4):123-135.
[14] Renner J,Cavns E,Meybohm P,et al.Pulse pressure variation and stroke volume variation during different loading conditions in a paediatric animal model[J].Acta Anaesthesiol Scand,2008,52(3):374-380.
[15] Lee J Y,Kim J Y,Choi C H,et al.The ability of stroke volume variation measured by a noninvasive cardiac output monitor to predict fluid responsiveness in mechanically ventilated children[J].Pediatr Cardiol,2014,35(2):289-294.
[16] Nidorf S M,Picard M H,Triuzi M O,et al.New perspectives in the assessment of cardiac chamber dimensions during development and adulthood[J].J Am Coll Cardiol,1992,19(5):983-988.
[17] Lee J Y,Park H Y,Jung W S,et al.Comparative study of pressure-and volume-controlled ventilation on stroke volume variation as a predictor of fluid responsiveness in patients undergoing major abdominal surgery[J].J Crit Care,2012,27(5):531.e9-14.
[18] Cannesson M,Tran N P,Cho M,et al.Predicting fluid responsiveness with stroke volume variation despite multiple extrasystoles[J].Crit Care Med,2012,40(1):193-198.
[19] Monnet X,Guérin L,Jozwiak M,et al.Pleth variability index is a weak predictor of fluid responsiveness in patients receiving norepinephrine[J].Br J Anaesth,2013,110(2):207-213.
[20] Reuter D A,Kirchner A,Felbinger T W,et al.Usefulness of left ventricular stroke volume variation to assess fluid responsiveness in patients with reduced cardiac function[J].Crit Care Med,2003,31(5):1399-1404.
[21] Hadian M,Severyn D A,Pinsky M R.The effects of vasoactive drugs on pulse pressure and stroke volume variation in postoperative ventilated patients[J].J Crit Care,2011,26(3):328.e1-8.
[22] 褚铭肄,李春盛,安向光.超声心排血量监测仪与连续温度稀释法测量心排血量和心排血指数的比较研究[J].中国危重病急救医学,2009,21(6):367-368.
[23] Jain S,Allins A,Salim A,et al.Noninvasive Doppler ultrasonography for assessing cardiac function:can it replace the Swan-Ganz catheter?[J].Am J Surg,2008,196(6):961-968.
[24] Dey I,Sprivulis P.Emergency physicians can reliably assess emergency department patient cardiac output using the USCOM continuous wave Doppler cardiac output monitor[J].Emerg Med Australas,2005,17(3):193-199.
ApplicationofNon-invasiveVolumeParameterstoPredictionofFluidResponsivenessinChildrenUndergoingCongenitalHeartSurgery
Cheng Yuwei1,3,4,5,Xu Feng2,3,4,5,Li Jing2,3,4,5△
1DepartmentofEmergency,2DepartmentofPICU,Children’sHospitalofChongqingMedicalUniversity,3MinistryofEducationKeyLaboratoryofChildDevelopmentandDisorders,4KeyLaboratoryofPediatricsofChongqing,5ChongqingInternationalScienceandTechnologyCooperationCenterforChildDevelopmentandDisorders,Chongqing400014,China
ObjectiveTo use ultrasonic cardiac output monitor(USCOM)to monitor the hemodynamics of children who underwent congenital heart disease(CHD)surgery before and after fluid therapy,and to examine the accuracy of the hemodynamic parameters central venous pressure(CVP),stroke volume variation(SVV),corrected flow time(FTc) and smith madigan inotropy index(SMII)in predicting fluid responsiveness of children post operation.MethodsUSCOM was used to monitor the hemodynamic parameters of post-operative children before and after fluid therapy.The change of SVI(ΔSVI)was calculated based on the stroke volume index(SVI)before and after fluid therapy,and the inotropic scores(IS)were obtained based on the doses of inotropic drugs used.Children with ΔSVI≥15% were defined to be responders who responded to fluid resuscitation and those with ΔSVI<15% as non-responders.Two subgroups were also established in terms of IS:IS≤10 group and IS>10 group.ResultsAmong the parameters(CVP,FTc and SM,etc.),only the area under the ROC curve(AUC)of SVV was significantly different between before and after fluid therapy(AUC 0.776,P<0.01).Subgrouping analysis also showed significant difference in only the AUC of SVV between IS≤10 group and IS>10 group(AUC:0.732,P=0.045 or 0.813,P=0.002).ConclusionSVV monitored by USCOM,in contrast to CVP,FTc and SMII,can predict the fluid responsiveness in children after congenital heart surgery.Prediction of fluid responsiveness by SVV shows higher accuracy in IS>10 group than in IS≤10 group.
congenital heart disease; ultrasonic cardiac output monitor; stroke volume variation; corrected flow time; central venous pressure
程玉薇,女,1988年生,医学硕士,E-mail:496492336@qq.com
△通讯作者,Corresponding author,E-mail:lijingwangyi@126.com
R720.5
10.3870/j.issn.1672-0741.2017.05.020
(2016-10-18 收稿)

